二氧化碳加氢合成低碳烯烃的研究进展
2015-07-25梁兵连段洪敏侯宝林苏雄黄延强王爱琴王晓东张涛
梁兵连,段洪敏,侯宝林,苏雄,黄延强,王爱琴,王晓东,张涛
(中国科学院大连化学物理研究所,辽宁 大连 116023)
随着全球工业化进程的加快,大气中CO2的浓度不断升高,从工业革命前的280μL/L 上升到2010年的390μL/L,预计到21 世纪末将达到570μL/L[1],CO2的大量排放使得温室效应加剧。虽然CO2是一种温室气体,但同时CO2也是最为廉价、最为丰富的碳资源。通过太阳能、风能、生物质能等可再生能源获得的氢气与CO2反应可合成甲烷、低碳烯烃、高级烃、甲醇、甲酸、二甲醚、醛类等多种化学 品[1-8]。低碳烯烃是化学工业中最基本的原料,随着世界石油资源日益减少,导致以石油为原料的乙烯、丙烯等低碳烯烃产品的供应紧张。CO2加氢合成低碳烯烃是一项非石油路线合成低碳烯烃的技术,不但能够缓解CO2的排放压力,同时也能减少低碳烯烃的生产对石油资源的依赖。
CO2加氢合成低碳烯烃还是一项战略技术。美国海军研究实验室利用海水获得CO2和H2,通过CO2催化加氢反应先生成低碳烯烃,然后经低碳烯烃齐聚制取液态烃,它可以直接替代传统燃油用于现有的发动机[9-12]。该技术能够利用海水得到燃油,将海水变成一种丰富的战略资源,从而减少舰艇以及飞机对燃料补给的依赖,延长续航时间。CO2加氢是碳一化学中的重要反应,对它的研究不但可以更好地认识CO2在催化剂上的活化与转化,对理解非均相催化剂上表面碳物种的形成以及碳链增长也有重要意义,还能指导其他含碳物质的转化。
因此,CO2加氢合成低碳烯烃技术在环境保护、资源利用、战略需求以及学术研究等方面都具有重要意义。本文重点对CO2加氢合成低碳烯烃的热力学、反应机理和催化剂进行了综述,并对未来的发展方向进行了展望。
1 热力学分析
化学反应平衡状态下的热力学分析可以为研究工作提供理论指导。刘业奎等[13]对CO2加氢合成低碳烯烃反应平衡体系的热力学进行了研究。为了简化计算,提出了以下假设:体系中CO 的浓度近似认为是零,反应混合物按照理想气体溶液处理,烃类反应产物为 C1~C4低碳烃。通过热力学计算表明,在反应温度为307~357℃、反应压力为2.5~3.0MPa、H2/CO2为3 的条件下,CO2的理论最高转化率为 69%~71%。
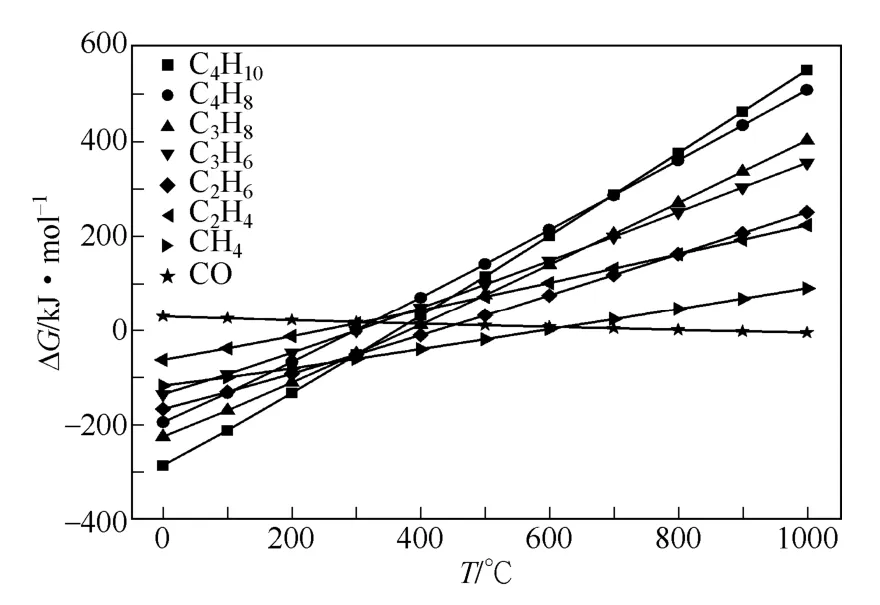
图1 CO2 加氢合成低碳烯烃体系反应吉布斯自由能随温度的变化
尽管刘业奎等提出的假设简化了计算,但在某些实际反应体系中CO 的浓度并不为零,会对计算结果产生不可忽略的影响,因此本文作者考虑了中间产物CO 的浓度对CO2加氢热力学平衡体系进行了计算。通过热力学计算得到了CO2加氢合成低碳烃和CO 的吉布斯自由能(ΔG)随温度的变化,如图1 所示。在590℃以下,CO2加氢生成CH4在热力学上最有利。CO2加氢生成CO 在820℃以下的ΔG 均为正值,在热力学上是不利的。图1 中各曲 线的斜率表示ΔG 对温度的敏感程度。在烃类产物中生成CH4的ΔG 斜率最小,因此温度变化对生成CH4的ΔG 影响最小。生成烯烃的ΔG 斜率都比生成相应的烷烃小,升高温度时,生成烯烃的ΔG 升高的程度更小,因此,在生成烯烃的ΔG 不大于零的情况下,适当升高温度,平衡组成中烯烃的比例会增大。生成烷烃的ΔG 曲线在280℃附近形成交汇点,生成烯烃的ΔG 曲线在320℃附近形成交汇点,而320℃时生成烯烃的ΔG 已经大于零。因此,在热力学达到平衡的反应体系中烷烃的收率将大于烯烃的收率。若想提高产物中烯烃的收率,应该从动力学上入手,优化操作条件和催化剂的设计[14]。
考虑到CO2加氢可能生成的产物,平衡体系近似可由CO2、H2、H2O、CO、CH3OH、C2H5OH、C1~C10的直链烷烃以及C2~C10的端位烯烃共25种组分构成。通过热力学方程计算了不同压力下CO2的平衡转化率与温度的关系,如图2 所示。在恒定压力下,随着温度的升高,CO2的平衡转化率呈现先降低后升高的趋势。这是由于CO2加氢合成低碳烯烃的反应均为放热反应,在较低温度下体系中合成低碳烯烃的反应占主导,因此随着温度的升高,CO2的平衡转化率降低。而在较高温度下,逆水气变换反应在体系中占主导,它是吸热反应,因此随着温度的升高,CO2的平衡转化率升高。在较低温度如400℃时,CO2的平衡转化率随着压力的升高而增大,这是由于在较低温度下,CO2加氢合成低碳烯烃在体系中占主导,它是物质的量减少的反应,因此压力升高有利于平衡向消耗CO2的方向移动。在较高温度如850℃时,CO2的平衡转化率随着压力的升高而减小,这是由于在850℃时,逆水气变换反应在体系中占主导,而它是等物质的量的反应,压力的变化对其平衡无影响。但压力的升高有利于烃类的合成,使得体系中H2O 的含量增加,从而引起逆水气变换反应向左移动,导致了在高温时CO2的平衡转化率随着压力的升高而降低。

图2 反应温度对CO2 平衡转化率的影响
表1 为CO2加氢生成低碳烯烃(C2=~C4=)反应的以及25℃时的平衡常数Kp。25℃时CO2加氢合成低碳烯烃的反应 ΔG 均小于零,在热力学上是可行的。从热力学方面考虑,合成低碳烯烃的反应在低温、高H2/CO2及高压下进行是有利的,但操作条件的选择要避免CO2大量转化为CO。故反应条件应控制在温度为300~400℃,压力为2.0~3.0MPa,H2/CO2为3,在该条件下CO2的平衡转化率为72.8%~74.5%。
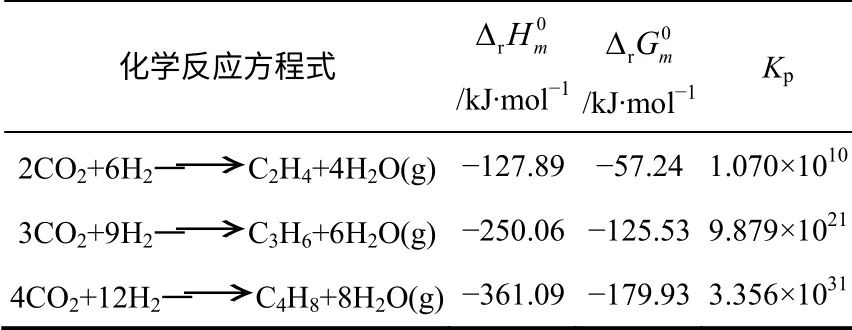
表1 25℃下CO2 加氢合成低碳烯烃的热力学函数值
2 反应机理
CO2加氢合成低碳烯烃与CO加氢的费托(F-T)合成有相似之处,亦有区别。目前,CO2加氢的反应机理主要可以分为两类。
第一类是以CO 为中间产物的间接方式合成低碳烯烃。CO2加氢反应可分为CO2经过逆水气变换(RWGS)过程转化为CO 和CO 加氢的F-T 合成两步反应[1,15-19],反应方程式如式(1)和式(2)。
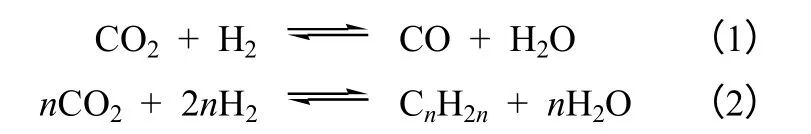
徐龙伢等[15]通过改变CO2加氢的反应条件,发现当 H2浓度偏低时,CO2加氢将主要生成 CO 而不利于生成烃类。只有存在足够量的H2时,反应生成的 CO 才进一步反应生成烃类,从而促使逆水气变换反应向生成CO 方向进行,因此他们认为CO2加氢合成烯烃的反应包括RWGS 和F-T 合成两步反应。同时还发现随着反应气空速的增加,CO2的转化率有所降低,而低碳烯烃的选择性则有所提高。因为空速的增大对反应速率更快的步骤有利,故推测第二步 F-T 合成比第一步RWGS 反应更快, RWGS 是该过程的速率控制步骤。Willauer 等[20]研究CO2加氢反应的动力学,通过实验测定不同停留时间下的RWGS 和F-T 合成的反应速率。发现RWGS 反应很快达到平衡,而F-T 反应缓慢达到平衡,表明F-T 合成比RWGS 反应要慢很多,故认为F-T 合成是CO2制低碳烯烃反应中的速率控制 步骤。
尽管大多数研究学者认为CO2加氢合成低碳烯烃要经过F-T 合成的步骤,但目前对于F-T 合成的机理也没有定论。有学者对CO 加氢直接合成低碳烯烃进行了研究[21-23],普遍认可的机理主要是表面碳化物机理,如图3。
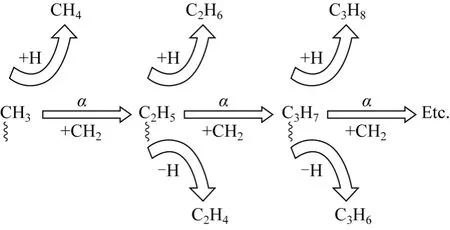
图3 F-T 合成的表面碳化物机理
Torres 等[24]研究了CO 加氢合成低碳烯烃的反应机理。认为CO 解离后的C 继续加氢形成—CH3,吸附在催化剂的表面作为链的引发剂,由—CH2插入吸附的烷基物种中而进行链增长,链终止是由β-氢化物的脱氢形成α-烯烃或加氢形成烷烃。
李梦青等[25]利用原位FT-IR 研究了CO2加氢的反应过程。根据观察到的吸附物种的变化,提出如图4 所示的反应机理。CO2在催化剂上的吸附以单齿碳酸根和双齿碳酸根插入M-H 形成甲酸根,而后分解为CO 或直接加氢形成M-CHO。M-CHO 在表面解离氢的作用下,脱水形成碳化物中间物种。Mössbauer 谱研究表明,催化剂中的铁主要以碳化铁物种存在,证明碳化物的形成确实是反应过程的重要步骤。烯烃可以通过M-CHx的链增长而形成,
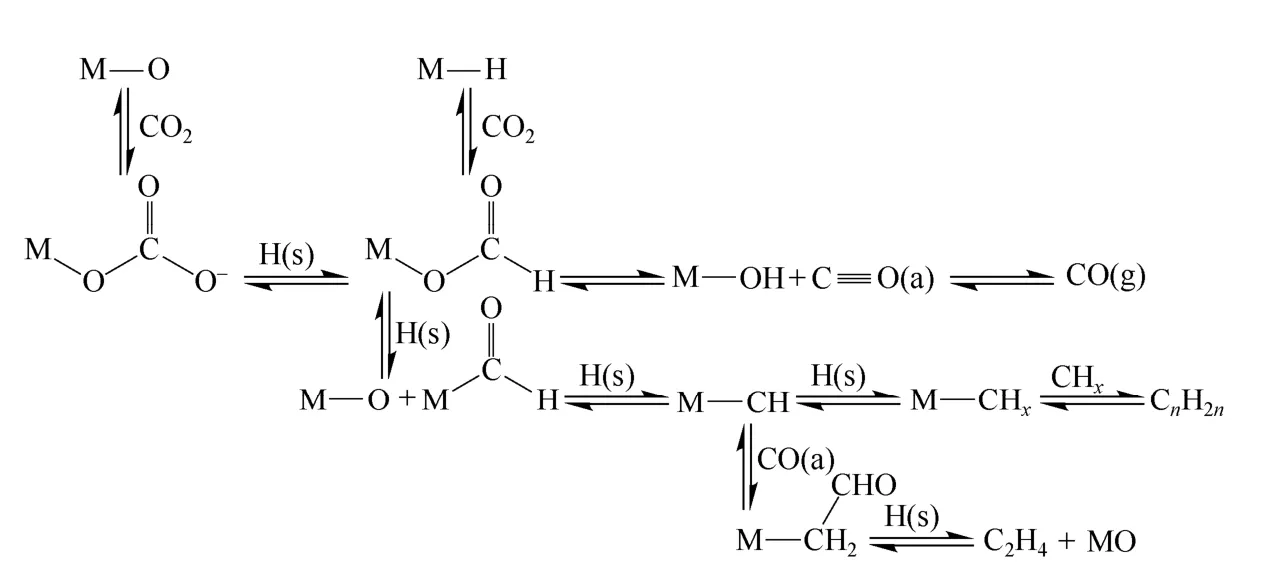
图4 CO2 加氢合成低碳烯烃的反应机理
也可由吸附态的一氧化碳插入形成M-CH2-CHO,再经加氢而生成。
第二类是CO2加氢直接合成低碳烯烃。Riedel等[26]对CO2加氢反应动力学进行了研究,通过测定不同停留时间下CO2的转化率与CO 及烃类选择性的关系,将CO2的转化率外推至零时,烃类的选择性大于零。作者据此推测CO2加氢反应中除了经CO 合成烃外,还有CO2直接加氢合成烃的反应存在,如式(3)所示。作者提出的CO2加氢的转化过程如图5 所示,但同时也表示这不足以成为CO2直接加氢合成烃的本征反应机理的证据。
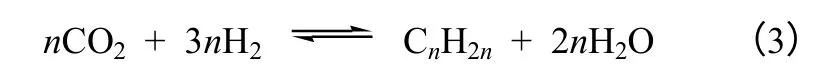

图5 CO2 加氢的转化过程[26]
3 催化剂
目前,CO2加氢合成低碳烯烃的催化剂主要可以分为直接转化催化剂和双功能催化剂。
3.1 直接转化催化剂
Fe 系催化剂有良好的逆水气变换反应活性和F-T 合成反应活性,因此目前对CO2加氢合成低碳烯烃催化剂的研究以负载型Fe 系催化剂为主,研究者对载体、助剂以及双金属催化剂进行了探索。
3.1.1 载体
对于负载型催化剂而言,载体是催化剂的重要组成部分,它的作用是担载和分散活性组分,同时提供反应场所。载体的孔结构、比表面积、表面酸碱性等对催化剂的性能有重要影响。合适的载体可以提高催化剂的稳定性,载体还可能与活性组分发生相互作用而改善催化剂的性能,甚至形成新的活性相。CO2加氢合成低碳烯烃催化剂的载体主要有γ-Al2O3、炭载体、SiO2、分子筛载体等。
γ-Al2O3是一种常用的载体,它具有良好的热稳定性,大的比表面积,有利于稳定Fe 粒子。郑斌 等[27-28]研究了 15%Fe10%K/γ-Al2O3催化剂。在400℃、3MPa、H2/CO2=3、3600h-1的反应条件下,CO2的转化率为51.3%,C2=~C4=的选择性为29.5%。徐龙伢等[15]制备了K-Fe-MnO/Al2O3催化剂,用于CO2加氢合成低碳烯烃反应。在345℃、2MPa、H2/CO2=4、1200h-1的反应条件下,CO2的转化率达到50.3%,C2=~C4=的选择性为17.8%。Dorner 等[9]研究了K-Fe-Mn-Ce/γ-Al2O3催化剂在CO2加氢中的性能,在290℃、1.37MPa、H2/CO2=3、5400mL/(h·g)的反应条件下,CO2的转化率达到50.4%,C2~C5+的选择性为62.3%,CH4的选择性为22.9%,CO 的选择性为14.8%,产物中的烯烷比为4.4。Drab 等[12]研究了γ-Al2O3负载K/Mn/Fe 催化剂用于CO2加氢反应。在300℃、1.8 MPa、H2/CO2=3、370mL/(h·g) 的反应条件下,CO2的转化率为38.1%,C2~C6+的选择性为51.8%,烯烷比为4.4。利用正硅酸乙酯改性后的催化剂,CO2的转化率为31.2%,C2~C6+的选择性为61.4%,烯烷比为3.6。
炭材料作为一种重要的载体,在许多反应中都有应用。活性炭的比表面积通常很大,一般可以达到1000 m2/g 以上。炭载体可能更易与Fe 形成F-T合成反应的活性相Fe5C2。卢振举等[29]用Fe/AC 对CO2加氢合成低碳烯烃进行了研究。在320℃、1.5 MPa、H2/CO2=0.95、650h-1的反应条件下,CO2的转化率达到37.54%,C2=~C4=的选择性达到41.8%。碳纳米管是一种新型的炭材料,除了具有大比表面积的特性外,其表面还具有可改性的基团,能够与Fe 之间相互作用。Chew 等[30]将Fe 纳米粒子负载于具有含氧官能团的碳纳米管上,并将制备的Fe/OCNT 催化剂用于CO2加氢反应。通过含氧官能团改性的碳纳米管对Fe 粒子的锚定作用,在碳纳米管上稳定Fe 粒子。在360℃、2.5MPa、H2/CO2=3、8333mL/(h·g)的反应条件下,CO2的转化率为35.2%,C2=~C5=的选择性为14%。
SiO2是一种中性载体,有利于排除载体酸碱性对反应的影响。相对于其他的载体而言,SiO2与金属的相互作用较弱,有利于独立考察活性组分对催化剂性能的影响。Owen 等[31]制备了Fe/SiO2催化剂用于CO2加氢反应,在370℃、0.1MPa、H2/CO2=3的反应条件下,CO2的转化率为34.8%,但C2=~C4=的选择性仅为0.54%。同时,SiO2作为一种疏水性的材料,可以利用其疏水特性来考察CO2加氢反应中H2O 的移除对反应性能的影响。Ding 等[32]研究了FeK/Al2O3催化剂上涂覆SiO2对CO2加氢合成低碳烯烃催化性能的影响。在400℃、3MPa、H2/CO2=3、1800mL/(h·g)的反应条件下,当SiO2的涂覆量从0 增加到9%(质量分数)时,CO2的转化率由49%升高至63%,C2+的选择性由63%上升至74%。当SiO2质量分数为9%时,C2=~C4=的选择性约为34%。
分子筛载体表面具有酸性位点,其特殊的孔道结构具有择形催化作用,通过对其表面酸碱性以及孔道结构进行调节,可以提高目标产物的选择性。徐龙伢等[15]以全硅分子筛Silicalite-2 为载体制备了K-Fe-MnO/Silicalite-2 催化剂,用于CO2加氢合成低碳烯烃反应。在345℃、2MPa、H2/CO2=4、1200h-1的反应条件下,CO2的转化率达到35.2%,C2=~C4=的选择性达到65.9%。作者还比较了不同载体上K-Fe-MnO 催化剂的性能,结果见表2。
由表2 可知,虽然在K-Fe-MnO/Al2O3催化剂上CO2的转化率能够达到50.3%,但C2=~C4=的选择性仅为17.8%。利用碱性载体MgO 制备的K-Fe-MnO/MgO 催化剂,CO2的转化率为28.4%,C2=~C4=的选择性为62.7%。相对于Al2O3和MgO,Silicalite-2 是一种更加有利于CO2加氢合成低碳烯烃的载体,这可能是由于Silicalite-2 的弱酸性和孔道结构的共同作用使得低碳烯烃的选择性提高。
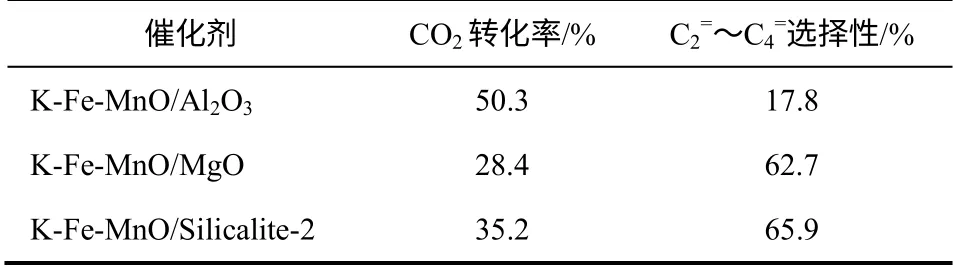
表2 不同载体上K-Fe-MnO 催化剂的性能
对于其他载体,如ZrO2、TiO2等也均有研究[16]。王湘波[33]利用复合载体ZrO2-SiO2制备了Fe-Cu- K2O-La2O3/ZrO2-SiO2催化剂,在340℃、0.1MPa、H2/CO2=3、2400mL/(h·g)的反应条件下,CO2的转化率达到51.4%,C2=~C4=的选择性达26.6%。而在相同条件下,以单组分SiO2和ZrO2载体制备的催化剂,C2=~C4=的选择性分别为14.3%和22.8%。这可能是由于使用ZrO2-SiO2复合载体时,助剂CuO、K2O、La2O 能很好地负载在催化剂上,且分散均匀,通过各组分的协同作用产生了新粒子或复合氧化物。Hu 等[17]利用介孔氧化锰载体负载Fe,制备了Fe/K-OMS-2(KMn3+Mn74+O16)催化剂用于CO2加氢反应。在320℃、1.37MPa、H2/CO2/Ar=6/3/1、3360h-1的反应条件下,CO2的转化率为45%,C2=~C6=的选择性为51%。Wang 等[16]考察了1%K10%Fe在不同载体上CO2加氢的催化性能,在340℃、2MPa、H2/CO2=3、1200mL/(h·g)的反应条件下,发现 C2=~C4=的选择性顺序为 ZrO2>TiO2>Al2O3> CNT>Meso-C> SiO2。
3.1.2 助剂
尽管Fe 系催化剂对CO2加氢合成低碳烯烃有一定的选择性,但是仍有较多的甲烷生成,这对于合成烯烃是不利的,因此需要通过添加助剂来改善催化剂的性能。在CO2加氢反应中使用的助剂主要有结构型助剂和电子型助剂。结构型助剂的作用是改变活性组分的物理性能,如调整催化剂的孔结构、增大催化剂的比表面积等。电子型助剂的作用是改变活性组分的电子结构来提高催化剂的活性和对目标产物的选择性。
K 是一种良好的助剂,在合成氨、F-T 合成等许多反应中均有应用。K 作为一种碱金属,能够提高CO2的吸附量,从而提高CO2的转化率。Wang等[16]研究了不同K 含量的K-Fe/ZrO2在CO2加氢合成低碳烯烃反应中的性能。CO2-TPD 的测定结果表明,随着K 含量的增加,CO2的吸附量增加。在340℃、2MPa、H2/CO2=3、1200mL/(h·g)的反应条件下,当K 质量分数从0 升高至1%时,CO2的转化率由32%上升至42%。但K 的质量分数继续提高到5%,CO2的转化率反而下降。可能是由于过多的K 覆盖了活性位点,从而导致CO2的转化率下降。
K 作为一种电子型助剂能够促进CO 的解离吸附,同时也有利于降低H2的吸附热,削弱了烯烃的进一步加氢能力,从而提高产物中烯烃的选择 性[1,4-5]。此外,K 的添加还能够抑制CH4的生成。Wang 等[16]制备了不同含量的K-Fe/ZrO2催化剂。当K 的质量分数从0 升高至1%时,低碳烯烃的选择性由0.075%上升至29.04%,而CH4的选择性从52.5%降低至11.9%。You 等[34]研究了非负载型Fe系催化剂中K 含量的影响。当K 的质量分数从0升高至5%时,CO2的转化率从5.6%上升至38%,CH4的选择性从54.6%降低至16.4%,低碳烯烃的选择性从0 上升至26.5%。通过XRD 表征发现,反应后的催化剂中含有Fe5C2,作者认为K 的添加促进了Fe5C2物种的形成。
γ-Al2O3与K 的相互作用可以形成KAlH4,从而改善催化剂的性能。Dorner 等[35]研究了Fe-Mn/γ-Al2O3中K 的添加对反应性能的影响。通过XRD 表征发现在催化剂中形成了KAlH4。在有H2O 存在的情况下,KAlH4可与H2O 反应生成H2,如式(4)所示。KAlH4作为一个可逆的“氢池”,不但活化了氢气,还抑制了产物的进一步加氢。在290℃、1.37MPa、H2/CO2=3、5400mL/(h·g)的反应条件下,反应结果如表4 所示。添加8%的K 后,CO2的转化率提高至41.4%,C2~C5+的选择性由55.3%提高至62.4%,CH4的选择性由34.0%降低至26.0%,烯烷比由1.2 提高至4.2。
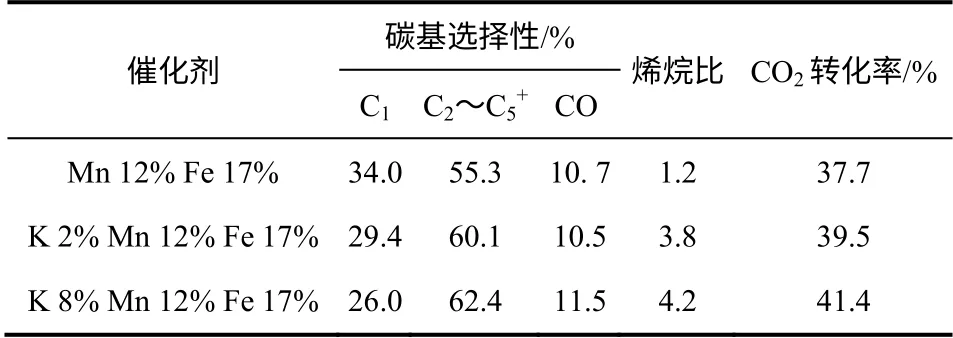
表4 不同K 添加量的Fe-Mn/γ-Al2O3 催化剂的性能
对于其他的碱金属助剂也有研究报道。You 等[34]在非负载的Fe 系催化剂中添加不同的碱金属助剂,发现CO2加氢合成低碳烯烃的活性顺序为Rb>K≈Cs>Li>Na。Jingjuan Wang 等[16]研究了不同的碱金属助剂改性的10%Fe/ZrO2(质量分数)在CO2加氢反应中的性能,发现催化剂加氢合成低碳烯烃的活性顺序为K>Na≈Cs>Rb>Li。碱金属助剂在不同的催化剂中表现出不同的活性顺序,可能与负载型催化剂中使用的载体有关。
Mn 既是结构型助剂也是电子型助剂。Mn 能够促进催化剂的还原,提高催化剂的分散度,还能促进Fe2O3的渗碳形成Fe5C2活性相。Mn 可以进入Fe的晶格中,使得催化剂表面的碱性增强,从而提高CO2的吸附量。Dorner 等[10,36]研究了Fe-Mn/γ-Al2O3催化剂在CO2加氢中的性能。在290℃、1.37MPa、H2/CO2=3、5400mL/(h·g)的反应条件下,考察了Fe的负载量与Mn 的添加量对催化剂性能的影响,结果见表5。当Mn 的添加量为12%,Fe 的负载量为17%时,CO2的转化率为37.7%,C2~C5+的选择性为55.3%,烯烷比为1.2。从表5 中可以看出,Mn的加入抑制了CH4的生成,同时提高了烯烷比。但过量的Mn 可能会覆盖催化剂中CO2加氢的活性位点和链增长位点,从而降低CO2的转化率和低碳烯烃的选择性。

表5 不同Fe 负载量与Mn 沉积量的Fe-Mn/γ-Al2O3 催化剂的性能
CeO2具有优异的水气变换反应活性,它也能提高RWGS 的反应活性,因此可以利用CeO2作为加氢反应催化剂的助剂。Dorner 等[36]研究了Fe-Mn/γ-Al2O3中CeO2对反应性能的影响。在添加2% Ce 后,CO2的转化率和C2~C5+的选择性都略有提高,且CH4的选择性降低。当Ce 的质量分数达到10%时,C2~C5+的选择性降低,而CO 的选择性提高。这可能是由于CeO2优先在链增长位点的沉积而使得RWGS 反应更多的发生。他们[9]还考察了CeO2对K-Fe-Mn/γ-Al2O3催化剂的影响,CeO2的添加使得CO2的转化率由41.4%提高至50.4%,C2~C5+的选择性提高至62.3%,同时CH4的选择性降低至22.9%,CO 的选择性略有提高至14.8%。
3.1.3 双金属活性组分
除了添加助剂会影响CO2加氢反应的性能外,添加某些金属与Fe 形成双金属催化剂,也可以改善反应的性能。Song 等[37]采用等体积浸渍法制备了Fe-Co/AlO3双金属催化剂用于CO2加氢反应。在400℃、1.1MPa、H2/CO2=3、3600mL/(h·g)的反应条件下,当在金属 Fe 催化剂中添加 Co 形成Fe-Co(0.17)/Al2O3双金属催化剂时,CO2的转化率由12.1%提高至25.2%,C2+的选择性由10%提高至43%,CO 的选择性由49%降低至13%。这是由于Fe 与Co 的结合改变了CO2和H2在催化剂表面的吸附性质,有利于碳链增长形成高碳烃。在双金属Fe-Co(0.17)/Al2O3催化剂中添加少量的K,使得CO2的转化率和C2+的选择性分别提高到33.7%和68%。在Fe-Co 双金属催化剂研究的基础上,作者还研究了Fe-Ni、Fe-Cu、Fe-Pd 双金属催化剂在CO2加氢反应中的性能[38]。尽管单金属Cu 和Pd 对C2+几乎没有选择性,但形成双金属Fe-Cu、Fe-Pd 后CO2的转化率和C2+选择性相对于单金属Fe 均有较大幅度的提高。而Fe-Ni 双金属催化剂的产物几乎全部为CH4。这可能与Fe-Ni 强的加氢能力有关,使得表面碳物种优先加氢形成CH4而不是形成C—C键。K 的加入减弱了H2的吸附,使得Fe-Ni 催化剂中CH4的选择性略有降低,而Fe-Cu、Fe-Pd 双金属作用被部分抑制了,这可能与Cu、Pd 较弱的H2吸附强度有关。故调整催化剂对于H2和碳物种的吸附性质是控制CO2加氢产物的关键。
刘歆颖等[39]采用共沉淀法制备了Ni-Fe 双金属催化剂用于CO2加氢合成低碳烯烃反应。在350℃、H2/CO2=3、5000mL/(h·g)的条件下,单金属Fe 催化剂上CO2的转化率只有0.03%,产物中没有烯烃生成。添加1%的Ni 后,产物中C2=~C3=的选择性达到5.3%,CO2的转化率为32.6%,烯烷比为4.7。该研究小组还发现钴的添加也能够提高CO2的转化率[40]。这可能是由于少量镍或钴的加入改变了催化剂中铁的性质,促进了铁的还原,并增加了铁的碳化,而碳化铁被认为是CO2加氢合成烃的重要物种,因此产物中低碳烯烃的比例上升。Ru 在F-T 合成反应中也有应用,它具有良好的加氢性能。Fe-Ru 双金属催化剂可能会提高低碳烯烃的选择性。Fe-Ru之间还可能形成合金,进一步增强金属间的相互作用,从而改变金属Fe 和Ru 的性质,进而改善催化剂的性能[41]。
3.2 双功能催化剂
对于CO2加氢合成低碳烯烃的路线,除了经过以CO 为中间产物的路线外,还可以利用CO2加氢先合成甲醇,然后经过甲醇制烯烃(MTO)路线合成低碳烯烃,如图6 所示。
Fujimoto 等[42]利用商业化的甲醇催化剂Cu-Zn与Y型分子筛等质量混合作为CO2加氢的双功能催化剂。在320℃、2.1MPa、H2/CO2=2、0.05mol/(g·h)的反应条件下,CO2的转化率为17%,C2~C5的选择性为23%。作者认为烃类的形成首先是CO2在甲醇催化剂上形成CO,然后CO 加氢形成CH3OH,而后扩散至分子筛的表面转化为烯烃,烯烃进一步加氢形成烃。Bai 等[43]采用共沉淀法制备了Fe-Zn-Cr 催化剂,再与HY 分子筛混合制得双功能的CO2加氢催化剂,在340℃、5.0MPa、H2/CO2=3、3000mL/(h·g)的 反 应 条 件 下,CO2的 转 化 率 为22.4%,C2~C5的选择性为38.2%。对于采用双功能催化剂经CH3OH 路线的CO2加氢制低碳烯烃过程,由于CO2加氢合成CH3OH 在热力学上较低温度才有利,而甲醇制烯烃要求较高的反应温度,因此将这两个反应耦合在一起进行的效果并不佳。
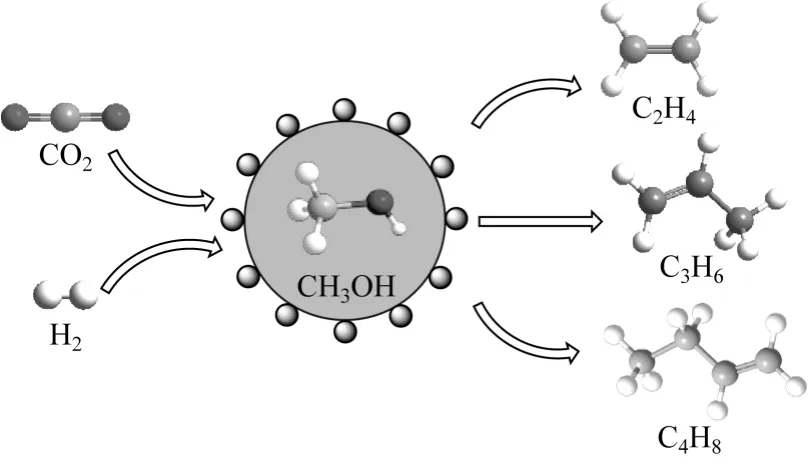
图6 CO2 加氢经甲醇路线合成低碳烯烃的示意图
考虑到CO2加氢合成甲醇以及甲醇经过MTO过程合成烯烃分两步进行,可以使这两个反应分别在两个反应器中进行。
Inui 等[44]采用串联反应器研究了CO2加氢过程。在第一个反应器中放入 6%Pd 改性的Cu-Zn-Cr-Al 催化剂作为甲醇催化剂,在第二个反应器中放入H-Fe-silicate作为CH3OH合成烃类的催化剂。第一个反应器中在250℃、5.0MPa、H2/CO2=3、4700h-1的反应条件下,第二个反应器中的条件为300℃,烃的单程收率为21.2%。
Fujiwara等[45]利用Cu-Zn-Al催化剂在第一个反应器中实现RWGS 反应,在第二个反应器中装填Cu-Zn-Al 催化剂和HB 分子筛,实现CO 和CO2加氢转化为CH3OH,而后CH3OH 再转化为烃的过程。在两个反应器中间加设冷阱,将RWGS 反应生成的H2O 移除,反应示意图见图7。在第一个反应器为0.98MPa、H2/CO2=3、420℃、1500mL/(h·g),第二个反应器为0.98MPa、H2/CO2=3、300℃、15000 mL/(h·g)的反应条件下,CO2的转化率为47.8%,C2~C4烃的选择性为30.3%。而未加设冷阱时,CO2的转化率只有25%,C2~C4烃的选择性为1.2%,加设冷阱后,CO2的转化率上升至47.2%,C2~C4烃的选择性上升至20.3%。因此,作者推断移除H2O有利于C2~C4烃类选择性的提高。
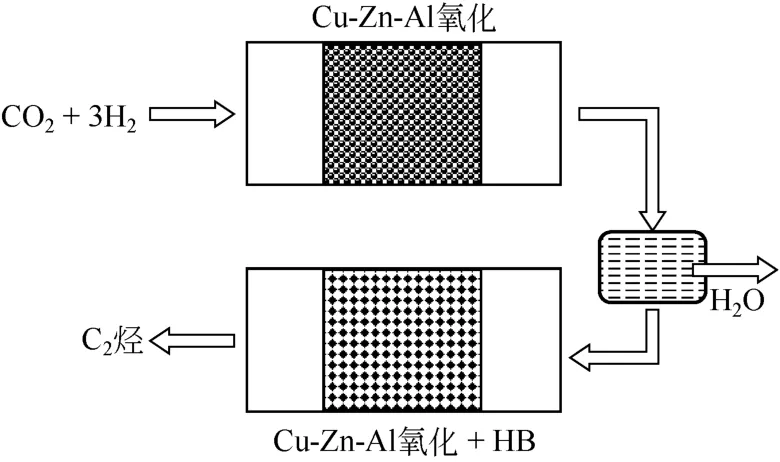
图7 CO2 加氢合成烃的双反应器示意图
4 展 望
CO2加氢合成低碳烯烃在环境保护、资源利用、战略需求上都具有重要意义。未来该过程的发展方向将主要在以下3 个方面。
(1)原料气 近年来,CO2的分离与捕获技术有了很大的发展,相信未来能够更好地从电厂尾气甚至海水中分离CO2[46-51]。而对于H2,随着未来能源的发展,可以从太阳能、风能、生物质能源[5-6,21]等清洁能源制得H2,这样既可以促进清洁能源的利用,同时也能够减少CO2的排放。
(2)催化剂 目前二氧化碳加氢合成低碳烯 烃催化剂的活性和对目标产物的选择性还有待提高,反应过程中CH4的生成量较大。如何抑制CH4的生成,提高低碳烯烃的选择性将是未来发展的关键。在催化剂载体方面,选择适宜的载体,对载体进行合适的改性处理,以提高活性组分的分散度。利用分子筛载体表面的酸碱性和孔道的择形作用改善催化剂的性能。通过添加适当的助剂以及添加适宜含量的第二活性金属组分,以提高催化剂的活性和低碳烯烃的选择性,是今后开展研究工作的方向。
(3)反应机理 虽然目前所提出的反应机理能够对部分反应现象进行解释,但在更深层次上,如CO2的活化位点以及与H2的相互作用还未得到清楚的认识。未来可利用原位表征手段考察催化剂在原位反应条件下的结构以及与反应物之间的相互作用等,深入探索CO2加氢的反应机理。反应机理的研究对于高性能催化剂的设计将会给出有益的 指导。
[1] Wang W,Wang S,Ma X,et al. Recent advances in catalytic hydrogenation of carbon dioxide[J]. Chemical Society Reviews,2011,40(7):3703-3727.
[2] 李静,邓廷云,杨林,等. CO2吸附活化及催化加氢制低碳烯烃的研究进展[J]. 化工进展,2013,32(2):340-345.
[3] Rodemerck U,Holeňa M,Wagner E,et al. Catalyst development for CO2hydrogenation to fuels[J]. Chem. Cat. Chem.,2013,5(7):1948-1955.
[4] Dorner R W,Hardy D R,Williams F W,et al. Heterogeneous catalytic CO2conversion to value-added hydrocarbons[J]. Energy & Environmental Science,2010,3(7):884-890.
[5] Kondratenko E V,Mul G,Baltrusaitis J,et al. Status and perspectives of CO2conversion into fuels and chemicals by catalytic,photocatalytic and electrocatalytic processes[J]. Energy & Environmental Science,2013,6(11):3112-3135.
[6] Centi G,Quadrelli E A,Perathoner S. Catalysis for CO2conversion:A key technology for rapid introduction of renewable energy in the value chain of chemical industries[J]. Energy & Environmental Science,2013,6(6):1711-1731.
[7] 许文娟,马丽萍,黄彬,等. CO2催化加氢研究进展[J]. 化工进展,2009,28(s1):284-289.
[8] Saeidi S,Amin N A S,Rahimpour M R. Hydrogenation of CO2to value-added products——A review and potential future developments[J]. Journal of CO2Utilization,2014,5:66-81.
[9] Dorner R W,Hardy D R,Williams F W,et al. C2-C5+ olefin production from CO2hydrogenation using ceria modified Fe/Mn/K catalysts[J]. Catalysis Communications,2011,15(1):88-92.
[10] Dorner R W,Willauer H D,Hardy D R,et al. Effects of loading and doping on iron-based CO2hydrogenation catalysts[R]. NRL/MR/6180-09-9200. Washington , D C : Naval Research Laboratory. 2009.
[11] Willauer H D,Hardy D R,Schultz K R,et al. The feasibility and current estimated capital costs of producing jet fuel at sea using carbon dioxide and hydrogen[J]. Journal of Renewable and Sustainable Energy,2012,4(3):033111.
[12] Drab D M,Willauer H D,Olsen M T,et al. Hydrocarbon synthesis from carbon dioxide and hydrogen:A two-step process[J]. Energy & Fuels,2013,27(11):6348-6354.
[13] 刘业奎,王黎,侯栋,等.二氧化碳加氢合成低碳烯烃反应平衡体系热力学研究[J]. 催化学报,2004,25(3):210-218.
[14] Torrente-Murciano L,Mattia D,Jones M D,et al. Formation of hydrocarbons via CO2hydrogenation——A thermodynamic study[J]. Journal of CO2Utilization,2014,6:34-39.
[15] 徐龙伢,王清遐,梁东白,等. CO2加氢制低碳烯烃的Fe/Silicalite-2 催化剂研究[J]. 天然气化工,1995,20(5):6-10.
[16] Wang J J,You Z,Zhang Q,et al. Synthesis of lower olefins by hydrogenation of carbon dioxide over supported iron catalysts[J].Catalysis Today,2013,215:186-193.
[17] Hu B,Frueh S,Garces H F,et al. Selective hydrogenation of CO2and CO to useful light olefins over octahedral molecular sieve manganese oxide supported iron catalysts[J]. Applied Catalysis B:Environmental,2013,132-133:54-61.
[18] Gupta N M,Kamble V S,Iyer R M. Effect of γ-irradiation on methanation of carbon dioxide over supported Ru catalysts[J]. Journal of Catalysis,1980,66(1):101-111.
[19] Gupta N,Kamble V,Rao K A,et al. On the mechanism of CO and CO2methanation over Ru/molecular-sieve catalyst[J]. Journal of Catalysis,1979,60(1):57-67.
[20] Willauer H D,Ananth R,Olsen M T,et al. Modeling and kinetic analysis of CO2hydrogenation using a Mn and K-promoted Fe catalyst in a fixed-bed reactor[J]. Journal of CO2Utilization,2013,3:56-64.
[21] Torres Galvis H M,de Jong K P. Catalysts for production of lower olefins from synthesis gas:A review[J]. ACS Catalysis,2013,3(9):2130-2149.
[22] Wang C,Xu L,Wang Q. Review of directly producing light olefins via CO hydrogenation[J]. Journal of Natural Gas Chemistry,2003,12(1):10-16.
[23] Zhang Q,Kang J,Wang Y. Development of novel catalysts for Fischer-Tropsch synthesis:Tuning the product selectivity[J]. Chem. Cat. Chem.,2010,2(9):1030-1058.
[24] Torres Galvis H M,Bitter J H,Khare C B,et al. Supported iron nanoparticles as catalysts for sustainable production of lower olefins[J]. Science,2012,335(6070):835-838.
[25] 李梦青,邓国才,陈荣悌,等. FeCoMnK/BeO 催化剂上二氧化碳加氢合成低碳烯烃的反应性能和原位FT-IR 研究[J]. 催化学报,2000,21(1):71-74.
[26] Riedel T,Schaub G,Jun K-W,et al. Kinetics of CO2hydrogenation on a K-promoted Fe catalyst[J]. Ind. Eng. Chem. Res.,2001,5(40):1355-1363.
[27] 郑斌,张安峰,刘民,等.纳米铁基催化剂在CO2加氢制烃中的性能[J]. 物理化学学报,2012,28(8):1943-1950.
[28] 郑斌. 二氧化碳加氢制烃类铁基催化剂的制备及性能[D]. 大连:大连理工大学,2012.
[29] 卢振举,林培滋,徐长海,等. CO2+H2直接合成低碳烯烃的研究[J]. 天然气化工,1993,18(1):23-27.
[30] Chew L M,Ruland H,Schulte H J,et al. CO2hydrogenation to hydrocarbons over iron nanoparticles supported on oxygen-functionalized carbon nanotubes[J]. Journal of Chemical Sciences,2014,126(2):481-486.
[31] Owen R E,O’Byrne J P,Mattia D,et al. Promoter effects on iron-silica Fischer-Tropsch nanocatalysts:Conversion of carbon dioxide to lower olefins and hydrocarbons at atmospheric pressure[J]. Chem. Plus. Chem.,2013,78(12):1536-1544.
[32] Ding F,Zhang A,Liu M,et al. Effect of SiO2-coating of FeK/Al2O3catalysts on their activity and selectivity for CO2hydrogenation to hydrocarbons[J]. RSC Advances,2014,4(17):8930.
[33] 王湘波. 二氧化碳加氢合成低碳烯烃催化剂的研究[D]. 长春:长春工业大学,2012.
[34] You Z Y,Deng W,Zhang Q,et al. Hydrogenation of carbon dioxide to light olefins over non-supported iron catalyst[J]. Chinese Journal of Catalysis,2013,34(5):956-963.
[35] Dorner R W,Hardy D R,Williams F W,et al. K and Mn doped iron-based CO2hydrogenation catalysts:Detection of KAlH4as part of the catalyst’s active phase[J]. Applied Catalysis A:General,2010,373(1-2):112-121.
[36] Dorner R W,Hardy D R,Williams F W,et al. Effects of ceria-doping on a CO2hydrogenation iron-manganese catalyst[J]. Catalysis Communications,2010,11(9):816-819.
[37] Satthawong R,Koizumi N,Song C S,et al. Bimetallic Fe-Co catalysts for CO2hydrogenation to higher hydrocarbons[J]. Journal of CO2Utilization,2013,3-4:102-106.
[38] Satthawong R,Koizumi N,Song C,et al. Comparative study on CO2hydrogenation to higher hydrocarbons over Fe-based bimetallic catalysts[J]. Topics in Catalysis,2014,(57):588-594.
[39] 刘歆颖,邓国才,郭先芝,等.铁镍双金属催化剂用于二氧化碳加氢合成低碳烯烃的研究[J]. 燃料化学学报,1999,27(5):447-450.
[40] 刘歆颖,邓国才,陈荣悌,等.铁钴双金属催化剂上二氧化碳加氢合成低碳烯烃[J]. 燃料化学学报,1999,27(2):145-149.
[41] Li B,Wang J,Yuan Y,et al. Carbon nanotube-supported rufe bimetallic nanoparticles as efficient and robust catalysts for aqueous-phase selective hydrogenolysis of glycerol to glycols[J]. ACS Catalysis,2011,1(11):1521-1528.
[42] Fujimoto K,Shikada T. Selective synthesis of C2-C5hydrocarbons from carbon dioxide utilizing a hybrid catalyst composed of a methanol synthesis catalyst and zeolite[J]. Applied Catalysis,1987,31(1):13-23.
[43] Bai R X,Tan Y,Han Y. Study on the carbon dioxide hydrogenation to iso-alkanes over Fe-Zn-M/zeolite composite catalysts[J]. Fuel Processing Technology,2004,86(3):293-301.
[44] Inui T,Takeguchi T. Effective conversion of carbon dioxide and hydrogen to hydrocarbons[J]. Catalysis Today,1991,10(1):95-106.
[45] Fujiwara M,Sakurai H,Shiokawa K,et al. Synthesis of C2+hydrocarbons by CO2hydrogenation over the composite catalyst of Cu-Zn-Al oxide and HB zeolite using two-stage reactor system under low pressure[J]. Catalysis Today,2015,242:255-260.
[46] 桂霞,王陈魏,云志,等.燃烧前CO2捕集技术研究进展[J]. 化工进展,2014,33(7):1895-1901.
[47] Keith D W,Ha-duong M,Stolaroff J K. Climate strategy with CO2capture from the air[J]. Climatic Change,2006,74(1-3):2006.
[48] Sumida K,Rogow D L,Mason J A,et al. Carbon dioxide capture in metal-organic frameworks[J]. Chem. Rev.,2012,112(2):724-781.
[49] Furukawa H,Ko N,Go Y B,et al. Ultrahigh porosity in metal-organic frameworks[J]. Science,2010,329(5990):424-428.
[50] 郑修新,张晓云,余青霓,等. CO2吸收材料的研究进展[J]. 化工进展,2012,31(2):360-366.
[51] 张立武,单春晖. 新型CO2捕获材料研究进展[J]. 化工新型材料,2011,39(9):18-20.
