纳米多相催化材料在常温反应中的应用
2015-07-25周颖陈立宇李映伟
周颖,陈立宇,李映伟
(华南理工大学化学与化工学院,广东 广州 510640)
在化工生产中,节能环保不仅仅意味着使用清洁的能源、温和的溶剂,而且催化剂的可重复利用也是节能减排的重要内容。多相催化剂由于稳定性较好,不易失活,而且易于回收利用,因而在化工与能源工业领域扮演着日益重要的角色。但同时多相催化剂的催化效率往往比均相催化剂低,且选择性远远低于均相催化剂,这是传统多相催化剂的一大缺陷。而纳米技术的出现为研制和改良多相催化剂提供了新的机遇。通过调节纳米材料的微观结构和形貌,能使其拥有远远优于传统多相催化剂的反应活性、选择性等优异特性[1-4]。
常温反应由于能耗低、节能环保,因此引起了越来越多的重视。此外,由于反应温度的降低,热引发的副反应也会大大减少[5-6]。要将化工反应控制在接近常温下进行,就需要开发和设计高效的常温反应催化剂。
1 金属纳米粒子
当金属颗粒的粒径小至纳米维度,成为金属纳米粒子(metal nanoparticles,MNPs)时,其性质也发生了巨大的变化,如比表面积增大、活性中心增多等,使其催化活性大大提高。例如贵金属Au 通常被认为没有催化活性,但当其以纳米颗粒的形式高度分散于载体表面时,就会表现出催化活性[7]。但同时,由于其具有很高的表面能,所以往往不稳定,在反应过程中容易团聚。所以有机表面活性剂或者聚合物经常被用作表面保护剂来防止金属纳米粒子的团聚。另外,多孔材料(如多孔碳材料、介孔硅铝酸盐、金属有机骨架等)也常被用于金属纳米粒子的载体,来控制金属纳米粒子的生长[8]。
1.1 配体稳定的金属纳米粒子
配体对金属纳米粒子的催化性能有着十分重要的影响。合适的配体可以保护金属纳米粒子,防止其团聚,还能有效地调节金属纳米粒子的表面性 质[9],从而提高金属纳米粒子的活性和选择性。
使用聚乙烯亚胺(PEI)作为保护配体,将Co负载在氧化石墨烯(GO)上,制得PEI-GO/Co[10]。在氨硼烷(AB)水解脱氢反应中,使用Co、GO/Co、PEI/Co 以及PEI-GO/Co 分别作为催化剂,结果显示,PEI-GO/Co 表现出非常高的催化活性,转换频率TOF 值达到了39.9molH2/(min·molCo)。其活性甚至高于一些贵金属催化剂,如 40% Pt/C 和Ru/Al2O3。对比实验发现PEI-GO/Co 相对于Co 和GO/Co 有显著提升,这是由于PEI 上的氨基官能团可与Co 配位,从而防止Co 的团聚,实现小颗粒纳米钴催化剂在GO 上的高分散。
1.2 金属有机骨架负载金属纳米颗粒
金属有机骨架(metal-organic frameworks,MOFs)是由含氧、氮等的多齿有机配体(大多是芳香多酸和多碱)与过渡金属离子自组装而成的具有既定结构、空间无限延伸的框架结构。这类材料的比表面积远大于相似孔道的分子筛,而且能够在去除孔道中的溶剂分子后仍然保持骨架的完整性。跟传统使用的微孔无机材料如沸石相比,它们可以更加灵活地通过不同金属离子与各种刚性桥联有机配体进行络合,设计与合成具有不同孔径的金属有机骨架材料,从而使得MOFs 的结构变化无穷[13-14]。由于这些优异的特性,利用MOFs 作为金属纳米粒子的载体引起了广泛的关注。
MIL-101(Cr3F(H2O)2O[(O2C)-C6H4-(CO2)]3)是一种沸石型MOFs,拥有极大的比表面积和孔径[15],并且对水稳定,因而可作为良好的载体,用于负载金属或金属氧化物纳米粒子[16-18]。在移除配位水分子后,MIL-101 会暴露出许多配位不饱和铬位(高达3.0mmol/g),这些不饱和铬位可以提供路易斯酸性位,提高芳香族底物的反应活性[19-21]。
2010年,Liu 等[22]以氯金酸(HAuCl4)为金的前体,首次使用液相法将金纳米粒子高分散负载在MOFs 载体上。他们开发了多种溶液合成方法制备Au/MIL-101,即利用PVP 作为保护剂的溶胶凝胶法(CD/PVP)、浸渍法(IMP)、以氢氧化钠为沉淀剂的沉积沉淀法(DPSH)以及利用葡萄糖作为保护剂的胶体沉积法(CD/glucose)。对催化剂的表征发现,CD/PVP 法制得的Au/MIL-101 粒径最小而均匀(2.5±0.5nm),而采用其他方法制得的Au 纳米粒子粒径大而且分散度较差。将Au/MIL-101(CD/PVP) 用于1-苯乙醇有氧氧化反应(图1),在室温下和无碱条件下反应15h,1-苯乙醇几乎完全转化为相应的酮。将氧气替换成空气,同一条件下反应35h,也得到了几乎完全转化为相应酮的结果。该催化剂的高活性可能是MIL-101 的路易斯酸性和高分散Pd 纳米粒子共同作用的结果。

图1 Au/MIL-101(CD/PVP) 催化1-苯乙醇有氧氧化
将Pd 负载在MIL-101 上,制得的Pd/MIL-101材料是高效的加氢催化剂。在丙酮溶液中以Pd(NO3)2为Pd 前体,用浸渍法制得不同负载量的Pd/MIL-101,并将其用于苯酚加氢合成环己酮的反应[23]。5%负载量(Pd 的质量分数)的Pd/MIL-101活性最高,以水为溶剂,在室温(25℃)和0.1MPa H2的条件下反应11h,苯酚的转化率 >99.9%,环己酮选择性 >99.9%。对比考察了MIL-101 和Pd/C催化剂的反应活性,MIL-101 载体作为催化剂时苯酚未转化,而使用Pd/C 催化剂时活性不高。进一步以嫁接吡啶和乙二胺分别屏蔽材料的路易斯酸性位和钯位,发现前者催化活性明显降低,而后者几乎无活性。这是因为Pd 纳米粒子可以活化氢气,而MIL-101 的路易斯酸性位则可以活化苯环,并提高其产物选择性,载体的路易斯酸性位和Pd 的协同作用给Pd/MIL-101 带来优异的反应活性和选择性。将该材料用于其他取代苯酚以及萘酚的加氢反应,也取得了很好的效果(图2)。
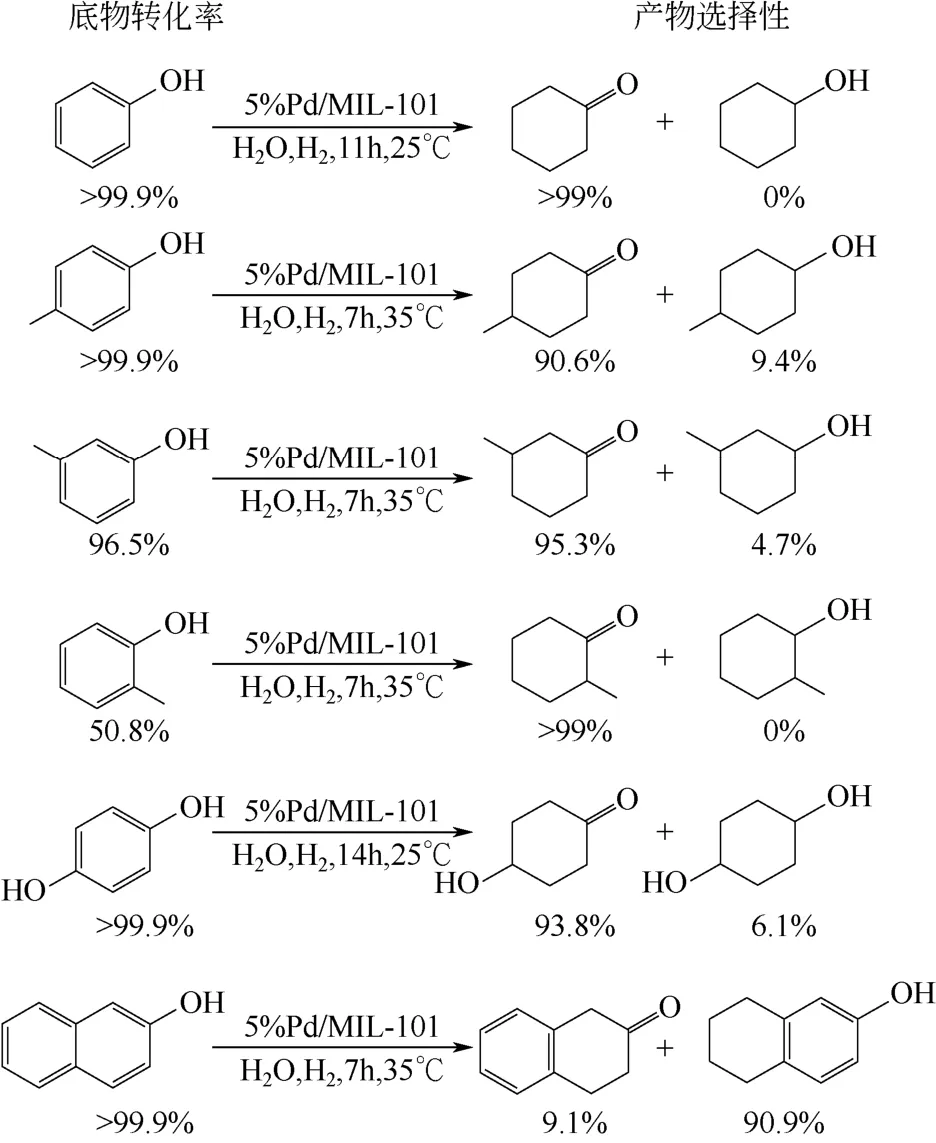
图2 Pd/MIL-101 催化酚加氢
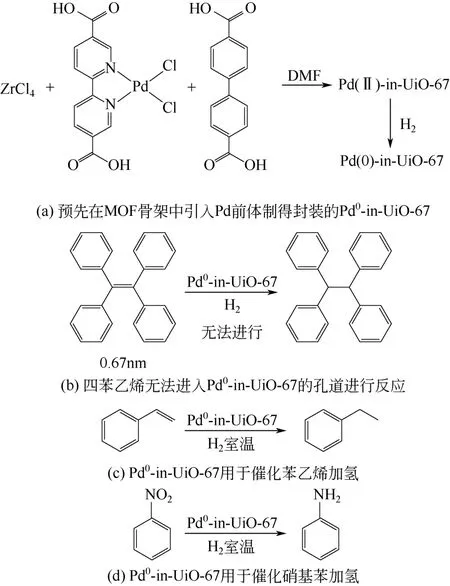
图3 Pd0-in-UiO-67 的制备及催化反应
Chen 等[24]设计了一种新颖的方法,成功将金属纳米粒子引入MOFs 的孔道内。该方法先将金属前体嫁接在有机配体上,然后再组装成MOFs,通过进一步还原从而将金属纳米粒子封装在MOFs 骨架中[图3(a)]。这种设计能避开不同内外表面扩散阻力的影响,大大降低了金属前体进入MOFs 孔道的 难度。使用这种方法将Pd 纳米粒子封装入UiO-67中,得到Pd 均匀分散的Pd0-in-UiO-67 材料。由于MOFs 的孔径为6.6Å(1Å=0.1nm),大于这一尺寸的分子将无法接触嵌入MOFs 孔道内部的Pd,因而该材料在烯烃加氢反应中表现出良好的分子尺寸选择性。例如四苯乙烯(6.7Å)无法进入孔道[图3(b)],因而不能进行加氢生成加氢产物;而苯乙烯(4.2Å)则能扩散到MOFs 孔道内,在0.1MPa H2、25℃条件下,1h 就能完全加氢[图3(c)]。将该材料用于常温、0.1MPa H2条件下的硝基苯加氢反应,也取得了很好的结果,如图3(d)。而使用传统浸渍法制得的Pd纳米粒子主要沉积在MOFs 的外表面,其催化活性和稳定性相比该方法制备的催化剂都要低得多。
在不使用稳定剂的条件下,采用气相沉积法可将Pt 负载在MOF-177 上。将制得的Pt@MOF-177纳米复合物用于醇氧化反应中,在室温下,不加碱,以空气作为氧化剂的条件下,该催化剂表现出很高的活性[25],各种类型醇能很快地转化为相应的醛或酮,如图4。
公示语汉英语料库的充实有助于公示语翻译的统一性与规范性。当翻译公示语时,译者可以首先从语料库中查找相对应的译文,这样既可以规范了公示语的翻译,准确率又得到提高。语料库可以不断地充实、更新,以便跟上时代的发展以及大众的心理要求。
合成金属@MOFs 复合物的另一种方法是利用金属纳米粒子作为模板,在其表面构建MOFs。而这种方法通常要用到保护剂,而保护剂很难完全除去,将会大大影响制得材料的催化性能。最近,Chen等[26]首次报道了一种不需要使用保护剂的一锅法制取Pd@MOFs 的方法。只需简单地将Pd 前体[Pd(NO3)2]、MOFs 前体(ZrCl4和2,2'-联吡啶-5.5'-二羧酸)、还原剂(NH3BH3)溶解在N,N-二甲基甲酰胺(DMF)中,这种N 杂环羧酸盐配体(2,2'-联吡啶-5.5'-二羧酸)能够吸附Pd 纳米粒子,对Pd起到了稳定作用,避免其团聚,从而便于MOFs 在Pd 上的异相成核。采用这种方法制得的材料,Pd高度分散在MOFs 内部,在常温常压下的肉桂醛(CAL)加氢反应中表现出优秀的催化活性和化学选择性。合成溶液中还原剂(NH3BH3)的量对Pd@MOF1 有着显著的影响。CAL 加氢反应结果表明,2.0% Pd@MOF1-40(即在合成溶液中加入40mg NH3BH3)性能最佳,在25℃时反应6h,CAL 完全转化为氢化肉桂醛(HCAL),如图5。
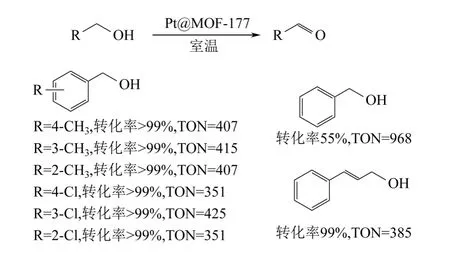
图4 Pt@MOF-177 催化醇氧化
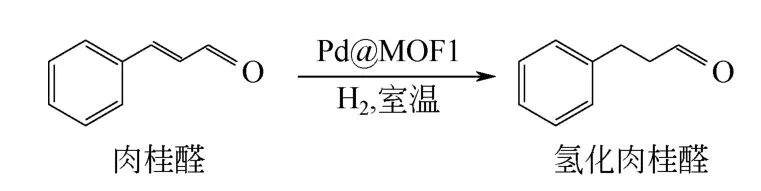
图5 2.0%Pd@MOF1-40 催化肉桂醛选择性加氢
1.3 碳材料负载金属纳米粒子
碳是一种廉价易得的材料,它们有着丰富的孔结构,且对水以及酸碱稳定。基于以上特性,它们常常被用作金属纳米粒子的载体。常见的碳材料有活性炭、碳纳米管、石墨烯等[27-28]。
通过甲酸催化脱氢反应能获得一种清洁的能源,即氢气,但这一过程常常会产生杂质CO。Zhu等[29]使用一种碳材料MSC-30 为载体,这种材料有着较大的孔径(2.1nm)和较高的比表面积(> 3000m2/g),并且与金属粒子有一定相互作用。使用氢氧化钠辅助还原法将Pd 负载在MSC-30 上,获得较小的Pd 纳米粒子,且分散度好。将这种材料用于甲酸脱氢,即使在25℃时TOFs 也能达到750h-1,并且没有CO 生成。这种材料同时具有良好的可重复利用性,重复利用5 次后催化活性无明显降低。研究表明,该材料制备过程中,氢氧化钠的存在能使得Pd 纳米粒子分散度更好。使用氢氧化钠时,Pd 的平均粒径为2.3±0.4nm;而不使用氢氧化钠时,Pd 粒子的平均粒径为3.6±0.6nm,材料的催化性能大大降低。
热解MOFs 材料能获得包裹金属的碳材料。以一种含Co 的MOFs、ZIF-67[Co(MeIM)2,MeIM = 2-甲基咪唑]为牺牲模板,在氩气气氛中,分别在600℃、700℃、800℃和900℃下热解制备Co@C-N(x)材料(x 为热解温度)[30]。将这些材料用于室温下醇氧化反应。研究发现,在800℃下制得的Co/C-N活性最高,在不需要加碱的情况下,对硝基苯甲醇能完全与甲醇反应生成相应的酯[图6(a)]。将此反应延伸至其他取代苯甲醇[图6(b)],或将甲醇替换为其他醇[图6(c)]以及二元醇[图6(d)],也可获得相当高的收率。
三维石墨烯骨架(3DGFs)是一种稳定、具有连续大孔结构的材料。而N 的存在能增加其碱性和极性,从而影响其表面性能。Mahyari 等[31]将Ni 纳米粒子负载在一种掺杂氮的三维石墨烯骨架(3D-(N)GFs)上,制得NiNPs@3D-(N)GFs 材料,并将这种材料用于室温下氨硼烷水解反应。该材料表现出极高的反应活性, TOF 值达到了41.7molH2/(molNi·min) 。研 究 了 N 含 量 对NiNPs@3D-(N)GFs 催化性能的影响,发现N 含量越高,催化性能越好。当氮含量超过3.65%时,TOF无明显增长。实验表明N 的存在能增强金属纳米粒子与载体的相互作用,从而提升催化性能。
碳纳米管(CNT)有着高表面积,能使金属纳米粒子在其上高度分散。用一种叠层(layer by layer,LBL)组装方式将金纳米粒子负载在碳纳米管上,制得的CNT-Au 纳米复合物用于硅烷氧化反应(图7)。无论烷基或芳基硅烷在室温下都很容易转化为相应的硅醇,获得了很高的收率。使用摩尔分数0.1%Au-CNT,以水和THF 作溶剂时,二甲基苯基硅烷仅需45min 就达到了98%的收率,且没有副产物生成。三乙基硅烷在15min 内达到了99%的收率。以二甲基苯基硅烷为底物,进行重复利用实验,重复4 次后,CNT-Au 的活性并无明显降低[32]。
1.4 硅材料负载金属纳米粒子
介孔二氧化硅材料具有有序的介孔结构、高的比表面积、较大的孔容,它规整的纳米孔道为制备纳米催化剂提供了良好的场所[33]。将一锅机械化学方法制备的磁赤铁矿/二氧化硅负载Pd 纳米复合物(Pd-MAGSNC)用于催化Suzuki-Miyaura 偶联反应,表现出很高的反应活性[34]。在室温(25℃)下,反应时间30min,对溴苯甲醛、溴苯、对溴苯甲醚等底物能得到较好的收率(图8)。
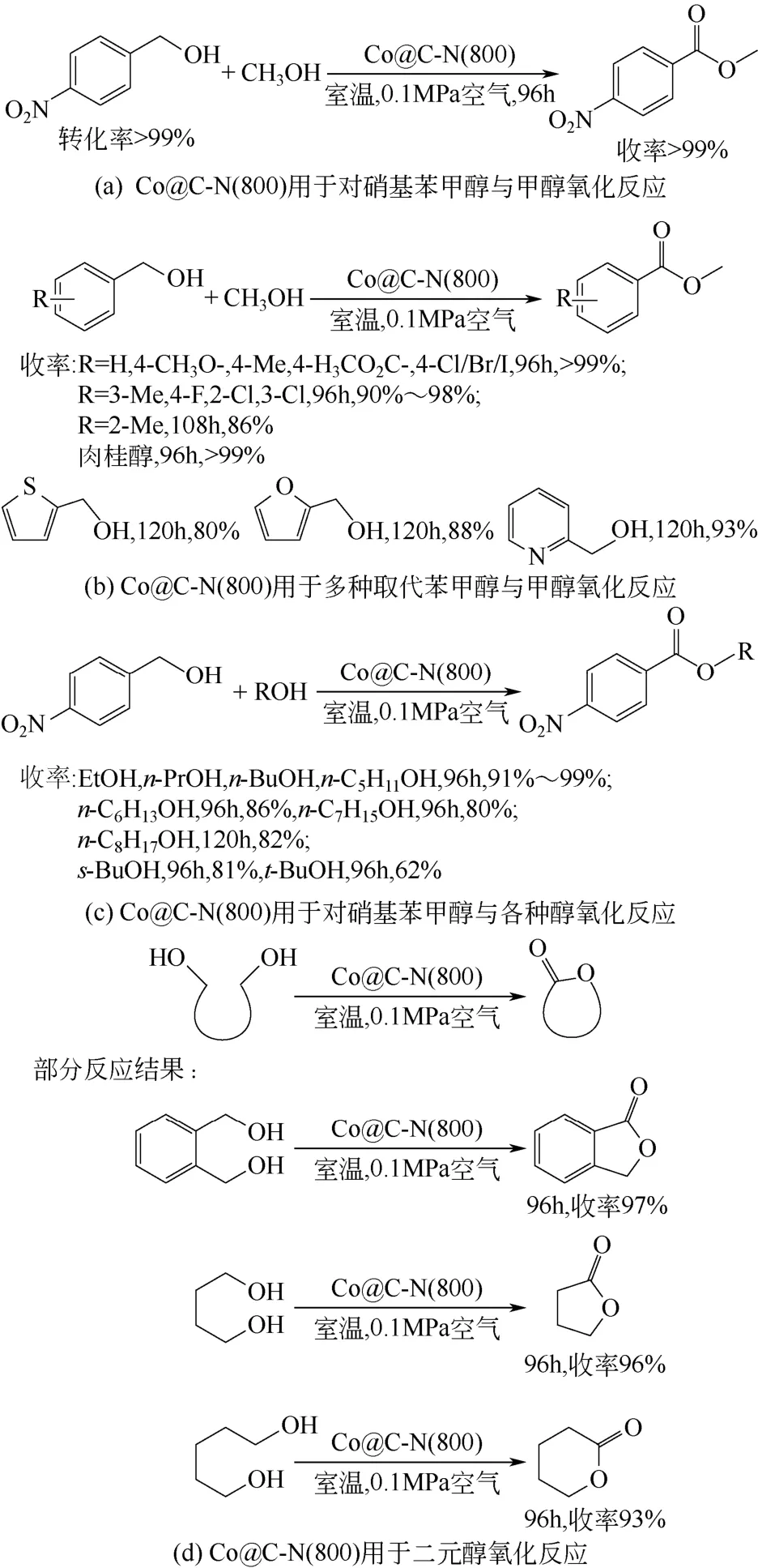
图6 Co@C-N(800)作为催化剂的氧化反应
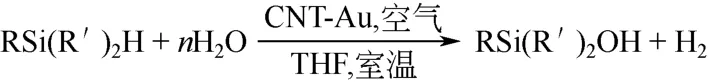
图7 CNT-Au 催化硅烷氧化
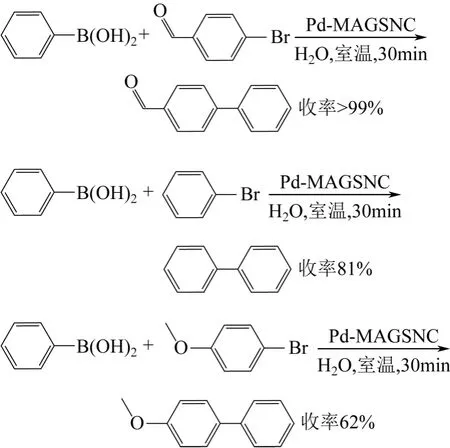
图8 Pd-MAGSNC 室温下催化Suzuki-Miyaura 偶联反应
有序介孔有机硅材料(PMO)有着很高的比表 面积,可调节的孔结构,而且其组成可调控,所以能用作金属纳米粒子的良好载体。PMO 骨架中含有芳环,能够提升金纳米簇的催化性能。Karimia 等[35]使用浸渍法将金纳米粒子负载在PMO 上,制得的Au@PMO 催化剂用于催化不同醇类的有氧氧化,部分结果如图9 所示。不同类型的醇均能在室温下转化为相应的醛或者酮。苯环和金纳米粒子之间由π电子产生的相互作用能防止或减缓Au 纳米粒子的团聚。
使用新颖的原位热解和还原法,能将铁磁性纳米粒子镍(Ni)负载在二氧化硅纳米管上,制得Ni/SNTs 催化剂[36]。首先碳纳米管和CTAB 分别作为硬模板和软模板制得二氧化硅纳米管,然后在高温和碱性条件下用水热合成反应,通过硅酸盐离子和镍离子的反应,引入Ni 前体,最后在原位分解和还原步骤中制得Ni/SNTs 材料。将这种材料用于对硝基苯酚的还原反应,获得了超高的反应活性,在室温下反应仅需一分钟就能完成。相对于湿浸渍法制得的催化剂,其活性得到了巨大的提高。
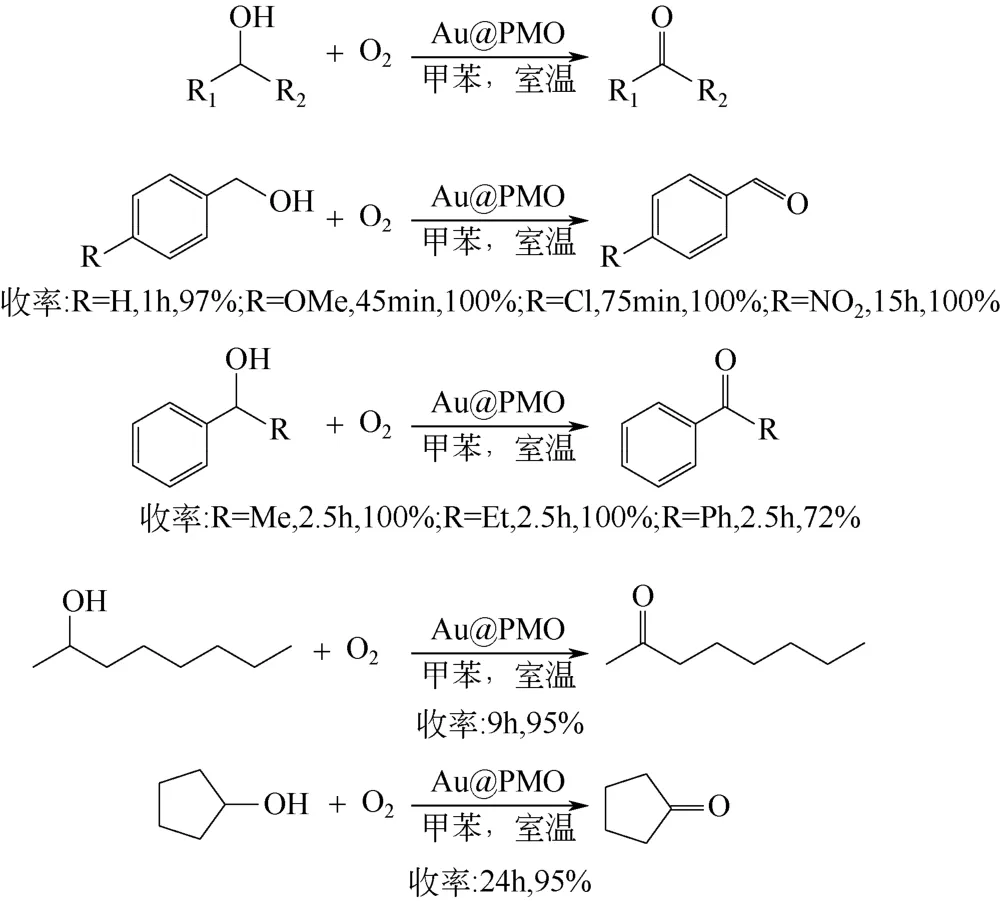
图9 Au@PMO 催化醇氧化反应
1.5 金属氧化物负载金属纳米粒子
许多金属氧化物有着有序的孔结构,被广泛用作金属纳米粒子的载体。金属氧化物载体能增加金属纳米粒子的稳定性,由于其与金属纳米粒子之间的协同效应,还能提高金属纳米粒子的催化活性。金属氧化物载体与金属纳米粒子之间的作用主要表现在:①影响金属纳米粒子的形状和大小;②载体和金属纳米粒子之间的电荷传递;③金属与载体之间的相互作用;④稳定金属离子,等[37-39]。
Layek 等[40]将一种商业化的氧化镁纳米晶体( Nano Active™ Magnesium Oxide Plus ,NAP-MgO)用于负载Au 纳米粒子,制得NAP-Mg- Au(0)催化剂。将这种材料用于多种硝基芳香化合物在室温下的还原反应中(图10),表现出乎很高的活性,能将硝基顺利地转化为氨基。室温下,硝基苯仅需1h 便达到了98%的转化率,苯胺的选择性达到91%。邻、间、对羟基硝基苯则分别在3min、1min、7min 内完全转化为相应的胺。该材料还具有很好的化学选择性,在硝基被还原的同时,其他易被还原的基团(如C=C、C=O、杂环、氰基等)不受影响。
王喜兵等[41]将金纳米粒子负载在一种亚稳态的二氧化钛晶体(TiO2-B)上,制得Au/TiO2-B 催化剂。将这种催化剂用于低温下一氧化碳氧化反应,表现出很高的活性。研究表明,300℃下活化的Au/TiO2-B 催化剂具有最高的CO 氧化性能,在30℃下CO 能达到较高的转化率。
甲醛会对人体皮肤黏膜产生刺激,伤害人体健康,是最常见的装修污染之一。因而开发高活性的催化剂,使得甲醛能够在室内条件下降解为无毒物质成为一个颇有前景的课题。Chen 等[42]用沉积沉淀法(DP 法),用尿素(U)和氢氧化钠(N)作为沉淀剂,分别制得Au/CeO2(DPU)和Au/CeO2(DPN)两种催化剂,用于室温下除甲醛。将催化剂安装在固定床微型反应器中,连续通入不同甲醛浓度和相对湿度(RH)的气流。结果表明,Au/CeO2(DPU)具有更高的活性,在室温下能使得甲醛完全转化为CO2和H2O,而Au/CeO2(DPN)则需要在70℃温度下进行。经过不同湿度的测试,发现水的存在并没有明显影响 Au/CeO2(DPU)的活性。此外, Au/CeO2(DPU)性质稳定,在连续使用60h 后依然能保持活性。
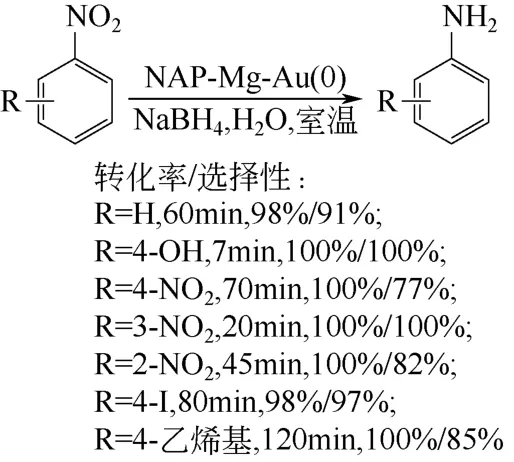
图10 NAP-Mg-Au(0) 催化硝基芳香化合物加氢反应
笪国进等[43]使用浸渍法制得了吡啶改性的Pd/SiO2催化剂,将其用于由氢气和氧气直接合成过氧化氢,反应在三相玻璃反应器中进行,使用质量流量计控制气体比例。使用10mg 负载量为3.0%的吡啶改性Pd/SiO2催化剂,反应温度为10℃,反应压力为0.1MPa,搅拌速率400 r/min,O2流速36mL/min,H2流速为 9mL/min,N2流速为15mL/min,经监测发现,过氧化氢的生成速率达到了1.034mol H2O2/(g Pd·h)。
1.6 聚合物负载金属纳米粒子
聚合物用作金属纳米粒子的载体能提高金属纳米粒子的稳定性。将金属纳米粒子封装在聚合物中,能对其大小、形态进行调控。目前,聚合物-金属纳米复合物被广泛用于众多领域,尤其是催化[44]。
使用亲水聚合物聚乙烯吡咯烷酮(PVP)作为稳定剂,在水中合成双金属金钯(Au/Pd)合金催化剂,即Au-Pd/PVP。将这种材料用于氯代芳烃的Ullmann 偶联反应,在室温下有很高的活性[45]。实验了不同的金钯比例,发现当Au∶Pd=1∶1(原子数比)时,制得的材料活性最高。以对氯甲苯为底物,在室温下反应24h 后,4-氯甲苯生成相应偶联产物的产率达到了98%(图11)。
聚合物1(如图12a)的苯环与金纳米簇之间有着微弱的相互作用,可以起到稳定金纳米簇的作用。在室温下,将金前体(AuClPPh3)加入聚合物1 和硼氢化钠(NaBH4)的四氢呋喃(THF)溶液中,然后加热至150℃保持5h,使侧链交联,然后用THF和水洗,制取PI Au 材料(2a)[46]。将这种PI Au催化剂用于 (±)-1-苯乙醇的有氧氧化,反应在二氯甲烷和水的混合溶剂中进行。在常温和氧气气氛下,反应24h,苯乙酮的收率达到了99%以上[图12(b)]。实验发现,金的负载量越低,反应效果越好,这可能是因为负载量越低,分散度越好。此材料仅需过滤即可回收利用,且催化性能并无显著降低。此外,在制取PI Au 纳米簇的方法上稍作改变,制得纳米簇3 的反应活性有进一步显著提升。以BTF 和水作为混合溶剂,常温下反应5h,苯乙酮的收率达到了99%以上。同一条件,在空气中反应5h,也能获得88%的收率。
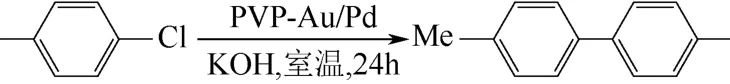
图11 Pd-Au/PVP 催化4-氯甲苯的Ullmann 偶联反应
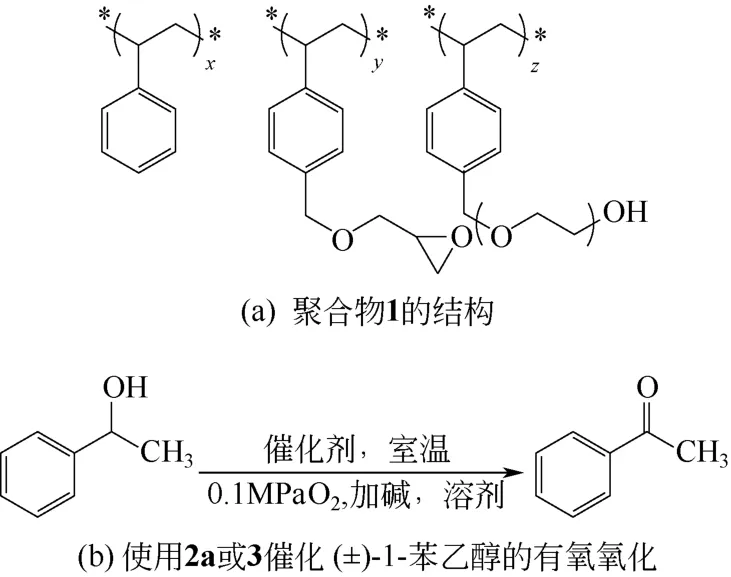
图12 PI Au 催化剂中的有效组分聚合物1的结构及有氧氧化催化反应
2 固载金属离子纳米材料
金属复合物作为催化剂在很多反应中有着广泛应用,但它有着一系列局限性,如活性位的利用率不高等。将金属复合物负载在多孔纳米材料骨架上,使其非均相化,所制备的材料兼有均相和多相催化剂的优点,如活性高、易于分离和可重复利用 等[47-48]。无机材料、有机聚合物、金属有机骨架等都是良好的骨架材料。
相比于传统骨架材料,功能磁性纳米粒子有着稳定、易得、比表面积大等优秀特性,可作为多相催化剂的良好载体。由于它具有磁性,能使得多相催化剂更易于分离和回收利用。将氯化镍固定在一种功能性铁酸盐纳米粒子上,所制得的材料用于室温下催化炔烃加氢,表现出很高的活性[49]。溶剂对于炔烃加氢反应有着显著的影响。试验了一系列炔烃,在室温下,以甲醇作为溶剂,炔烃转化成相应烷烃,获得了大于或等于90%的收率。同一条件下使用二氯甲烷作为溶剂,炔烃转化为相应的烯烃,也得到了不错的收率(图13)。
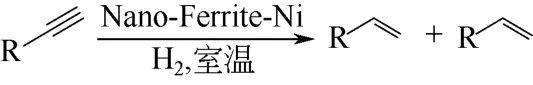
图13 炔烃在室温下催化加氢生成烯烃或烷烃
Kong 等[50]用Zn(NO3)2·6H2O 和NHC 配体[图 14(a)]组装成一种新的金属有机纳米管(MONT)即[ZnLCl2]·8H2O(1) ,将 Pd 固 定 在 1 上 制 得Pd/[ZnLCl2]·8H2O 催化剂。将这种纳米复合材料用于常温、0.1MPa 氢气条件下烯烃的加氢反应,使用5% (Pd∶底物,摩尔比) 的催化剂2,经过1h 反应,大多数底物都几乎完全转化为相应的还原产物[图14(b)]。将催化剂2 用于硝基苯加氢反应,同一条件下,反应1h 后,得到了很高的收率[图14(c)]。经过重复利用实验,发现这种材料可以重复利用6 次而活性不降低。
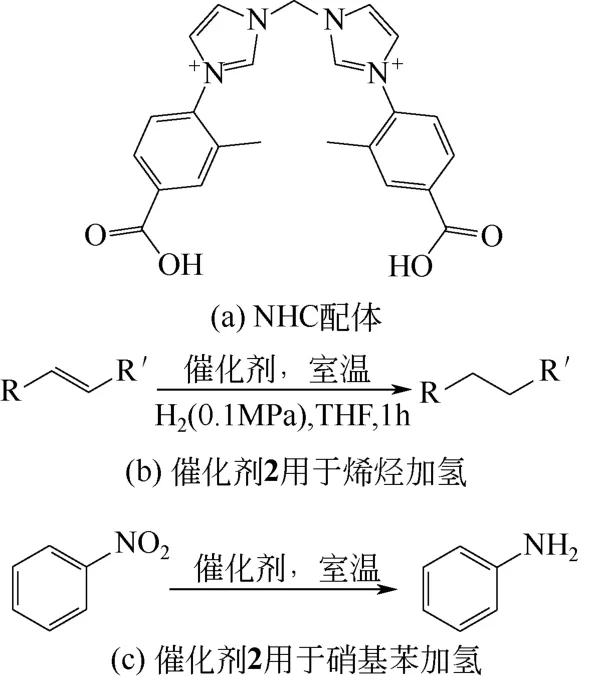
图14 催化剂2 的有效组分NHC 配体化学结构及催化反应
3 金属氧化物纳米材料
金属氧化物纳米粒子由于具有高密度的边角或表面位,因而具有独特的物理化学性质。此外,金属氧化物的形状可以通过控制表面活性剂的用量来进行调控。有许多金属氧化物表面同时具有路易斯酸性位和路易斯碱性位(例如二氧化钛、氧化铝等),使之对于多种有机反应具有良好的催化活性。因而金属氧化物不仅可以作为载体负载金属纳米粒子,其自身亦能作为催化剂,催化一系列化学转化[51-53]。
二氧化钛(TiO2)光催化能用于降解污染物,固定CO2,以及光解水。Yue 等[54]将TiO2用于常温下环氧化合物去氧生成相应烯烃(图15)。这种转化的机理是TiO2表面Ti3+原子将电子转移到环氧化合物,光催化下TiO2再次产生氧化了的表面Ti 原子作为还原剂[50]。
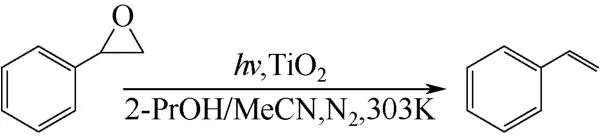
图15 TiO2 光催化环氧化合物脱氧
金属氧化物的形态对其催化性能有着显著影响。Co3O4纳米棒将其{110}位面暴露在外,这使其对CO 氧化具有极高的催化活性[56],即使温度低至-77℃,也能很好的催化CO 氧化。在室温时,Co3O4在65h 内能使得CO 全部氧化。Co3O4具有如此之高的活性是因为其裸露的{110}位面上有着丰富的Co3+离子。
4 固体酸纳米材料
酸催化剂(布朗斯特酸如硫酸、氢氟酸等,路易斯酸如氯化铝、氯化锌等)能催化多种反应。将液体酸替换成固体酸能大大简化分离与回收操作。对于固体路易斯酸催化剂,酸性位存在于沸石、磷酸铝等骨架中含有金属的多孔材料中。在带有微孔结构的有序晶体中嵌入固体酸催化剂,能使其具有形状选择性[57-60]。
在石墨烯中引入磺酸基能增加其酸性,从而影响其催化性能。Liu 等[61]将氧化石墨烯(GO)用硼氢化钠进行还原制得部分还原的氧化石墨烯(rGO)。将制得的rGO 在180℃与发烟硫酸反应制得磺化石墨烯(G-SO3H)。在环氧丙烷水合反应中,在27℃下反应6h,生成1,2-丙二醇的收率达到66.8%,选择性接近100%(如图16),其反应活性远远优于其他材料,如OMC-SO3H、SBA-15-SO3H、GO、rGO 等。而且该材料在重复使用5 次之后,活性并无显著下降。
Mn3[(Mn4Cl)3(BTT)8(CH3OH)10]2(化合物1)是一种方钠石型金属有机骨架,其反应活性中心为配位不饱和的Mn2+(路易斯酸性位)。室温下化合物1 在芳醛和芳酮的硅氰化反应中表现出优秀的催化活性[62][图17(a)]。室温下苯甲醛在反应9h 以后,收率达到98%。将化合物1 用于Mukaiyama-aldol反应也有着良好的反应活性[图17(b)]。以二氯甲烷为溶剂,在温度低至 -45℃时,反应6h,转化率能达到51%,而同一条件下不使用化合物1 时转化率 则有显著下降。化合物1 的BET 表面积达到2100m2/g,其孔结构使其表现出形状选择性,当底物分子大于其孔径时,反应活性明显降低。
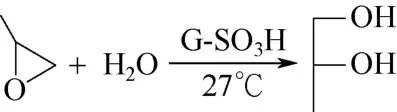
图16 环氧丙烷水合生成1,2-丙二醇
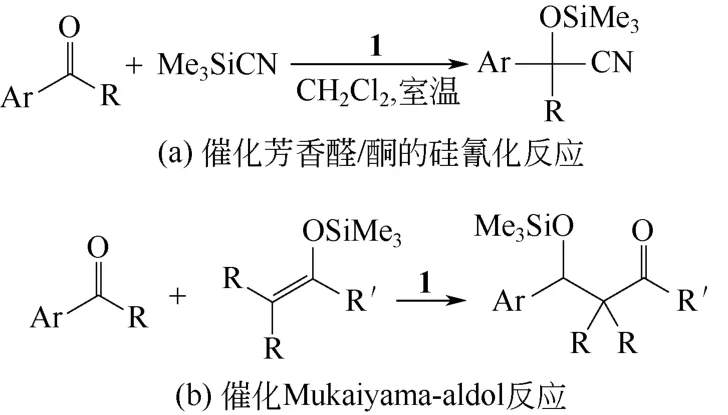
图17 使用Mn3[(Mn4Cl)3(BTT)8(CH3OH)10]2 作催化剂的 化学反应
5 结 语
经济增长和人类物质要求的提高,使得化工生产的需求也日益增长,因而能源匮乏的问题也随之而来。催化剂的出现减缓了化工生产的能源消耗速度,但随着科学技术的发展,需要更加高效、更加环保、可持续的催化剂。纳米技术的出现给催化剂的发展注入了新的能量,也开拓了新的道路。许多纳米级材料因其体积小、比表面积高、具多孔结构,因而能够更高效而且选择性地催化化学反应过程,从而大大降低能耗。而多相的特性,则使得催化剂易于回收利用,从而大大减少了物质资源的消耗。如今,许多化学过程在合适的催化剂作用下,已经能在常温下顺利而高效的进行。将反应控制在常温下进行,不需要额外的热能供给,十分环保节能。精心设计优秀的纳米催化材料,作为多相催化剂应用到化工反应过程中,可使得一系列反应在室温下迅速而选择性地进行,无论从能源利用效率或资源消耗的方面来讲,这类课题都有着无限的发展前景。
[1] Vivek P,Rafael L,et al. Megnetically recoverable nanocatalysts[J]. Chemical Reviews,2011,111(5):3036-3075.
[2] Schlogl R,Abd Hamid S B,Sharifah B. Nanocatalysis:Mature science revisited or something really new?[J]. Angewandte Chemie International Edition,2004,43(13):1628-1637.
[3] Pagliaro M,Pandarus V,Ciriminna R,et al. Heterogeneous versus homogeneous palladium catalysts for cross-coupling reactions[J]. ChemCatChem.,2012,4(4):432-445.
[4] Philippe Serp,Karine Philippot. Nanomaterials in Catalysis[M]. Weinheim,Germany:Wiley-VCH,2012:1-54.
[5] Lam F L Y,Li M C L,Chau R S L,et al. Catalysis at room temperature:Perspectives for future green chemical processes[J].WIREs Energy Environ.,2015,4(4):316-338.
[6] Zhu X,Hoang T,Lobban L,et al. Low CO content hydrogen production from bio-ethanol using a combined plasma reformingcatalytic water gas shift reactor[J]. Applied Catalysis , B :Environmental,2010,94(3-4):311-317.
[7] 韩丹,张爱文,高官俊,等. 负载型纳米Au 催化剂光催化性能的研究进展[J]. 化工进展,2012,31(2):435-440.
[8] White R J,Luque R,Budarin V L. Supported metal nanoparticles on porous materials. Methods and applications[J]. Chemical Society Reviews,2009,38(2):481-494.
[9] Wu B,Zheng N. Surface and interface control of noble metal nanocrystals for catalytic and electrocatalytic applications[J]. Nano Today,2013,8(2):168-197.
[10] Hu J,Chen Z,Li M,et al. Amine-capped Co nanoparticles for highly efficient dehydrogenation of ammonia borane[J]. ACS Applied Materials& Interfaces,2014,6(15):13191-13200.
[11] Yasukawa T , Miyamura H , Kobayashi S. Chiral metal nanoparticle-catalyzed asymmetric C—C bond formation reactions[J]. Chemical Society Reviews,2014,43(5):1450-1461.
[12] Sawai K,Tatumi R,Nakahodo T,et al. Asymmetric Suzuki-Miyaura coupling reactions catalyzed by chiral palladium nanoparticles at room temperature[J]. Angewandte Chemie,International Edition,2008,47(36):6917-6919.
[13] Wigley T M L,Richels R,Edmonds J A. Economic and environmental choices in the stabilization of atmospheric CO2concentrations[J]. Nature,1996,379(6562):240-243.
[14] Furukawa H,Cordova K E,O′Keeffe M,et al. The chemistry and applications of metal-organic frameworks[J]. Science,2013,341(6149):1230444.
[15] Férey G,Mellot-Draznieks C,Serre C,et al. A chromium terephthalate-based solid with unusually large pore volumes and surface area[J]. Science,2005,309(5743):2040-2042.
[16] Yuan B,Pan Y,Li Y,et al. A highly active heterogeneous palladium catalyst for the Suzuki-Miyaura and Ullmann coupling reactions of aryl chlorides in aqueous media[J]. Angewandte Chemie ,International Edition,2010,49(24):4054-4058.
[17] Liu H,Chen G,Jiang H,et al. From alkyl aromatics to aromatic esters:Efficient and selective C-H activation promoted by a bimetallic heterogeneous catalyst[J]. ChemSusChem,2012,5(10):1892-1896.
[18] Balu A M,Lin C S K,Liu H,et al. Iron oxide functionalized MIL-101 materials in aqueous phase selective oxidations[J]. Applied Catalysis,A:General,2013,455:261-266.
[19] Liu H,Li Y,Jiang H. Significant promoting effects of Lewis acidity on Au-Pd systems in the selective oxidation of aromatic hydrocarbons[J]. Chemical Communications,2012,48(67):8431-8433.
[20] Hwang Y K,Hong D Y,Chang J S,et al. Amine grafting on coordinatively unsaturated metal centers of MOFs:Consequences for catalysis and metal encapsulation[J]. Angewandte Chemie ,International Edition,2008,47(22):4144-4148.
[21] Pan Y,Yuan B,Li Y,et al. Multifunctional catalysis by Pd@MIL-101:One-step synthesis of methyl isobutyl ketone over palladium nanoparticles deposited on a metal-organic framework[J]. Chemical Communications,2010,46:2280-2282.
[22] Liu H,Liu Y,Li Y,et al. Metal-organic framework supported gold nanoparticles as a highly active heterogeneous catalyst for aerobic oxidation of alcohols[J]. Journal of Physical Chemistry C,2010,114(31):13362-13369.
[23] Liu H,Li Y,Luque R,et al. A Tuneable bifunctional watercompatible heterogeneous catalyst for the selective aqueous hydrogenation of phenols[J]. Advanced Synthesis & Catalysis,2011,353(17):3107-3113.
[24] Chen L,Chen H,Luque R,et al. Metal-organic framework encapsulated Pd nanoparticles:Towards advanced heterogeneous catalysts.[J]. Chemical Science,2014,5(10):3708-3714.
[25] Proch S,Herrmannsdörfer J,Kempe R,et al. Pt@MOF-177:Synthesis,room-temperature hydrogen storage and oxidation catalysis quick view other sources[J]. Chemistry:A European Journal,2008,14(27):8204-8212.
[26] Chen L,Chen H,Li Y. One-pot synthesis of Pd@MOF composites without the addition of stabilizing agents[J]. Chemical Communications,2014,50(94):14752-14755.
[27] Su D S,Perathoner S,Centi G. Nanocarbons for the development of advanced catalysts[J]. Chemical Reviews,2013,113(8):5782-5716.
[28] Yang Y,Chiang K,Burke N. Porous carbon-supported catalysts for energy and environmental applications:A short review[J]. Catalysis Today,2011,178(1):197-205.
[29] Zhu Q-L,Tsumori N,Xu Q. Sodium hydroxide-assisted growth of uniform Pd nanoparticles on nanoporous carbon MSC-30 for efficient and complete dehydrogenation of formic acid under ambient conditions[J]. Chemical Science,2014,5(1):195-199.
[30] Zhong W,Liu H,Bai C,et al. Base-free oxidation of alcohols to esters at room temperature and atmospheric conditions using nanoscale Co-Based catalysts[J]. ACS Catalysis,2015,5:1850-1856.
[31] Mahyari M,Shaabani A. Nickel nanoparticles immobilized on threedimensional nitrogen-doped graphene as a superb catalyst for the generation of hydrogen from the hydrolysis of ammonia borane[J]. Journal of Materials Chemistry A:Materials for Energy and Sustainability,2014,2(39):16652-16659.
[32] John J,Gravel E,Hagège A,et al. Catalytic oxidation of silanes by carbon nanotube-gold nanohybrids[J]. Angewandte Chemie International Edition,2011,50(33):7533-7536.
[33] 黄超,杨惠,杨旭,等. 介孔氧化硅负载贵金属催化剂研究进展[J]. 化工进展,2014,33,6:1459-1464.
[34] Ojeda M,Pineda A,Romero A A,et al. Mechanochemical synthesis of maghemite/silica nanocomposites:Advanced materials for aqueous room-temperature catalysis[J]. ChemSusChem,2014,7(7):1876-1880.
[35] Karimia B,Esfahani F K. Gold nanoparticles supported on the periodic mesoporous organosilicas as efficient and reusable catalyst for room temperature aerobic oxidation of alcohols[J]. Advanced Synthesis & Catalysis,2012,354(7):1319-1326.
[36] Zhang S,Gai S,He F,et al. In situ assembly of well-dispersed Ni nanoparticles on silica nanotubes and excellent catalytic activity in 4-nitrophenol reduction[J]. Nanoscale,2014,6(19):11181-11188.
[37] Ma C Y,Mu Z,Li J J,et al. Mesoporous Co3O4and Au/Co3O4catalysts for low-temperature oxidation of trace ethylene[J]. Journal of the American Chemical Society,2010,132(8):2608-2613.
[38] Shekhar M,Wang J,Lee W-S,et al. Size and support effects for the water-gas shift catalysis over gold nanoparticles supported on modelAl2O3and TiO2[J]. Journal of the American Chemical Society,2012,134(10):4700-4708.
[39] Liu J,Zou S,Li S,et al. A general synthesis of mesoporous metal oxides with well-dispersed metal nanoparticles via a versatile sol-gel process[J]. Journal of Materials Chemistry A:Materials for Energy and Sustainability,2013,1(12):4038-4047.
[40] Layek K,Kantam M L,Shirai M,et al. Gold nanoparticles stabilized on nanocrystalline magnesium oxide as an active catalyst for reduction of nitroarenes in aqueous medium at room temperature[J]. Green Chemistry,2012,14(11):3164-3174.
[41] 王喜兵,纪拓,李力成,等. Au/TiO2-B 催化剂的 CO 低温氧化性能[J]. 化工学报,2014,65(5):1636-1643.
[42] Chen B-B,Shi C,Crocker M. Catalytic removal of formaldehyde at room temperature over supported gold catalysts[J]. Applied Catalysis,B:Environmental,2013,132-133:245-255.
[43] 笪国进,欧阳李科,徐晶,等. 吡啶改性Pd/SiO2催化剂用于H2和O2直接合成H2O2[J]. 化工学报,2013,64(2):561-567.
[44] Bronstein L M,Shifrina Z B. Dendrimers as encapsulating,stabilizing,or directing agents for inorganic nanoparticles[J]. Chemical Reviews,2011,111(9):5301-5344.
[45] Dhital R N,Kamonsatikul C,Somsook E,et al. Low-temperature carbon-chlorine bond activation by bimetallic gold/palladium alloy nanoclusters:An application to Ullmann coupling[J]. Journal of the American Chemical Society,2012,134(50):20250-20253.
[46] Miyamura H,Matsubara R,Miyazaki Y,et al. Aerobic oxidation of alcohols at room temperature and atmospheric conditions catalyzed by reusable gold nanoclusters stabilized by the benzene rings of polystyrene derivatives[J]. Angewandte Chemie , International Edition,2007,46(22):4151-4154.
[47] Genna D T,Wong-Foy A G,Matzger A J,et al. Heterogenization of homogeneous catalysts in metal-organic frameworks via cation exchange[J]. Journal of the American Chemical Society,2013,135(29):10586-10589.
[48] Chen L,Rangan S,Li J,et al. A molecular Pd(II)complex incorporated into a MOF as a highly active single-site heterogeneous catalyst for C—Cl bond activation[J]. Green Chemistry,2014,16(8):3978-3985.
[49] Polshettiwar V,Baruwati B,Varma R S. Nanoparticle-supported and magnetically recoverable nickel catalyst:A robust and economic hydrogenation and transfer hydrogenation protocol[J]. Green Chemistry,2009,11(1):127-131.
[50] Kong G-Q,Ou S,Zou C,et al. Assembly and post-modification of a metal-organic nanotube for highly efficient catalysis[J]. Journal of the American Chemical Society,2012,134(48):19851-19857.
[51] Fernández-García M,Martínez-Arias A,Hanson J C,et al. Nanostructured oxides in chemistry : Characterization and properties[J]. Chemical Reviews,2004,104(9):4063-4104.
[52] Knözinger H. Perspective:Surface science:Catalysis on oxide surfaces[J]. Science,2000,287(5457):1407,1409.
[53] 范立群,隋吴彬. 金属氧化物纳米复合催化剂的研究进展[J]. 化工进展,2013,32(8):1832-1861.
[54] Li Y,Ji H,Chen C,et al. Concerted two-electron transfer and high selectivity of TiO2in photocatalyzed deoxygenation of epoxides[J]. Angewandte Chemie,International Edition,2013,52(48):12636-12640.
[55] Shiraishi Y,Hirakawa H,TogawaY,et al. Noble-metal-free deoxygenation of epoxides:Titanium dioxide as a photocatalytically regenerable electron-transfer catalyst[J]. ACS Catalysis,2014,4(6):1642-1649.
[56] Xie X,Li Y,Liu Z Q,et al. Low-temperature oxidation of CO catalysed by Co3O4nanorods[J]. Nature,2009,458(7239):746-749.
[57] Cañeque T,Truscott F M,Rodriguez R,et al. Electrophilic activation of allenenes and allenynes:Analogies and differences between Bronsted and Lewis acid activation[J]. Chemical Society Reviews,2014,43(9):2916-2926.
[58] Busca G. Acid catalysts in industrial hydrocarbon chemistry[J]. Chemical Reviews,2007,107(11):5366-5410.
[59] Toshio Okuhara. Water-tolerant solid acid catalysts[J]. Chemical Reviews,2002,102(10):3641-3665.
[60] Climent M J,Corma A,Iborra S. Heterogeneous catalysts for the onepot synthesis of chemicals and fine chemicals[J]. Chemical Reviews,2011,111(2):1072-1133.
[61] Liu F,Sun J,Zhu L,et al. Sulfated graphene as an efficient solid catalyst for acid-catalyzed liquid reactions[J]. Journal of Materials Chemistry,2012,22(12):5495-5502.
[62] Horike S,Dincǎ M,Tamaki K,et al. Size-selective lewis acid catalysis in a microporous metal-organic framework with exposed Mn2+coordination sites[J]. Journal of the American Chemical Society,2008,130(18):5854-5855.
