聚合氯化铝投加时间对好氧颗粒污泥的形成和胞外聚合物的影响
2015-07-25王亚利刘永军刘喆程祯李星杨贺棋
王亚利,刘永军,刘喆,程祯,李星,杨贺棋
(西安建筑科技大学环境与市政工程学院,陕西 西安 710055)
好氧颗粒污泥的技术研究一直都是国内外学者研究的热点问题[1]。与普通的活性污泥相比,好氧颗粒污泥具有沉降性能好[2],可以同步实现脱氮除磷[3]等优点,应用和研究前景良好。然而常规条件下,好氧颗粒污泥形成周期较长,一般在90 天左 右[4-5],这成为限制其广泛应用和发展的重要原因之一。近年来,许多研究发现锌、镁、钙[6-7]等具有混凝性能的金属离子的添加可以有效缩短颗粒污泥形成周期。而聚合氯化铝(poly aluminium chloride,PAC)用于水处理领域已有很长的历史,它在一般条件下就可以促进水中微小悬浮物质和胶体物质聚集、成长。目前关于颗粒污泥的形成,普遍认为与胞外聚合物(extracellular polymeric substances,EPS)的产生有关[8-9]。EPS 是细菌和其他微生物在一定环境条件下产生的用于自我保护和相互黏附的高分子聚合物[10],它普遍存在于污泥絮体的内部及表面,包含有多糖、蛋白质、脂类和核酸等。虽然目前许多研究者已经对EPS的组成及其物化性质进行了一些研究,然而,EPS 对好氧颗粒污泥颗粒化的影响仍不很明确[11]。
本研究通过在颗粒污泥培养初期的不同时间投加聚合氯化铝,研究不同操作条件下好氧颗粒污泥的形成过程,分析该条件对EPS总量及其各组分在颗粒培养进程中的变化及作用,并观察颗粒污泥中EPS 的空间分布情况,进一步了解不同组分的EPS对好氧颗粒污泥的影响。
1 材料与方法
1.1 实验装置及运行
本实验采用两个相同的双层透明有机玻璃制成的序批式活性污泥(SBR)反应器R1、R2,其有效容积为2.4L,内径为50mm,高为1500mm,高径比(H/D)为30。实验装置底部设砂芯曝气头,采用空气泵曝气,通过LZB-6型玻璃转子流量计控制曝气量,曝气量为3L/min。反应器的上部设有进水口,中部设排水口,每周期的换水量为1.2L。
SBR 反应器在室温下运行,每天运行4 个周期,每个周期6h,每个周期运行时间由时间继电器控制。反应器采用进水、曝气、沉淀、排水、闲置的运行方式。其中,进水、排水、闲置时间分别为5min、5min、35min。在反应器启动的前7 天,沉淀时间由15min逐渐调整至5min,曝气时间则从最初的300min 调整至310min;从第8 天开始,反应器的曝气时间为310min,沉淀时间为5min。另外,通过实验确定在反应器R1 运行的第1~7 天和反应器R2 运行的第8~14 天投加PAC。PAC 在每天前两个周期的闲置阶段人工投加,投加量为50mL,浓度为20g/L。
1.2 接种污泥和进水水质
本实验接种所用的活性污泥来源于西安市第四污水处理厂(A2/O 工艺)的二沉池回流污泥,该污泥呈深褐色,悬浮固体浓度(MLSS)约为8500mg/L,污泥容积指数(SVI)为115,每个反应器的污泥接种量均为1.2L。
实验用水采用人工模拟废水,组成成分为:葡萄 糖 1000mg/L,NH4Cl 200mg/L,CaCl2·2H2O 30mg/L,MgSO4·7H2O 25mg/L, K2HPO4·3H2O 45mg/L,FeSO4·7H2O 20mg/L, H3BO30.15µg/L,Na2Mo7O24·2H2O 0.06µg/L , CuSO4·5H2O 0.03µg/L , MnCl2·2H2O 0.12µg/L , ZnSO4·7H2O 0.12µg/L,CoCl2·6H2O 0.15µg/L, KI 0.03µg/L,Na2Mo7O24· 2H2O 0.06µg/L,FeCl3·6H2O 1.5µg/L。
1.3 分析方法
(1)好氧颗粒污泥的MLSS、SVI、密度、含水率、强度及COD、氨氮的去除效果均按标准方法测定[12]。
(2)污泥形态采用数码相机采集照片,粒径分布采用激光粒径分布仪(型号为LS230)测定。
(3)本实验中,采用TOC 表征污泥中EPS 的总量。颗粒污泥EPS 的提取采用阳离子树脂交换 法[13],多糖的测定采用蒽酮-硫酸分光光度计法,以葡萄糖作为标准样品;蛋白质的测定采用Lowry法,以牛血清蛋白作为标准样品;TOC 采用TOC分析仪(型号为岛津TOC-V CPH)进行测定。
(4)多重荧光染色
本实验通过对好氧颗粒污泥EPS中蛋白质、多糖、脂类等及活细胞进行荧光染色,以观察其各自在颗粒污泥中的空间分布。
在实验中,异硫氰酸荧光素(FITC)用于胞外蛋白质的染色;Con A(Tetramethylrhodamine conjugates of Concanvalin A)用来指示α-呋喃葡萄糖和α-甘露糖残基;卡尔科弗卢尔荧光增白剂(Calcofluor white)用来染色β-D-呋喃葡萄糖基;尼罗红(Nile red)用以指示脂类及疏水基团;使用SYTO 63染色颗粒污泥中活细胞。颗粒污泥经染色后用冰冻切片机进行切片(厚度为40~60μm),再使用激光共聚焦显微镜(Leica TCS SP5)进行观察。多重荧光染色所用荧光染料的激发波长和发射波长见表1。FITC 和尼罗红购自美国Mpbio 公司;Calcofluor white 购自美国Sigma 公司;Con A 和SYTO 63 购自美国invitrogen 公司。染色具体步骤参照文献[14]。
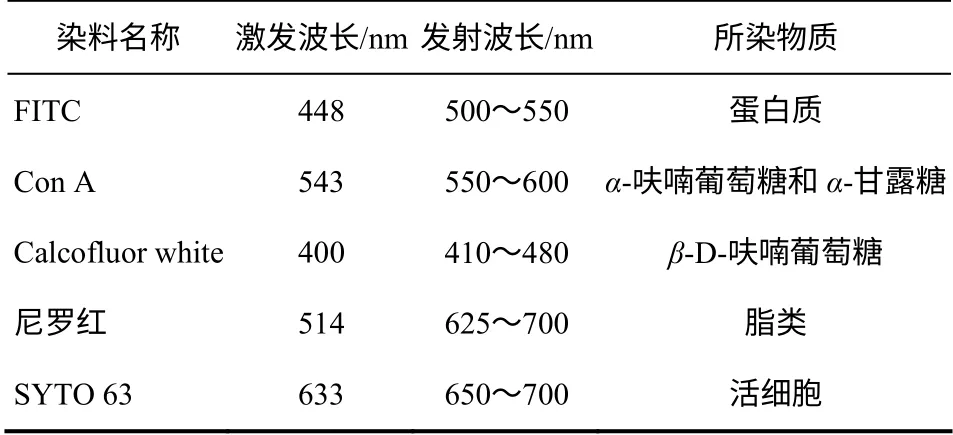
表1 颗粒污泥多重荧光染色所用染料的激发及发射波长
2 结果与讨论
2.1 强化造粒条件下颗粒污泥的形成
2.1.1 好氧颗粒污泥的培养
本实验中,两个反应器运行了49 天。接种时污泥呈絮状,结构松散,形态不规则。在两个反应器启动的1~7 天,通过不断缩短沉淀时间,增加水力选择压,筛选出沉降性能较好的污泥,同时反应器内污泥形态等方面发生重大变化,颜色也逐渐由深褐色变为浅黄色,污泥的沉降性能均得到明显改善,反应器R1、R2 的SVI 值分别下降至65mg/L和80mg/L 左右。在R1 投加混凝剂的第6 天,反应器内开始出现白色透明壳状物,该物质不断增多,在反应器运行的第10 天,已形成大量白色透明物质,如图1(a),推测这种物质主要由有机物和无机物组成;随着反应器的运行,微生物大量繁殖,反应器内污泥量增加,从第8 天开始向反应器R2 内投加混凝剂,污泥迅速聚集形成大量浅黄色粒状物如图1(d)。
在反应器R1 中,由于白色透明物质强度小,在水力剪切作用下,大量粒状物开始破裂,形成片状物质,图1(b)为第15 天反应器R1 内污泥片状物形态。在反应器运行过程中,大量污泥絮体进入颗粒前体内部,在微生物胞外聚合物的粘结作用下,形成颗粒内部结构。片状物逐渐变黄,在污泥培养的第30 天,污泥完全颗粒化如图1(c)。在反应器R2 中,在水力剪切力下,通过电中和,吸附架桥等作用,粒状物粒径明显增大,到第15 天时反应器内污泥形态如图1(d)。15 天后,已经停止投加PAC,松散的污泥和粒状物相互凝聚,聚集在一起,粒状物粒径逐渐增加,在第24 天污泥完全颗粒化,比R1 提前了6 天,如图1(f)为第30 天R2中颗粒污泥形态。
2.1.2 好氧颗粒污泥的特性
由图1(c)和图1(f)可以看出:本实验中反应器R1 和R2 中均培养出呈椭圆形,颜色为黄色,形状规则,边缘清晰光滑的好氧颗粒污泥。测定表明:这个时期R1、R2 中MLSS 分别达到6500mg/L 和6900mg/L,SVI 分别为35mg/L 左右和25mg/L 左右。由表2 可以看出,反应器R2 中颗粒污泥比R1中的污泥含水率较低,相对密度更大,颗粒强度也更高。说明强化造粒条件下在第8~14 天投加混凝剂形成的好氧颗粒污泥微生物聚集紧密,结构紧凑,具有较良好的沉降性能。
表3 显示了成熟期两个反应器内颗粒粒径分布情况,由此可以看出,R1 中颗粒有65%分布在736.9~1941.0µm,而R2 中65%的颗粒粒径分布在593.9~1664.0µm,说明R2 中颗粒粒径分布较为均匀,且粒径明显小于反应器R1,有利于基质的传递,耐负荷冲击能力更强。而R2 中污泥在成熟期SVI 在25%左右,说明R2 中颗粒结构较为紧凑。

图1 两种反应器分别培养10 天,15 天,30 天的污泥形态

表2 颗粒污泥的基本特性
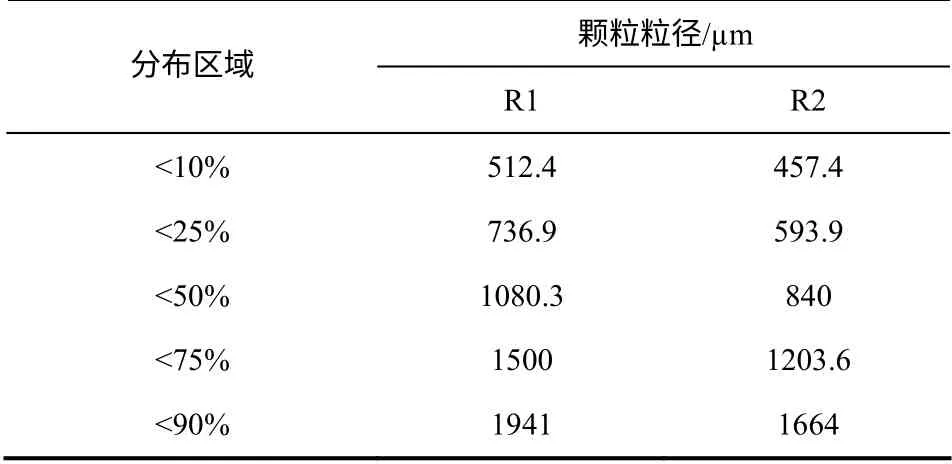
表3 颗粒粒径分布
反应器R1 和R2 分别在第6 天和第8 天开始出现细小颗粒,颗粒在第32天和第25天颗粒成熟(颗粒平均粒径达到600µm 视为成熟期)。表4 反映了在颗粒形成期(R1,6~32 天;R2,8~25 天)和成熟期(R1,32 天以后;R2,25 天以后)两个反应器中COD 和NH4+-N 的平均去除率,结果表明在颗粒形成期每个反应器的污染物平均去除率均比成熟期时稍低,这是因为PAC 的投加会对污泥活性有一定的毒害作用,影响污泥对污染物的去除效果。对比两个反应器,在整个实验中,两者对COD 和NH4+-N 的去除作用差别不大,均具有良好的污染物去除性能。综上说明混凝剂的投加时间对成熟好氧颗粒污泥的去污特性没有不良影响。
2.2 好氧颗粒污泥中不同EPS 的含量变化
2.2.1 颗粒污泥中EPS 各成分含量变化
EPS 是微生物在一定环境条件下形成的天然有机物,对好氧颗粒的形成和保持有紧密的关系。图2 为反应器R1、R2 随着培养天数的增加不同组分EPS 含量的变化情况。
由图2 可知,在整个实验过程中,两个反应器中EPS 总量和蛋白质(PN)、多糖(PS)的含量变化趋势大致相同:在颗粒化进程中,EPS 总量和PN 含量大幅增加,在颗粒形成阶段达到最高,之后两者含量均逐渐降低,在颗粒成熟时期趋于稳定;而PS 的含量只有在反应器启动初期有小幅增长,之后呈波动变化,说明颗粒的形成与PS 的含量相关性不大。PN 的含量远远高于PS,在EPS 中占较大的比例。
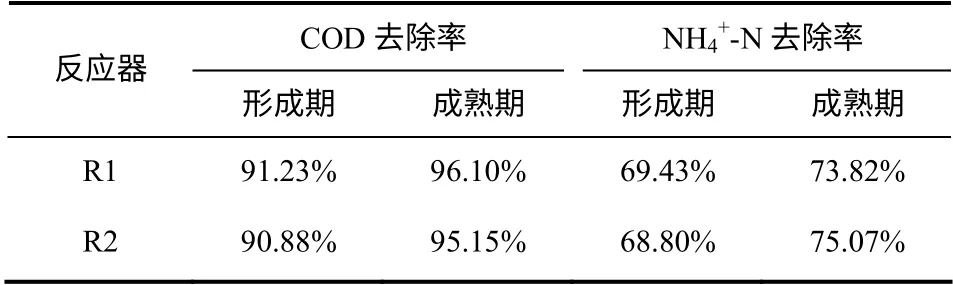
表4 COD、NH4+-N 的去除率
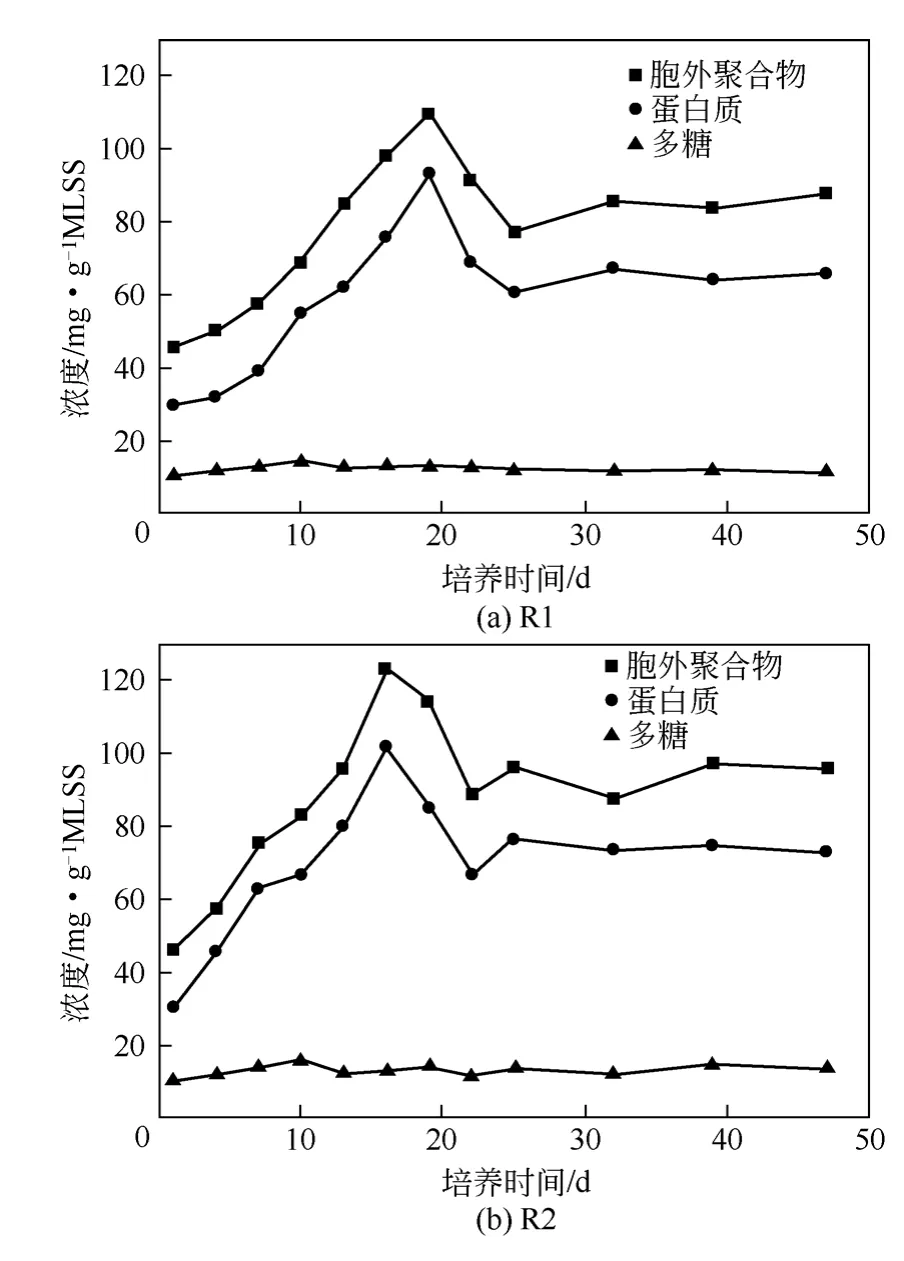
图2 EPS 总量、蛋白质和多糖含量变化情况
在反应器启动时,R1、R2 中的EPS 总量分别为45.46mg/gMLSS 和46.11mg/gMLSS,PN 的浓度分别分别为29.76mg/gMLSS 和30.23mg/gMLSS。运行初期(运行第一周),两个反应器中EPS 总量和PN 浓度均有增加,但R1 的增长幅度小于R2,这可能是由于混凝剂的投加对微生物的毒害作用影响了胞外聚合物的合成或分泌。之后反应器内污泥量不断增加,微生物也迅猛增殖,分泌大量EPS,EPS 含量迅速增加。R1 中EPS 和PN 含量的峰值浓度分别是109.26mg/gMLSS 和92.72mg/gMLSS,R2中EPS 和PN 含量最高达到123.15mg/gMLSS 和101.92mg/gMLSS。缩短沉降时间可能会刺激细胞产生多糖[15],因此在反应器启动阶段反应器R1 和R2 中PS 的含量分别从10.31mg/gMLSS、10.07mg/ gMLSS 增 加 到 14.53mg/gMLSS 和 15.92mg/ gMLSS,在之后的污泥培养过程中多糖含量无明显变化。此时反应器内的污泥处于颗粒形成阶段。
在颗粒成熟时期,EPS 总量及其各组分的含量比颗粒形成阶段略有降低均有稳定的趋势。R1 中EPS、PN、PS 的平均含量分别为 82.66mg/ gMLSS、63.43mg/gMLSS、11.87mg/gMLSS,R2中 EPS、PN、PS 的平均含量分别为 94.98mg/ gMLSS、72.91mg/g MLSS、13.39mg/gMLSS。
EPS 带有大量负电荷而呈负电性,在7~14 天时反应器中EPS 总量和PN 的浓度均比1~7 天时高,在此时投加的PAC 和水中的阳离子能中和更多的EPS中的负电基团,减小细胞或污泥絮体之间的静电斥力,增加了相互之间的亲和力,有利于颗粒污泥的形成; EPS 中PN 容易与金属离子通过静电作用而键和[16],降低细胞表面的负电性,促进污泥的絮凝作用,同时PN 中含有大量疏水基团,其含量的变化会改变微生物的表面性质,从而促进污泥的颗粒化进程;其次,在反应器R2 中EPS 含量从整体上高于R1 中的含量,EPS 能够通过架桥作用使微生物群体形成三维结构,使微生物之间结合紧密更好的进行生化作用,微生物颗粒结构也更坚 固[1]。综上可知,在第7~14 天投加混凝剂更有利于污泥的凝聚作用,促进颗粒污泥的形成,进而使颗粒污泥的形成时间更短。
2.2.2 PN/PS 的变化
图3 显示了两个反应器在运行过程中蛋白质与多糖的比值(PN/PS)的变化情况。
由图3 可以看出:在好氧颗粒污泥形成过程中,PN/PS 呈明显增大趋势,随着颗粒稳定,该比值略有下降,并在颗粒成熟稳定在一定范围之内。启动时反应器R1 和R2 的PN/PS 值分别为2.89 和3.00,在颗粒形成时期最高分别达到7.16 和7.83,比启动时增加了超过2.5 倍,这与张丽丽等[17]和Tay 等[18]的研究结果相似。
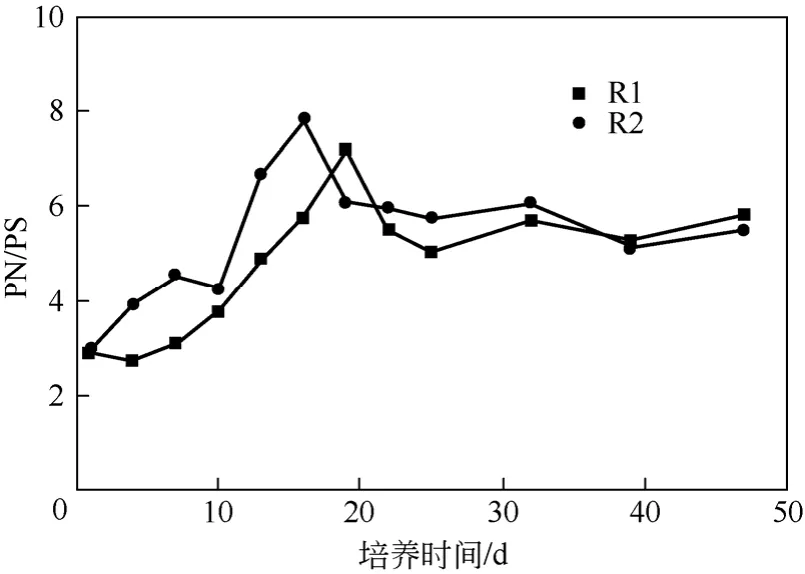
图3 反应器运行过程中PN/PS 的变化情况
在本实验中,在颗粒形成过程中,PN/PS 逐渐增大,污泥的表面疏水性随PN/PS 值的增加而增 加[17],细胞表面疏水性的增加与颗粒污泥的形成有密切联系[19]。细胞疏水性能的增加能够降低细胞Gibbs 表面自由能,加强细胞间的亲和力,促进细胞聚集,有利于形成结构稳定的好氧颗粒。细菌一般带有负电荷,EPS 中含有带正电荷的氨基和带有负电荷的羧基和磷酸基,PN 含量的增加能够中和PS 中负电官能团所产生的负电荷,从而降低了微生物表面的负电荷,降低微生物细胞的Zeta 电位,根据DLVO 理论,这样可以减小细胞之间的静电斥力,有利于污泥聚集,PN/PS 的增大增加了这种趋势,有利于颗粒的形成。也就是说EPS 中PN/PS 比值的提高可以促进污泥颗粒化进程。
2.3 EPS 不同组分的空间分布
多重荧光染色(图4)显示两个反应器的颗粒污泥中活细胞及不同EPS 的空间分布情况。
R1 的EPS染色结果[图4(R1)]表明:蛋白质(绿色)和α-呋喃葡萄糖和α-甘露糖(浅蓝色)都均匀分布在好氧颗粒污泥整个断面上,分布情况较为类似;β-D-呋喃葡萄糖(蓝色)大部分分布在颗粒的外侧;脂类(黄色)大部分分布在颗粒内部,少量散落在颗粒外侧;活细胞(红色)集中分布在颗粒内部。R2 的多重荧光染色[图4(R2)]呈现出和反应器R1 不同的分布特点。R2 的颗粒污泥中,蛋白质和α-呋喃葡萄糖和α-甘露糖在整个颗粒断面上均有分布,且外侧分布较多;β-D-呋喃葡萄糖集中分布在颗粒核心位置;脂类大部分分布在颗粒外侧,只有少量分布在颗粒核心位置;活细胞分布在颗粒 外侧。
反应器R1 和R2 中蛋白质和α-呋喃葡萄糖和α-甘露糖在好氧颗粒污泥断面上均有分布,猜测这两种物质对颗粒结构稳定性的保持有重要作用。蛋白质颜色比较明显,亮度高于EPS其他成分,说明其含量比EPS其他组分的含量多,可以认为蛋白质为EPS 的主要组成部分。Chen 等[20]发现蛋白质分布在颗粒的内部,α-呋喃葡萄糖和α-甘露糖分布在颗粒外侧;高景峰等[21]的研究结果与反应器R1 相符。
反应器R1 中的β-D-呋喃葡萄糖集中分布在颗粒外侧,与高景峰等[22]和Chen 等[23]的研究结果相似。而反应器R2 中呈现出β-D-呋喃葡萄糖分布在颗粒内核的特点,Chen 等[14]对以乙酸钠和丙酸钠作为附加碳源培养的好氧颗粒污泥进行染色,发现处理乙酸钠废水的颗粒污泥和处理苯酚废水的颗粒污泥中β-D-呋喃葡萄糖均分布在颗粒内核处。而Adav 等[24]通过对经过水解酶处理的颗粒染色,发现只有β-D-呋喃葡萄糖的水解会引起颗粒解体,认为β-D-呋喃葡萄糖为颗粒的骨架,对颗粒的结构稳定性影响最大。
由图4 可以看出脂类的分布情况与活细胞较为相似,且有活细胞分布的范围均有脂类出现,推测活细胞新陈代谢会产生脂类,细胞的凋亡可能会释放少量脂类。Adav 等[24]的研究发现脂类分布在颗粒外侧,与本研究中反应器R2 的结果相似;Adav等[25]的研究发现脂类在整个颗粒断面均有分布,与本研究结果不同。
R1 中颗粒污泥的活细胞分布在颗粒内部,而R2 中的活细胞存在于相对外层位置,推测这与颗粒的形成过程有密切关系。反应器R1 中,微生物是在颗粒形成过程中以填充的形式进入颗粒内部,基质和氧气充足,细胞能够正常新陈代谢,形成了活细胞独特的分布情况。反应器R2 运行过程中,首先形成内部“晶核”,微生物不断包裹内核,形成颗粒,氧气和基质受到传质阻力,不能到达颗粒内部,不足以支持细胞的生命活动,导致颗粒污泥内核位置不存在活细胞。McSwain 等[26]和Lee 等[27]研究发现活细胞分布在颗粒外侧,与R2的结果相同。
在本实验中,对比两个反应器,在不同时间投加PAC,颗粒污泥中不同组分的EPS呈现出不同的分布特点。其中分布最广泛的是蛋白质和α-呋喃葡萄糖和α-甘露糖,受到PAC 投加影响最小,而β-D-呋喃葡萄糖、脂类和活细胞空间分布情况各不同。每个反应器中,颗粒污泥中的α-呋喃葡萄糖和α-甘露糖和β-D-呋喃葡萄糖的分布范围和数量都很不相同,说明这两种物质的生成环境和其对颗粒污泥形成和稳定性的影响均有所不同。对比国内外研究和本实验,发现不同操作条件下所培养颗粒的EPS 及活细胞的分布有很大的不同,但其分布形成原因仍不很明确,有待进一步研究。
3 结 论
(1)在反应器运行第8~14 天投加PAC 比在第1~7 天投加混凝剂形成颗粒更快,且形成的颗粒形状规则,粒径分布均匀,结构紧凑,机械强度好,对污染物的去除效率良好,具有良好的沉降性能。
(2)颗粒污泥中不同EPS含量变化结果表明:颗粒形成过程中,污泥中EPS总量和蛋白质呈现出增加的趋势,多糖含量稍有增加,之后EPS含量和蛋白质略有下降,并在颗粒稳定后趋于稳定,而多糖含量始终变化不大;并且在8~14 天投加PAC,污泥中EPS总量和蛋白质含量较高,更有利于污泥颗粒化。
(3)混凝剂的投加时间对EPS 和活细胞的空间分布有较大影响。蛋白质和α-呋喃葡萄糖、α-甘露糖的分布较为均匀,受操作条件不同的影响较小,而β-D-呋喃葡萄糖、脂类和活细胞在不同操作条件下分布较为不同,在1~7 天投加PAC 形成的颗粒中β-D-呋喃葡萄糖分布在颗粒外侧,脂类大部分则集中在颗粒内部,活细胞分布在颗粒内部;在8~14 天投加PAC 形成的颗粒中β-D-呋喃葡萄糖分布在内核位置,活细胞和大部分脂类分布在颗粒外侧。
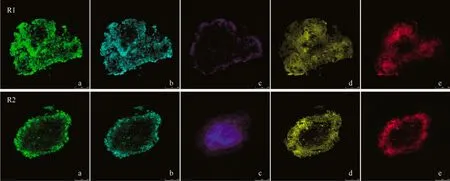
图4 好氧颗粒污泥的多重荧光染色
[1] 朱灵峰,何卫卫,张杰. 好氧颗粒污泥的研究现状及应用前景[J]. 环境污染与防治,2008,30(5):78-82.
[2] Di Iaconi,C,Ramadori R,Lopez A,et al. Hydraulic shear stress calculation in a sequencing batch biofilm reactor with granular biomass[J]. Envioronmental Science & Technology,2005,39(3):889-894.
[3] 陈冉妮,高景峰,郭建秋,等. 好氧颗粒污泥同步脱氮除磷的常温启动和低温维持[J]. 环境科学,2009,30(10):2995-3001.
[4] 梁梦晓,倪晋仁. SBR 中好氧颗粒污泥的培养及特性研究[J]. 应用基础与工程科学学报,2009,17(4):502-512.
[5] 黄国富,王成端. 2 种反应器中好氧颗粒污泥培养的比较研究[J]. 环境污染与防治,2009,31(4):48-52.
[6] 肖蓬蓬,曹德菊,李浩,等. 同步脱氮除磷好氧颗粒污泥形成与反应机制的研究[J]. 四川农业大学学报,2012,30(3):342-347.
[7] Li Xiaoming,Liu Qianqian,Yang Qi,et al. Enhanced aerobic sludge granulation in sequencing batch reactor by Mg2+augmentation[J]. Bioresource Technology,2009,100(1):64-67.
[8] Liu Yong-qiang,Liu Yu,Tay Joo-Hwa. The effects of extracellular polymeric substances on the formation and stability of biogranules[J]. Applied Microbiology and Biotechnology,2004,65(2):143-148.
[9] Wang Zhiping,Liu Lili,Yao Jie,et al. Effects of extracellular polymeric substances on aerobic granulation in sequencing batch reactors[J]. Chemosphere,2006,63(10):1728-1735.
[10] 王洪武,李晓岩,赵庆祥. 胞外聚合物对活性污泥沉降和絮凝性能的影响研究[J]. 中国安全科学学报,2003,13(9):31-34.
[11] 廖青,李小明,杨麒,等. 好氧颗粒污泥的快速培养以及胞外多聚物对颗粒化的影响研究[J]. 工业用水与废水,2008,39(4):13-19.
[12] 国家环境保护总局. 水和废水监测分析方法[S]. 第4 版. 北京:中国环境科学出版社,2002.
[13] Wilen Britt marie,Jin Bo,Lant Paul. The influence of key chemical constituents in activated sludge on surface and flocculating properties[J]. Water Research,2003,37(9):2127-2139.
[14] Chen Ming Yuan,Lee Duu Jong,Tay Hwa. Staining of extracellular polymeric substances and cells in bioaggregates[J]. Appl. Microbiol. Biotechnol.,2007,75(2):467-474.
[15] Qin Lei,Tay Joo Hwa,Liu Yu. Selection pressure is a driving force of aerobic granulation in sequencing batch reactors[J]. Process Biochemistry,2004,39(5):579-584.
[16] Laspidou Chrysi S,Rittmann Bruce E. A unified theory for extracellular polymeric substances,soluble microbial products,and active and inert biomass[J]. Water Research,2002,36(11)2711-2720.
[17] 张丽丽,陈效,陈建孟,等. 胞外多聚物在好氧颗粒污泥行程中的作用机制[J]. 环境科学,2007,28(4):795-799.
[18] Tay Joo -Hwa,Pan Shun,He Yanxin,et al. Effect of organic loading rate on aerobic granulation. Ⅱ:Charactoristics of aerobic granules[J]. Journal of Environmrnal Engineering,2004,130(10):1102-1109.
[19] 蔡春光,刘军深,蔡伟民. 胞外多聚物在好氧颗粒化中的作用机理[J]. 中国环境科学,2004,24(5):623-626.
[20] Adav Sunil S,Lee Duu-Jong. Extraction of extracellular polymeric substances from aerobic granule with compact interior structure[J]. Journal of Hazardous Materials,2008,154(1-3):1120-1126.
[21] 高景峰,张倩,王金惠,等. 颗粒活性炭对SBR 反应器中好氧颗粒污泥培养的影响研究[J]. 应用基础与工程科学学报,2012,3(20):345-354.
[22] 高景峰,陈冉妮,等. 同步脱氮除磷好氧颗粒污泥形成与反应机制的研究[J]. 环境科学,2010,31(4);1021-1029.
[23] Chen M Y,Lee D J,Tay J H. Distribution of extracellular polymeric substances in aerobic granules[J]. Applied Microbiology and Biotechnology,2007,73(6):1463-1469.
[24] Adav Sunil S,Lee Duu Jong,Tay Joo-Hwa. Extracellular polymeric substances and structural stability of aerobic granule[J]. Water Research,2008,4(6-7):1644-1650.
[25] Adav Sunil S,Lee Duu Jong,Ren N Q. Biodegradation of pyridine using aerobic granules in the presence of phenol[J]. Water Reserch,2007,41(13):2903-2910.
[26] McSwain B S,Irvine R L,Hausner M,et al. Composition and distribution of extracellular polymeric substances in aerobic flocs and granular sludge[J]. Appl. Environ. Microbiol.,2005,71(2)1051-1057.
[27] Lee Duu Jong,Chen Yu You,Show Kuan Yeow,et al. Advances in aerobic granule formation and granules stability in the course of storage and reactor operation[J]. Biotechnology Advances,2010,28(6):919-934.
