延龄草正丁醇萃取物对大鼠非酒精性脂肪性肝病的改善作用及对抗氧化酶活性和肝内质网应激的影响
2015-07-24陈显兵谭志鑫覃芙蓉朱晓静李金涛何巧媛
陈显兵,谭志鑫,覃芙蓉,朱晓静,李金涛,何巧媛
(1.生物资源保护与利用湖北省重点实验室,湖北恩施445000;2.湖北民族学院医学院,湖北恩施445000)
延龄草正丁醇萃取物对大鼠非酒精性脂肪性肝病的改善作用及对抗氧化酶活性和肝内质网应激的影响
陈显兵1,2,谭志鑫2,覃芙蓉2,朱晓静2,李金涛2,何巧媛2
(1.生物资源保护与利用湖北省重点实验室,湖北恩施445000;2.湖北民族学院医学院,湖北恩施445000)
目的探讨延龄草(TTM)正丁醇萃取物对非酒精性脂肪肝的治疗作用,并探讨其可能的作用机制。方法50只Wistar大鼠分成5组,正常对照组、高脂模型组、模型+TTM正丁醇萃取物50,100和200 mg·kg-1组。高脂模型组喂高脂饲料;给药组喂高脂饲料4周后ig给予TTM正丁醇萃取物,每天1次,共6周。取大鼠肝组织HE常规染色及苏丹Ⅲ染色观察肝组织病理变化和肝脂肪变性程度。用全自动生化分析仪测定血清谷丙转氨酶(GPT)和谷草转氨酶(GOT)活性、总胆固醇(TC)和甘油三酯(TG)水平及肝匀浆中谷胱甘肽过氧化物酶(GSH-Px)和丙二醛(MDA)含量的变化。免疫组织化学法和RT-PCR测定肝组织葡萄糖调节蛋白78(GRP78)蛋白和mRNA表达。结果模型组肝脂肪变性程度、血清GPT和GOT活性、TC和TG水平及肝组织MDA含量均高于正常对照组(P<0.05),肝组织GSH-Px含量明显低于正常对照组(P<0.05)。TTM正丁醇萃取物50,100和200 mg·kg-1组肝组织脂肪变性程度、血清GPT和GOT活性和MDA含量均低于模型组(P<0.05),各剂量组间无明显差异。与正常对照组相比,模型组肝组织GRP78 mRNA和蛋白表达增加(P<0.01)。与模型组相比,TTM正丁醇萃取物50,100和200 mg·kg-1组肝组织GRP78 mRNA和蛋白表达明显降低(P<0.05),不同剂量组间无明显差异。结论TTM正丁醇萃取物能有效减轻非酒精性脂肪肝大鼠肝损伤和脂肪变性程度,该作用可能与其提高非酒精性脂肪肝的抗氧化酶活性及降低肝组织内质网应激作用有关。
延龄草;葡萄糖调节蛋白78;脂肪肝,非酒精性;内质网应激
DOl:10.3867/j.issn.1000-3002.2015.04.008
随着经济的发展和生活水平的提高,非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)的发病率均达到相当高的水平,逐渐成为继病毒性肝炎之外的第一大病因。NAFLD发病机制尚不十分清楚,但已有研究表明,线粒体呼吸活动增加,生成大量的活性氧(reactive oxygen species,ROS),增强肝组织氧化应激反应会严重危害肝功能[1]。葡萄糖调节蛋白78(glucose regulated protein 78,GRP78)是位于内质网上的一种分子伴侣蛋白,在氧化应激时大量表达以维持内质网的稳定,被看作是内质网应激(endoplasmic reticulum stress,ERS)的标志性蛋白[2]。研究表明,ERS信号通路及其效应与NAFLD关系密切[3]。
目前,尚无治疗药物可根治NAFLD。因此,研发安全有效干预NAFLD的药物具有重大意义。延龄草(Trillium tschonoskiiMaxim.,TTM)又名头顶一颗珠,系百合科延龄草属植物延龄草的干燥根茎(俗称地珠)。作为土家族地区的珍稀植物,被土家族人奉为“神药”。研究表明,TTM主要含甾体皂苷、黄酮苷及倍半萜苷等有效成分[4],延龄草苷具有抗癌、抗炎、镇痛、提高免疫力、改善心功能和降压以及抗衰老等作用[5-6]。本研究拟通过制备大鼠脂肪肝模型,观察TTM正丁醇萃取物对NAFLD的影响,并探讨其可能的作用机制,为TTM应用于NAFLD的预防及辅助治疗提供科学依据。
1 材料与方法
1.1 药物、主要试剂和仪器
TTM于2013年9月采自巴东及神农架林区,经湖北民族学院医学院中药实验室鉴定为延龄草(百合科延龄草属)。药材经60℃恒温烘箱干燥后粉碎,用75%乙醇浸泡24 h后回流提取,将提取液滤过并减压浓缩、干燥,得TTM总提取物。然后加适量去离子水至总提取物全部溶解,水饱和的正丁醇萃取,减压浓缩干燥,得TTM正丁醇萃取物。延龄草苷对照品(≥98%),北京北纳创联生物技术研究院,延龄草苷对照品制作标准曲线,紫外光分光光度计波长550 nm测定TTM总皂苷含量为14.72 mg·g-1正丁醇萃取物。
谷胱甘肽过氧化物酶(glutathione eroxidase,GSH-Px)和丙二醛(malondialdehyde,MDA)试剂盒,南京建成生物工程研究所;总胆固醇(total cholesterol,TC)和甘油三酯(triglycerides,TG)检测试剂,美国Beckman公司;兔抗大鼠GRP78抗体,武汉博士德生物工程有限公司;GRP78和GAPDH引物由上海生物工程公司合成,GRP78引物:5′-TCTGGTTGGCGGATCTACTC-3′(上游),5′-TC-TTTTTGTCAGGGGTCGTTC-3′(下游);GAPDH:5′-GCAAGTTCAACGGCACAG-3′(上游),5′-AGGTGGAAGAATGGGAGTTGCT-3′(下游),扩增产物长度分别为345和723 bp;Trizol提取试剂盒和RT-PCR试剂盒,上海生物工程公司。Mastercycler pro PCR扩增仪,德国Eppendorf公司;Leica 1850冰冻切片机,Leica 2245石蜡切片机,德国Leika公司;HPIAS-1000病理图文分析系统,武汉千屏有限技术公司。
1.2 实验动物、分组及处理
健康12周龄Wistar大鼠50只,由湖北省实验动物中心提供,动物许可证号:SCK(鄂)2008-0014,雌雄不限,体质量150~180 g,常规喂养1周后分为正常对照组(普通饲料喂养)、高脂模型组(在普通饲料中添加胆固醇2%、猪油10%和鸡蛋5%)、模型+TTM正丁醇萃取物50,100和200 mg·kg-1(高脂饲料喂养4周后开始ig给药,每天1次,持续6周)。正常对照和模型组给予相同体积蒸馏水。按上述要求,每组10只分笼饲养,自由饮水。喂养10周后,禁食12 h,心脏取血,4℃,1200×g离心15 min制备血清。处死大鼠,迅速取出肝组织,在左肝叶同一部位,分成3份,一份用4℃生理盐水冲洗,滤纸吸干后,以4%多聚甲醛溶液固定,用于HE染色观察肝组织结构;一份立即制作冰冻切片,进行苏丹Ⅲ染色,用于观察脂肪变性程度;剩余组织-80℃保存,用于抗氧化酶活性和GRP78 mRNA等检测。
1.3 一般情况的观察
实验前后观察各组大鼠体质量、毛发及死亡情况。
1.4 肝外观、组织病理变化和脂肪变性的观察
观察各组大鼠肝外观形态、体积、颜色及质地的变化,并将上述肝组织常规HE染色和苏丹Ⅲ染色。①4%多聚甲醛固定,石蜡包埋切片,常规HE染色观察炎细胞浸润及纤维化程度。②苏丹Ⅲ染色观察肝脂肪变性。分级标准参考中华肝脏病学会脂肪肝和酒精性肝病学组《非酒精性脂肪肝诊断标准》[7]:肝小叶内脂肪变性的肝细胞占小叶1/3~1/2为轻度脂肪肝,用“+”表示;占小叶1/2~2/3为中度脂肪肝,用“++”表示;占小叶2/3以上或肝细胞弥漫脂肪变性者为重度脂肪肝,用“+++”表示。每张病理切片随机取5个高倍视野,进行计算。
1.5 肝功能和血脂检测
运用全自动生化分析仪检测大鼠血清谷丙转氨酶(glutamic-pyruvic transaminase,GPT)和谷草转氨酶〔glutamic-oxal(o)acetic transaminase,GOT〕活性,以及TC和TG的水平。
1.6 肝组织GSH-Px和MDA含量测定
取-80℃冻存肝组织约1g,在冰浴中用EDTAPBS缓冲液(pH 7.4)制成10%的匀浆,447.2×g离心,取上清测GSH-Px和MDA含量。测定方法均按试剂盒说明书操作,GSH-Px和MDA测定分别采用二硫代二硝基苯甲酸法和硫代巴比妥酸法。
1.7 免疫组织化学染色检测肝细胞GRP78蛋白表达
采用链霉菌抗生物素蛋白-过氧化酶免疫组化法(SP)法,DAB显色,一抗GRP78的工作浓度为1∶100,操作流程按试剂说明书进行。分别在光镜下观察10个以上高倍视野对每张切片染色进行初步判定,每张切片随机摄取3个高倍(×400)视野,输入计算机,应用HPIAS-1000病理图文分析系统进行处理,计算染色阳性面积积分光密度。
1.8 RT-PCR检测肝组织中GRP78 mRNA表达
用Trizol试剂盒提取总mRNA。采用Trizol一步法提取总RNA,按照RNA纯化试剂盒说明书进行纯化。紫外分光光度计检测RNA,配置200 g·L-1的RNA样品稀释液50 mL。取5 mL RNA稀释液按逆转录试剂盒说明书逆转录成cDNA,稀释后备用。反应条件:94℃预变性2 min,94℃变性30 s,退火40 s,72℃延伸40 s,35个循环;72℃延伸10 min;取扩增产物4 μL上样于1.5%琼脂糖凝胶(含EB 0.5 g·L-1),100 V电泳30 min,将凝胶放入凝胶成像系统摄像,计算GRP78与GAPDH基因扩增条带积分吸光度的比值表示GRP78 mRNA表达的相对水平。
1.9 统计学分析
2 结果
2.1 TTM正丁醇萃取物对NAFLD大鼠整体情况的影响
各组大鼠均无死亡,进食饮水均可,毛发光洁。实验前后各组大鼠体质量变化无统计学意义(数据略)。
2.2 TTM正丁醇萃取物对NAFLD大鼠肝外观、肝组织病理变化和脂肪变性的影响
正常对照组大鼠肝呈暗红色,质地柔软,包膜光滑;模型组大鼠肝体积增大,边缘略饱满,呈淡黄色;各给药组较模型组有所改善。
HE染色结果(图1)表明,正常对照组肝小叶结构完整、清晰(图1A);模型组肝组织脂肪变性的肝细胞占肝小叶2/3以上,为重度脂肪变,肝细胞体积增大,排列紊乱,细胞内充满以小空泡为主的混合性空泡,部分伴肝细胞水样变(图1B);模型+TTM正丁醇萃取物组较模型组病变有明显减轻。
苏丹Ⅲ染色结果(图2,表1)表明,正常对照组肝细胞浆内无脂肪变性(图2A);模型组见弥漫性红色脂滴,肝细胞脂肪变性加重(图2B)(P<0.01);模型+TTM正丁醇萃取物50,100和200 mg·kg-1组肝内脂滴数量减少,脂肪变性较模型组减轻(图2C~E)(P<0.05,P<0.01),但组间无显著差异。
2.3 TTM正丁醇萃取物对NAFLD大鼠肝功能和血脂的影响
由表2可见,与正常对照组比较,模型组大鼠血清GPT和GOT明显升高,说明模型组大鼠肝受到损伤;模型+TTM正丁醇萃取物50,100和200 mg·kg-1组与模型组比较GOT明显下降(P<0.01),GPT变化不明显。与正常对照组比较模型组血清TC和TG明显升高(P<0.01),模型+TTM正丁醇萃取物100 mg·kg-1组与模型组比较TG降低(P<0.05),TC无明显变化。

Fig.1 Effect of n-butylethyl extract from Trillium tschonoskii Maxim(TTM)on liver pathological changes in model rats with non-alcoholic fatty liver disease(NAFLD)(HE staining×400).The rats were fed with high-fat forage and 4 weeks later simultaneously ig administered with n-butylethyl extract from TTM 100 mg.kg-1,once a day,for 6 weeks.A:normal control group;B:model group;C:model+n-butylethyl extract from TTM 100 mg·kg-1group.The arrows show necrosis or edema of hepatocytes.

Fig.2 Effect of n-butylethyl extract from TTM on liver fatty degeneration of model rats with NAFLD(SudanⅢstaining×400).See Fig.1 for the rat treatment.A:normal control group;B:model group;C,D and E:model+n-butylethyl extract from TTM 50,100 and 200 mg·kg-1group,respectively.The arrows show fatty drops of liver tissue.

Tab.1 Effect of n-butylethyl extract of TTM on liver fatty degeneration of model rats with NAFLD

Tab.2 Effect of n-butylethyl extract from TTMon liver function and blood lipid of NAFLD rats
2.4 TTM正丁醇萃取物对NAFLD大鼠肝组织GSH-Px和MDA变化的影响
由表3所见,与正常对照组相比,模型组肝组织中MDA含量显著升高,GSH-Px含量降低(P<0.01);与模型对照组相比,模型+TTM正丁醇萃取物100和200 mg·kg-1组MDA含量降低,GSH-Px含量升高(P<0.05,P<0.01),但组间无显著性差异。
2.5 TTM正丁醇萃取物对NAFLD大鼠肝细胞GRP78蛋白表达的影响
GRP78表达定位于肝细胞胞浆,呈棕黄色颗粒状或团块状。正常对照组肝细胞内GRP78蛋白表达不明显,模型组肝细胞内GRP78表达明显增强(P<0.01),尤以中央静脉周围脂肪变性严重的肝细胞更突出;模型+TTM正丁醇萃取物50,100和200 mg·kg-1组肝细胞内GRP78表达较模型组减弱(P<0.05),不同剂量给药组间无显著性差异(图3)。
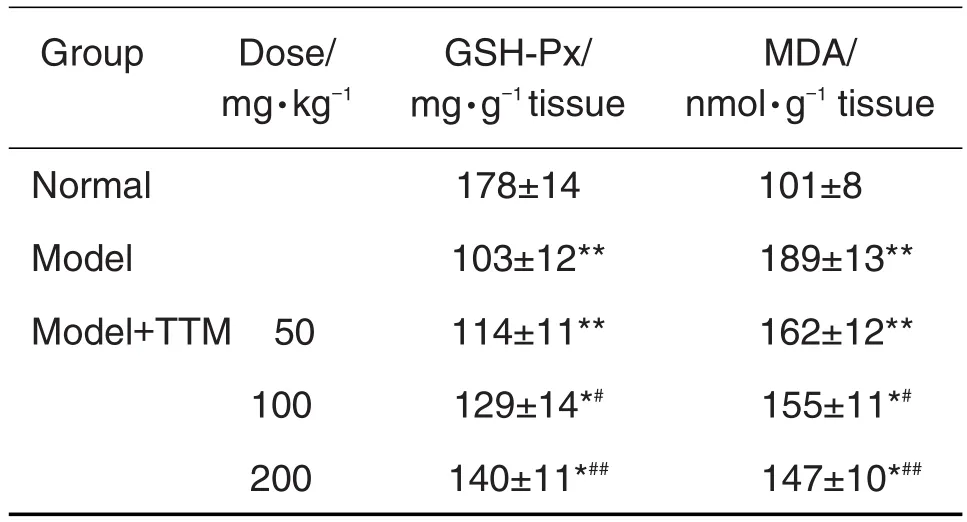
Tab.3 Effect of n-butylethylextract from TTM on glutathione peroxidase(GSH-Px)and malondialdehyde(MDA)of model rats with NAFLD
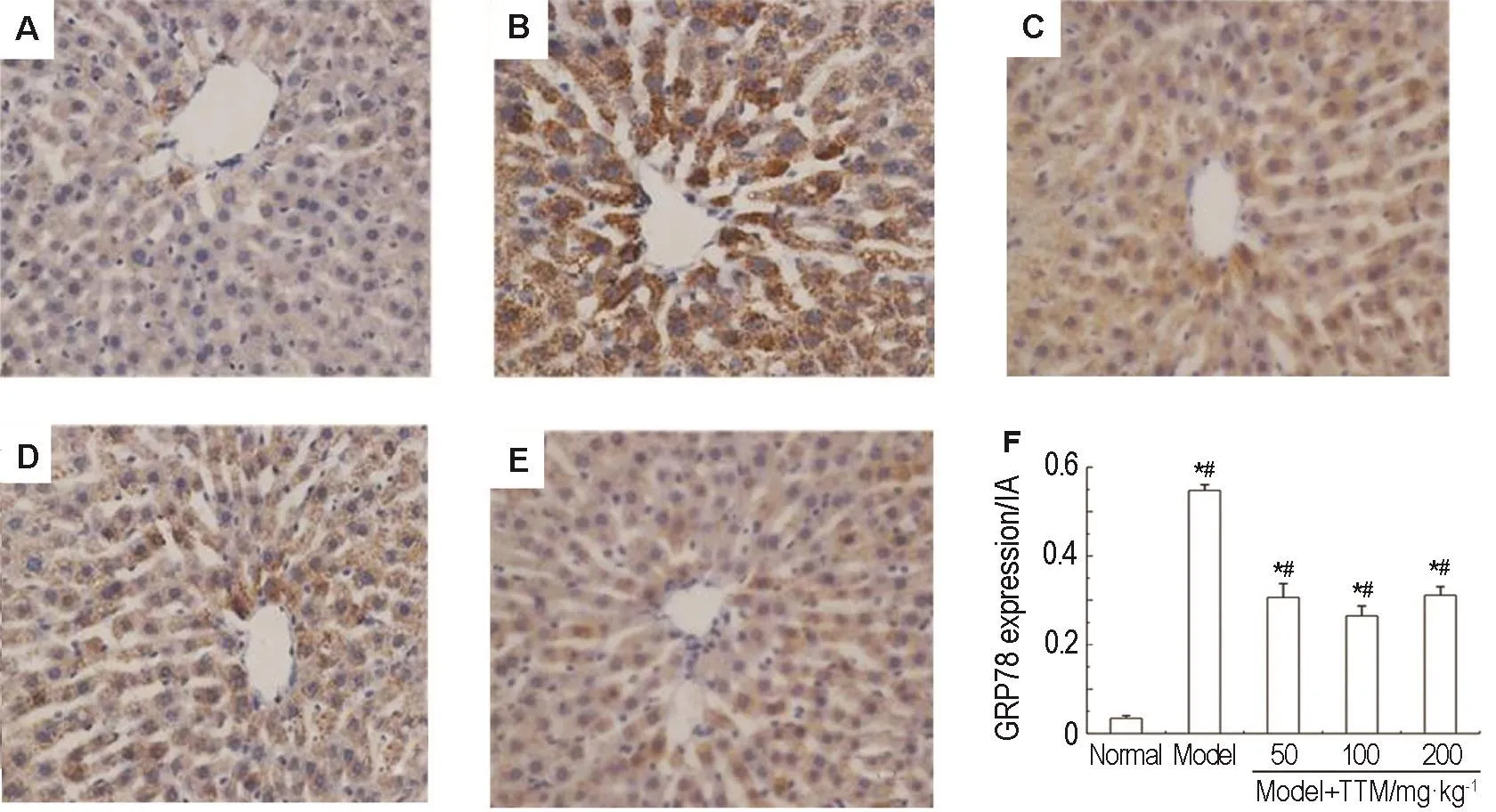
Fig.3 Effect of n-butylethyl extract from TTM on glucose regulated protein 78(GRP78)expreesion in liver tissue of rats with NAFLD(IHC staining×400).See Fig.1 for the rat treatment.A:normal control group;B:model group;C-E:model+n-butylethyl extract from TTM 50,100 and 200 mg·kg-1group,respectively.B was the semiquantitative result of A-E.n=10.*P<0.05,compared with normal control group;#P<0.05,compared with model group.
2.6 TTM正丁醇萃取物对NAFLD大鼠肝组织GRP78 mRNA表达的影响
RT-PCR实验结果(图4)表明,与正常对照组比较,模型组肝组织内GRP78 mRNA表达明显增强(P<0.01);模型+TTM正丁醇萃取物50,100和200 mg·kg-1组肝组织GRP78 mRNA表达较模型组减弱(P<0.05),不同剂量给药组间无显著性差异。

Fig.4 Effect of n-butylethyl extract from TTM on expression of GRP78 mRNA in liver tissue of rats with NAFLD by RT-PCR.See Fig.1 for the rat treatment.1:normal control group;2:model control group;3-5:model+nbutylethyl extract from TTM 50,100 and 200 mg·kg-1,respectively. B was the semiquantative result of A.,compared with normal control group;#P<0.05,compared with model group.
3 .讨论
NAFLD是一种无过量饮酒史,以肝细胞脂肪变性和脂质贮积为特征的临床病理综合征。目前,在欧美发达国家NAFLD已被公认为是最普遍的肝脏疾病。美国的流行病学调查结果表明其发病率接近20%[8],远远超过丙型肝炎或酒精性肝病的发病率。随着社会经济的发展,人民生活水平的提高,饮食结构和生活方式的变化,非酒精性脂肪肝病在我国发病率也在逐年升高[9]。
自从NAFLD被发现至今,人们对其发病机制尚未完全明了,现今虽然有很多关于NAFLD发病机制的理论,但都还停留在假说阶段。Day等[10]提出的“二次打击”学说在目前学术界得到较为普遍的认可。由内质网结构和功能异常导致的ERS对脂质代谢有重要调控功能,而脂类中的胆固醇、饱和脂肪酸摄入过多可能是诱导ERS致NAFLD的重要原因。另研究表明,NAFLD的发病机制与脂质过氧化和氧化应激密切相关[11],而这也是引起ERS的重要因素。本研究结果显示,模型组大鼠血脂(TC和TG)及血清GPT和GOT均较正常对照组升高,血清及肝匀浆内GSH-Px含量均低于正常对照组,MDA含量显著高于正常对照组,表明肝内抗氧化反应酶活性降低,同时脂质过氧化反应增强,提示氧化应激和脂质过氧化反应可能参与NAFLD的发生。
近年来,对ERS信号通路及效应在代谢综合征中的研究十分广泛[12-13],而细胞内氧化应激可破坏内质网稳态和诱导ERS,内质网是脂肪酸代谢的第一场所,同时发现脂肪酸在内质网代谢会生成一定量的ROS,而ROS又是ERS的重要诱发因素,ROS和ERS联合介导细胞的凋亡过程[14-15]。氧化应激能启动钙从内质网钙池的释放,导致线粒体内钙积聚,这进一步增加了ROS的生成,放大氧化应激及钙负载,引起恶性循环。GRP78是ERS的标志性蛋白,其表达增加能维持内质网的稳定[16],引导蛋白质正确折叠,改善细胞生理状态,起到暂时保护细胞、延缓炎细胞浸润等作用[17]。本研究结果发现,高脂饮食引起的NAFLD大鼠肝组织GRP78表达增加,提示高脂饮食诱导了肝ERS。TTM正丁醇萃取物干预后,可降低肝细胞GRP78蛋白和肝组织GRP78 mRNA表达,减轻由氧化应激引起的ERS,对脂肪肝有一定的治疗作用。但究竟是ERS异常进而引起NAFLD的发生发展,还是脂质代谢障碍引起ROS生成增多加剧脂肪变性,从而导致肝细胞凋亡促使NAFLD的发生,尚待深入研究。
综上所述,TTM正丁醇萃取物对NAFLD大鼠脂肪肝有一定的改善作用,其作用机制可能与提高机体抗氧化酶活性、抑制脂质过氧化反应、降低肝组织GRP78蛋白表达,以及减轻肝细胞ERS有关。
参考文献:
[1]Chang Y,Ryu S,Sung E,Jang Y.Higher concentrations of alanine aminotransferase within the reference interval predict nonalcoholic fatty liver disease [J].Clin Chem,2007,53(4):686-692.
[2]Lee AS.The ER chaperone and signaling regulator GRP78/BiP as a monitor of endoplasmic reticulum stress[J].Methods,2005,35(4):373-381.
[3]Min M,Chen DF.Endoplasmic reticulum stress and nonalcoholic fatty liver disease[J].Int J Dig Dis(国际消化病杂志),2008,28(6):458-460.
[4]Yu LL,Zhou K.The progress in the research of the chemical components and pharmacological activities ofTrillium tschonoskiiMaxim[J].Chin Tradit Pat Med(中成药),2008,30(9):1350-1354.
[5]Li ZY,Zhou FQ,Tu Y,Zhang M,Zhu D,Cui J.The progress in the research onTrillium tschonoskiiMaxim[J].Chin J Inf TCM(中国中医药信息杂志),2011,18(1):104-106.
[6]Jian GL,Yu X,Xu K,Liu Y.comparision between intraperitoneal and subcutaneous injection on rat aging model made by D-galactose[J].Chin J Gerontol(中国老年学杂志),2013,33(5):1101-1103.
[7]Fatty liver and alcoholic liver disease group of Chinese Medical Association,Diagnostic criteria for nonalcoholic fatty liver disease(Draft))[J].Chin J Hepatol(中华肝脏病杂志),2002,7(4):attached sheet 2.
[8]Clark JM,Brancati FL,Diehl AM.The prevalence and etiology of elevated aminotransferase levels in the United States[J].Am J Gastroenterol,2003,98(5):960-967.
[9]Fan JG.Clinical epidemiological study of nonalcoholic fatty liver disease[J].Chin J Dig(中华消化杂志),2002,22:106-107.
[10]Day CP,James OF.Steatohepatitis:a tale of two″hits″?[J].Gastroenterology,1998,114(4):842-845.
[11]Matsuzawa N,Takamura T,Kurita S,Misu H,Ota T, Ando H,et al.Lipid-induced oxidative stress causes steatohepatitis in mice fed an atherogenic diet[J].Hepatology,2007,46(5):1392-1403.
[12]Marciniak SJ,Ron D.Endoplasmic reticulum stress signaling in disease[J].Physiol Rev,2006,86(4): 1133-1149.
[13]Zhang YD,Wang FX,Ouyang XH,Yang Y.Endoplasmic reticulum stress and changes of plasminogen activator inhibitor-1 in C57 mice with high-fat diet-induced fatty liver[J].Acta Med Univ Sci Technol Huazhong〔华中科技大学学报(医学版)〕,2011, 40(5):574-576,584.
[14]Lee GH,Kim HK,Chae SW,Kim DS,Ha KC,Cuddy M,et al.Bax inhibitor-1 regulates endoplasmic reticulum stress-associated reactive oxygen species and heme oxygenase-1 expression[J].J Biol Chem,2007,282(30):21618-21628.
[15]Chen XD,Wang J,Xiong J,Mu G,Tao L,Wang B,et al.The change and significance of endoplasmic reticulum stress-induced apoptosis in alcoholic liver disease rats[J].Chin J Gastroenterol Hepatol(肠病学和肝病学杂志),2013,22(3)::215-218.
[16]Ji C.Dissection of endoplasmic reticulum stress signaling in alcoholic and non-alcoholic liver injury [J].J Gastroenterol Hepatol,2008,23(Suppl 1): S16-S24.
[17]Min M,Chen DF,Wang J,Ai ZL,Fan LL,Yan LL. Expression and significance of glucose regulated protein GRP78 in nonalcoholic steatohepatitis of rats[J].Acta Acad Med Mil Tert(第三军医大学学报),2009,31(1):79-81.
Efficacy of N-butylethyl extract from Trillium tschonoskii Maxim for non-alcoholic fatty liver disease of rats and its effect on activity of antioxidant enzymes and endoplasmic reticulum stress in liver tissue
CHEN Xian-bing1,2,TAN Zhi-xin2,QIN Fu-rong2,ZHU Xiao-jing2,LI Jin-tao2,HE Qiao-yuan2
(1.Key Laboratory of Biologic Resource Protection and Utilization of Hubei Province,Enshi 445000,China;2.College of Medicine,Hubei Institute for Nationalities,Enshi 445000,China)
OBJECTlVETo investigate the efficacy of n-butylethyl extract fromTrillium tschonoskiiMaxim.(TTM)for non-alcoholic fatty liver disease and its possible mechanism.METHODSFifty Wistar rats were randomly divided into 5 groups:normal control group,model group fed with high-fat diet,experimental groups fed with high-fat forage and 4 weeks later ig coadministered with n-butylethyl extract from TTM 50,100 and 200 mg·kg-1,respectively,once a day,for 6 weeks.The pathological changes and pimelosis level of liver tissue were investigated by HE staining and SudanⅢstaining,respectively.The activity of serum glutamic-pyruvic transaminase(GPT)and glutamic-oxal(o)acetic transaminase(GOT),the level of blood total cholesterol(TC)and triglycerides(TG),the content of glutathione peroxidase(GSHPx)and malonyldialdehyde(MDA)in liver tissues were analyzed respectively by auto-biochemical instrument.The mRNA and protein expression of hepatic glucose regulated protein 78(GRP78)in liver tissue was detected by immunohistochemical assay and RT-PCR.RESULTSThe degree of fatty degeneration,activity of serumGPT and GOT,level of blood TCand TG,and content of MDAin liver tissue in model group were obviously higher than in normal control group(P<0.05),while the level of GSH-Px in model group was lower than that of normal control group(P<0.05).Compared with model group,the fatty degenertion degree,level of GPT,GOT,TC,TG and MDA became significantly lower and the expression decreased in n-butylethyl extract from TTM 50,100 and 200 mg·kg-1groups(P<0.05),but there was no significant difference in the degree of change between the groups of different doses.Moreover, the expression of GRP78 mRNA and protein in liver tissue in model group was higher than that in normal control group(P<0.01).CONCLUSlONn-Butylethyl extract from TTM can effectively prevent liver cell injury and reduce fatty degeneration of the liver in NAFLD rats.This effect may be related to the increase of antioxidant enzyme activity and reduction of endoplasmic reticulum stress in liver tissue.
Trillium tschonoskiiMaxim.;glucose regulated protein 78;fatty liver,non-alcoholic;endoplasmic reticulum stress
The project supported by Key Laboratory of Biologic Resource Protection and Utilization of Hubei Province(PKLHB1308);and Hubei Provincial Bureau of Education(D20131904)
CHEN Xian-bing,E-mail:chenxianbing7612@163.com,Tel:(0718)8437479
R285.5
A
1000-3002(2015)04-0578-07
2015-01-15接受日期:2015-07-21)
(本文编辑:齐春会)
生物资源保护与利用湖北省重点实验室项目(PKLHB1308);湖北省教育厅科学技术重点项目(D20131904)
陈显兵(1976-),男,硕士,副教授,主要从事中药药理学研究。
陈显兵,E-mail:chenxianbing7612@163.com,Tel:(0718)8437479
