微生物燃料电池在重金属处理中的应用
2015-07-21金巧
金 巧
(南昌大学 生命科学院,江西 南昌 310013)
微生物燃料电池在重金属处理中的应用
金 巧
(南昌大学 生命科学院,江西 南昌 310013)
重金属处理过程需要消耗大量的能量,而重金属本身含有化学能,若将其化学能转化为电能的同时得以去除,无疑是重金属废水处理中的崭新技术和方法。本文从重金属离子在阴极接受电子完成电化学还原的燃料电池系统角度,对重金属离子的产电原理进行了阐述,结合实例介绍了重金属在阴极完成还原反应的方式,讨论了重金属自产电能处理技术的优势和存在的问题。利用污染物自身产生一定的能量,而不是消耗的电化学处理技术有着十分美好的前景。
重金属自产电能 电化学处理
1 引言
工业废水中含有不同种类的重金属,由于重金属对生态环境造成很大的影响,对其治理一直以来都是环保领域的一大热门课题。传统的治理方法主要有物理化学处理方法,如化学沉淀、吸附、离子交换、膜分离、电沉积等,处理过程中需消耗大量的能量。事实上,重金属中含有潜在的能量,能否将其转化成电能而不是能量的消耗?从有机废水获取能量已广为人们之所知,如厌氧条件下的产甲烷,但是如何获取电能却是最近因燃料电池尤其微生物燃料电池的研究才引起科学家的关注[1]。
环境污染中主要的重金属有Cr(Ⅵ)、Hg(Ⅱ)、Pb(Ⅱ)和Cd(Ⅱ),具有一定毒性且广泛分布的重金属有Cu(Ⅱ)、Zn(Ⅱ)、Sn(Ⅱ)和Ni(Ⅱ),以及贵重金属Au、Ag、Pt。从热力学上可知以上重金属自身含有丰富的能量,如果采用电化学原理利用燃料电池系统使重金属离子在阴极接受电子完成电化学还原,自身能量被转化出来的同时重金属毒性降低(如Cr(Ⅵ)转化为毒性较小的三价铬或其化合物)或被回收(如铜),不仅节约能耗还可以产生一定的能量。
2 重金属离子产电的原理
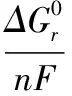

(1)

(2)
(pH=7,常温,[CH3COO-]=[HCO3-]=0.05M)
由方程式(1)所示,1mol乙酸盐可产生9mol质子和8mol电子,根据能斯特方程可计算当乙酸盐和碳酸氢盐均为0.05M时,阳极的电极电势为-0.289V(相对标准氢电极)。理论上,根据E电池=E阴极-E阳极,只有E电池大于零即E阴极大于-0.289V时才有推动力促使电子从阳极通过外电路迁移至阴极,在有负载时会产生电流,但若在阴极有大量电子富集势必造成阴极电势降低,当E阴极不大于E阳极时电子推动力消失,电子停止迁移,从而电流中断,所以在阴极需要氧化剂接受电子发生还原反应,氧化剂电极电势越大接受电子的趋势越大,在电子不断消耗的过程中以保持电流的持续。这里需注意的是方程式(1)的反应在微生物作用下当以乙酸盐为底物生成碳酸氢盐的反应即是微生物燃料电池(MFCs)[2]。目前,在微生物燃料电池上比较成功地得到重金属离子自产电能并同时降低自身毒性或转变形态降低污染特性。
同理,分析重金属的标准电极电位数据[3],可知Cr(Ⅵ)、Hg(Ⅱ)、Cu(Ⅱ)和三种贵重金属(Au、Ag、Pt)离子与方程(1)组成电池系统作为阴极电子受体产生电能的可能性较大,Pb(Ⅱ)、Sn(Ⅱ)和Ni(Ⅱ)的理论电池电势较小,Cd(Ⅱ)和Zn(Ⅱ)的电池电势为负值,若在此系统中不加其他外在条件不可能有电流产生。
对于Pb(Ⅱ)、Sn(Ⅱ)和Ni(Ⅱ)的与方程(1)组成电池系统的理论电池电势较小,但与其他电势较低的阳极系统组成电池产生电流的可能会增加,对于Cd(Ⅱ)和Zn(Ⅱ)只要阳极电势足够负,也同样可以作为微生物燃料电池的阴极电子受体。当然也可以通过外加电压等手段使不能进行的反应可以发生[5]。
3 重金属在阴极上的还原反应
在双室微生物燃料电池阴极重金属以溶解态存在于阴极溶液中,可通过方程(3)发生还原反应,转化为毒性较小的形态(如六价铬转化为三价铬)或生成固体形态进行回收(如铜离子生成铜单质等)。完成还原反应可大致通过三种方式:(ⅰ)直接接受电子发生电化学还原反应;(ⅱ)借助某种介质接受电子完成电化学还原反应;(ⅲ)与产生的还原性物质完成同位还原反应。
Mz+(aq)+ne-→M(z-n)+(aq)orM(s)
(3)
3.1 直接接受电子发生电化学还原反应
金属铜是一种极具价值的工业用金属,从废水中回收金属铜非常有意义。电解铜可以实现铜单质的回收,但需要大量的电能消耗。利用微生物燃料电池从含铜废水中回收金属铜不仅可以实现铜的回收与处理,而且可以产生电能,避免能量消耗。铜在阴极主要发生两种还原反应生成金属铜和氧化物(Cu2O),见方程(4)-(6)。
Cu2++2e-→Cu(E0=0.337V)
(4)
2Cu2++H2O+2e-→Cu2O+2H+(E0=0.207V)
(5)
Cu2O+2H++2e-→2Cu+H2O(E0=0.059V)
(6)

(7)

(8)

(9)
由方程(7)-(9)可知,(ⅰ)二价铜离子(Cu2+)生成铜单质(Cu)只由Cu2+浓度决定;(ⅱ)Cu2+铜离子生成Cu2O由Cu2+浓度和pH值共同决定,且pH值增加阴极电势越大,发生还原反应的趋势越大;(ⅲ)Cu2O进一步还原为Cu仅有pH值决定,且只在低pH值范围内才易发生。例如Cu2+浓度若为1g/L,阴极液pH值要维持在3以下才能保证无铜的氧化物生成。但若Cu2+浓度很低比如0.001M,即使阴极液pH值在3以下也会生成铜的氧化物。
一般阳极微生物的生长环境需要维持在中性条件下,若同时满足阴极液pH值维持在酸性条件,有人用双极膜来达到这一要求。Annemiek Ter Heijne等人[6]利用双室微生物燃料电池,用双极膜代替质子交换膜处理含铜废水。双极膜通过水分解产生的质子通过阳离子交换膜进入阴极室,氢氧根离子通过阴离子交换膜进入阳极室从而维持阴阳极pH值的不同。铜离子在阴极直接接受阳极微生物氧化产生的电子发生电化学还原反应生成金属铜,由于维持pH值在3以下,所以实验的最后结果并未检测到有铜的氧化物生成。此实验系统可达到最大功率密度为0.43W·m-2,此时电流密度为1.7A·m-2,铜的去除率大于99.88%。对阴极液pH值不加以控制,利用双室微生物燃料电池,质子交换膜将阴阳极室分隔开,Cu2+还原产物除单质铜外还会有氧化物生成。Tao Hu-Chun等人[7]的实验结果证明了这一点。实验采用葡萄糖为阳极有机质、质子交换膜分割阴阳极室,硫酸铜溶液为阴极液。考察了不同外电阻负载、不同铜离子起始浓度下微生物燃料电池的性能以及铜的去除效果和产物生成。通过X射线衍射分析阴极电极上不仅有铜单质还有Cu2O生成。
3.2 借助介质接受电子的电化学反应
六价铬化合物广泛应用于制革、纺织品生产、印染、颜料以及镀铬行业中,产生大量的工业废水。六价铬因具有诱变性、致畸、致癌性,所以对人体健康和动植物都有很大的危害,但三价铬的毒性较小,所以很多处理方式将六价铬转化为三价铬或三价铬的化合物。六价铬发生还原反应见方程式(10)。
(10)

(11)
2Cr3++6H2O→2Cr(OH)3(s)+6H+
(12)
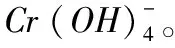
利用微生物燃料电池处理六价铬,在阴极直接作为电子受体有报道[8-9]。2007年逐渐兴起生物阴极,是指在阴极利用微生物取代金属催化剂Pt等,以O2、NO3-等为电子受体,完成相应的阴极半反应[10]。利用生物阴极可以产氢也可处理重金属,即借助微生物体的生命代谢,以污染物作为电子受体,间接的利用阳极氧化产生的电子发生还原反应。已发现有很多菌株对六价铬有抗性和还原性,所以可借助六价铬还原菌的代谢活动,以六价铬作为电子受体来处理含铬废水。
2009年微生物燃料电池生物阴极首次应用在六价铬还原上[11],阴极室利用六价铬还原菌接受阳极氧化产生的电子和质子,将六价铬转化为三价铬或三价铬的氧化物。六价铬最大还原率可达到0.46mgCr(Ⅵ)/gVSS·h。阴极六价铬本身也可以作为电子受体,在阴极无生命体存在的对比实验中可看出六价铬无机还原对六价铬去除率的贡献非常小,原因是中性pH限制六价铬的还原,Li等人[9]已报道当pH值从2升至中性时六价铬还原会降低。这充分体现了生物阴极的优越性,由于微生物的作用可充分利用来自阳极的电子和质子用于六价铬的还原。Huang等人[12]将六价铬污染点的微生物作为生物阴极的接种菌,利用石墨颗粒增加了阴极微生物的生长面积,显著提高了生物阴极微生物燃料电池处理六价铬的还原率和产电性能。六价铬还原率达到2.4±0.2 mgCr(Ⅵ)/gVSS·h,功率密度为2.4±0.10W·m-3,此时电流密度为6.9A·m-3。增加阴极微生物生长面积可提高六价铬的还原率,在此研究基础上,Huang等[13]评价了不同碳基质的管状生物阴极微生物燃料电池对六价铬的还原和产电性能。分别采用石墨纤维、石墨毡和石墨颗粒作为生物催化的阴极材料,阴阳极面积比率为(阴极/阳极)3,通过对比实验确定石墨纤维的较其他两种碳材料阴极效果好,六价铬还原率进一步提高,范围12.4~20.6 mgCr(Ⅵ)/gVSS·h,功率密度为6.8~15W·m-3,此时电流密度为20~48A·m-3。
3.3 与产生的还原性物质完成同位还原反应
某些重金属离子如六价铬在酸性条件下具有强氧化性,若在阴极有还原性物质生成,可辅助六价铬的去除。Liu等[14]利用微生物燃料电池证明六价铬在阴极接受电子发生还原反应的同时可同位产生过氧化氢。此体系是利用铁离子还原菌的推动力,氧气在阴极接受阳极氧化产生的电子和质子生成过氧化氢,所以六价铬的总去除包括两部分,六价铬发生电化学反应的一部分和与过氧化氢发生化学反应的一部分。
4 存在问题与展望
重金属自产电能处理技术具有很大的环境优势:它不仅不需要输入能量,还可将储存在重金属中的化学能转化为电能;操作简单、条件温和,可以在常温环境下进行,只需导线连接还可能将在一定距离上处理污染物;此外,可同时处理两种不同种类的污染物,如阳极处理有机废水、阴极处理重金属废水。
[1]McCarty P L,Bae J,Kim J.Domestic Wastewater Treatment as a Net Energy Producer-Can This be Achieved?Environ.Sci.Technol.2011,45,7100-7106.
[2]Logan Bruce E.Microbial Fuel Cells[M].Hoboken,New Jersey:John Wiley & Sons,Inc,2007,5.
[3]Lide D R.Handbook of Chemistry and Physics[M].84thedition,CRC PRESS.2003-2004:1217-1222.
[4]Logan B E.Microbial Fuel Cells[M].Hoboken,New Jersey:John Wiley & Sons,Inc,2007,51-55.
[5]Rabaey K,Rozendal R A.Microbial electrosynthesis-revisiting the electrical route for microbial production[J].Appl.Indus.Microb.2010,8:705-715.
[6]Ter Heijne A,et al.Copper Recovery Combined with Electricity Production in a Microbial Fuel Cell[J].Environ.Sci.Technol,2010,44:4376-4381.
[7]Tao H C,et al.Removal of copper from aqueous solution by electrodeposition in cathode chamber of microbial fuel cell[J].J.Hazard.Mater.,2011,189:186-192.
[8]Wang Gang,Huang Liping,Zhang Yifeng.Cathodic reduction of hexavalent chromium[Cr(VI)]coupled with electricity generation in microbial fuel cells[J].Biotechnol.Lett.,2008,30:1959-1966.
[9]Li Zhongjian,Zhang Xingwang,Lei Lecheng.Electricity production during the treatment of real electroplating wastewater containing Cr6+using microbial fuel cell[J].Process Biochem.,2008,43:1352-1358.
[10]Clauwaert P,Biological denitrification in microbial fuel cells[J].Environ.Sci.Technol.,2007,41(9):3354-3360.
[11]Samuelj M,et al.Biological Chromium(VI)Reduction in the Cathode of a Microbial Fuel Cell[J].Environ.Sci.Technol.2009,43,8159-8165.
[12]Huang Liping,Chen Jingwen,Quan Xie,et al.Enhancement of hexavalent chromium reduction and electricity production from a biocathode microbial fuel cell[J].Bioprocess Biosyst.Eng.,2010,33:937-945.
[12]Huang Liping,Chai Xiaolei,Cheng Shaoan,et al.Enhancement of hexavalent chromium reduction and electricity production from a biocathode microbial fuel cell[J].Chem.Eng.J.,2011,166:652-661.
[14]Liu Liang,Yuan Yong,Li Fang-bai,et al.In-situ Cr(VI)reduction with electrogenerated hydrogen peroxide driven by iron-reducing bacteria[J].Bioresour.Technol.,2011,102:2468-2473.
