伪石榴碱的提取与合成及其衍生物的应用研究进展
2015-07-18
(1.西华大学理学院,四川 成都 610039;2.西华大学食品与生物工程学院,四川 成都 610039)
·基础学科·
伪石榴碱的提取与合成及其衍生物的应用研究进展
王周玉1,2,何 其2,赖 鹏2,杨文宇2,钱 珊2
(1.西华大学理学院,四川 成都 610039;2.西华大学食品与生物工程学院,四川 成都 610039)
伪石榴碱是一种重要的生物碱,存在于石榴的茎皮、根皮和果皮中。伪石榴碱具有一个独特的9-氮杂双环[3.3.1]壬烷结构,该结构与托品酮类似,是一些活性物质的主要骨架。本文综述伪石榴碱的提取、合成方法及其衍生物在生物活性和合成方面的应用,指出研究伪石榴碱的提取和生物活性、进一步合成更加新颖的伪石榴碱衍生物并研究其应用是研究伪石榴碱及其衍生物下一步需要解决的问题。
伪石榴碱;提取;合成;应用
生物碱是植物中含氮的碱性有机化合物,大部分有明显的生理活性,是很多中草药及药用植物的有效成分。石榴的生物碱自19世纪以来就有人研究,石榴中主要含哌啶类和吡咯烷类生物碱[1]。伪石榴碱属于哌啶类生物碱,存在于石榴的茎皮、根皮和果皮中。它具有一个独特的9-氮杂双环结构,该结构类似于托品酮,是一些活性物质的主要骨架,特别是在止吐药物格拉司琼中,伪石榴碱独特的9-氮杂双环结构对格拉司琼的活性至关重要。托品酮和伪石榴碱的结构如图1所示。另外,该双环结构还可作为原料合成手性的杂环类化合物。本文将对伪石榴碱的提取、合成方法及其衍生物在生物活性和合成方面的应用进展做一综述。

图1 托品酮和伪石榴碱的结构
1 伪石榴碱的提取和合成方法
1879 年Tanret和1880年Piccinini的报道中分别提取出了伪石榴碱,但其含量很少。直到20世纪,文献[2-3]相继报道了伪石榴碱在石榴中的存在,但没有专门关于其提取方法的报道。直到1957年,文献[2-3]才详细地记载了通过Robinson-Schöpf反应合成伪石榴碱的实验方法(图2)。该方法以丙酮二羧酸、戊二醛和甲胺为原料通过Mannich反应合成伪石榴碱,该方法操作简单、原料易得。目前,市场上的纯伪石榴碱来源主要通过该反应合成。

图2 通过Robinson-Schöpf反应合成伪石榴碱
除此之外,Putney小组在1955年报道了1-甲基-2,6-哌啶乙酸二乙酯在金属钠的作用下通过Dieckmann 缩合得到伪石榴碱[4](图3)。该方法以1-甲基-2,6-哌啶乙酸二乙酯为原料在金属钠的条件下通过Dieckmann缩合反应得到乙氧羰基伪石榴碱,紧接着在酸性条件下脱羧得到伪石榴碱。通过此方法合成伪石榴碱在收率上和通过Robinson-Schöpf反应差不多;但是该方法在操作上要复杂一些,而且原料1-甲基-2,6-哌啶乙酸二乙酯的制备要复杂得多。

图3 通过Dieckmann 反应合成伪石榴碱
在1999年,文献[5]报道了一个利用N-甲基尸胺氧化酶(MPO)介导合成托品烷酮和伪石榴碱及其类似物的方法(图4)。该文以尸胺或腐胺为起始原料,首先烷基化生成N-烷基二元胺,然后在N-甲基尸胺氧化酶(MPO)作用下将N-烷基二元胺转化为N-烷基托品烷酮,最终生成伪石榴碱。
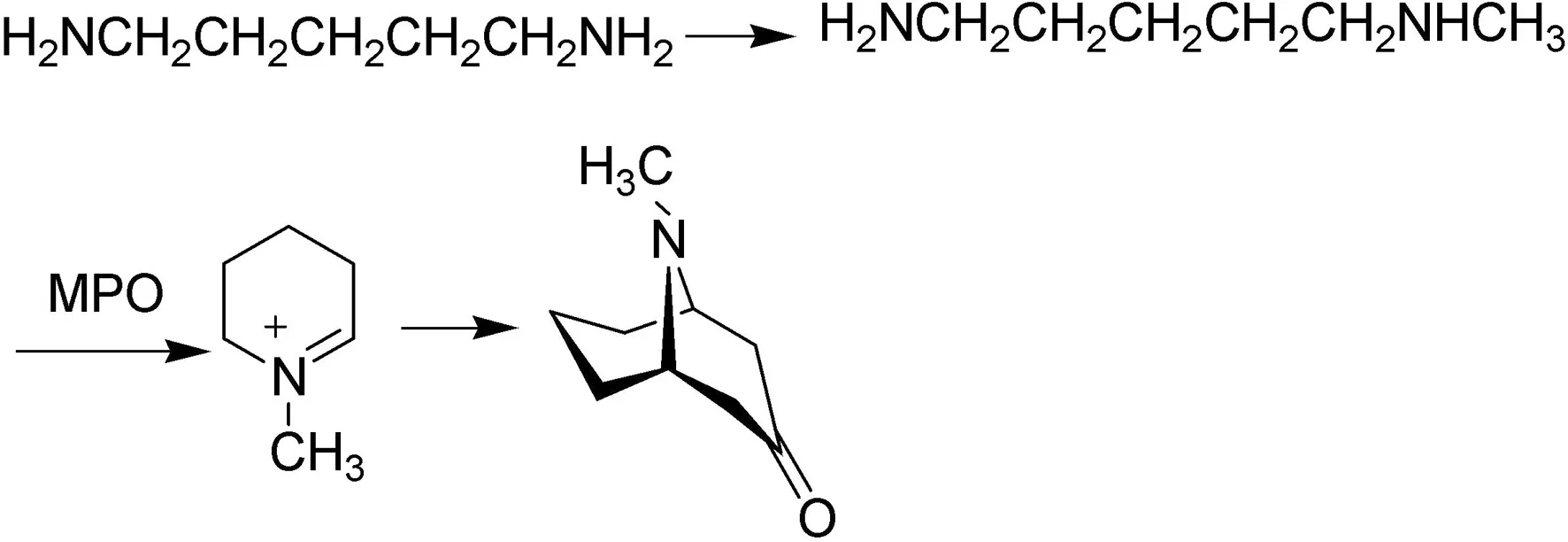
图4 N-甲基尸胺氧化酶介导合成伪石榴碱
邻-碘酰基苯甲酸(IBX),是一个非常好的高价碘氧化试剂。2001年,K. C. Nicolaou等[6]利用IBX氧化环辛酮得到伪石榴碱(图5)。该文以环辛酮为起始原料,可以分步或一锅法合成伪石榴碱。在分步合成中,环辛酮(A)在IBX的存在下能够高效地合成环辛二烯酮(C, 88%收率),得到的环辛二烯酮可以顺利地得到伪石榴碱。同时,他们以环辛酮为起始原料采用一锅法也可以顺利地合成伪石榴碱,收率可以高达80%。
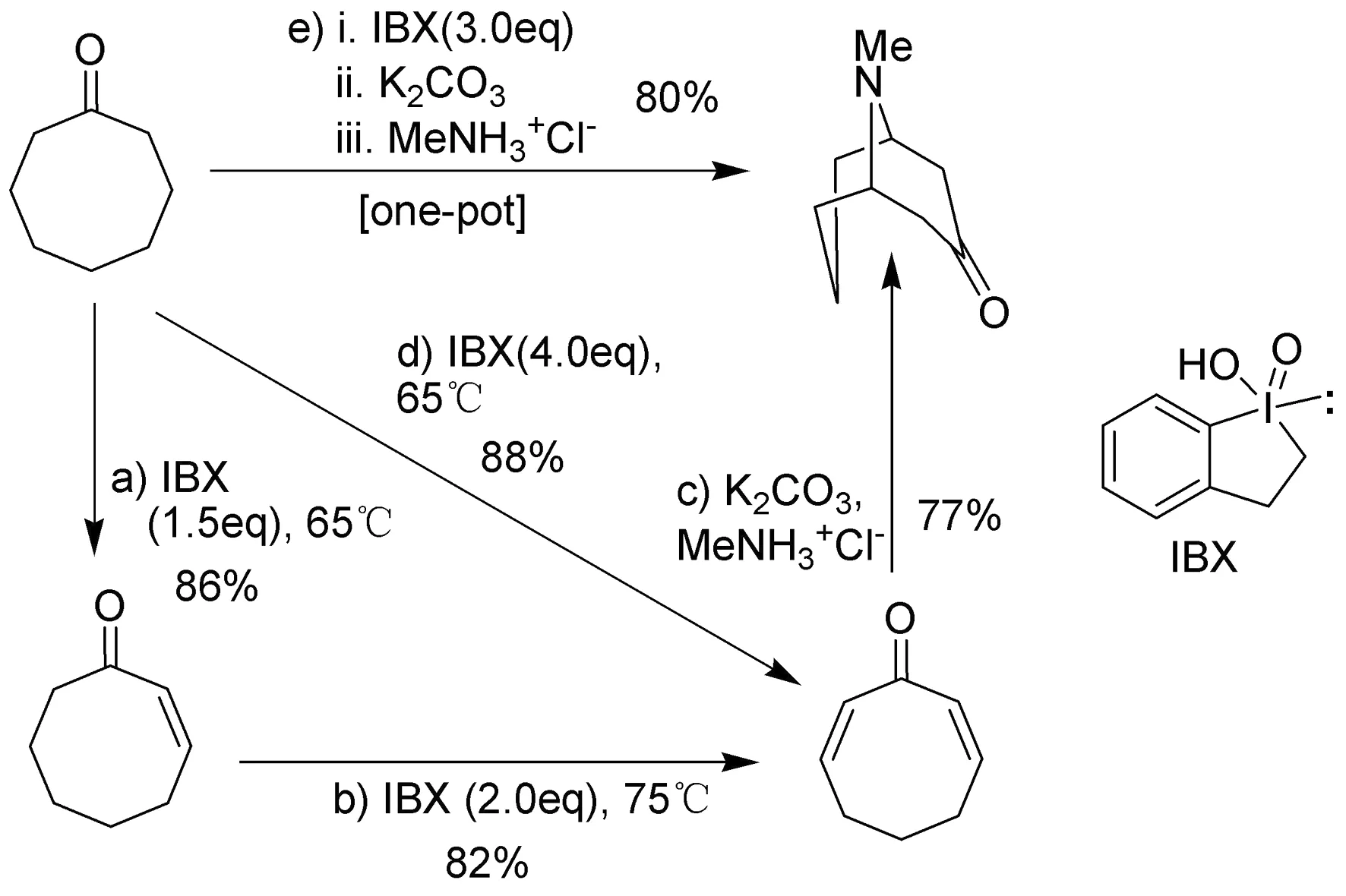
图5 利用IBX合成伪石榴碱
2 伪石榴碱及其衍生物的生物活性
具有氮杂环结构的生物碱广泛存在于很多药物和天然产物中,该结构是这些物质具有生物活性的关键原因之一,也是学术界研究的主要结构之一。由于伪石榴碱及其衍生独特的杂氮双环结构是许多生物活性物质的关键结构,关于伪石榴碱及其衍生物在生物活性方面的应用主要集中在以下几个方面。
2.1伪石榴碱衍生物在5-HT3受体拮抗剂中的生物活性
5-羟色胺(5-HT)是一种重要的脑神介质。Fozard在1984年首次发现5-HT3受体位于外周神经系统,并报道了最早的5-HT3受体拮抗剂MDL 72222[7]。在接下来的几年里又有其他几种5-HT3受体拮抗剂[8-9]相继被报道。
直到1989年,Gareth J. Sanger等报道了BRL 43694(格拉司琼)在周围神经模型中的活性,通过观察其在已经建立的5-HT3受体模型中的活性,证明BRL 43694是一个有效的和选择性良好的5-HT3受体拮抗剂[8]。
同一年,文献[9]报道了BRL 43694作为5-HT3受体拮抗剂的药代动力学研究情况。通过静脉注射18例(30 min输入40 ug/kg剂量的BRL43694)接受高致吐性化疗药物的病人的研究路线来研究BRL43694对5-HT3的抑制作用。实验结果表明,其中9个患者完全不存在胃肠道不良反应,剩余的大部分患者中,恶心的发生和严重程度显著改善。此外,观察在此剂量下无其他不良反应,并且在所用情况下药物的耐受性良好[9]。
格拉司琼中的一个关键结构特征是9 - 氮杂双环[3.3.1]壬烷碱性侧链,被认为与5-HT3受体的关键结合相互作用,可能是与天门冬氨酸的离子相互作用。1994年F.D. King[10]发现在9 - 氮杂双环[3.3.1]壬烷的三位上引入杂原子(O和S),在保持活性的条件下可以改变侧链的PKa值(图6)。

图6 格拉司琼及其衍生物
在这一发现的启发下,1994年文献[11]开发出了一系列新的3,9-二氮杂双环[3.3.1]壬烷体系,通过变化芳香基团和在三位上引入N原子基团来形成系列3,9-二氮杂双环[3.3.1]壬烷,活性研究结果表明该芳基酰胺类保持了良好的5-HT3受体的亲和力和拮抗剂的效力(图7)。

图7 3,9-二氮杂环[3.3.1]壬烷-7-氨基衍生物
在随后的几年里相继报道了关于格拉司琼的研究,然而对其衍生物的研究较少。直到2010年文献[12]对格拉司琼衍生物的构效关系进行了研究。这篇文章首先取代格拉司琼可能的位置,取得了14种不同的格拉衍生物,并首次报道格拉司琼衍生物的晶体结构,同时对这些衍生物对人类5-HT3亲和力进行了探索,实验结果显示衍生物2a,5a,5c和7的亲和力等于或优于格拉司琼测量的亲和力(图8)。

图8 格拉司琼衍生物对人类5-HT3亲和力的研究
2.2伪石榴碱衍生物在其他方面的生物活性
1996年,文献[13]报道了关于伪石榴碱衍生物多巴胺转运蛋白(DAT)中作为可卡因结合位点的亲和力的研究。在这篇报道中,研究者们合成了一系列的9-甲基-3β-苯基-2-取代-9-氮杂双环[3.3.1]壬烷衍生物(图9),并研究了这一系列衍生物在多巴胺转运蛋白(DAT)中作为可卡因结合位点的亲和力。

图9 2-(甲氧基羰基)-9-甲基-3-苯基-9-氮杂双环[3.3.1]壬烷衍生物
虽然这一系列的伪石榴碱衍生物对于多巴胺转运蛋白中可卡因结合位点的亲和力不如托品烷类,但关于伪石榴碱衍生物在多巴胺转运蛋白中其他结合位点表现出较好的亲和力得到证明。
2001年,Robert H. Mach小组[14]报道了伪石榴碱衍生物Re-2对于σ2受体的亲和力研究。以9-苯基-9-杂氮双环[3.3.1]壬烷-3-酮为起始原料经过一系列的步骤合成伪石榴碱衍生物Re-2,并测定其对σ1和σ2受体的亲和力(图10)。体外结合实验结果显示Re-2对于σ2受体的亲和力为(13.7±0.9) nmol/L,对于σ1受体的亲和力为(112.5±35) nmol/L,这一结果表明该衍生物对于σ2受体具有良好的亲和力。
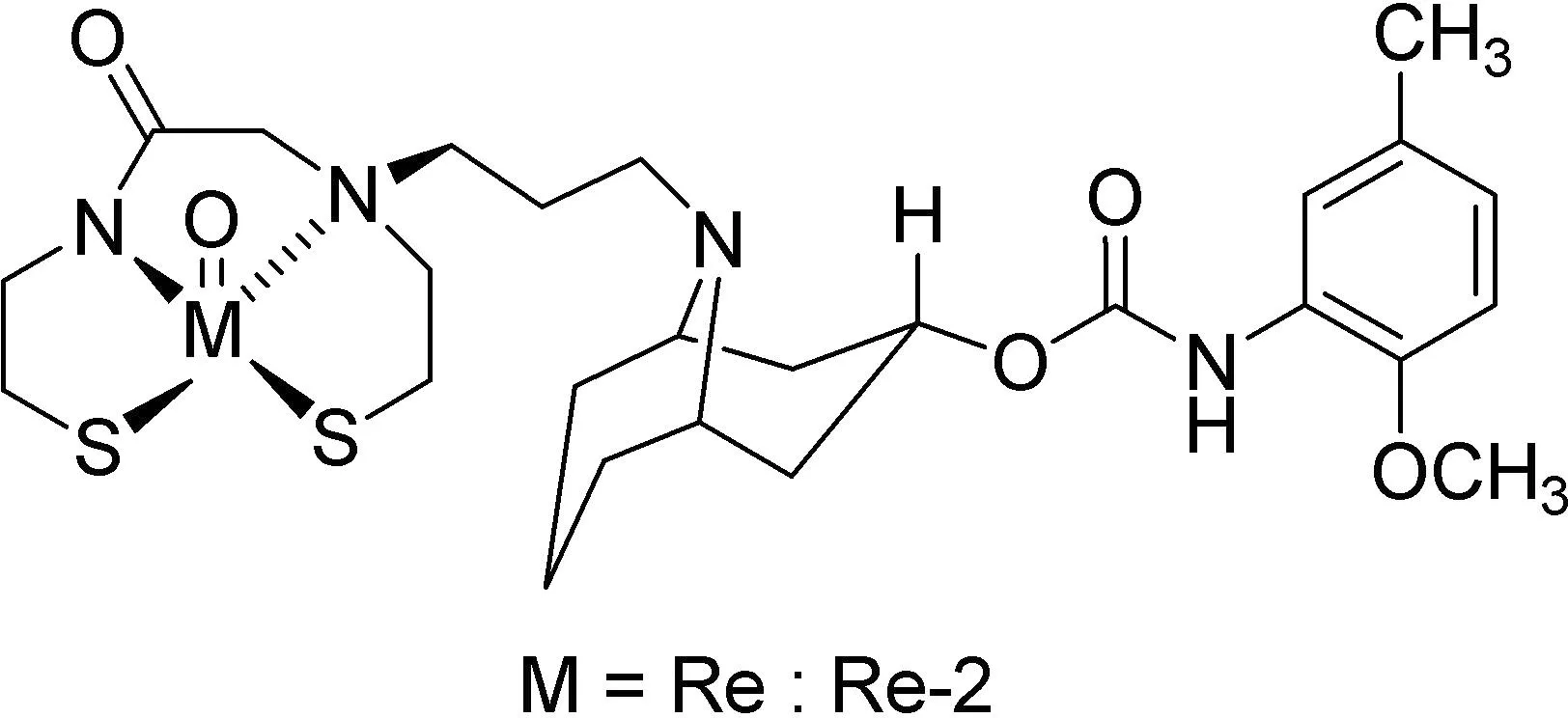
图10 铼试剂Re-2
关于伪石榴碱衍生物的生物活性的研究报道主要集中在上面几个方面,进一步研究伪石榴碱衍生物在其他方面的生物活性仍然具有重要的研究价值。
3 伪石榴碱及其衍生物在合成反应中的应用
伪石榴碱的同系物托品酮是为人熟知的合成托烷衍生物和二环结构的生物碱,托品酮作为原料物质已被成功地用作合成许多生物活性物质(包括可卡因及其类似物),但是利用伪石榴碱作为原料或中间体应用于杂环化合物的合成和研究相对较少,下面就近几年伪石榴碱及其衍生物在合成反应中的应用作一简单介绍。
3.1伪石榴碱衍生物在合成5-HT3拮抗剂中的应用
如前所述,药物格拉司琼是一种强效高选择性外周和中枢神经系统的5-HT3受体拮抗剂。伪石榴碱是合成格拉司琼的一个主要原料,格拉司琼化合物最初采用吲哚-3-羧酸甲基化产物与伪石榴碱烷胺反应制得;然而,吲唑-3-羧酸及其甲基化产物在溶剂中的溶解度不佳,吲唑-3-羧酸甲基化反应的反应条件比较剧烈,反应速率较低,通常收率只有约50%,这影响到合成格拉司琼的总收率。2003年,中国专利1451660A中公开一种高收率制备格拉司琼的方法[15]。该发明发现N-(内-9-甲基-9-氮杂二环[3.3.1]壬-3-基)-吲唑-3-羧酸酰胺化合物具有很好的脂溶性,进行甲基化反应的反应条件比较温和,反应收率超过85%(图11)。

图11 一种制备格拉司琼及其盐的方法
2004年,Isabel Iriepa小组报道了由伪石榴碱衍生物9-甲基-9-氮杂双环[3.3.1]壬-3-β-醇衍生出一系列苯并咪唑、噻唑和苯并噻唑氨基甲酸酯的方法[16](图12)。

图12 伪石榴碱衍生物合成系列苯并咪唑、噻唑和苯并噻唑氨基甲酸酯
3.2伪石榴碱在羟醛缩合反应中的应用
利用托品酮的醛醇缩合反应已经成为了可卡因和一些潜在的生物活性的生物碱的不对称合成中的关键步骤。然而,对于伪石榴碱的羟醛缩合反应直到2011年才由Ryszard Lazny等首次报道[17]。在这篇报道中,9-甲基-9-氮杂双环[3.3.1]壬烷-3-酮经过脱质子与锂酰胺反应成烯醇化锂,它可与醛对映选择性反应得到外向异构体并且反式/顺式的比例可以高达98/2。如果将伪石榴碱与手性氨基化锂反应,得到的非外消旋烯醇化合物与醛反应可以得到ee值高达93%的羟醛缩合反应产物,重结晶以后ee值可以达到99%(图13)。

图13 伪石榴碱对应选择性羟醛缩合反应
同年,文献[18]又报道了一种在水的参与下不添加任何催化剂和另外添加剂的条件下酮的羟醛缩合反应。报道中4 -甲基-1-哌啶酮、托品酮和伪石榴碱在没有任何催化剂或另外的添加剂的情况下,在水中可以自发的发生羟醛缩合反应(图14)。该醛醇缩合反应的非对映选择性取决于水的用量。以水为溶剂,伪石榴碱和对硝基苯甲醛在室温下反应20 h,可以得到93%的收率和98%的转化率,非对映选择性可以达到90%。由于在此条件下的aldol反应同时具有了环境友好性和原子经济性,所以,这一方法无论是在理论研究还是在实际应用方面都有很好的前景。
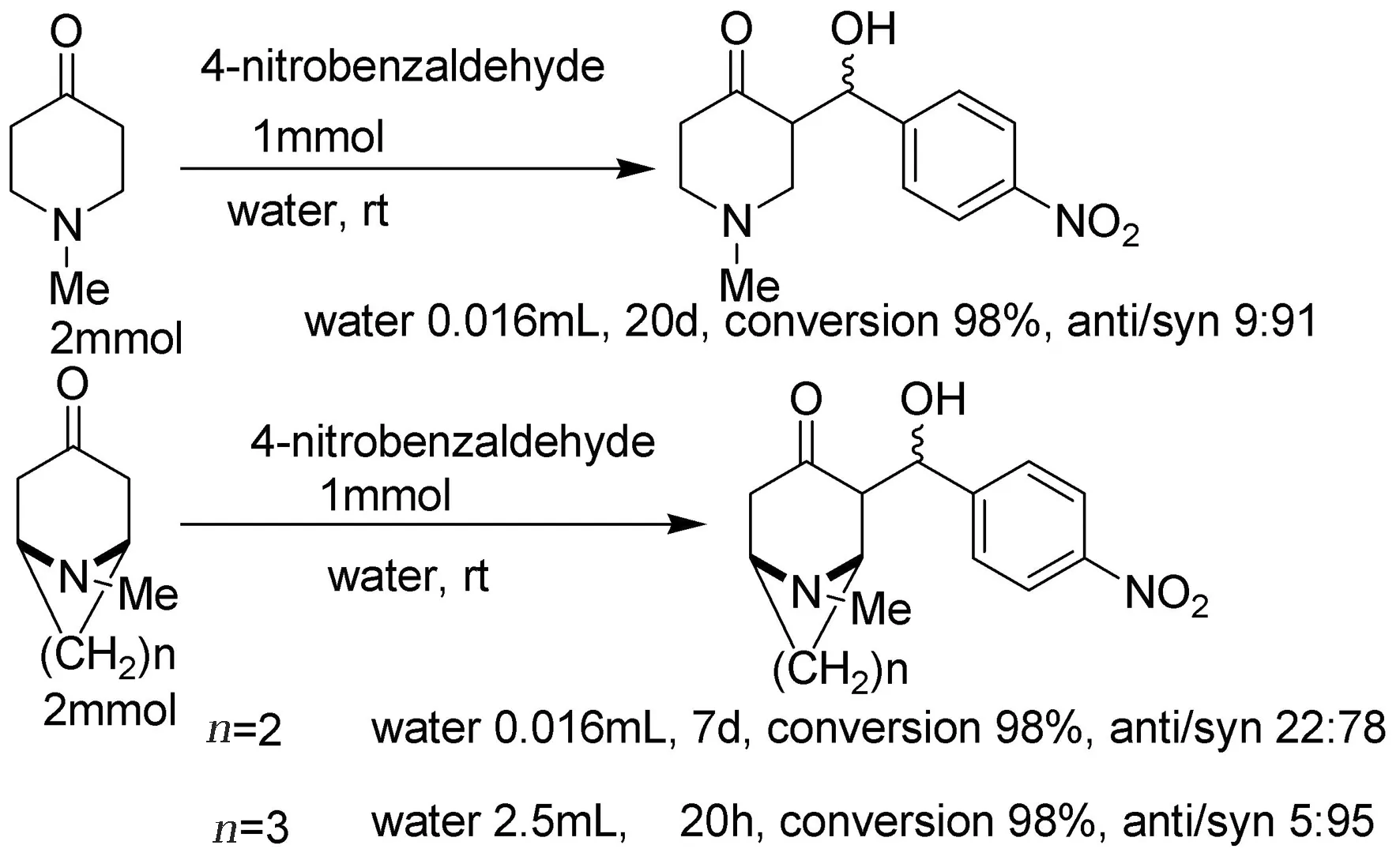
图14 在水的存在下β-氨基酮自发的非对应选择羟醛缩合反应
3.3伪石榴碱及其衍生物作为原料合成氮杂环生物碱
伪石榴碱独特的氮杂双环结构是许多杂环化合物的前提物质,常常用于合成结构更复杂的化合物。1999年,文献[19]报道了以此结构合成哌啶和吲嗪啶生物碱的方法(图15)。文章中采用氮保护的9-氮杂双环[3.3.1]壬烷-3-酮(伪石榴碱的类似物)为起始原料,通过Koga's 手性氨基锂烯醇化得到手性的烯醇硅醚,随后通过环丙烷化、开环等反应最终合成了哌啶生物碱、吡啶和吲嗪啶生物碱。

图15 以伪石榴碱及其类似物不对称合成哌啶及其对映异构体
4 结束语
由此可见,伪石榴碱自从19世纪从石榴树的树皮中被发现以来,就得到了较多的研究。伪石榴碱可以通过不同路线合成,其中最经济、最常用的方法是通过Robinson-Schöpf 反应得到。伪石榴碱中独特的9-氮杂双环[3.3.1]壬烷-3-酮双环结构是一系列生物活性物质的主要骨架,围绕这一骨架的活性物质主要集中在5-HT3受体拮抗节和多巴胺受体基因上。特别是药物格拉司琼对因放疗、化疗及手术引起的恶心和呕吐具有很好的预防和治疗作用,其止吐效果和作用时间远高于同类药。伪石榴碱中独特的双环结构还是许多环状物质的前提物质,常常运用到合成结构更复杂的杂环化合物中;但是,关于伪石榴碱本身的提取、活性研究非常少,以伪石榴碱为基本骨架合成的活性物质还相对较少,同时,将伪石榴碱及其衍生物作为活性物质应用于生物活性研究以及合成方法学研究报道的也非常少,所以,研究伪石榴碱的提取和生物活性、进一步合成更加新颖的伪石榴碱衍生物并研究其应用是研究伪石榴碱及其衍生物下一步需要解决的问题。
[1]王如峰, 向兰, 杜力军, 等. 石榴的化学成分[J]. 亚太传统医药, 2006(3): 61-71.
[2]Cope C, Hugh L Dryden, Charles F Howell. Pesudopelletierine[J]. Organic Syntheses, 1957, 37: 73.
[3]Leonard N J, Morrow D F,Smart W D. Pesudopelletierine[J]. Organic Syntheses, 1963, 4: 816.
[4]Putney,Soine.A Synthesis of Pseudopelletierine[J]. J Am Pharm Assoc, 1955, 44(17): 17-22.
[5]Henry D Boswell, Birgit Drager, Russell McLauchlan W, et al. Specicities of the Enzymes of N-alkyltropane Biosynthesis in Brugmansia and Datura[J]. Phytochemistry, 1999, 52: 871-878.
[6]Nicolaou K C,Montagnon T,Baran P S, et al. Iodine(V)Reagents in Organic Synthesis. Part 4.o-Iodoxybenzoic Acid as a Chemospecific Tool for Single Electron Transfer-Based Oxidation Processes[J]. J Am Chem Soc, 2002, 124(10): 2002-2245.
[7]Fozard J R. MDL 72222: A Potent and Highly Selective Antagonist at Neuronal 5-hydroxytryptamine receptors[J].Naunyn Schmiedeb Arch Pharmacol, 1984,326(1): 36-44.
[8]Gareth J Sanger, David R Nelson. Selective and Functional 5-hydroxytryptamine 3 Receptor Antagonism by BRL 43694 (granisetron)[J]. European Journal of Pharmacology, 1989, 159: 113-124.
[9]Carmichael J, Cantwell B M J, Edwards C M, et al. A pharmacokinetic Study of Granisetron (BRL 43694A), a Selective 5-HT3 Receptor Antagonist: Correlation with Anti-emetic Response[J]. Cancer Chemother Pharmacol, 1989, 24:45-49.
[10]King F D. In 5-Hydroxytryptamine-3 Receptor Antagonists [M]. Boca Raton, Florida:CRC Press Inc,1994: 1 - 44.
[11]Bermudez J,Gaster L,Gregory J,et al. Synthesis and 5-HT3Receptor Antagonist Potency of Novel (endo)3,9- Diazabicyclo[3.3.1]nonan-7-amino Derivatives[J]. Bioorganic & Medicinal Chemistry Letters,1994, 4(20): 2373-2376.
[12]Sanjeev Kumar V Vernekar, Hasan Y Hallaq, Guy Clarkso, et al. Toward Biophysical Probes for the 5-HT3Receptor: Structure-activity Relationship Study of Granisetron Derivatives[J]. J Med Chem, 2010, 53: 2324-2328.
[13]Zhengming Chen, Sari Izenwasser, Jonathan L Katz, et al. Synthesis and Dopamine Transporter Affinity of 2-(Methoxycarbonyl)-9-methyl-3-phenyl -9-azabicyclo[3.3.1]nonane Derivatives[J]. J Med Chem, 1996, 39: 4744-4749.
[14]Robert H Mach, Kenneth T Wheeler, Suwanna Blair, et al. Preparation of a Technetium-99m SPEC Tagent for Imaging the Sigma-2 Receptor Status of Solid Tumors[J]. J Labelled Cpd Radiopharm, 2001, 44: 899-908.
[15]浙江海正药业股份有限公司. 一种制备格拉司琼及其盐的方法: 中国, 1451660A[P]. 2003, 10, 29.
[16]Isabel Iriepa,Javier Villasante F, Enrique Ga′lvez, et al. Synthesis, Spectroscopic a Crystallographic Study of some Carbamates from an Azabicyclic Chloroformate and Primary Heterocyclic Amines[J]. New J Chem, 2004, 28: 618-624.
[17]Ryszard Lazny, Karol Wolosewicz, Paulina Zielinska, et al. Diastereo- and Enantioselective Aldol Reaction of Granatanone (Pseudopelletierine)[J]. Tetrahedron, 2011, 67: 9433-9439.
[18]Ryszard Lazny, Aneta Nodzewska, Iwona Tomczuk. Spontaneous and Diastereoselective Aldol Reactions of Cyclic β-amino Ketones in the Presence of Water[J]. Tetrahedron Letters, 2011, 52: 5608-5683.
[19]Masayuki Kirihara, Takashl Nishio, Satoshi Yokoyama, et al. Hypervalent λn-Iodane-mediated Fragmentation of Tertiary Cyclopropanol Systems II: Application to Asymmetric Syntheses of Piperidine and Indolizidine Alkaloids[J]. Tetrahedron, 1999, 55: 2911-2926.
(编校:叶超)
ProgressonExtraction,SynthesisofPseudopelletierineandApplicationofDerivatives
WANG Zhou-yu1,2,HE Qi, LAI Peng2, YANG Wen-yu2, QIAN Shan2
(1.SchoolofScience,XihuaUniversity,Chengdu610039China;2.SchoolofFoodandBioengineering,XihuaUniversity,Chengdu610039China)
Pseudopelletierine is an important alkaloid which exists in the pomegranate stem bark, root bark and pericarp. Pseudopelletierine has a unique 9- azabicyclo [3.3.1] nonane structure which is the analogue of tropinone and main skeleton of some active substances. We summarized the extraction, synthesis methods of pseudopelletierine and the application of both biological activity and synthetic aspects of its derivatives. Meanwhile, the studies of pseudopelletierine extraction, biological activities, novel pseudopelletierine derivatives synthesis and application are the future research direction.
pesudopelletierine; extraction; synthesis; application
2014-09-22
教育部“春晖”项目(Z2012020)国家自然科学基金(21102115);
王周玉(1977—),女,教授,硕士生导师,主要研究方向为医药中间体合成及应用。
O636
:A
:1673-159X(2015)04-0042-05
10.3969/j.issn.1673-159X.2015.04.009
