过表达和抑制表达2–Cys Prx 基因烟草的 生长特性和叶片光合功能
2015-07-15胡举伟张会慧孙广玉
胡举伟,张会慧,孙广玉*
(1.东北林业大学生命科学学院,黑龙江 哈尔滨150040;2.东北农业大学资源与环境学院,黑龙江 哈尔滨 150030)
Prxs是通过其所具有的半胱氨酸残基(–Cys)清除生物生理过程产生的活性氧的一类蛋白[1–2],不含结合金属离子辅基,存在于多种生物中[3–4]。植物叶绿体中,目前发现只有一种Prxs,即2–Cys Prx,它由核基因编码[5–6],2–Cys Prx与叶绿体中的类囊体膜相结合,具有较高的保守性[7–8]。
植物在代谢过程中产生的活性氧可破坏细胞内多种物质的结构和活性,叶绿体内的活性氧可对光合机构造成破坏,2–Cys Prx可能在降低活性氧对光合机构的损伤中发挥重要作用[9],从而在非生物胁迫导致APX 活性下降时,清除叶绿体内的H2O2[10]。2–Cys Prx清除活性氧自由基主要依赖于硫氧还蛋白为电子受体而发挥作用,2–Cys Prx也可发生可逆性氧化失活来调节H2O2浓度[11]。非生物胁迫条件可促进2–Cys Prx基因的表达[12],另外,2–Cys Prx还可以通过十聚体的形式,发挥分子伴侣的功能[13–14],参与植物体内多种与氧化相关的生理病理过程,且十聚体具有较高的活性[15–16]。2–Cys Prx基因表达水平的提高有助于增强植物对非生物胁迫的耐受能力[17–18]。笔者分别以过表达和抑制表达2–Cys Prx基因烟草(Nicotiana tabacum)龙江911为试验材料,比较了2–Cys Prx基因过表达和抑制表达烟草的生长特性和叶片光合功能,拟为进一步揭示2–Cys Prx基因的生理功能提供参考。
1 材料与方法
1.1 材料
试验材料为过表达和抑制表达2–Cys Prx基因烟草(龙江911),其阳性植株由东北林业大学植物生理学实验室通过反转录克隆出2–Cys Prx基因,分别构建了过表达和抑制表达载体,通过电击法导入农杆菌LBA4404中,利用农杆菌叶盘法转化烟草而获得[19]。过表达2–Cys Prx基因烟草阳性植株记为过表达Prx,抑制表达2–Cys Prx基因烟草阳性植株记为抑制表达Prx。
1.2 方法
试验于2014年03—06月在东北林业大学植物生理实验室进行。过表达Prx 和抑制表达Prx 进行生根培养,生根后移栽到培养钵中,以混合的草炭土、蛭石(体积比2∶1)为培养基,每钵定植1 株。移栽后,初期用保鲜膜覆盖2 d,待其缓苗后将培养钵置于光照为200 μmol/m2·s,每天照光12 h,黑暗12 h,温度控制在25~30℃的光照培养箱培养。采用非转基因烟草作为对照(CK)。待植株长至10片叶时,进行生长特性和叶绿素荧光参数的测定。
生长特性包括烟苗株高、根系长度、地上部和地下部的鲜重及干重。每个处理重复5次。
利用便携式脉冲调制荧光仪(英国 FMS–2 (Hansatch 公司出品),测定充分光适应后的幼苗倒数第2 片功能叶片的开放PSⅡ反应中心的激发能捕获效率(Fv'/Fm')、电子传递速率(ETR),暗适应30min 后测定PSⅡ最大光化学效率(Fv/Fm)。
选取幼苗倒数第2 片功能叶片,暗适应30min,利用Mini 调制式掌上叶绿素荧光仪(捷克FluorPen FP 100 max)测定其OJIP 曲线,将OJIP 曲线按Vt=(Ft–Fo)/(Fm–Fo)公式进行标准化,参照Strasser等[20]的方法计算相关参数。测定时避开叶脉,每个处理5次重复。
1.3 数据处理和统计方法
利用Excel 2003和DPS 7.05软件对试验数据进行统计分析,采用单因素方差分析、最小显著差异法比较不同处理间的差异。
2 结果与分析
2.1 过表达和抑制表达2–Cys Prx 基因烟草的生长特性
由表1 可以看出,过表达2–Cys Prx 基因烟草的株高和根长分别高于CK24.45%(P<0.01)和40.38% (P<0.01),差异均极显著。抑制表达2–Cys Prx 基因烟草的长势与CK 差异较小,但整体长势弱于CK,其株高和根长分别低于CK 15.09%(P>0.05)和12.45%(P>0.05),与CK 差异均不显著。过表达和抑制表达2–Cys Prx 基因烟草的叶片数与CK 均无显著差异。过表达2–Cys Prx 基因烟草植株的地上部鲜重、地下部鲜重、总鲜重、地上部干重、地下部干重和总干重均大于CK,抑制表达2–Cys Prx基因烟草的最低,且不同处理之间各指标均达极显著差异水平(P<0.01)。

表1 烟草植株的生长性状 Table 1 Growth characteristics of tobacco seedlings
2.2 过表达和抑制表达2–Cys Prx 基因烟草的叶绿素荧光参数
由表2 可以看出,过表达和抑制表达2–Cys Prx基因烟草叶片的Fv/Fm均维持在0.8 以上,不同处理之间无显著差异。过表达2–Cys Prx 基因烟草叶片的Fv'/Fm'与CK 间没有显著差异,而ETR 则较CK 增加了9.86%(P>0.05),但未达显著差异水平。抑制表达2–Cys Prx 基因烟草叶片的Fv'/Fm'和ETR分别低于CK 7.00%(P<0.05)和35.96%(P<0.01)。

图2 烟草叶片的叶绿素荧光参数 Fig.2 Chlorophyll fluorescemce parameters in leaves of tobacco seedlings
2.3 过表达和抑制表达2–Cys Prx 基因烟草的OJIP 曲线
由图1 可以看出,过表达和抑制表达2–Cys Prx基因烟草叶片的OJIP 曲线形态明显不同于CK,其中过表达和抑制表达2–Cys Prx 基因烟草叶片OJIP曲线上各点的相对荧光强度Ft均较CK 有所增加,且过表达2–Cys Prx 基因烟草的增加幅度更大,另外,随着时间的延长,不同处理之间的差异幅度增大。将OJIP 曲线标准化后可以看出,不同处理之间烟草叶片OJIP 曲线上各点的相对可变荧光Vt之间差异变得较小,而大约在J 点和I 点不同处理之间表现出明显的差异,不同处理烟草叶片的VI较CK 均有不同程度的增加。
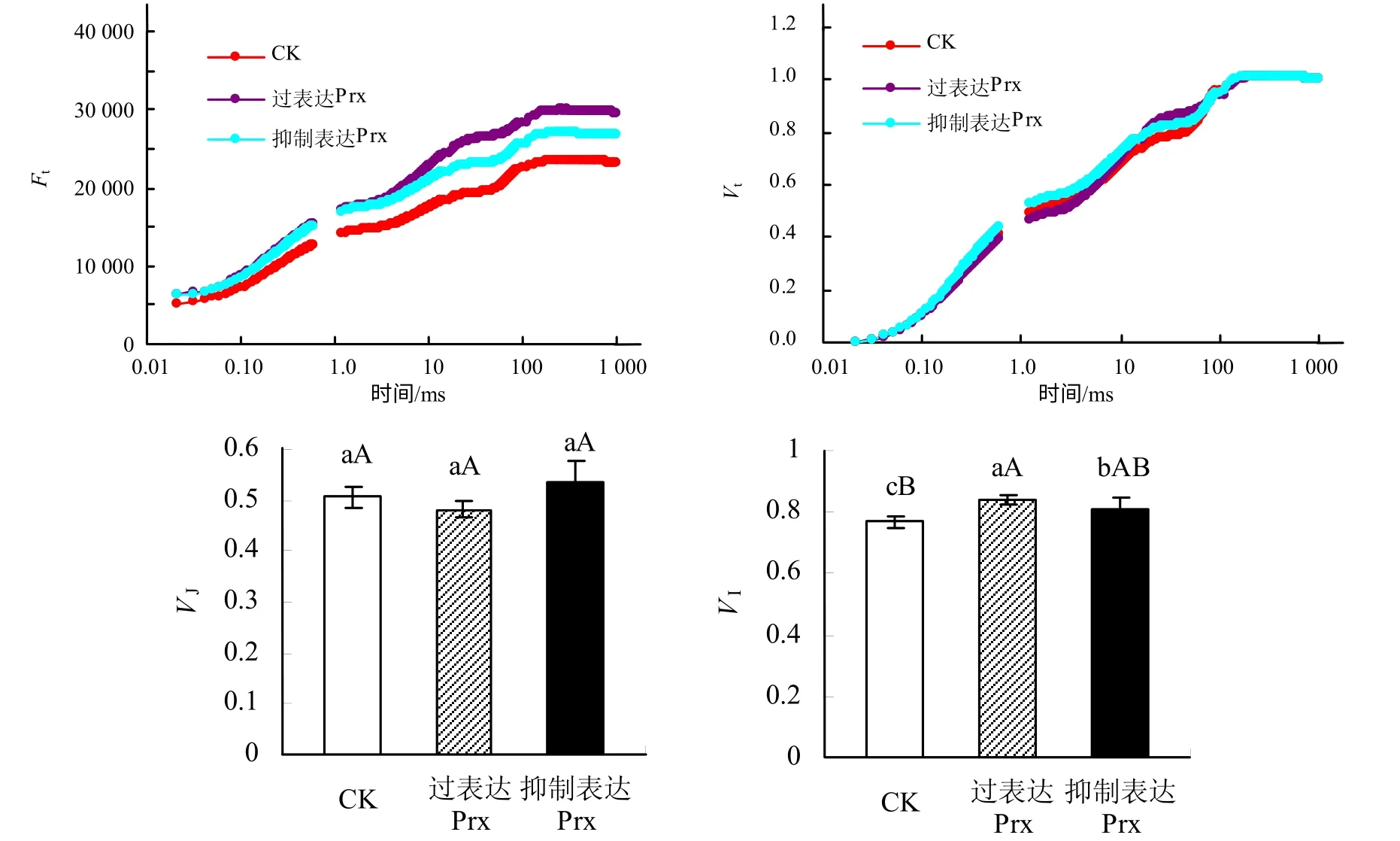
图1 过表达和抑制表达2–Cys Prx 基因烟草叶片的OJIP 曲线和标准化OJIP 曲线 Fig.1 Chlorophyll a fluorescemce tramsient (OJIP) and normalized OJIP for leaves of tobacco seedlings with 2–Cys Prx overexpressed and suppressed
2.4 过表达和抑制表达2–Cys Prx 基因烟草叶片的叶绿素荧光参数雷达图
由图2 可以看出,过表达2–Cys Prx 基因烟草叶片的Area 和Ψo分别较CK 有不同程度的增加,而抑制表达处理则呈明显的降低趋势。过表达2–Cys Prx 基因烟草叶片的φEo和ETo/RC 较CK 分别增加了6.93%和4.24%,而φDo和DIo/RC 则较CK 分别降低了5.49%和6.82%,抑制表达2–Cys Prx基因烟草叶片的φEo和ETo/RC 较CK 分别降低了7.26%和7.24%,而φDo和DIo/RC 则较CK 分别增加了3.42%和3.30%。过表达和抑制表达2–Cys Prx基因烟草叶片的ABS/RC和TRo/RC 均没有发生明显变化。
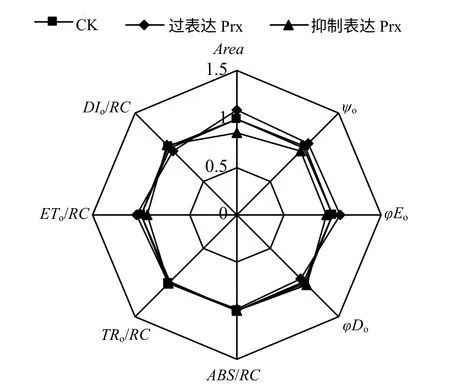
图2 烟草叶片的叶绿素荧光参数雷达图 Fig.2 Radar plot of fluorescence data in leaves of tobacco seedlings
3 讨论
过表达2–Cys Prx 基因烟草的生长优于CK,表现为株高和根长明显高于CK,并且地上部和地下部鲜重和干重也明显高于CK,而抑制表达2–Cys Prx 基因烟草生长受到抑制。不同处理烟草植株的叶片数没有明显差异,即过表达2–Cys Prx 基因烟草和抑制表达2–Cys Prx 基因烟草生长的区别主要表现为植株叶片面积的增加或降低,而并没有明显促进新生叶片的发生,但是,株高的变化却说明过表达2–Cys Prx 基因烟草的节间距相对增加。
没有经受环境胁迫并经过充分暗适应的植物叶片的Fv/Fm是比较恒定的,基本不存在物种间的差异[21]。本试验中,过表达和抑制表达2–Cys Prx基因烟草叶片的Fv/Fm与CK 没有明显差异,均维持在0.8 以上,说明在没有其他环境胁迫条件下并没有引起烟草叶片发生光抑制现象。虽然过表达2–Cys Prx 基因烟草叶片的Fv'/Fm'较CK 没有明显增加,但过表达2–Cys Prx 基因烟草叶片的ETR 较CK明显增加,并且抑制表达2–Cys Prx 基因烟草叶片的Fv'/Fm'和ETR 也较CK 明显降低,表明过表达和抑制表达2–Cys Prx 基因烟草叶片的光能转化和电子传递情况不同,特别是抑制表达2–Cys Prx 基因烟草叶片的电子传递能力明显降低。
不同处理下烟草叶片的OJIP 曲线形态明显不同,但由于原始的OJIP 曲线受外界环境的影响较大,因而,在数据处理中常常将OJIP 曲线进行标准化[22]。不同处理下标准化OJIP 曲线在J 点和I点出现明显差异,OJIP 曲线上J 点荧光变化反映了PSⅡ电子受体侧QA向QB的电子传递特征[23],结合表2 可以发现,过表达和抑制表达2–Cys Prx 基因烟草叶片电子传递的差别主要体现在PSⅡ受体侧。过表达2–Cys Prx 基因烟草叶片的Area 和Ψo均较CK 明显增加,而抑制表达2–Cys Prx 基因烟草叶片的Area 和Ψo均呈明显的降低趋势,即过表达2–Cys Prx 基因烟草叶片的PSⅡ电子受体库(QA、QB和PQ库等)以及PSⅡ反应中心的活性相对高于抑制表达2–Cys Prx 基因烟草[24],这也说明过表达和抑制表达2–Cys Prx 基因烟草叶片受体侧电子传递速率增加或降低的原因与PSⅡ受体侧电子受体库大小的改变具有直接的关系。过表达和抑制表达2–Cys Prx基因烟草叶片的光能分配和利用情况存在区别,虽然过表达和抑制表达2–Cys Prx 基因烟草叶片的ABS/RC和TRo/RC与CK相比均没有发生明显变化,但过表达2–Cys Prx 基因烟草叶片的φEo和ETo/RC较CK 明显增加,而φDo和DIo/RC 则明显降低,说明过表达2–Cys Prx 基因烟草叶片吸收的光能更倾向于分配到光化学反应,而以无效热能形式耗散的能量比例降低,这有利于光反应同化力的供应,以维持正常的碳同化。而抑制表达2–Cys Prx 基因烟草叶片吸收光能用于光化学反应的比例相对降低。
综上所述,过表达和抑制表达2–Cys Prx 基因烟草叶片的PSⅡ光化学活性无明显差异,但过表达2–Cys Prx 基因烟草叶片的PSⅡ光合电子传递能力相对高于抑制表达2–Cys Prx 基因烟草,这主要与其PSⅡ电子受体侧接受电子能力的增强有关,而抑制2–Cys Prx 基因烟草叶片的电子传递能力和光能分配到光化学反应的比例相对降低,以无效热能形式的耗散比例相对增加。
[1] Pena-Ahumada A,Kahmann U,Dietz K J,et al. Regulation of peroxiredoxin expression versus expression of Halliwell-Asada-Cycle enzymes during early seedling development of Arabidopsis thaliana[J].Photosynthesis Research,2006,89(2/3):99–112.
[2] 张海燕,李国田,王晓杰,等.小麦过氧化物还原酶基因TaPrx的克隆与功能初步分析[J].中国农业科学,2009,42(4):1222–1229.
[3] Horling F,Baier M,Dietz K J.Redox-regulation of the expression of the peroxide–detoxifying chloroplast 2–Cys peroxiredoxin in the liverwort Riccia fluitans[J].Planta,2001,214(2):304–313.
[4] Jang H H,Kim S Y,Park S K,et al.Phosphorylation and concomitant structural changes in human 2–Cys peroxire- doxin isotype I differentially regulate its peroxidase and molecular chaperone function[J].FEBS Letters,2006,508(1):351–355.
[5] Baier M,Noctor G,Foyer C H,et al.Antisense suppression of 2–Cysteine peroxiredoxin in Arabidopsis specifically enhances the activities and expression of enzymes associated with ascorbate metabolism but notglutathione metabolism[J].Plant Physiology,2000,124(2):823–832.
[6] Baier M,Dietz K J.Protective function of chloroplast 2–cysteine peroxiredoxin in photosynthesis.Evidence from transgenic Arabidopsis[J].Plant Physiology,1999,119(4):1407–1414.
[7] Baier M,Dietz K J.Primary structure and expression of plant homologues of animal and fungal thioredoxin- dependent peroxide reductases and bacterial alkyl hydroper-oxide reductases[J].Plant Molecular Biology,1996,31(3):553–564.
[8] Brehelin C,Meyer E H,de Souris J P,et al.Resemblance and dissemblance of Arabidopsis type II peroxiredoxins:Similar sequences for divergentgene expression,protein localization,and activity[J].Plant Physiology,2003,132(4):2045–2057.
[9] König J,Lotte K,Plessow R,et al.Reaction mechanism of plant 2–Cys peroxiredoxin role of the cterminus and the quaternary structure[J].The Journal of Biological Chemistry,2003,278(27):24409–24420.
[10] 张会慧,田褀,刘关君,等.转2–Cys Prx 基因烟草抗氧化酶和PSⅡ电子传递对盐和光胁迫响应[J].作物学报,2013,39(11):2023–2029.
[11] Wood Z A,Poole L B,Karohs P A.Peroxiredoxin evolution and the regulation of hydrogen peroxide signaling[J].Science,2003,300(8):650–653.
[12] Contreras L,Moenne A,Gaillard F,et al.Proteomic analysis and identification of copper stress-regulated proteins in the marine alga Scytosiphongracilis (Phaeophyceae) [J].Aquatic Toxicology,2010,96(2):85–89.
[13] Lim J C,Chio H I,Park Y S.Irreversible oxidation of the active–site cysteine of peroxiredoxin to cysteine sulfonic acid for enhanced molecular chaperone activity[J]. Journal of Biological Chemistry,2008,283(43):28873– 28880.
[14] Rhee S G,Jeong W,Chang T S,et al.Sulfiredoxin,the cysteine sulfinic acid reductase specific to 2–Cys peroxiredoxin:its discovery,mechanism of action,and biological significance[J].Kidney International,2007,72(6):3–8.
[15] 康瑞霞,刘震西,刘芸,等.Prx1对细胞信号转导过程的调控[J].现代生物医学进展,2012,12(11):2186–2190.
[16] Lee W,Choi K S,Riddell J,et al.Human peroxiredoxin 1 and 2 are not duplicate proteins:the unique presence of CYS83 in Prx1 underscores the structural and functional differences between Prx1 and Prx2[J].Journal of Biological Chemistry,2007,282(30):22011–22022.
[17] König J,Baier M,Horling F,et al.The plant-specific function of 2–Cys peroxiredoxin-mediated detoxification of peroxides in the redox-hierarchy of photosynthetic electron flux[J].PNAS,2002,99(8):5738–5743.
[18] 胡举伟,张会慧,逄好胜,等.转2–Cys Prx基因烟草F1幼苗叶片PSⅡ光化学活性对干旱胁迫的响应[J].湖南农业大学学报:自然科学版,2014,40(6):593–598.
[19] 田祺.2–Cys Prx 烟草遗传转化及其在光破坏防御中的功能初探[D].哈尔滨:东北林业大学,2014.
[20] Strasser R J,Srivastava A,Govindjee.Polyphasic chlorophyll a fluorescence transient in plants and cyanobacteria[J]. Photochemistry and Photobiology,1995,61(1):32–42.
[21] 张会慧,张秀丽,王娟,等.利用快相叶绿素荧光参数综合评价3 种丁香的耐盐性[J].南京林业大学学报,2013,37(5):13–19.
[22] 丁俊男,张会慧,迟德富.土壤菲胁迫对高丹草幼苗叶片光合机构功能的影响[J].草业科学,2014,31(9):1732–1738.
[23] 李鹏民,高辉远,Strasser R J.快速叶绿素荧光诱导动力学分析在光合作用研究中的应用[J].植物生理与分子生物学学报,2005,31(6):559–566.
[24] 陈锋,田纪春,孟庆伟,等.短期高温胁迫对高产小麦品系灌浆后期旗叶光系统Ⅱ功能的影响[J].应用生态学报,2006,17(10):1854–1858.
