氢键构筑网络结构的三正丁基锡羧酸酯的合成、结构及抗癌活性
2015-07-14邝代治庾江喜冯泳兰张复兴蒋伍玖朱小明
邝代治 庾江喜 冯泳兰 张复兴 蒋伍玖 朱小明
(功能金属有机材料湖南省普通高等学校重点实验室,衡阳师范学院化学与材料科学系,衡阳 421008)
0 前 言
超分子化合物具有特殊的结构,由于在催化、磁性、气体存储、生物医学成像和药物传递等功能材料领域有着潜在的应用价值而引起人们的兴趣[1-4]。研究表明,分子间的氢键、π-π堆积、C-H…π等弱相互作用是构筑超分子化合物的主要工具[5-6]。一些由弱作用组装的结构新颖的链状、螺旋状、层状、蜂窝状的金属超分子配合物被人们不断挖掘[7-9]。
有机锡化合物具有较强的生物活性和丰富多变的结构特点,被广泛应用于工农业,是合成化学、药物化学、材料化学等学科关注的热点之一[10-11]。有机锡化合物的结构和性质,除了与中心锡原子连接的烃基、配体以及反应条件有关外[12-15],还与溶剂分子参与配位[16]和分子间的弱作用[12]有关。近年来,弱作用构筑的有机锡超分子已有报道[17-18]。为了进一步研究配体、分子间弱作用对有机锡化合物的空间结构及性质的影响,我们用微波辐射方法,以μ-氧-双(三正丁基锡)分别与二苯乙醇酸、2-氯烟酸反应,合成了氢键构筑的二、三维网络结构的三正丁基锡羧酸酯(1)和(2),对其结构进行了表征,并研究了它们的抗癌活性及热稳定性。
1 实验部分
1.1 仪器和试剂
配合物的合成于MicroSYNTH微波合成仪 (莱伯泰科公司)上进行。熔点用X4双目体视显微熔点测定仪(北京泰克仪器有限公司)测定,温度计未经校正。C、H、N含量用PE-2400(Ⅱ)元素分析仪 (美国PE公司)测定。红外光谱用IR Prestige-21红外光谱仪(日本 Shimadzu 公司,4 000~400 cm-1)测定。核磁共振氢谱、碳谱分别用Bruker Avance 400和Bruker Avance 500核磁共振仪 (瑞士Bruker公司,TMS为内标)测定。热重分析在TG 209 F3热重分析仪(德国Netzsch公司)上进行。
二苯乙醇酸按文献[19]方法合成。μ-氧-双(三正丁基锡)(96%)、2-氯烟酸(98%)购自上海晶纯生化科技股份有限公司。卡铂(99%)、氘代甲醇和氘代氯仿(XD≥99.8%)购自百灵威科技有限公司,其余试剂为分析纯。乙醇、苯购自天津市大茂化学试剂厂,二甲基亚砜(DMSO)购自天津市科密欧化学试剂厂。人结肠癌细胞(Colo205)、人肝癌细胞(HepG2)、人乳腺癌细胞 (MCF-7)、人宫颈癌细胞 (Hela)、人肺癌细胞(NCI-H460)细胞株取自美国模式培养物集存库(ATCC),含10%胎牛血清的RPMI-1640培养基购自美国Gibico公司,胰蛋白酶(Trypsin)购自甘肃金盛生化制药有限公司。
1.2 配合物的合成
50 mL 圆底烧瓶中,加入 0.5 mmol(0.298 g)(n-Bu3Sn)2O,1 mmol(0.228 g) 二苯乙醇酸或 1 mmol(0.158 g)2-氯烟酸,乙醇和苯各 10 mL,搅拌混合均匀,然后置于微波合成仪中反应,设定辐射功率800 W,温度90℃,时间30 min。反应完成后,冷却至室温,过滤,滤液静置数天后,得配合物1或2。
配合物 1:无色透明晶体 0.268 g,收率 50.1%。m.p.36~37 ℃。元素分析(C26H40O4Sn),理论值(%):C 58.34,H 7.53;实测值(%):C 58.31,H 7.52。IR(KBr,cm-1):3 059(w),3 028(w),2 955(s),2 922(m),2 855(m),1 645(vs),1 593(m),1 491(m),1 452(m),1 414(w),1 377(m),1 337(m),1 315(s),1 167(m),1 084(w),1 053(m),964(w),939(w),908(w),876(w),808(w),756(s),698(vs),675(s),623(w),606(w),525(w),459(w),430(w)。1H NMR(CDCl3,400 MHz),δ 7.28~7.51(m,10H,Ph-H),4.62(s,1H,Ph2C(OH)-),1.19~1.63(m,18H,-CH2-),0.85(t,J=7.2 Hz,9H,Me-H)。13C NMR(CDCl3,100 MHz),δ 13.58(Me-C),17.03(SnCH2-,1J(119Sn-13C)=344 Hz,1J(117Sn-13C)=329 Hz),26.92(SnCH2CH2CH2-,3J(119Sn-13C)=63 Hz,3J(117Sn-13C)=61 Hz),27.65(SnCH2CH2-,2J(119Sn-13C)=22 Hz),81.22(Ph2C(OH)-),127.37(3-Ph-C),127.42(4-Ph-C),127.75(2-Ph-C),143.48(1-Ph-C),178.33(-COO)。
配合物 2:无色透明晶体 0.299 g,收率 64.3%。m.p.69~71 ℃。元素分析 (C18H32ClNO3Sn),理论值(%):C 46.53,H 6.94,N 3.01;实测值(%):C 46.53,H 6.98,N 3.03。IR(KBr,cm-1):2 953(s),2 924(s),2 855(m),1 607(vs),1 580(m),1 466(m),1 450(m),1 391(s),1 267(w),1 196(w),1 169(m),1 124(w),1 078(m),1 022(w),997(w),854(m),822(w),777(m),737(w),683(m),658(w),617(w),592(w),484(w),463(w),407(w)。1H NMR(CD3OD,500 MHz),δ 8.37(dd,J=5,2 Hz,1H,6-Py-H),8.01(dd,J=7.5,2 Hz,1H,4-Py-H),7.41(dd,J=7.5,5 Hz,1H,5-Py-H),1.27~1.73(m,18H,-CH2-),0.92(t,J=7.2 Hz,9H,Me-H)。13C NMR(CDCl3,100 MHz),δ 13.61(Me-C),16.94(SnCH2-,1J(119Sn-13C)=348 Hz,1J(117Sn-13C)=332 Hz),27.02(SnCH2CH2CH2-,3J(119Sn-13C)=63 Hz,3J(117Sn-13C)=61 Hz),27.81(SnCH2CH2-,2J(119Sn-13C)=21 Hz),110.04,121.96,132.89,140.25,150.80(Py-C),162.83(-COO)。
1.3 晶体结构测定
选取尺寸为 0.21 mm×0.17 mm×0.13 mm (1)和0.23 mm×0.19 mm×0.17 mm(2)的晶体 ,在 Bruker SMART APEX II CCD单晶衍射仪上,采用经石墨单色化的 Mo Kα 射线(λ=0.071 073 nm),于 296(2)K,以φ~ω扫描方式收集衍射数据。配合物1在2.32°~26.99°范围内共收集 117 536 个衍射点,其中独立衍射点11 019个(Rint=0.044 4),用于结构精修的可观察衍射点 7 056个(I>2σ(I));配合物 2在1.96°~27.48°范围内共收集 20 639 个衍射点,其中独立衍射点5 158个(Rint=0.028 4),用于结构精修的可观察衍射点4 759个(I>2σ(I))。全部数据经Lp因子和多重扫描吸收校正。晶体结构由直接法解出,全部非氢原子、配位水分子的氢原子坐标在差值Fourier合成中陆续确定,其余氢原子由理论加氢法给出在晶胞中的位置坐标。对氢原子和非氢原子分别采用各向同性和各向异性热参数进行全矩阵最小二乘法修正。全部结构分析计算工作采用SHELXTL程序[20-21]完成。配合物的晶体学数据列于表1。
CCDC:1030063,1;1030062,2。
1.4 抗癌活性测定
配合物的体外抗癌活性测试在中国科学院广州生物医药与健康研究院完成。采用四氮唑盐还原法 (MTT法)测定配合物对人癌细胞Colo205、HepG2、MCF-7、Hela、NCI-H460 增殖的抑制活性。实验分为药物试验组 (分别加入不同浓度的测试药)、对照组(只加培养液和细胞,不加测试药)和空白组(只加培养液,不加细胞和测试药)。取处于对数生长期的肿瘤细胞,加入适量的Trypsin消化,使贴壁细胞脱落,用含10%胎牛血清的RPMI-1640培养液在含5%(体积分数)CO2、饱和湿度培养箱内于37℃下培养。取 96孔板,将测试药液 (0.1 nmol·L-1~10 μmol·L-1)按浓度梯度分别加入至各孔中,每个浓度设6个平行孔,于前述培养箱条件下培养72 h,然后每孔加 MTT 40 μL(用 D-Hanks缓冲液配成 4 mg·mL-1),继续培养 4 h,移去上清液,每孔加 DMSO 150 μL,振荡5 min,使甲瓒结晶充分溶解,利用Ap22 Speedy全自动酶免分析系统在570 nm波长处检测各孔的光密度。对照药物(卡铂)的活性按照配合物的活性测试方法测定。实验数据应用Graph Pad Prism 5.0统计软件分析,通过存活率百分比数据相对于药物浓度的非线性回归分析 (曲线拟合),用S形剂量响应(变量)方程确定IC50值。

表1 配合物的晶体学数据Table 1 Crystal data and structure refinements of the complexes
2 结果与讨论
2.1 谱学表征
配合物的红外光谱中,1在 2 955、2 922、2 855 cm-1和 2 在 2 953、2 924、2 855 cm-1均出现饱和 CH的特征吸收,表明配合物中丁基的存在[10,12]。羧基去质子化与锡发生配位后,在配合物的红外光谱中,二苯乙醇酸和2-氯烟酸的羧羟基缔合吸收峰(2 400~3 500 cm-1,2 200~3 200 cm-1)消失;二苯乙醇酸在 1 719、1 246 cm-1和 2-氯烟酸在 1 582、1 261 cm-1处的羧基不对称与对称伸缩振动,在配合物的红外光谱中分别迁移到1645、1315 cm-1(1)和1 607、1 391 cm-1(2),其差值 Δν分别为 330和 216 cm-1,说明1和2中羧基均为单齿配位[14,16-18],与X-射线单晶衍射实验结果一致。此外,配合物在525、459 cm-1(1)和 592、463 cm-1(2)出现 Sn-C、Sn-O 伸缩振动吸收[22]。
配合物的1H NMR谱中,各组峰的积分面积之比与预期的各组质子数基本吻合。1 在 7.28~7.51 范围内的多重峰,归属为苯环质子吸收峰[10,12-18];2中吡啶环的3个氢受邻近质子影响,呈3组双二重峰[23]。配合物的13C NMR谱中,芳环碳原子出现在127.37~143.48(1)和 110.04~150.80(2)范围内[10,13-18]。1 和 2 中羧基碳信号分别出现在 178.33、162.83,与文献值[13-14,16-18]基本一致。
2.2 晶体结构
在晶体解析过程中,对1中无序的丁基,同一个丁基的4个碳原子被限制具有相同的位移参数进行精修;对丁基的部分C-C和4个苯环的全部CC键长作了限制性处理,使其在合理的范围内。对2中C7-C8键长进行限制,使其具有化学合理性。
配合物1、2的分子结构分别见图1、2,主要键长和键角列于表2。从分子结构图和结构参数可知,配合物2的N原子未参与配位。1的不对称结构单元中包含2个结构相似的独立配合物分子,与2分子结构类似,中心锡原子的配位环境类同,锡原子与3个碳、1个羧基氧、1个水分子的氧原子配位。与锡原子相连的5个键长均不等,水分子氧与锡形成的配键最长,还由于1和2中配体的空间效应不同,使轴向角∠O-Sn-O偏离线性角,赤道位置的丁基均分别偏离位阻较大的二苯乙醇酸、2-氯烟酸,因此,锡与配位原子组成畸变三角双锥构型。

图1 配合物1的不对称单元(椭球率15%)Fig.1 Asymmetric unit of complex 1 with 15%probability ellipsoids

图2 配合物2的分子结构图(椭球率15%)Fig.2 Molecular structure of complex 2 with 15%probability ellipsoids

表2 配合物的主要键长(nm)和键角(°)Table 2 Selected bond lengths(nm)and angles(°)for the complexes

续表2
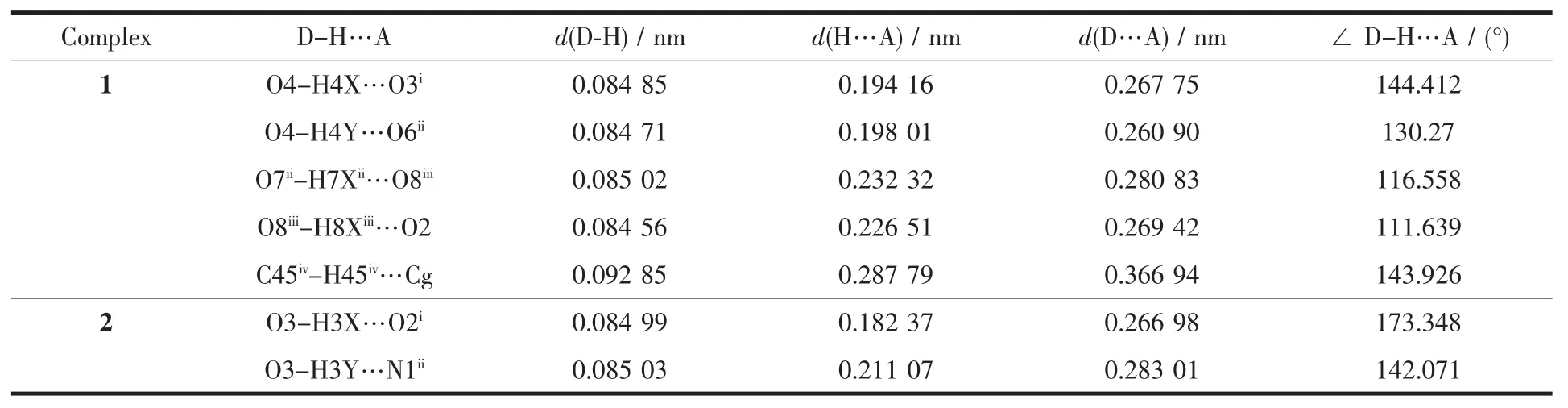
表3 配合物的氢键数据Table 3 Parameters of hydrogen bonding interactions in the complexes

图3 O-H…O和C-H…π作用构筑的配合物1二维网状结构Fig.3 2D network structure of complex 1 by O-H…O and C-H…π interactions
2个配合物的晶体中存在氢键弱作用,氢键参数列于表3。配合物1中,1个配合物分子的配位水与邻近的2个配合物分子的羰基氧或醇羟基分别形成O-H…O氢键,由这种分子之间的交叉氢键弱作用组成13元环拓展的一维无限链结构。两条相邻的链之间,通过1条链的苯环氢与另一条链上的苯环发生C-H…π作用,扩展成二维网状,如图3所示,Cg(Centroid:0.649 30,-0.489 10,-1.026 90)代表1中C27~C32原子组成的苯环质心。配合物2中,与锡配位水分子的2个O-H键分别与一邻近配合物分子的羰基氧和另一配合物分子的吡啶N原子形成O-H…O和O-H…N氢键、向空间拓展成三维大环超分子网络。其中在ab面上构成相互连接的28元环和16元环,在ac面上则形成互相衔接的32元环和12元环。
2.3 抗癌活性
配合物的体外抗癌活性测试结果列于表4。由表4可知,配合物1对5种人体癌细胞的抑制活性远高于临床使用的药物卡铂,特别对人结肠癌细胞、人肺癌细胞的抑制作用更明显。
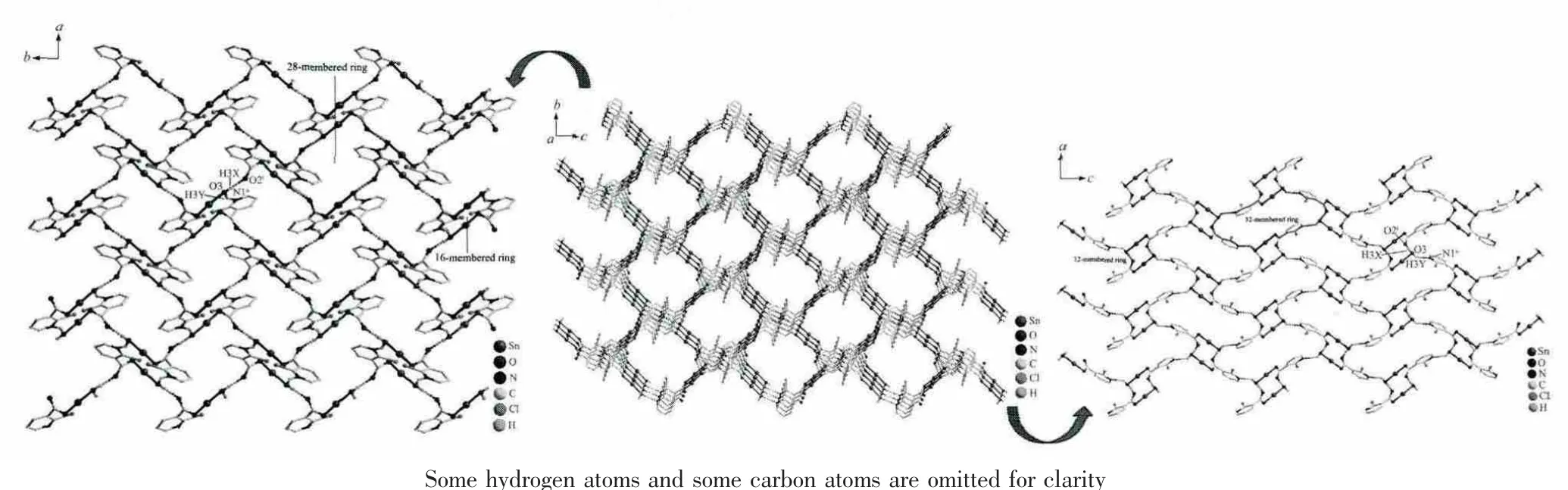
图4 O-H…O和O-H…N作用构筑的配合物2三维超分子结构Fig.4 3D supermolecular structure of complex 2 by O-H…O and O-H…N interactions
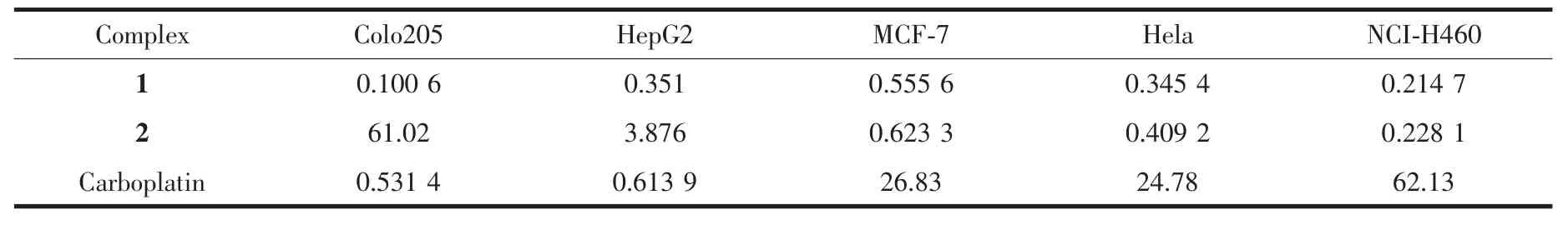
表4 配合物1、2和卡铂对肿瘤细胞的半抑制率Table 4 IC50of complex 1,2 and carboplatin on tumor cells μmol·L-1
配合物2除对人结肠癌细胞和人肝癌细胞的抑制作用弱于卡铂外,对人乳腺癌细胞、人宫颈癌细胞、人肺癌细胞的抑制活性也远优于临床使用的药物卡铂,尤其对人肺癌细胞的抑制效果最好。配合物1和2均分别约为卡铂对人乳腺癌细胞、人宫颈癌细胞、人肺癌细胞抑制率的40~290倍,两者均具有一定的药用价值,且1和2具有更高的抗肿瘤活性,这种差异可能与配体性质有关。
2.4 热稳定性实验
在空气氛下、以20℃·min-1的升温速率,于40~600℃范围内,对配合物1、2进行热稳定性测试,其热失重曲线分别如图5a、5b所示。从图5a可见,随着温度的上升,配合物1出现了两段较为明显的失重过程:在165~300℃范围内,总重量损失了29.03%,对应于 3个正丁基的损失 (计算值32.01%);300~400 ℃范围内,又发生分解,失重42.90%,对应于二苯乙醇酸根和水分子的离去(计算值45.82%),此后继续升温,重量不再变化。配合物2在170~338℃范围内,总重量损失了67.7%,当温度高于338℃时,重量基本不再变化,如图5b所示。假定残渣对应的成分是SnO2,理论计算值分别为 28.15%(1)和 32.40%(2),计算值与实测值基本吻合。热重分析结果表明:配合物1和2具有较好的热稳定性,分别在165、170℃以下可稳定存在,两者热稳定性的差异可能与配体分子及分子间的弱作用力有关。

图5 配合物的热重分析曲线Fig.5 Thermogravimetric analysis curves of the complexes
[1]Nayak S,Harms K,Dehnen S.Inorg.Chem.,2011,50(7):2714-2716
[2]Zhang S,Shi W,Li L,et al.Inorg.Chem.,2014,53(19):10340-10346
[3]Tan Y X,He Y P,Zhang J.Cryst.Growth Des.,2012,12(5):2468-2471
[4]Rocca J D,Liu D,Lin W.Acc.Chem.Res.,2011,44(10):957-968
[5]Ma Y,Cheng A L,Zhang J Y,et al.Cryst.Growth Des.,2009,9(2):867-873
[6]Mistri S,Zangrando E,Figuerola A,et al.Cryst.Growth Des.,2014,14(7):3276-3285
[7]HUANG Yan-Ping(黄燕萍),ZHANG Xiao(张潇),LIU Lei(刘蕾),et al.Chinese J.Inorg.Chem.(无机化学学报),2014,30(5):1001-1008
[8]LIU Dong-Sheng(刘冬生),SUI Yan(隋岩),CHEN Wen-Tong(陈文通),et al.Chinese J.Inorg.Chem.(无机化学学报),2011,27(8):1607-1612
[9]WEN Li-Yuan(温丽媛),YIN Han-Dong(尹汉东),WANG Da-Qi(王大奇).Chinese J.Inorg.Chem.(无机化学学报),2009,25(8):1470-1473
[10]Muñoz-Flores B M,Santillán R,Farfán N,et al.J.Organomet.Chem.,2014,769:64-71
[11]Jr C E C,Roner M R.J.Organomet.Chem.,2014,751:67-82
[12]Chandrasekhar V,Thirumoorthi R.Organometallics,2009,28(7):2096-2106
[13]Iqbal M,Ali S,Muhammad N,et al.J.Organomet.Chem.,2013,723:214-223
[14]Xiao X,Han X,Mei Z,et al.J.Organomet.Chem.,2013,729:28-39
[15]Ma C,Yang M,Zhang R,et al.Inorg.Chim.Acta,2008,361(9-10):2979-2984
[16]Wang H,Li D,Hong M,et al.J.Organomet.Chem.,2013,740:1-9
[17]YU Jiang-Xi(庾江喜),FENG Yong-Lan(冯泳兰),KUANG Dai-Zhi(邝代治),et al.Chinese J.Inorg.Chem.(无机化学学报),2014,30(6):1267-1272
[18]KUANG Dai-Zhi(邝代治),FENG Yong-Lan(冯泳兰),YU Jiang-Xi(庾江喜),et al.Chem.J.Chinese Universities(高等学校化学学报),2014,35(8):1629-1634
[19]WANG Qing-Lian(王清廉),SHEN Feng-Jia(沈凤嘉).Experiments in Organic Chemistry.2nd Ed.(有机化学实验.2版).Beijing:Higher Education Press,1994:233-241
[20]Sheldrick G M.SHELXS-97,Program for Crystal Structure Solution,University of Göttingen,Germany,1997.
[21]Sheldrick G M.SHELXL-97,Program for Crystal Structure Refinement,University of Göttingen,Germany,1997.
[22]KE Yi-Kan(柯以侃),DONG Hui-Ru(董慧茹).Analysis Chemistry Handbook:Vol.3(分析化学手册:第三分册).Beijing:Chemical Industry Press,1988:932-935
[23]YU Jiang-Xi(庾江喜),FENG Yong-Lan(冯泳兰),KUANG Dai-Zhi(邝代治),et al.Chinese J.Inorg.Chem.(无机化学学报),2012,28(2):279-284