高考化工流程题高分突破
2015-07-13张瑞
张瑞

化工流程题是最近五年高考的新题型,它将高中阶段的理论知识与化学工业生产紧密地联系在一起,能很好地体现《新课程标准》和《考试大纲》的要求,在近几年全国各地高考题中频频出现,本文对此类试题解题策略做此总结,以期帮助考生顺利解题。
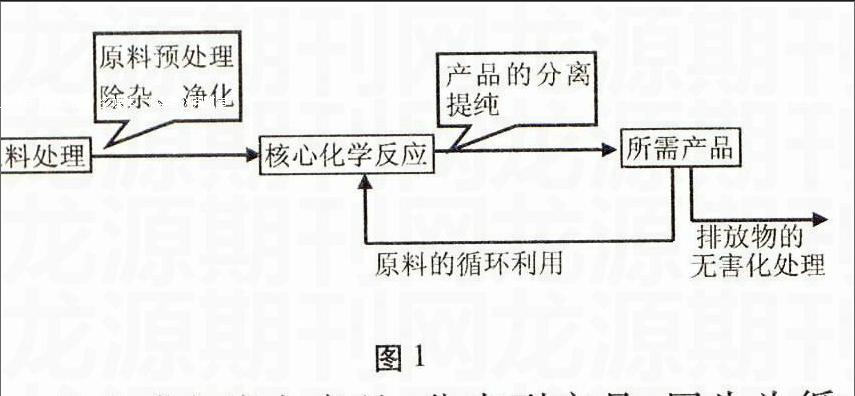
一、结构特点(如图1所示)
图1
规律:“主线主产品,分支副产品,回头为循环。”
二、内容特点
1.原料处理阶段的常见考点与常见名词
(1)溶解:通常用酸溶,如用硫酸、盐酸、浓硫酸等。
水浸:与水接触反应或溶解;浸出:固体加水(酸)溶解得到离子;浸出率:固体溶解后,离子在溶液中含量的多少。
(2)灼烧、焙烧、煅烧:改变结构,使一些物质能溶解,并使一些杂质高温下氧化、分解。
2.分离提纯阶段的常见考点
(1)调pH:一般加入难溶的碱或金属氧化物来调pH。注意控制pH范围是使杂质离子沉淀完全,而目标离子不能沉淀。
(2)试剂除杂。
(3)加热的目的:加快反应速率或促进平衡向某个方向移动。
(4)降温反应的目的:防止某物质在高温时会溶解或为使化学平衡向着题目要求的方向移动。
(5)萃取:利用溶质在互不相溶的两种溶剂中的溶解性差异进行分离,一般需要梨形分液漏斗。
3.获得产品阶段的常见考点
(1)趁热过滤:防止某物质降温时会析出。
(2)冷水洗涤:洗去晶体表面的杂质离子,并减少晶体在洗涤过程中的溶解损耗。
(3)有机物(乙醇、乙醚等)洗涤:洗涤(冰水、热水)洗去晶体表面的杂质离子,并减少晶体在洗涤过程中的溶解损耗。
(4)蒸发、反应时的气体氛围抑制水解:如从溶液中析出FeCl3、AlCl3、MgCl2等溶质时,应在HCl的气流中加热,以防其水解。
(5)蒸发浓缩、冷却结晶:是物质从溶液到固体的实验操作,一般在蒸发皿中进行。
三、突破策略
1.读题头,划有用信息
首先从题头中找出用什么合成什么物质,需要除去哪些杂质。
2.综合全题,找出主干
处理问题时不可只看框图,应先将整题审完,做到心中有数。框图处理时,一定要写清每个框图中的离子或者物质,得出合成的主题路线。
3.分析过程,推测用意
对于读得懂的部分,往往是中学常见的化学反应、化学实验操作等基本知识;对于读的不太懂的,一定要看看问题环节有没有信息,整合得到结论。
4.规范作答,突破高分
看清楚题目要求,例如:是写化学方程式还是离子方程式,注意配平;除杂时需注明“是为了除去××杂质”;是检验是否沉淀完全,还是检验沉淀是否洗涤干净等等,一定按要求作答。
例1(2014年江苏卷)烟气脱硫能有效减少二氧化硫的排放。实验室用粉煤灰(主要含Al2O3、SiO2等)制备碱式硫酸铝[Al2(SO4)x(OH)6-2x]溶液,并用于烟气脱硫研究,其流程如图2所示。
图2
(1)酸浸时反应的化学方程式为;滤渣Ⅰ的主要成分为(填化学式)。
(2)加CaCO3调节溶液的pH至3.6,其目的是中和溶液中的硫酸,并使Al2(SO4)3转化为
Al2(SO4)x(OH)6-2x。滤渣Ⅱ的主要成分为(填化学式);若溶液的pH偏高,将会导致溶液中铝元素的含量降低,其原因是(用离子方程式表示)。
(3)图2所示流程中经完全热分解放出的SO2量总是小于吸收的SO2量,其主要原因是;与吸收SO2前的溶液相比,热分解后循环利用的溶液的pH将(填“增大”“减小”或“不变”)。
解析
1.读题头,划有用信息。
目的是Al2O3、SiO2 Al2(SO4)x(OH)6-2x需要除SiO2,并把Al2O3酸溶转化成溶液
2. 综合全题,找出主干(如图3所示)。
图3
3.分析过程,推测用意。
(1)粉煤灰中的Al2O3能与H2SO4反应生成Al2(SO4)3,而SiO2不能与H2SO4反应,因而滤渣Ⅰ为SiO2。(2)滤液为Al2(SO4)3,与CaCO3反应生成微溶物CaSO4,因而滤渣Ⅱ为CaSO4。溶液中存在Al3++3H2OAl(OH)3+3H+,CaCO3+2H+Ca2++H2O+CO2↑,溶液的pH偏高,碱性增强,会促进Al3+水解,铝元素容易转化为Al(OH)3沉淀而导致溶液中铝元素含量降低。(3)+4价S具有较强还原性,溶液中的SO2-3容易被氧化为SO2-4。SO2在水中溶解度较大且SO2溶于水生成H2SO3,且加热时部分H2SO3会被氧化为酸性更强的H2SO4,因而比吸收SO2前酸性增强,pH减小。
4.规范作答,突破高分。要看清该题要求的写化学方程式、物质的化学式、离子方程式等要求,切记不可不看要求填空。
答案:(1)Al2O3+3H2SO4Al2(SO4)3+3H2O SiO2
(2)CaSO4 3CaCO3+2Al3++3SO2-4+3H2O2Al(OH)3↓+3CaSO4+3CO2↑
(3)部分SO2-3被氧化成SO2-4 减小
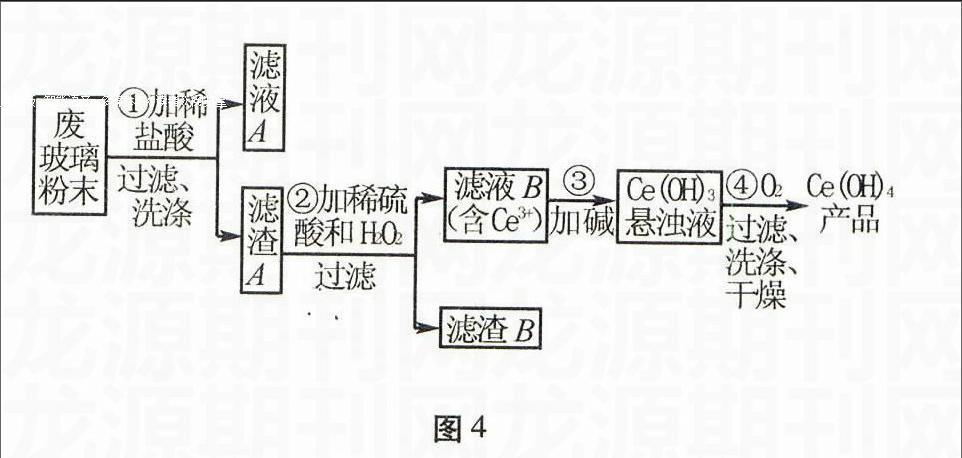
例2 (2013年安徽高考节选)二氧化铈(CeO2)是一种重要的稀土氧化物。平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2以及其他少量可溶于稀酸的物质)。某课题组以此粉末为原料回收铈,设计实验流程如图4所示。
图4
(1)洗涤滤渣A的目的是为了除去 (填离子符号),检验该离子是否洗涤干净的方法是 。
(2)第②步反应的离子方程式是 ,滤渣B的主要成分是 。
(3)萃取是分离稀土元素的常用方法。已知化合物TBP作为萃取剂能将铈离子从水溶液中萃取出来,TBP (填“能”或“不能”)与水互溶。实验室进行萃取操作时用到的主要玻璃仪器有 、烧杯、玻璃棒、量筒等。
解析
1.读题头,划有用信息。
目的是SiO2、Fe2O3、CeO2、少量可溶于稀酸的物质 Ce(OH)4
2. 综合全题,找出主干(如图5所示)。
图5
3.分析过程,推测用意。
该反应过程为:①CeO2、SiO2、Fe2O3等中加入稀盐酸,Fe2O3转化为FeCl3存在于滤液中,滤渣为CeO2和SiO2;②加入稀硫酸和H2O2,CeO2转化为Ce3+,滤渣为SiO2;③加入碱后Ce3+转化为沉淀,④通入氧气将Ce从+3价氧化为+4价,得到产品。第(3)问中考查物质的分离,可以利用我们所学的萃取原理来推测用意,两种溶剂互不相溶,萃取操作需要分液漏斗来进行实验。
4.规范作答,突破高分。
(1)滤渣上附着的Fe3+、Cl-,取最后洗涤液少量,滴加AgNO3,如无白色沉淀,则洗干净。
(2)2CeO2+H2O2+6H+2Ce3++O2↑+4H2O SiO2
(3)不能 分液漏斗
(收稿日期:2015-01-10)
