羊肚菌菌塘土壤细菌群落的结构及多样性
2015-07-13熊川李小林李强郑林用
熊川,李小林,李强,郑林用,3*
(1.四川大学生命科学学院,四川 成都 610065;2.四川省农业科学院土壤肥料研究所,四川 成都 610066;3.四川省农业科学院,四川 成都 610066)
羊肚菌因其菌盖有不规则的凹陷且多具褶皱,外形似羊肚而得名[1]。作为享誉世界的美味食用菌和药用菌,羊肚菌受到越来越多的关注。由于自然界中可供人类利用的羊肚菌资源十分有限,许多学者很早就开始研究羊肚菌的人工栽培[2]。羊肚菌生活史周期复杂,发生地环境多样,使得其人工栽培一直没有取得大的进展[3]。羊肚菌半人工栽培时,播种后都需要覆盖往年发生过羊肚菌的土壤,即只有完成“覆土”操作[4–7],才可能收获羊肚菌子实体。这说明羊肚菌发生地土壤中有某些理化或者微生物因素能够有效刺激羊肚菌的再发生。自然界中大多数微生物由于难于模拟其生长繁殖的真实条件而不能获得纯培养[8],因此,若要更好地了解微生物的群落结构及其在自然生态系统中的作用,还需要其他的补充技术。自从1993年变性梯度凝胶电泳(denaturinggradientgel electrophoresis,DGGE)被引入微生物生态学以来,该技术已被广泛地用于比较微生物群落的多样性和监视种群动态,在土壤微生物、大型食药用真菌内生菌研究方面已经有了许多成功的应用[9–13]。该技术能够有效提供群落中优势种类信息,可以平行分析多个样品,具有检测极限低、重复好和操作容易等特点,适合于调查种群的时空变化,并且可通过对切下的条带进行序列分析或结合特异性探针杂交分析来鉴定群落的成员,展示群落结构的多样性。本研究中以羊肚菌自然发生地土壤为材料,采用扩增土壤细菌16S rDNA目的片段和变性梯度凝胶电泳(DGGE)相结合的方法,探讨羊肚菌菌塘土壤细菌的群落结构,以期从微观角度来评价土壤群落结构与多样性对羊肚菌发生的影响。
1 材料与方法
1.1 样地环境调查
采用孟珍贵等[14]的方法完成样地环境调查。采用GPS定位羊肚菌分布区,详细调查区域植物种类组成、郁闭度、地貌类型、海拔高度、坡度、坡向、坡位等生境因子,拍摄照片,并逐项填写调查表。
1.2 样品采集与处理
于2013年9月15日在冕宁县后山乡采集土壤样品(后山乡野儿塘的一处山地有羊肚菌发生)。在该地域选定5处样点,除去地表枯枝落叶层,采样。将土样混匀,用于土样理化性质测定。在羊肚菌发生地随机选取4个菌塘,采集羊肚菌子实体和菌塘土壤。每个样点按土壤表层以下0~10 cm(A层,4个菌塘分别记作1A、2A、3A、4A)和10~20 cm(B层,4个菌塘分别记作1B、2B、3B、4B)分层采集土样,3次重复。用同样的方法采集环境相似却未发生羊肚菌的土壤作为对照(A层和B层分别标记为5A和5B)。用无菌手套采样,土样采后立即装入已灭菌的封口聚乙烯袋, 迅速放入冰盒保存,并及时运回实验室进行分析。采样数据记录见表1。
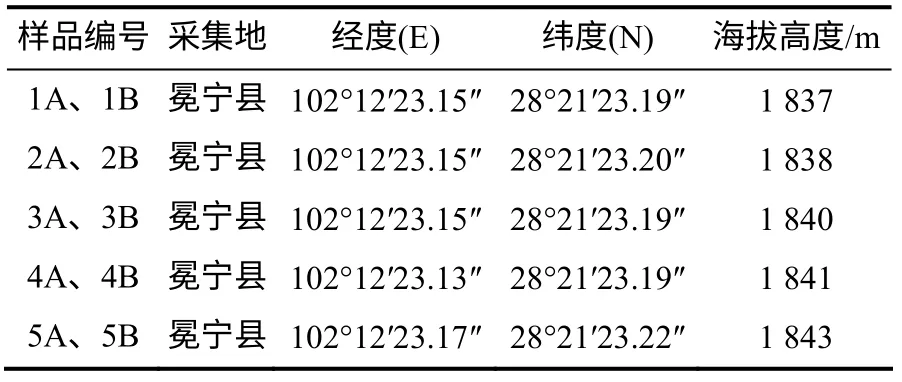
表1 样地的经纬度和海拔高度 Table 1 Plot location information of this study
将采集回的土壤样品分成两部分:一部分土壤风干后用于土壤理化性质测定 (土壤氮、磷、钾含量和有机质含量测定用《土坑农化分析》第3版中的方法[15],速效磷含量测定用钼锑抗比色法[15];速效钾含量测定用火焰光度法[15],速效氮含量测定用CaCl2浸提流动注射分析仪法[15],有机质含量测定用重铬酸钾容量法(稀释热法)[16])另一部分用于土壤DNA的提取。获得的DNA样品置于-20℃保存。
1.3 主要试剂
DNA marker、2×Taq PCR Master Mix购于天根公司;PCR胶回收试剂盒、pUCm–T载体试剂盒、大肠杆菌 DH5α感受态细胞均购自TAKARA;D3390–02 E.Z.N.A. TM Soil DNA Kit (200)真菌DNA 提 取 试 剂 盒 购 于OMEGA 公 司;PCR 引 物968f–GC、1401r和968f由上海生工生物技术有限公司合成。
1.4 细菌群落结构与多样性研究
1.4.1 土壤总DNA 的提取
采用美国OMEGA公司的Soil DNA Kit(D200)试剂盒,按操作说明对土壤进行总DNA的提取与纯化,用0.8%的琼脂糖凝胶电泳检测。
1.4.2 PCR 扩增
16S rDNA V6-V8区的PCR扩增:以提取的总DNA 为 模 板,用 细 菌 通 用 引 物968f–GC(5′– GCclamp–AACGCGAAGAACCTTAC–3′) 和1401r (5′–CGGTGTGTACAAGACCC–3′)进行扩增,上游引物5′端有40 bp GC夹(5′–CGCCCGCCGCGCCCC GCGCCCGGCCCGCCGCCCCCGCCCC–3′)[17]。为减少非特异性扩增,试验中采用降落PCR法。反应体系预设为50 μL:2×Taq PCR Master Mix 25 μL,10 μmol/L引物各2 μL,DNA模板2 μL,ddH2O补齐至50 μL。反应条件:94 °C预变性5min;94 °C变性30 s,61~56 °C退火30 s,72 °C延伸1min,10个循环(其中每个循环退火温度降低0.5 °C);94 °C变性30 s,56 °C退火30 s,72 °C延伸1min,25个循环;最后72 °C延伸10min。所得PCR产物用1%的琼脂糖凝胶电泳检测。
1.4.3 变性梯度凝胶电泳(DGGE)及图像分析
利用DcodeTMUniversal Mutation Detection System系统(Bio–Rad Laboratories,Hercules,CA,USA)对PCR反应产物进行分离。从每个样品PCR产物中取200 ng DNA加入到6%的聚丙烯酰胺凝胶中,凝胶的变性范围为40%~65%(100%变性相当于7 mol/L尿素和40%去离子甲酰胺)。电泳条件:在温度60 °C和电压80 V条件下电泳12 h;电泳缓冲液为1×TAE。电泳完毕后,经SYBRgreen Ⅰ(1∶10 000稀释)染色45min,经超纯水脱色后,用Bio–Rad公司的凝胶成像系统进行拍照,并用图形分析软件(Quantity One 4.5,Bio–Rad)对凝胶图像进行分析。香农指数(H)、丰度(S)、均匀度(EH)和辛普森指数(Si)等[18]指标被用来描述与比较各个样品的细菌多样性。
1.4.4 DGGE 条带切胶测序及系统发育树的构建
根据DGGE图谱,挑选一些共有或特有的优势条带,用无菌手术刀片把选定的条带从凝胶上切割下来,随即浸泡于50 μL超纯水中,4 °C过夜。用所得的浸提液作为模板进行新一轮PCR扩增,引物分别为不含GC夹的968f和1401r。采用1.4.2中的体系及步骤完成扩增。获得的PCR产物经DNA凝胶回收试剂盒(OMEGA) 进行纯化后与克隆载体pMDTM19–T(Vector试剂盒,宝生物,大连)连接,得到的阳性克隆送Invitrogen公司(上海)测序。将测序结果在GenBank数据库中进行比对分析,找出相似序列, 使用MEGA 5.0软件绘制系统进化树。
1.4.5 统计分析
数据分析采用Microsoft Excel 2010和SPSS 19.0软件进行,主要完成土壤理化性质分析和土壤细菌群落多样性指数的相关性分析。
2 结果与分析
2.1 样地环境调查结果
样地位于四川省凉山州西昌市冕宁县后山乡,海拔高度1 840 m,年均温17.2℃,平均最低气温(1月)9.63℃,年均日照时间2 347 h,年均降水量1 018.8 mm,平均相对湿度为61.4%。该地域有多种大型珍稀食用、药用菌生长(图1)。样地处于山中坡,东偏南15°,具有干热河谷稀树灌丛带到云南松林过渡带特征。样地为疏林样地,郁闭度0.2,地表覆盖有少量松针,有稀疏苔藓Bryophyta科植物生长。有狗尾草Setaria sp.等禾本科的杂草生长,同时发现肾蕨(Nephrolepis sp.)和大量的紫茎泽兰(Ageratina adenophora),高大乔木有松树(Pinus sp.),但较为稀疏。样地土壤呈棕黄色,为沙棕壤,颗粒致密,黏度低,保水性差,但由于苔藓、松针的覆盖,整体湿度较大。样地土壤pH为6.67,有机质、全氮、全磷、全钾的含量分别为2.53%,0.12%,0.04%,2.02%,碱解氮、有效磷、速效钾含量分别为130,3.4,159mg/kg。

图1 羊肚菌的形态及生长土壤环境 Fig.1 Morphology of Morchella and soil environment
2.2 菌塘土壤细菌DGGE 图谱分析
DGGE图谱直观地展现了羊肚菌菌塘土与对照土壤细菌群落结构的差异(图2),共有条带表示相应的土壤类型之间可能存在一些共有的细菌物种,但条带亮度的不同也间接反映出这些物种在土壤中的丰度高低。特殊条带则表示某一类物种仅存在于某一类型或深度的土壤中。羊肚菌菌塘土细菌多样性明显强于对照样品。各个泳道条带数量有所不同,且各条带的强度和迁移率存在差异,显示出一定的细菌多样性。1A–1条带在菌塘土与非菌塘土样 品中都有分布,是采样地土壤的优势菌落,2A–1、4A–1条带是菌塘土的优势菌落。
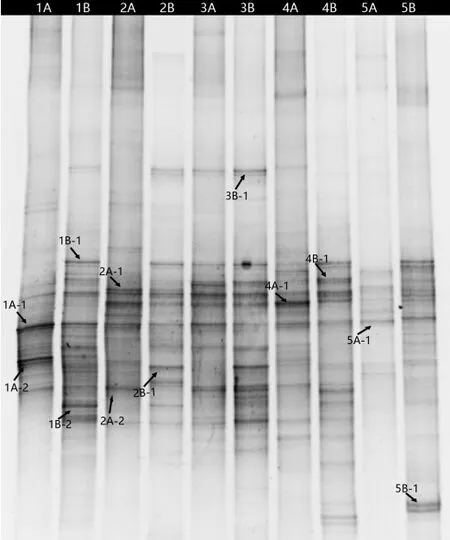
图2 羊肚菌发生地土壤细菌的DGGE 图谱 Fig.2 DGGE map of the bacteria in different Morchella colonies
2.3 DGGE 条带的多样性指数、丰度、均匀度和辛普森指数
用DGGE 图谱对样地细菌香农指数(H)、丰度(S)、均匀度(EH)和辛普森指数(Si)进行比较分析,结果(表2)表明各样品的多样性指数、丰度、均匀度和辛普森指数都存在一定的差异。羊肚菌菌塘土中细菌丰度明显高于对照样品,同一样本的上下层土样相比较,上层的均匀度明显高于下层。
2.4 细菌群落结构的相似性
对10份样本DGGE图谱条带的相似性进行比较分析,发现条带相似性最高的是3A与3B,相似度达到63.2%,其次为2B与3B,相似度达59.3%(表3)。上层土壤与上层土壤的相似性高,下层土壤与下层土壤的相似性高。菌塘土与菌塘土、菌塘土与非菌塘土之间均没有明显差异。
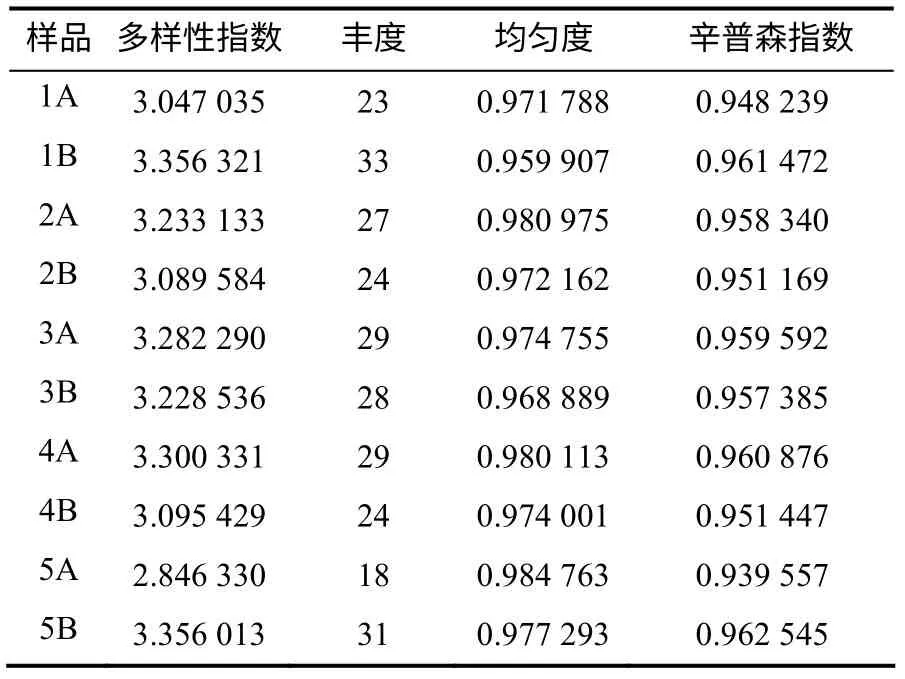
表2 供试样品DGGE 条带的多样性指数、丰度、均匀度和辛普森指数 Table 2 Shannon–weaver index (H), Richness (S), Evenness (EH) and Simpson index (Si) of DGGE from the tested samples
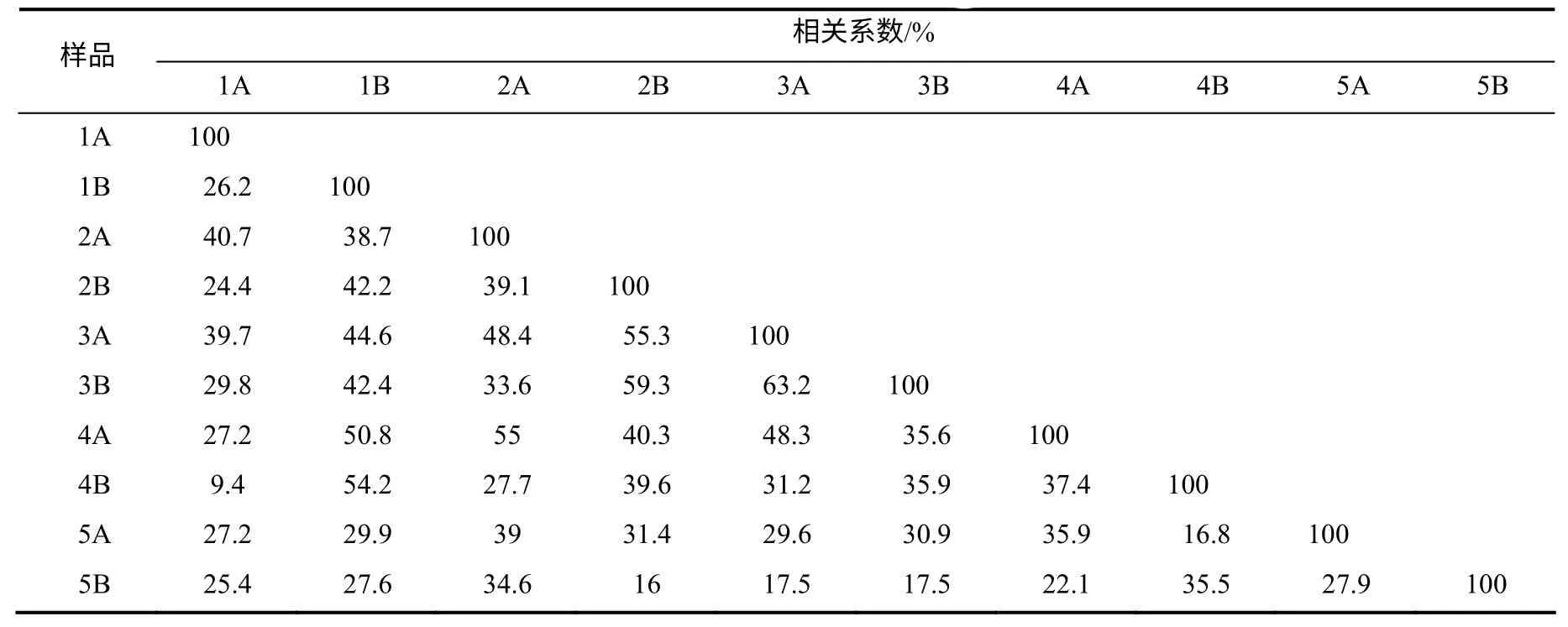
表3 不同样品细菌群落的相关系数 Table 3 Correlation coefficients of bacteria community from different samples
2.5 主成分的方差贡献率
在土壤细菌多样性分析与群落结构相似性分析的基础上,对各样品获得的所有数据进行主成分分析。第1主成分特征值的贡献率总和为98.8%,第2主成份的为1.2%,所以本文中选取2个主成分来进行分析(图3)。非菌塘土(编号5A、5B)与其余样品有较大的距离,说明微生物群落结构有一定的差异。整体来看,上层土壤具有较高的第1主成分得分,而下层土壤具有较高的第2主成分得分。非菌塘上层土样(5A)具有最高的第1、第2主成分得分。

图3 主成分的方差贡献率 Fig.3 Variance contribution ratio from PCA
2.6 菌塘土壤细菌的克隆条带
将DGGE图谱中12个优势条带进行回收、克隆、测序,然后与GenBank数据库中的序列进行比对,发现所有样品序列与GenBank中序列的相似性都在97%以上。在系统发育树中,12条序列隶属于Gammaproteobacteria、Myxococcaceae、Rhodospiri- llaceae、Acidobacteriaceae、Bacillaceae、Thermospo- rotrichaceae等6科(图4)。
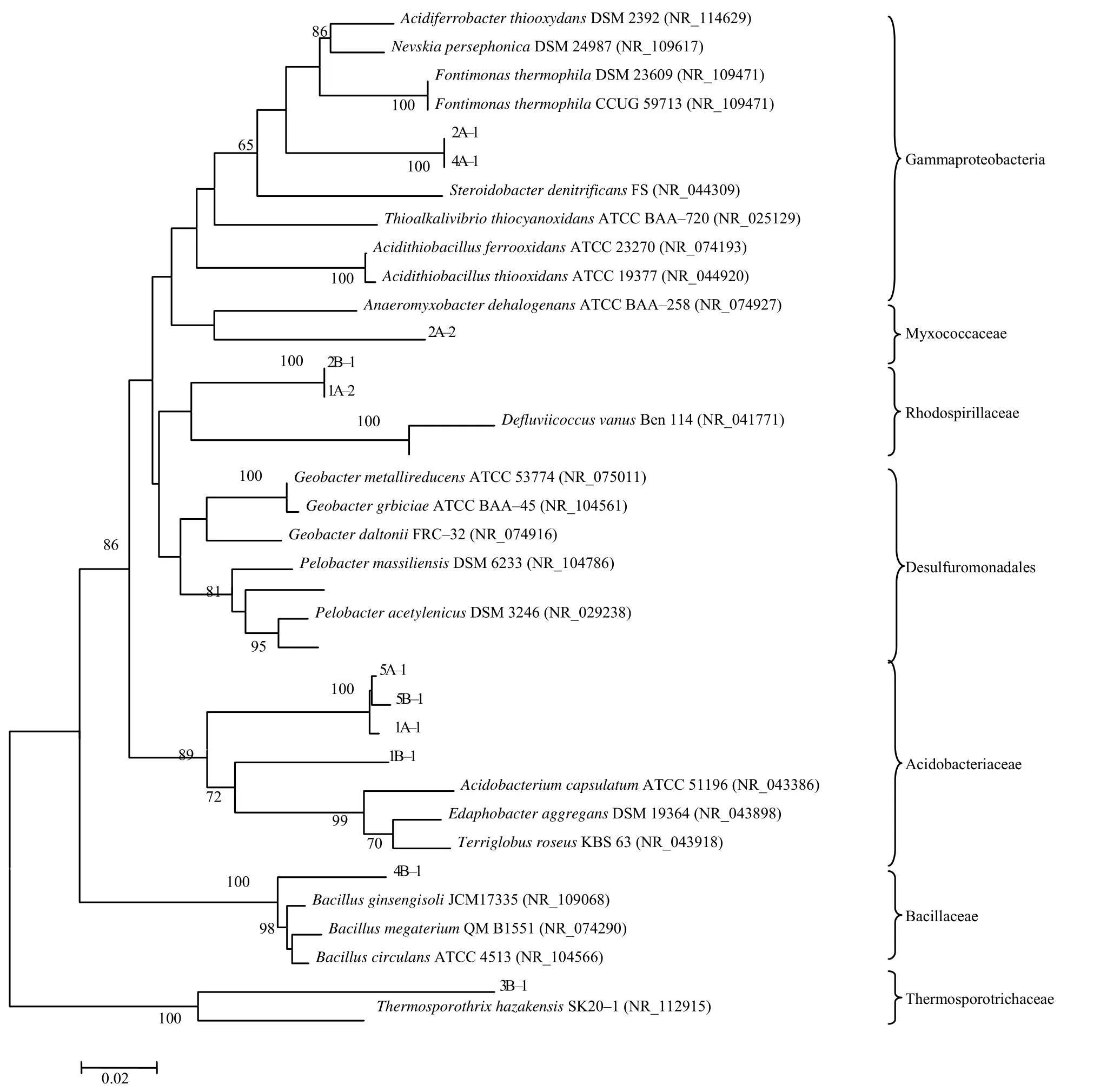
图4 PCR–DGGE 条带的系统发育树 Fig.4 Phylogenic tree from cloned DGGE bands
3 讨论与结论
微酸或微碱的土壤(pH6.8~8.5)适宜羊肚菌发生[19–20]。本研究中样地土壤呈微碱性(pH为6.67)。样地为陡坡。陡坡的降水流失快,土壤容易被雨水带走,所以,陡坡土层薄而贫瘠,水分也较少[21],这种不利的刺激促使羊肚菌发生。样地土壤碱解氮含量高,为多种微生物的发生提供了比较优良的条件[22]。本研究结果显示,较为丰富的细菌群落结构有利于羊肚菌的发生,这暗示了羊肚菌发生时需要某些微生物的刺激,或者需要土壤中某些特殊物质的作用,而这些特殊物质又与土壤中微生物活动有关,其具体的作用机制还有待进一步研究。羊肚菌发生地菌塘土和非菌塘土在细菌群落的结构与多样性方面均存在一定的差异。在测试样本中,菌塘土具有较高的香农指数、均匀度指数、丰富度指数和较低的辛普森指数,这可能是由羊肚菌在生活史周期中向土壤环境中释放代谢产物造成的。代谢产物中很多低分子量的化合物可作为化感物质影响植物根际土壤中微生物的群落结构。这种微生物群落结构的变化又会反作用于羊肚菌,影响羊肚菌的发生。
从细菌群落结构的多样性来看,本研究中菌塘土与菌塘土、菌塘土与非菌塘土之间相似性的差异不大,说明菌塘土中尚未形成高度适应羊肚菌发生的土著微生物,即便是菌塘土也不会支持羊肚菌持续发生[23–24]。
就羊肚菌菌塘土而言,上层土壤较下层土壤有更高的多样性与丰富度。因为表层土中的有机质含量较高,所以在有机质丰富的表层土壤中,微生物的数量多于养分较为贫瘠的下层。此外,土壤的通气性差也是产生这种现象的原因,下层土壤紧实,通气性差,不能提供给微生物良好的生存和繁殖空间,许多好气性的微生物不能生存和繁殖,因此土壤微生物的数量大大减少。采样时观察到,自然状态下羊肚菌菌丝延展的范围有限,直径未见超过30 cm 的情况,菌丝深度也没有超过10 cm 的。羊肚菌对于有机质、氧气都有一定的依赖,对于周围环境的影响有限。羊肚菌自然发生一般是单生或小范围的丛生,即便在相似的自然环境下,也很难发现较为均匀且广泛的分布。
本研究中从菌塘土样本中分离到的Thermo- sporotrichaceae、Myxococcaceae 和Rhodospirillaceae 3 科细菌,作为菌塘土的优势种群,很有可能是利于羊肚菌发生的细菌。酸杆菌科Acidobacteriaceae作为优势种群在样地所有样本中均有分布。在自然状态下,羊肚菌对于土壤有较强的适应能力,能否发生的先导因素是土壤中是否存在菌核,而细菌等微生物因素所起的作用只是刺激菌核萌发形成子实体。菌塘土中某些细菌可能会对羊肚菌子实体的形成产生影响,但不会是决定因素。相反,在人工栽培羊肚菌过程中,通过菌种制备和撒播覆土,能够保证土壤中存在大量的菌核。栽培成功与否的关键是找到刺激菌核萌发的微生物因素。显然,在人工栽培过程中,微生物因素居于更重要的地位,有更大的研究价值。
在羊肚菌生活史周期中,周围土壤微生物会起何种作用,而羊肚菌内生菌又会造成什么影响,现在都还没有定论。借助PCR–DGGE 方法仅能作出粗略的推论,更为系统、准确的研究还需要借助高通量测序等更先进的试验方法。
[1] 杨芳,王新风,李刚,等.不同碳、氮源对羊肚菌生长与胞内多糖的影响[J].食品科学,2007,28(11):396–400.
[2] Ower R D.Notes on the development of the morel ascocarp:Morchella esculenta[J].Mycologia,1982,74(1):142–144.
[3] 刘作喜,王永吉.羊肚菌栽培新技术与深层发酵技术[J]. 中国野生植物资源,1996(4):29–33.
[4] Ower R D,Mill G.Cultivation of Morchella:United States,US4866878(A)[P].1986–06–17.
[5] Miller S C.Cultivation of Morchella[J].US Patent,2005(6):907–912.
[6] 赵琪,徐中志,程远辉,等.尖顶羊肚菌仿生栽培技术[J].西南农业学报,2009,22(6):1690–1693.
[7] 朱斗锡.羊肚菌人工栽培研究进展[J].中国食用菌,2008,27(4):3–5.
[8] Muyzer G,Waal E C D,Uitterlinden A G,et al.Profiling of complex microbial populations by denaturinggradientgel electrophoresis analysis of polymerase chain reaction-amplifiedgenes coding for 16S rRNA[J]. Applied and Environmental Microbiology,1993,59:695–700.
[9] Li X,Penttinen P,Gu Y,et al.Diversity of nifHgene in rhizosphere and non-rhizosphere soil of tobacco in Panzhihua,China[J].Annals of Microbiology,2012,62(3):995–1001.
[10] Zhao Y G,Chen M,Bai J,et al.Response of microbial community to petroleum stress and phosphate dosage in sediments of Jiaozhou Bay,China[J].Journal of Ocean University of China,2014,13(2):249–256.
[11] Suresh K D,Alpana S,Takeshi W,et al.Methane production potential and methanogenic archaeal community structure in tropical irrigated Indian paddy soils[J].Boology and Fertiltity of Soils,2014,50(2):369–379.
[12] Nahid O,Carmen M G,Fernando M C,et al.Diversity and distribution of Halomonas in Rambla Salada,a hypersaline environment in the southeast of Spain[J].FEMS Microbiology Ecology,2014,87(2):460–474.
[13] 熊亚,陈强,唐玉明,等.泸州老窖不同窖龄窖泥中乳酸菌多样性PCR–DGGE 分析[J].应用与环境生物学报,2013,19(6):1020–1024.
[14] 孟珍贵,李永,赵琪,等.滇西北松口蘑菌塘的生态因子调查[J].食用菌学报,2011,18(1):12–17.
[15] 鲍士旦.土壤农化分析[M].3 版.北京:中国农业出版社,2000:34–35,81–83,106–107.
[16] 邵蕾,王丽霞,张民,等.控释肥类型及氮素水平对氮磷钾利用率的影响[J].水土保持学报,2009,23(4):170–175.
[17] Yu Z T,Mark M.Comparisons of different hypervariable regions of rrsgenes for use in fingerprinting of microbial communities by PCR–Denaturing Gradient Gel Electrop- horesis[J]. Applied and Environmental Microbiology,2004,70(8):4800–4806.
[18] Saikaly P E,Stroot P G,Oerther D B.Use of 16S rRNAgene terminal restriction fragment analysis to assess the impact of solids retention time on the bacterial diversity of activated sludge[J].Applied and Environmental Microbiology,2005,71(10):5814–5822.
[19] Jaccard P.Etude comparative de la distribution florale dans une portion des Alpes et des Jura[J].Bulletin de la Société vaudoise des Sciences Naturelles,1901,37:547–579.
[20] 王尚荣,刘高峰,赵贵红.菏泽黄河冲积平原羊肚菌资源及生态环境调查[J].中国食用菌,2008,27(6):12–14.
[21] 武冬梅,谢宗铭,李全胜,等.新疆伊犁野生羊肚菌种质资源调查及生境分析[J].中国食用菌,2013,32(3):12–14.
[22] 张君城,宋育红,黄晖等.福建三明地区石杉科(Huperziaceae)植物群落特征及其生境调查分析[J].复旦大学学报:自然科学版,2008,47(5):627–632.
[23] Liljeroth E,Bååth E,Mathiasson I,et al.Root exudation and rhizoplane bacterial abundance of barley (Hordeum vulgare L.) in relation to nitrogen fertilization and rootgrowth[J].Plant and Soil,1990,127(1):81–89.
[24] Goldway M,Amir R,Goldberg D,et al.Morchella conica exhibiting a long fruiting season[J].Mycological Research,2000,104(8):1000–1004.
