美沙拉嗪治疗轻中度溃疡性结肠炎的临床疗效研究
2015-07-12施嫣红汤茂春虞卫华王俊珊刘占举
施嫣红, 汤茂春, 虞卫华, 翁 韵, 王俊珊, 刘占举
(同济大学附属第十人民医院消化内科,上海 200072)
·临床研究·
美沙拉嗪治疗轻中度溃疡性结肠炎的临床疗效研究
施嫣红, 汤茂春, 虞卫华, 翁 韵, 王俊珊, 刘占举
(同济大学附属第十人民医院消化内科,上海 200072)
目的 观察利福昔明胶囊联合美沙拉嗪片治疗轻中度溃疡性结肠炎患者的临床疗效。方法 90例轻度、中度溃疡性结肠炎病人随机分为观察组46例、对照组44例。观察组给予美沙拉嗪片1.0g,每日4次,利福昔明胶囊0.2g,每日4次。对照组单用美沙拉嗪片1.0g,每日4次。总疗程为8周,观察两组治疗前后的临床活动指数、内镜评分、病理评分、临床综合疗效及不良反应。结果 治疗8周后,两组患者的临床活动指数均较治疗前显著降低(5.48±2.33比2.59±1.78,5.59±1.98比3.73±2.20,P<0.05),且观察组的临床活动指数显著低于对照组(P<0.05);两组患者治疗后的内镜评分、病理评分显著低于治疗前(P<0.01),观察组比对照组能更有效地改善患者的内镜评分及病理评分(P<0.01);观察组总有效率87.0%,显著高于对照组的68.2%(χ2=4.141,P<0.05)。两组不良反应发生率无显著差异(P>0.05)。结论 美沙拉嗪片联合利福昔明胶囊治疗轻中度UC可有效改善患者的临床活动指数、内镜下及病理评分,且副反应少。
溃疡性结肠炎; 美沙拉嗪; 利福昔明; 疗效
溃疡性结肠炎(ulcerative colitis, UC)是一种病因及发病机制尚不清楚的结肠慢性炎症性疾病。肠道微生物在其发病过程中占重要地位[1],肠道的细菌聚集远高于正常人[2]。抗生素、粪便转流、肠道休息等减少肠道微生物的方法可有效改善UC的活动性。利福昔明(Rifaximin)是一种对多种革兰阳性菌、革兰阴性菌和厌氧菌有高度抗菌活性的广谱抗生素,且仅局部作用于肠道。美沙拉嗪是治疗轻、中度UC的一线药物,这两者联合应用治疗UC是否能起协同作用,这方面研究较少。本研究使用利福昔明胶囊联合美沙拉嗪片治疗轻、中度UC患者,观察临床疗效,探讨联合用药的作用,寻找更有效的治疗UC的方法。
1 对象与方法
1.1 研究对象
选择2012年11月至2014年10月我院门诊及病房收治的Mayo评分在3~10分的轻度和中度活动期溃疡性结肠炎患者94例,所有病例均经电子结肠镜及病理确诊,诊断符合《炎症性肠病诊断与治疗的共识意见(2012年广州)》制定的标准[3]。排除标准: 近四周内服用抗生素或免疫抑制剂、近4周内服用肠道益生菌制剂、存在肝肾功能严重受损、哺乳期及妊娠期女性、肠道手术史、肠梗阻、严重出血性疾病及利福霉素类药物过敏史等患者排除。
1.2 用药方法
采用随机表试验方法,将观察病例分为观察组和对照组。观察组: 利福昔明胶囊(海南三叶制药有限公司,0.1g/片,批号120312)0.2g/次,qid,口服;美沙拉嗪片(瑞士Vifor AG Zweigniederlassung Medichemie Ettingen, 0.5g/片,批号H20100110)1.0g, qid,口服。对照组: 单用美沙拉嗪片1.0g/次, qid,口服。疗程均8周,每周随访。
1.3 观察内容
每日记录体温、粪便次数及形状、腹痛情况。血常规、血沉、肝功能、C-反应蛋白、大便常规分别于治疗前、治疗4周、治疗8周各检查一次;电子结肠镜治疗前、治疗8周后各一次,常规取肠黏膜活组织送病理检查。
1.4 疗效判断标准
临床活动指数采用改良Mayo评分标准(排便次数、便血、内镜发现、医师总体评价)[4]。内镜指数参照UCEIS评分标准(血管纹理、出血、糜烂和溃疡)[5],内镜病理评分参照四个变量: 隐窝、肠上皮细胞、嗜中性粒细胞、单核细胞[6]。综合疗效评定标准(参照2012年炎症性肠病诊断与治疗的共识意见)。缓解: 临床症状消失,结肠镜复查见黏膜大致正常或无活动性炎症。有效: 临床症状基本消失,结肠镜复查见黏膜轻度炎症。无效: 临床症状、结肠镜复查均无改善。
1.5 不良反应
用药过程中记录任何不良事件的发生情况及实验室指标(肝肾功能、血尿常规、心电图)有无变化,并进行药物相关性分析。
1.6 统计学方法
使用SPSS 17.0医学统计软件进行统计学分析。计量资料以mean±SD表示,组间比较用t检验,计数资料采用χ2检验。P<0.05认为有统计学意义。
2 结 果
2.1 临床资料
入选的94例患者中观察组及对照组各有1例因治疗效果不佳退出试验,另外对照组有2例因不能如期随访退出试验,最终完成试验共有90例患者,其中初发型28例,慢性复发型62例;直肠型(E1)56例,左半结肠型(E2)23例,广泛结肠型(E3)11例。观察组46例,其中男性26例、女性20例,年龄16~73岁,平均年龄34.7±2.3岁;对照组44例,其中男性25例、女性19例,年龄15~70岁,平均年龄35.8±2.1岁。两组患者的年龄、性别、临床类型、疾病严重程度、病变范围之间比较无统计学差异(P>0.05),见表1。
表1 治疗前2组患者一般资料比较
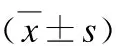
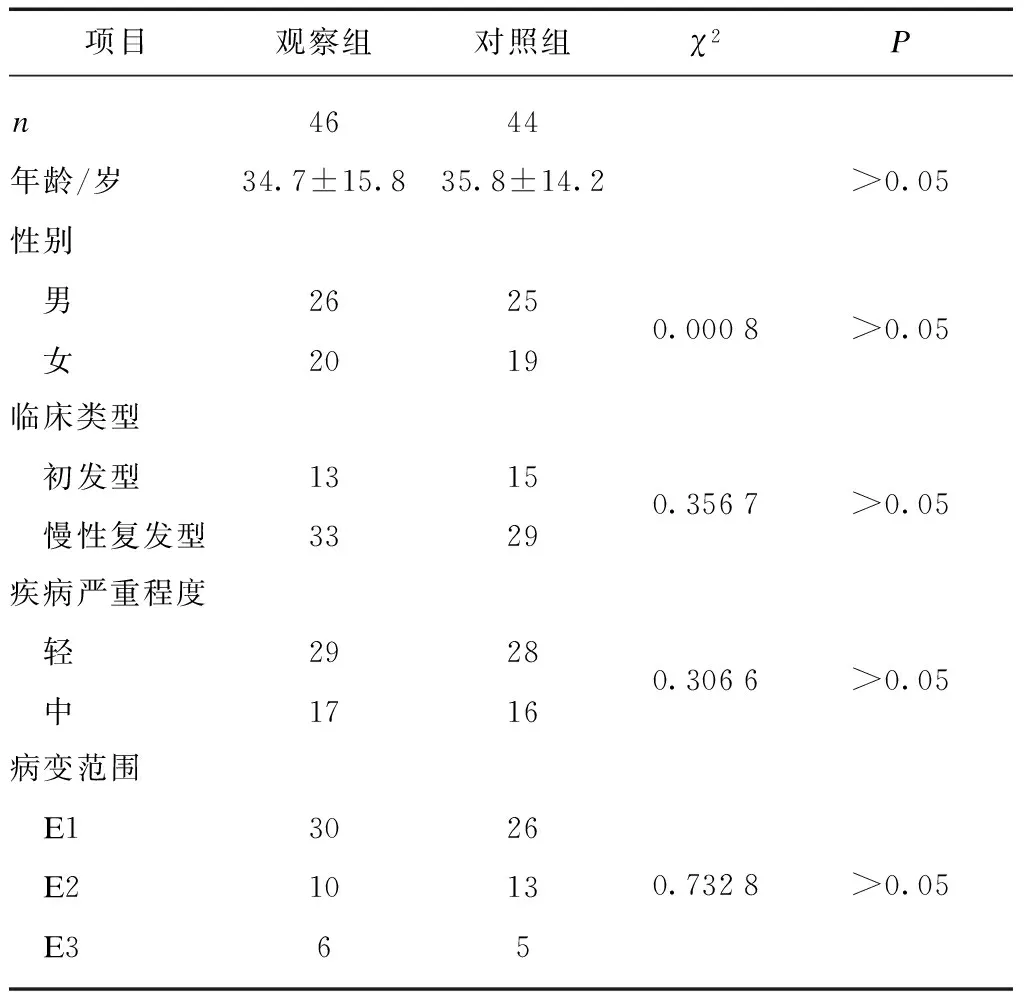
项目观察组对照组χ2Pn4644年龄/岁34.7±15.835.8±14.2>0.05性别 男2625 女20190.0008>0.05临床类型 初发型1315 慢性复发型33290.3567>0.05疾病严重程度 轻2928 中17160.3066>0.05病变范围 E13026 E21013 E3650.7328>0.05
2.2 两组患者治疗前后活动指数评分比较
治疗前两组Mayo评分比较无统计学差异(5.48±2.33比5.59±1.98,P>0.05)。两组分别治疗4、8周的Mayo评分均较治疗前明显降低(P<0.05);治疗后8周的Mayo评分也较治疗4周时下降(P<0.05),且观察组Mayo评分较对照组降低更显著(2.59±1.78比3.73±2.20,P<0.05、图1)。可见美沙拉嗪片联合利福昔明胶囊与单用美沙拉嗪片均能改善患者的临床活动指数,但是联合用药的活动指数改善明显优于单用美沙拉嗪片。
2.3 两组患者的内镜UCEIS及内镜病理评分比较
观察组和对照组患者治疗前的UCEIS评分无显著差异(6.05±0.34 比5.96±0.37,P>0.05),治疗8周后的UCEIS评分分别为3.06±0.80和4.29±0.50,均显著低于治疗前的内镜评分(P<0.01、图2)。两组患者治疗前的病理评分相比无显著差异(8.21±1.41 比8.40±1.29,P>0.05),治疗8周后观察组和治疗组患者的病理评分分别为5.13±1.80和6.93±1.58,与治疗前比较均显著下降(P<0.01、图3)。治疗8周后观察组比对照组能更有效地改善UC患者的内镜评分及病理评分(P<0.01)。
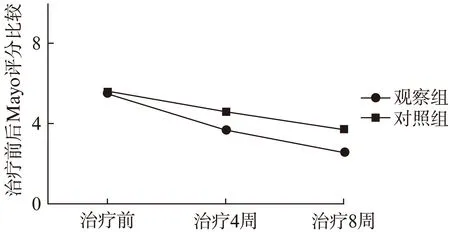
图1 两组患者治疗前后Mayo评分的比较Fig.1 The difference of Mayo scores in two groups before and after treatment
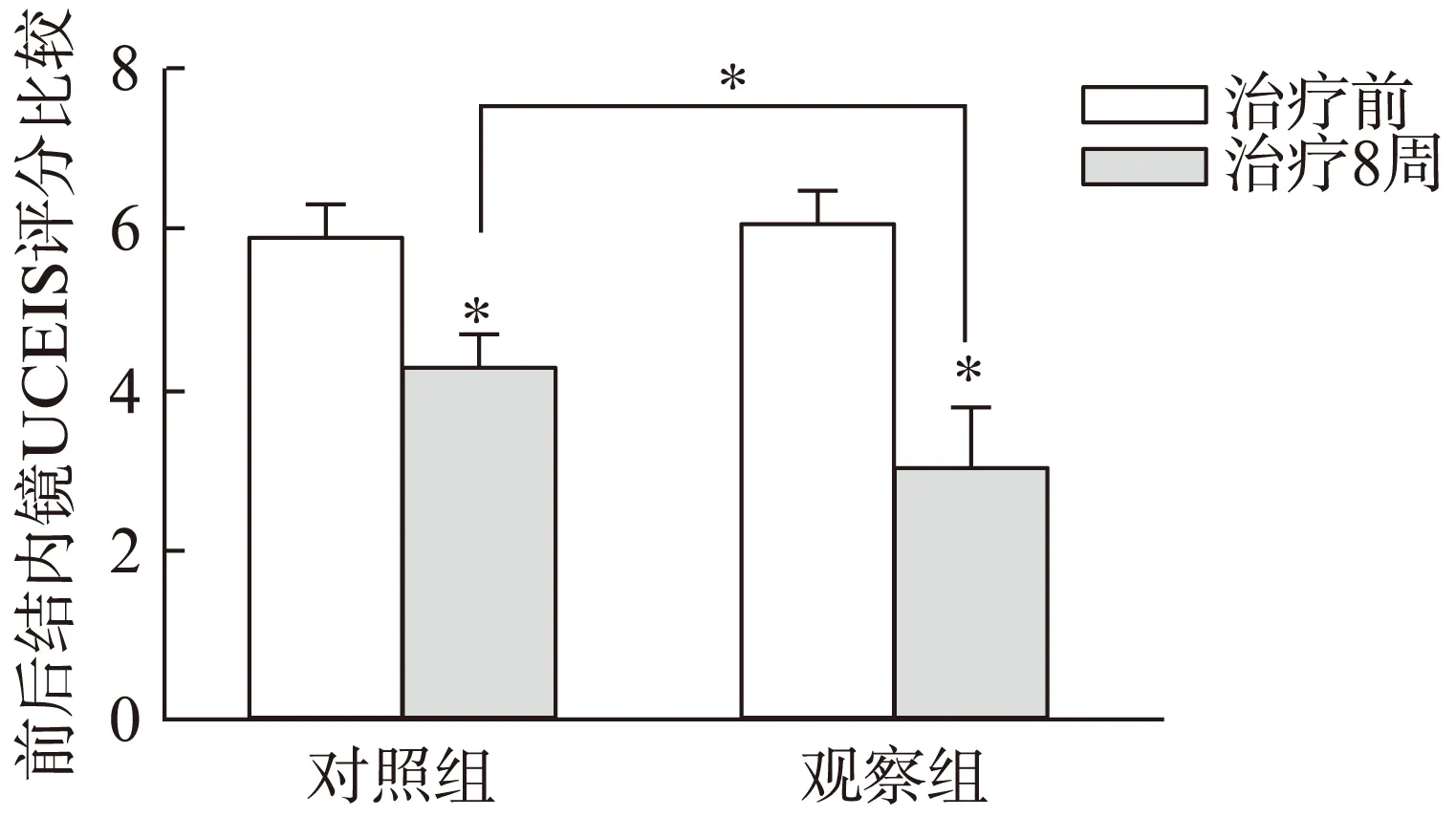
图2 两组患者治疗前后UCEIS评分的比较Fig.2 The difference of UCEIS scores in two groups before and after treatment,*P<0.01
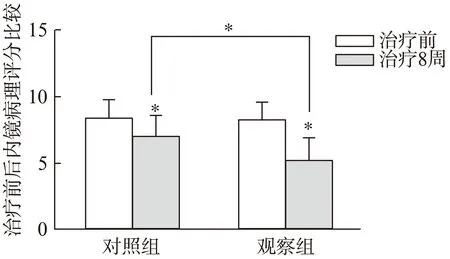
图3 两组患者治疗前后病理评分的比较Fig.3 The difference of histopathological scores in two groups before and after treatment,*P<0.01
2.4 两组患者的综合疗效比较
两组患者经过8周治疗后,观察组总有效率87.0%(40/46),其中缓解54.3%(25/46)、有效32.7%(15/46);而对照组的总有效率为68.2%(21/44),其中缓解43.2%(19/44)、有效25%(11/44)(表2)。观察组患者的总有效率显著高于对照组(χ2=4.141,P<0.05)。
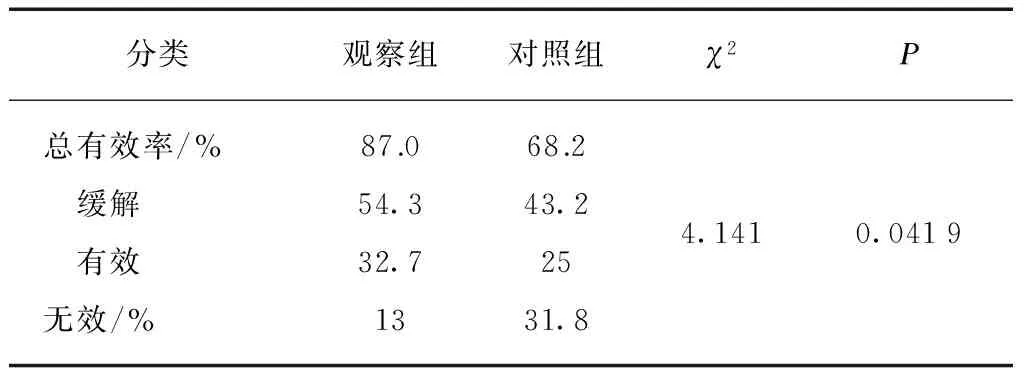
表2 两组患者治疗8周后综合疗效比较
2.5 两组患者不良反应的比较
观察组与对照组患者经过8周治疗,均有不良反应发生,分别为6.5%(3/46)与6.8%(3/44),经统计无显著差异(P>0.05),(表3)。治疗期间94例患者均未出现肝、肾功能损害和尿常规及心电图异常。
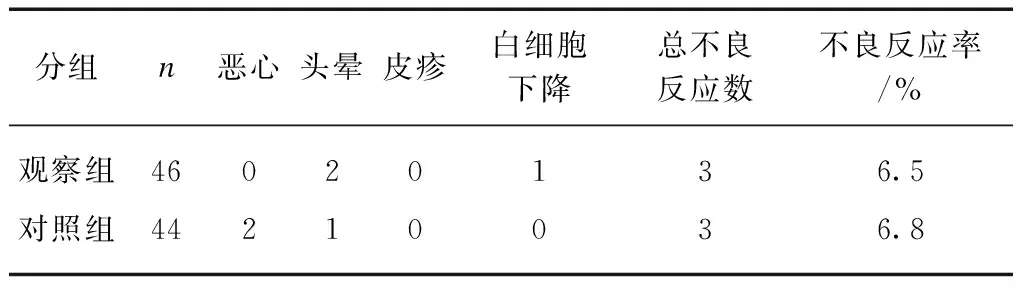
表3 两组患者治疗后的不良反应比较
经χ2检验,P>0.05
3 讨 论
UC的病因和发病机制尚未十分明确,目前认为它是环境、遗传、感染和免疫多因素相互作用的结果。研究表明肠道微生物在炎症性肠病的发病中起一定作用[7],启动并维持着肠黏膜的炎症反应。有益菌及致病菌的失衡也是一种潜在的发病机制[8-9]。在克罗恩病(Crohn’s Disease, CD)患者肠道中的大肠杆菌及弯曲杆菌增加,而普氏粪杆菌大量减少[10-11]。研究提示变形梭杆菌能促进UC病情的发展[12]。抗生素作为辅助药物在治疗UC的临床研究中取得了显著的效果[13]。9项共纳入662例UC患者的研究结果显示,使用抗生素可诱导病情缓解[14]。临床目前常用于UC患者的抗生素有硝咪唑类药物、喹诺酮类药物等,但由于这些药物长期使用后出现全身或局部的副反应,20%以上的病人不能耐受而中断治疗[15]。
利福昔明(Rifaximin)是一种局部作用于肠道的广谱杀菌剂,主要是通过阻碍细菌RNA聚合酶、抑制细菌蛋白质的合成,具有高度抗菌活性[16-17];口服后几乎不被吸收(吸收<0.4%),即使慢性炎症的肠黏膜(如UC)对其的吸收也是最小的[18],故利福昔明在胃肠道中有极高的浓度;约97%的利福昔明在粪便中以原形排出,仅有0.32%的剂量出现在尿液中,但不经过母乳和胆汁排泄,不良反应较少发生。利福昔明还可上调孕烷受体X相关基因的表达,抑制肠上皮细胞分泌TNF-α,从而发挥抗炎活性[19-21]。另外,利福昔明可通过提高炎症性肠病患者肠道内双歧杆菌和普氏粪杆菌的浓度来调节结肠内的微生态平衡[22]。
美沙拉嗪属于5-氨基水杨酸制剂,可有效抑制前列腺素的合成及释放、清除活性氧、抑制炎症细胞的活化和炎症介质的产生,而改善肠黏膜的炎症,全身副作用较少。
本研究中接受美沙拉嗪联合利福昔明治疗的UC患者,无论在临床活动指数、内镜UCEIS评分及内镜病理评分均优于单用美沙拉嗪的患者,缓解率和有效率明显增高,提示两种药物的联合应用对患者的临床症状、肠道黏膜炎症的控制和黏膜愈合有着更好的效果。联合用药可以从不同的途径共同抑制肠道黏膜炎症的发生和发展,促进黏膜的修复,产生协同效应,达到更有效地促进UC患者临床缓解和黏膜愈合的目的。两组患者的不良反应发生率相似,则提示利福昔明能安全地用于UC患者。但利福昔明治疗UC的具体疗程不是特别明确,国外许多临床研究中,有服用10d、4周、3个月,甚至24个月,但临床都取得了明显效果[7]。
基于微生物在炎症性肠病发病中的地位,抗生素治疗有着巨大的潜力。利福昔明作为口服不吸收、局部作用于肠道的抗生素,使用安全且易于耐受。但利福昔明在UC中使用的疗程及长期使用的安全性和耐药性,还需要大样本的临床研究;另外需一步的基础研究以明确利福昔明对溃疡性结肠炎患者肠道菌群的具体调节机制。
[1] Macfarlane S, Steed H, Macfarlane GT. Intestinal bacteria and inflammatory bowel disease[J]. Crit Rev Clin Lab Sci, 2009,46(1): 25-54.
[2] Swidsinski A, Ladhoff A, Pernthaler A, et al. Mucosal flora in inflammatory bowel disease[J]. Gastroenterology, 2002,122(1): 44-54.
[3] 中华医学会消化病学分会炎症性肠病学组.炎症性肠病诊断与治疗的共识意见(2012年广州)[J].胃肠病学杂志,2012,17(12): 763-781.
[4] D’Haens G, Sandborn WJ, Feagan BG, et a1. A review of activity indices and eficacy end points for clinical trials of medical therapy in adults with ulcerative colitis[J].Gastroenterology, 2007,132(2): 763-786.
[5] Travis SP, Schnell D, Krzeski P, et al. Reliability and initial validation of the ulcerative colitis endoscopic index of severity[J]. Gastroenterology, 2013,145(5): 987-985.
[6] Nikolaus S, Schreiber S. Diagnostics of inflammatory bowel disease[J]. Gastroenterology, 2007,133(5): 1670-1689.
[7] Guslandi M, Rifaximin in the treatment of inflam-matory bowel disease[J]. World J Gastroenterol, 2011,17(42): 4643-4646.
[8] Tamboli CP, Neut C, Desreumaux P, et al. Dysbiosis in inflammatory bowel disease[J]. Gut, 2004,53(7): 1-4.
[9] 施嫣红,黄培新,郭传勇.柳氮磺胺吡啶联合培菲康治疗溃疡性结肠炎的临床研究[J].同济大学学报: 医学版,2007,28(4): 61-63.
[10] Man SM, Zhang L, Day AS, et al.Campylobacter concisus and other Campylobacter species in children with newly diagnosed Crohn’s disease[J]. Inflamm Bowel Dis, 2010,16(6): 1008-1016.
[11] Schwiertz A, Jacobi M, Frick JS, et al. Microbiota in pediatric inflammatory bowel disease[J]. J Pediatr, 2010,157: 240-244 e1.
[12] Ohkusa T, Okayasu I, Ogihara T, et al. Induction of experimental ulcerative colitis by Fusobacterium varium isolated from colonic mucosa of patients with ulcerative colitis[J]. Gut, 2003,52(1): 79-83.
[13] Rahimi R, Nikfar S, Rezaie A, et al.A meta-analysis of antibiotic therapy for active ulcerative colitis[J]. Dig Dis Sci, 2007,52(11): 2920-2925.
[14] Khan KJ, Ullman TA, Ford AC, et al. Antibiotic therapy in inflammatory bowel disease: a systematic review and meta-analysis [J].Am J Gastroenterol, 2011,106(4): 661-673.
[15] Muniyappa P, Gulati R, Mohr F, et al. Use and safety of rifaximin in children with inflammatory bowel disease[J]. J Pediatr Gastroenterol Nutr, 2009,49(4): 400-404.
[16] Gasztonyi B, Hunyady B. Clinical and pharmaco-logical aspects of rifaximin, local antibiotic therapy in intestinal disorders [J]. Orv Hetil, 2004,145(43): 2177-2181.
[17] Scarpignato C, Pelosini I.Experimental and clinical pharmacology of rifaximin, a gastrointestinal selective antibiotic [J]. Digestion, 2006,73(Suppl 1): 13-27.
[18] Pons MJ, Mensa L,Gascn J, et al. Fitness and molecular mechanisms of resistance to rifaximin in in vitro selected Escherichia coli mutants[J]. Microb. Drug Resist, 2012,18(4): 376-379.
[19] Mencarelli A, Migliorati M, Barbanti M, et al. Pregnane-X-receptor mediates the anti-inflammatory activities of rifaximin on detoxification pathways in intestinal epithelial cells [J]. Biochem Pharmacol, 2010,80(11): 1700-1707.
[20] Cheng J, Shah YM, Gonzalez FJ. Pregnane X receptor as a target for treatment of inflammatory bowel disorders [J]. Trends Pharmacol Sci, 2012,33(6): 323-330.
[21] Wan YC, Li T, Han YD, et al . Effect of Pregnane Xenobiotic receptor activation on inflammatory bowel disease treated with Rifaximin[J]. J Biol Regul Homeost Agents, 2015,29(2): 401-410.
[22] Maccaferri S, Vitali B, Klinder A, et al. Rifaximin modulates the colonic microbiota of patients with Crohn’s disease: an in vitro approach using a continuous culture colonic model system [J]. J Antimicrob Chemother, 2010,65(12): 2556-2565.
Clinical effect of the treatment of mild to moderate ulcerative colitis with the United States of America
SHIYan-hong,TANGMao-chun,YUWei-hua,WENGYun,WANGJun-shan,LIUZhan-jiu
(Dept. of Gastroenterology, Tenth People’s Hospital, Tongji University, Shanghai 200072, China)
Objective To evaluate the therapeutic effects of sulfasalazine combined with rifaximin in treatment of patients with mild or moderate ulcerative colitis (UC). Methods Ninety patients with mild or moderate UC were divided into two groups randomly: 44 patients received sulfasalazine 1.0g p.o. q.i.d alone for 8 weeks (control group) and 46 patients also received rifaximin 0.2g p.o. q.i.d for 8 weeks in addition to sulfasalazine (study group). The effective rate, modified Mayo scores, endoscopic index of severity (UCEIS), histopathological scores and adverse reactions of patients were analyzed and compared between two groups. Result After 8-week treatment, Mayo scores of both groups were lower than those before treatment (5.48±2.33vs2.59±1.78,5.59±1.98vs3.73±2.20, respectively, bothP<0.05). Mayo scores in study group decreased more significantly than that in control group (P<0.05). After 8 weeks, UCEIS and histopathological scores of two groups were statistically decreased than those before treatment (P<0.01). The UCEIS and histopathological scores were more markedly improved in study group than those in control group (P<0.01). The effective rate of study group was 87%, which was higher than that of control group (68.2%,P<0.05). There was no significant difference in the incidence of adverse reactions between two groups (P>0.05). Conclusion Sulfasalazine combined with rifaximin can effectively improve the clinical efficacy of patients with mild or moderate ulcerative colitis.
ulcerative colitis; sulfasalazine; Rifaximin; efficacy
10.16118/j.1008-0392.2015.06.021
2015-05-25
施嫣红(1971—),女,副主任医师,硕士研究生.E-mail: shiyanhong71@163.com
R 574.1
A
1008-0392(2015)06-0103-05
