丁酸盐激活CaMKK促进紧密连接重组装的研究
2015-07-12康志骞彭鲁英
张 洁,苗 伟,刘 畅,康志骞,李 丽,彭鲁英
·基础研究·
丁酸盐激活CaMKK促进紧密连接重组装的研究
张 洁,苗 伟,刘 畅,康志骞,李 丽,彭鲁英
(同济大学医学院病理学与病理生理学系,上海 200092)
目的 探讨丁酸盐激活AMPK从而调节紧密连接的重组装的途径。方法 使用丁酸盐、CaMKK特异抑制剂(STO-609)处理上皮屏障模型Caco-2细胞,在转钙过程中检测电阻(TER)值、细胞内ATP水平以及CaMKK和AMPK的磷酸化状况,从而判断丁酸盐促进紧密连接重组装的上游信号通路。结果 丁酸盐处理Caco-2细胞后,其TER值显著增高(P<0.05),CaMKK和AMPK均被磷酸化激活,而上述作用可被STO-609部分减弱。结论 丁酸盐可通过钙离子途径磷酸化激活CaMKK,继而活化AMPK促进紧密连接的重组。
丁酸盐;Caco-2细胞;紧密连接
肠上皮屏障既支持了水和营养物质的转运,也阻挡了有害物质对肠道的入侵,是维系机体正常消化系统功能的一重屏障。紧密连接(tight junction)是上皮细胞间最重要的连接方式之一,是维系正常上皮屏障功能基本的组分。多种因素可造成紧密连接组装的松散甚至破坏,导致的细胞通透性异常通常是多种疾病的诱因或结果,如Crohn病、溃疡性结肠炎等[1-3]。丁酸盐(butyrate)是体内菌群酵解膳食纤维等碳水化合物的产物,在维持肠上皮内部稳态方面发挥着重要作用[4-5]。研究[6]揭示:丁酸作为体内自然代谢产生的短链脂肪酸(SCFAs),其钠盐可通过磷酸化的方式活化AMP激活的蛋白激酶(AMP-activated protein kinase,AMPK),进而促进紧密连接的组装。丁酸盐通过何种途径激活AMPK而促进紧密连接分子组装目前尚不清楚。AMPK是细胞内的能量传感器,是调节葡萄糖和脂肪酸代谢以及蛋白质合成的重要分子[7-8]。探索丁酸盐如何激活AMPK而调节上皮屏障功能具有重要生物学意义。本研究利用经典的屏障细胞模型,鉴定丁酸盐刺激下激活AMPK的上游分子,阐明其上游信号通路,为相关肠道疾病的机理研究提供参考依据。
1 材料与方法
1.1 材料
DMEM、S-MEM、NEAA、L-Glu、胎牛血清、DMSO购自美国Gibco公司;细胞培养皿、transwell及15、50ml刻度塑料离心管购自Corning公司;试剂butyrate、STO-609购自美国Sigma公司;AMPKα抗体、Phospho-AMPKα(Thr172)抗体、CaMKII抗体、Phospho-CaMKII (Tyr231)抗体购自CST公司;GAPDH抗体购自Santa Cruz公司;BCA蛋白浓度测定试剂盒、ATP检测试剂盒、Western一抗二抗去除液购自碧云天生物技术有限公司;上皮细胞电阻仪购自WPI公司;倒置荧光显微镜购自Olympus公司;细胞培养箱、低温离心机购自Thermo公司;酶标仪、蛋白电泳仪及转膜仪器购自Bio-Rad公司。
1.2 方法
1.2.1 Caco-2细胞培养 Caco-2细胞(结肠腺癌细胞)购自中国科学院上海生科院细胞资源中心。在培养皿中,置于含10%胎牛血清、1%双抗、1%NEAA、1%L-Glu的DMEM培养基培养,在37℃、5%CO2培养条件下,每72h传代一次。在使用钙离子转化策略处理细胞时,选取培养至细胞间90%以上融合的细胞,吸尽培养基并使用PBS漂洗3遍后,加入等量的S-MEM培养基培养,16h后换回由DMEM配制的且加入了butyrate、STO-609的培养基。Transwell板培养时,将分化良好的Caco-2细胞接种于Transwell板上(孔径0.4μm,有效面积0.33cm2),隔天换液(Transwell上层加入100μl培养基,下层加入600μl培养基)。
1.2.2 跨上皮电阻的测定 在细胞生长过程中,按照时间节点使用上皮细胞电阻仪测定各组细胞的上皮电阻(transepithelial electrical resistance,TER)。为保证数据的准确性,重复测定3次,取平均值乘以Transwell膜面积,即为该样品的TER值。
1.2.3 Western 印迹法检测 向培养细胞中加入RIPA细胞裂解液(50mmol/L Tris,150mmol/L NaCl,1% Triton X-100,1% sodium deoxycholate,0.1% SDS,1%蛋白酶抑制剂,1%蛋白磷酸酶抑制剂),冰上充分裂解后,4℃,离心半径8.6cm,13000r/min,离心10min。采用BCA蛋白浓度测定试剂盒测定蛋白浓度,后加入loading buffer置于95℃金属浴加热10min至蛋白变性。将蛋白样品加入10%丙烯酰胺凝胶中,100V恒压电泳90min,之后用湿转法将胶中的蛋白转移到PVDF膜上,采用350mA恒流电泳120min。5%BSA封闭60min,加入一抗(1∶1000)摇床振荡孵育60min后置于4℃冰箱过夜孵育。TBS/T溶液彻底漂洗后加入二抗(1∶2000)摇床振荡孵育60min。最后,Thermo公司显影液拍照后,用Image J软件定量分析蛋白条带。实验重复3次。
1.2.4 模型细胞内ATP的检测 利用ATP检测试剂盒(S0026)检测细胞内ATP水平。
1.3 统计学处理
所有数据运用SPSS 17统计软件进行分析,每组样本均为3例。P<0.05为差异有统计学意义。
2 结 果
2.1 butyrate处理后肠上皮屏障组装情况及AMPK的磷酸化水平
为了验证butyrate(2mmol/L)促进肠上皮细胞紧密连接重组装的信号通路,将Caco-2细胞置于含钙的DMEM培养基中,待电阻值达到150Ω/cm2以上后通过钙离子转换策略(calcium switch strategy)在S-MEM培养条件下进行撤钙,16h后检测到上皮细胞电阻值降低至50Ω/cm2以下,证实细胞间的紧密连接已呈去组装状态。在复钙过程中,分别在0、2、4、6h观察DMEM对照组和含2mmol/L butyrate DMEM条件下Caco-2单层细胞屏障功能的变化。结果显示:从复钙2h开始,使用Butyrate处理的实验组,其上皮电阻TER值回升速度及程度明显高于对照组,且差异有统计学意义(图1A),提示butyrate可显著促进Caco-2细胞屏障的恢复,从而在细胞功能层面验证了其在紧密连接重组装过程中的促进作用。
进一步使用Western 印迹法检测了Caco-2细胞在复钙0、2、4h三个时间点AMPK的磷酸化情况,结果如图2所示。复钙2、4h后,butyrate处理的实验组细胞AMPK磷酸化水平显著高于对照组,而AMPK的总蛋白没有明显变化(图1B)。说明butyrate在促进Caco-2细胞紧密连接重组装过程中AMPK被活化,提示butyrate激活AMPK介导紧密连接重组装的潜在作用。
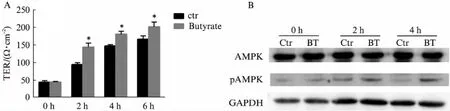
图1 butyrate促进紧密连接重组装并激活AMPKFig.1 Butyrate promotes tight junction reassembly and activates AMPKA:Caco-2细胞上皮电阻检测;B:Western 印迹法检测总AMPK、pAMPK的表达;Ctr:正常未处理的Caco-2细胞;BT:butyrate(2mmol/L)处理;GAPDH作为内参
2.2 butyrate处理后细胞内ATP水平及CaMKK的磷酸化水平
为了探究butyrate通过何种途径激活AMPK,检测了钙离子转化后Caco-2细胞内ATP水平变化。结果发现,在复钙0、2、4h后,butyrate并不能诱导细胞内ATP水平的增加(图2A),提示butyrate并不通过调节ATP/AMP比值这条通路激活AMPK。
基于上述结果,进一步检测butyrate是否通过激活钙离子/钙调蛋白依赖的蛋白激酶的激酶(Ca2+/calmodulin-dependent protein kinase kinase,CaMKK)进而活化AMPK。利用CaMKK特异抑制剂STO-609观察对Caco-2细胞紧密连接的影响以及能否阻止butyrate的促组装作用。结果显示:在钙转2、4、6h后,STO-609(STO)组与对照组没有明显差别,但是降低了butyrate对电阻值的上调作用,提示STO-609不影响紧密连接的自动组装过程,但是可以减弱butyrate(BT)对紧密连接组装的促进作用(图2B)。说明butyrate激活AMPK对上皮屏障功能的促进作用是依赖于CaMKK的介导。
在钙转复钙4h后,进一步利用Western印迹法观察了对CaMKK和AMPK的活化情况。实验结果揭示:STO-609可以减弱butyrate对CaMKK以及AMPK磷酸化水平的上调作用(图2C),佐证了CaMKK介导了butyrate激活AMPK调节Caco-2细胞紧密连接重组装的信号途径。

图2 butyrate激活CaMKK继而激活AMPKFig.2 Butyrate regulates the activation of AMPK through the activation of CaMKKA:细胞内ATP测定;B:上皮细胞电阻检测 C:Western 印迹法检测钙转4h后AMPK、CaMKK的磷酸化水平;Ctr:正常未处理的Caco-2细胞;BT:butyrate(2mmol/L)处理;STO:STO-609(5μg/ml)处理;GAPDH作为内参
3 讨 论
肠上皮屏障的健全对于机体正常生理功能的维持至关重要,其中紧密连接是其重要的组成部分。紧密连接由50余种蛋白组成,其中结构蛋白构成了紧密连接的结构骨架,主要有Occludin、Claudin、JAM等;功能蛋白连接细胞骨架以及膜蛋白,并传递信号,主要有ZO-1、ZO-2等[9]。紧密连接既可调控细胞的通透性,同时在细胞外环境和细胞内之间进行着双向信息传递,从而实现调控一些基因的表达以及细胞的生长等[10-11]。由于细胞通透性增加、结构蛋白分子突变、异常调节信号所导致紧密连接的破坏常常是许多疾病的诱因或结果,其中包括NEC、Crohn病、溃疡性结肠炎等。研究[12-13]显示胞外Ca2+对于紧密连接的组装和成熟十分必要。在Caco-2肠上皮屏障模型中,低浓度的细胞外钙将破坏紧密连接的组装,但当恢复至高钙浓度后,高细胞外钙将重新召集紧密连接蛋白至胞膜处完成组装重新行使功能。这个通过外钙调节紧密连接组装的方式被称为“钙离子转换策略”[14]。
butyrate是一种肠道自身菌群通过无氧酵解而代谢产生的一种短链脂肪酸,同时也是一种组蛋白去乙酰化酶抑制剂,具有参与基因表达调控、细胞分化、抗炎抗过敏、调节肠道屏障功能、作为能源为结肠细胞供能等多种功能,是维持肠道健康的重要因素[4]。Peng等[15]证实butyrate对肠道屏障的影响是双重的,即:低浓度的butyrate有利于促进肠道屏障功能,高浓度butyrate可诱发严重的肠上皮细胞凋亡和破坏肠道屏障。因此本研究选取2mmol/L生理浓度的butyrate处理细胞,由此可以排除其对细胞产生的复杂效应。在本研究中,利用钙离子转换策略,在低浓度细胞外Ca2+的培养环境下使得紧密连接解散,表现为细胞形态学改变以及细胞渗透力上升以及上皮电阻值持续下降,在恢复外钙的同时加入药理阻断抑制剂,探讨butyrate在紧密连接重组装过程中通过何种途径发挥作用。
本研究首先用生理浓度butyrate处理经典的肠上皮屏障重组装模型——经钙离子转换策略复钙后的Caco-2细胞,验证了其对于重组装过程的时间和效果上的促进作用,具体表现为实验组上皮电阻TER值的显著提高,接着使用Western印迹法证实了此过程伴随有AMPK的磷酸化水平的上升,实验结果与Peng等[6]的结果相吻合,即butyrate可通过磷酸化的方式激活AMPK,进而促进紧密连接的组装。
为了探索butyrate在屏障重组装过程中通过何种方式激活AMPK,本研究首先检测细胞内ATP的水平,发现钙转复钙0、2、4h后,细胞内ATP水平并无明显变化。 AMPK是丝氨酸(苏氨酸)激酶,当AMP结合AMPK可导致172苏氨酸被磷酸化,从而激活激酶,此过程主要由肿瘤抑制因子LKB1介导;而ATP与AMPK结合则可阻止其被激活[16]。Woods等[17]的研究证实,AMPK能够被CaMKK激活,过表达CaMKKβ能激活AMPK,而使用CaMKK抑制剂几乎废除AMPK的活性;Hurley等[18]在3个细胞系上使用缺乏LKB1的细胞进行研究,证实CaMKK能够激活缺乏LKB1细胞中的AMPK;Hawley等[19]的研究显示,相比于 CaMKKα,CaMKKβ能更快地激活AMPK。同时,已有多种试剂能够通过钙离子调节的信号通路介导CaMKK激活AMPK:如Shen等[20]证实在C2C12细胞中使用ALA(alpha-Lipoic acid),Stahmann等[21]证实在内皮细胞中使用thrombin都能够激活CaMKK从而激活AMPK。此外,在上述研究中使用选择性抑制剂STO-609抑制CaMKK活性以及使用RNA干扰能够沉默CaMKK,都能够消除ALA、thrombin刺激引起的AMPK的激活。目前,已知AMPK激活有两条途径:(1) 细胞内ATP水平降低所致的AMP/ATP比值上调而激活AMPK[22];(2) 细胞内Ca2+浓度上调,进而激活CaMKK,CaMKK再激活AMPK[18]。本研究结果揭示:butyrate在Caco-2细胞钙转实验中并不影响细胞内ATP水平的变化,据此推测可能由于butyrate影响了细胞内钙浓度的变化,进而激活CaMKK,并活化AMPK,从而促进Caco-2细胞紧密连接的重组装,发挥维系细胞屏障的功能。
总之,在本研究中基于以往的工作基础,利用生理浓度的butyrate(2mmol/L)刺激钙离子转化策略处理后的Caco-2细胞,验证其对于肠道屏障重组装的促进作用,从功能和生化水平分别证实了此过程是通过磷酸化CaMKK,激活AMPK,最终促进了紧密连接的重组装过程。
[1] Marchiando AM, Graham WV, Turner JR.Epithelial barriers in homeostasis and disease[J].Annu Rev Pathol,2010,5:119-144.
[2] Shen L, Su L, Turner JR.Mechanisms and functional implications of intestinal barrier defects[J].Dig Dis,2009,27(4):443-449.
[3] Shen L, Turner JR.Actin depolymerization disrupts tight junctions via caveolae-mediated endocytosis[J].Mol Biol Cell,2005,16(9):3919-3936.
[4] Leonel AJ, Alvarez-Leite JI.Butyrate:implications for intestinal function[J].Curr Opin Clin Nutr Metab Care,2012,15(5):474-479.
[5] Berni Canani R, Di Costanzo M, Leone L.The epigenetic effects of butyrate:potential therapeutic implications for clinical practice[J].Clin Epigenetics,2012,4(1):4.
[6] Peng L, Li ZR, Green RS, et al.Butyrate enhances the intestinal barrier by facilitating tight junction assembly via activation of AMP-activated protein kinase in Caco-2 cell monolayers[J].J Nutr,2009,139(9):1619-1625.
[7] Hardie DG, Hawley SA, Scott JW.AMP-activated protein kinase—development of the energy sensor concept[J].J Physiol,2006,574(Pt 1):7-15.
[8] Towler MC, Hardie DG.AMP-activated protein kinase in metabolic control and insulin signaling[J].Circ Res,2007,100(3):328-341.
[9] Forster C.Tight junctions and the modulation of barrier function in disease[J].Histochem Cell Biol,2008,130(1):55-70.
[10] Steed E, Balda MS, Matter K.Dynamics and functions of tight junctions[J].Trends Cell Biol,2010,20(3):142-149.
[11] 张金卫,林汉杰,韩凌.肠上皮细胞紧密连接的研究进展[J].中国医药导报,2015,12(6):160-163.
[12] Gonzalez-Mariscal L, Contreras RG, Bolivar JJ, et al.Role of calcium in tight junction formation between epithelial cells[J].Am J Physiol,1990,259(6 Pt 1):C978-986.
[13] Contreras RG, Miller JH, Zamora M, et al.Interaction of calcium with plasma membrane of epithelial (MDCK) cells during junction formation[J].Am J Physiol,1992,263(2 Pt 1):C313-318.
[14] Cereijido M, Robbins ES, Dolan WJ, et al.Polarized monolayers formed by epithelial cells on a permeable and translucent support[J].J Cell Biol,1978,77(3):853-880.
[15] Peng L, He Z, Chen W, et al.Effects of butyrate on intestinal barrier function in a Caco-2 cell monolayer model of intestinal barrier[J].Pediatric Res,2007,61(1):37-41.
[16] Kahn BB, Alquier T, Carling D, et al.AMP-activated protein kinase:ancient energy gauge provides clues to modern understanding of metabolism[J].Cell Metab,2005,1(1):15-25.
[17] Woods A, Dickerson K, Heath R, et al.Ca2+/calmodulin-dependent protein kinase kinase-β acts upstream of AMP-activated protein kinase in mamma-lian cells[J].Cell Metab,2005,2(1):21-33.
[18] Hurley RL, Anderson KA, Franzone JM, et al.The Ca2+/calmodulin-dependent protein kinase kinases are AMP-activated protein kinase kinases[J].J Biol Chem,2005,280(32):29060-29066.
[19] Hawley SA, Pan DA, Mustard KJ, et al.Calmodulin-dependent protein kinase kinase-β is an alternative upstream kinase for AMP-activated protein kinase[J].Cell Metab,2005,2(1):9-19.
[20] Shen QW, Zhu MJ, Tong J, et al.Ca2+/calmodulin-dependent protein kinase kinase is involved in AMP-activated protein kinase activation byalph-lipoic acid in C2C12 myotubes[J].Am J Physiol Cell Physiol,2007,293(4):C1395-1403.
[21] Stahmann N, Woods A, Carling D, et al.Thrombin activates AMP-activated protein kinase in endothelial cells via a pathway involving Ca2+/calmodulin-dependent protein kinase kinase beta[J].Mol Cell Biol,2006,26(16):5933-5945.
[22] Carling D, Sanders MJ, Woods A.The regulation of AMP-activated protein kinase by upstream kinases[J].Int J Obes (Lond),2008,32(Suppl 4):S55-59.
Butyrate facilitates tight junction reassembly via activation of Ca2+/calmodulin-dependent protein kinase
ZHANGJie,MIAOWei,LIUChang,KANGZhi-qian,LILi,PENGLu-ying
(Dept.of Pathology and Pathophysiology,Medical College, Tongji University, Shanghai 200092, China)
Objective To investigate the effect of butyrate on tight junction reassembly and related pathway.Methods The Caco-2 cell monolayer model was treated with butyrate and CaMKK inhibitor STO-609; then the transepithelial electrical resistance (TER), cellular ATP level, phosphorylated AMPK and CaMKK levels were measured.Results With the treatment of butyrate, the TER of Caco-2 cells significantly increased (P<0.05), phosphorylation of CaMKK and AMPK was increased; and those effects were partly abolished by STO-609.Conclusion Butyrate may regulate the activation of AMPK through phosphorylation of CaMKK, thus facilitate the reassembly of tight junction.
butyrate; Caco-2 cell; tight junction
10.16118/j.1008-0392.2015.05.002
2015-04-21
国家自然科学基金(31170791)
张 洁(1989—),女,硕士.E-mail:zhj3867@163.com
彭鲁英.E-mail:luyingpeng@tongji.edu.cn
R 33
A
1008-0392(2015)05-0008-05
