外源性过敏性肺泡炎21例病理和临床分析
2015-07-12罗本涛宇小婷易祥华
罗本涛, 宇小婷, 易祥华
(1. 湖北省襄阳市张湾医院内科,湖北 襄阳 441104; 2. 同济大学附属同济医院病理科,上海 200065)
·临床研究·
外源性过敏性肺泡炎21例病理和临床分析
罗本涛1,2, 宇小婷2, 易祥华2
(1. 湖北省襄阳市张湾医院内科,湖北 襄阳 441104; 2. 同济大学附属同济医院病理科,上海 200065)
目的 探讨外源性过敏性肺炎(extrinsic allergic alveolitis, EAA)的临床病理特点,提高临床和病理的诊断水平。方法 回顾性分析经肺活检病理诊断的21例EAA的临床、影像和病理特点并进行随访。结果 21例中女14例、男7例,年龄范围24~79岁(中位年龄51岁)。14例(66.7%)有过敏原接触史,其中7例为有机和无机物,5例有养猫、狗和鸽子史,2例有羊毛和皮革化纤接触史,4例(19.0%)无明显过敏原接触史,3例(14.3%)不详。主要症状是间断性咳嗽、咳痰、气喘。胸部CT均显示双肺弥漫性或者片状磨玻璃影。13例经电视胸腔镜(VATS)/小切口开胸肺活检、8例经TBLB肺活检,病理形态学表现为细支气管炎、间质淋巴细胞浸润、上皮样细胞或者多核巨细胞聚集(14例,66.7%)、非干酪性上皮样肉芽肿形成(8例,38.1%)。9例(42.9%)分别误诊为细菌性肺炎、肺结核和真菌感染。脱离过敏原和糖皮质激素治疗效果好。结论 EAA的临床和影像表现缺乏特征性,宠物以及其他过敏原接触史对诊断有重要的提示作用;病理组织学上部分患者缺乏特征性的上皮样结节形成,病理诊断需要结合临床和胸部影像学的表现。
过敏性肺炎; 外源性过敏性肺泡炎; 肺纤维化; 诊断
外源性过敏性肺泡炎(extrinsic allergic alveolitis, EAA),即过敏性肺炎(hypersensitivity pneumonitis, HP),是一种少见的间质性肺病(interstitial lung disease, ILD)。由于吸入各种有机粉尘或化学抗原物质诱发的机体免疫反应,临床上以咳嗽、咳痰和呼吸困难等为主要临床表现。临床表现和影像学表现相对缺乏特征性,有详尽的临床病理诊断的研究报道并不多见,导致临床医师对其认识不足,误诊及漏诊率常有发生。本研究经临床、影像和病理诊断的EAA,以期提高临床和病理对该病的认识和诊断水平。
1 资料与方法
1.1 一般资料
病例选自2008至2014年同济大学附属同济医院的住院和门诊会诊患者。5例EAA患者的纳入标准: (1) 所有病例均有完整的临床和和随访资料,以及胸部影像学资料;(2) 病理标本为电视胸腔镜(VATS)/小切口开胸肺活检或者经纤维支气管镜肺活检(Transbronchil Lung Biopsy, TBLB)获得的病灶组织;(3) 所有病例的最后诊断均由病理医师会同呼吸内科和影像科医师共同完成,即临床-影像-病理诊断(clinico-radiologic-pathologic diagnosis,CRP)。
1.2 病理学和免疫组化检查
VATS/小切口开胸肺活检以及TBLB获得的肺标本,经10%中性福尔马林固定、石蜡包埋,常规切片4μm,苏木素-伊红(H-E)染色,同时进行网状纤维染色、抗酸染色、过碘酸雪夫氏染色(PAS)和六胺银组织化学染色,光镜和偏光镜下观察[4-5]。术前均行胸部CT和X线胸片检查。
为方便观察和描述病变,同时进行免疫组化染色。采用EnVision法进行免疫组化检测。试剂: CK、CK7、Vimentin、CD68和LCA一抗和EnVision试剂盒为DAKO公司产品;操作步骤按说明书进行。
1.3 治疗和随访
作为病理医师诊断EAA时要结合临床和影像学,一般注意下面4点诊断要素: (1) 胸部CT显示双肺弥漫性阴影;(2) 有宠物等其他过敏原接触史;(3) 病理形态学显示细支气管炎、间质淋巴细胞浸润、非干酪性上皮样肉芽肿形成或者多核巨细胞聚集;(4) 排除已知病因的肉芽肿性疾病。确诊后主要行糖皮质激素治疗和对症治疗,出院后一般每3个月门诊随访1次。随访记录症状和体征、肺功能状况、胸片和/CT表现。结合症状和体征综合评定疗效。疗效分为显效、好转和无效三个级别。显效标准: 自觉症状或体征消失,肺功能改善,病灶基本吸收,随访病情稳定无复发;好转标准: 症状减轻,肺功能轻度改善,病灶部分吸收,随访病情有复发;症状无缓解,病灶无吸收为无效。
2 结 果
2.1 临床特点21例EAA中女14例、男7例,年龄范围24~79岁(中位年龄51岁)。病程2周至8年不等,其中慢性16例,亚急性5例。14例(66.7%)有过敏原接触史,4例(19.0%)无明显过敏原接触史,3例(14.3%)不详。有过敏原接触史者: 7例为有机和无机物(包括油漆、醇类、尘螨、汽油和金属加工等),5例有养猫、狗和鸽子史,2例有羊毛和皮革化纤接触史。主要症状是间断性咳嗽、咳痰、气喘。肺功能检查: 15例显示肺通气障碍: 6例表现为混合性通气功能障碍,9例为限制性通气功能障碍,6例有弥散功能轻-中度减退。胸部CT均显示双肺弥漫性或者片状磨玻璃影,见图1。9例(42.9%)分别误诊为细菌性肺炎、肺结核和真菌感染。
2.2 病理组织学
13例经电视胸腔镜(VATS)/小切口开胸肺活检、8例经TBLB肺活检。光镜观察,细支气管炎和肺间质淋巴细胞浸润,肺泡腔有不同程度的巨噬细胞聚集(DIP样改变)。14例有上皮样细胞聚集或者多核巨细胞(66.7%),8例可见非干酪性上皮样肉芽肿形成(38.1%),偏光镜观察未见折光性的粉尘颗粒。13例手术肺组织活检中,8例为斑片状分布,5例呈弥漫性分布;病变类型: NSIP样纤维化型5例,UIP样纤维化型3例,管周纤维化样型3例,2例为混合型表现,见图1~3。
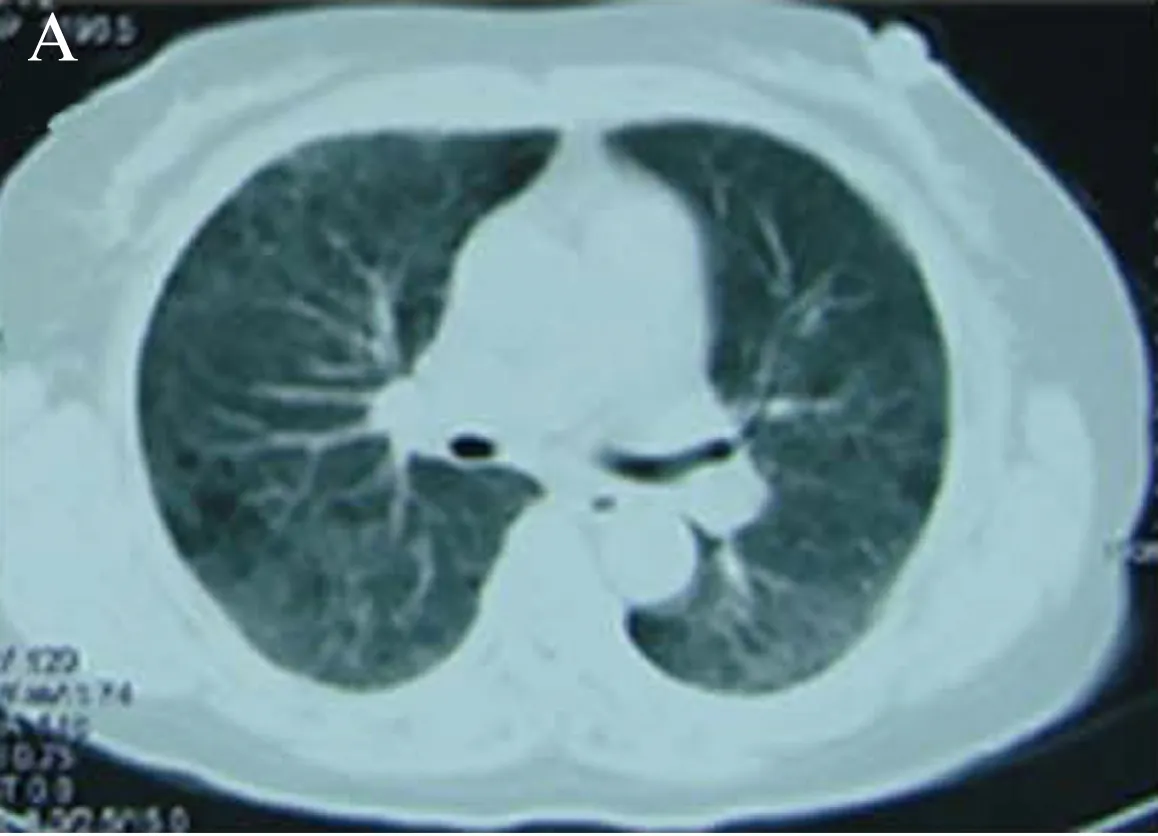
图1 显示患者双肺弥漫性磨玻璃影Fig.1 Shows bilateral diffuse ground glass opacity
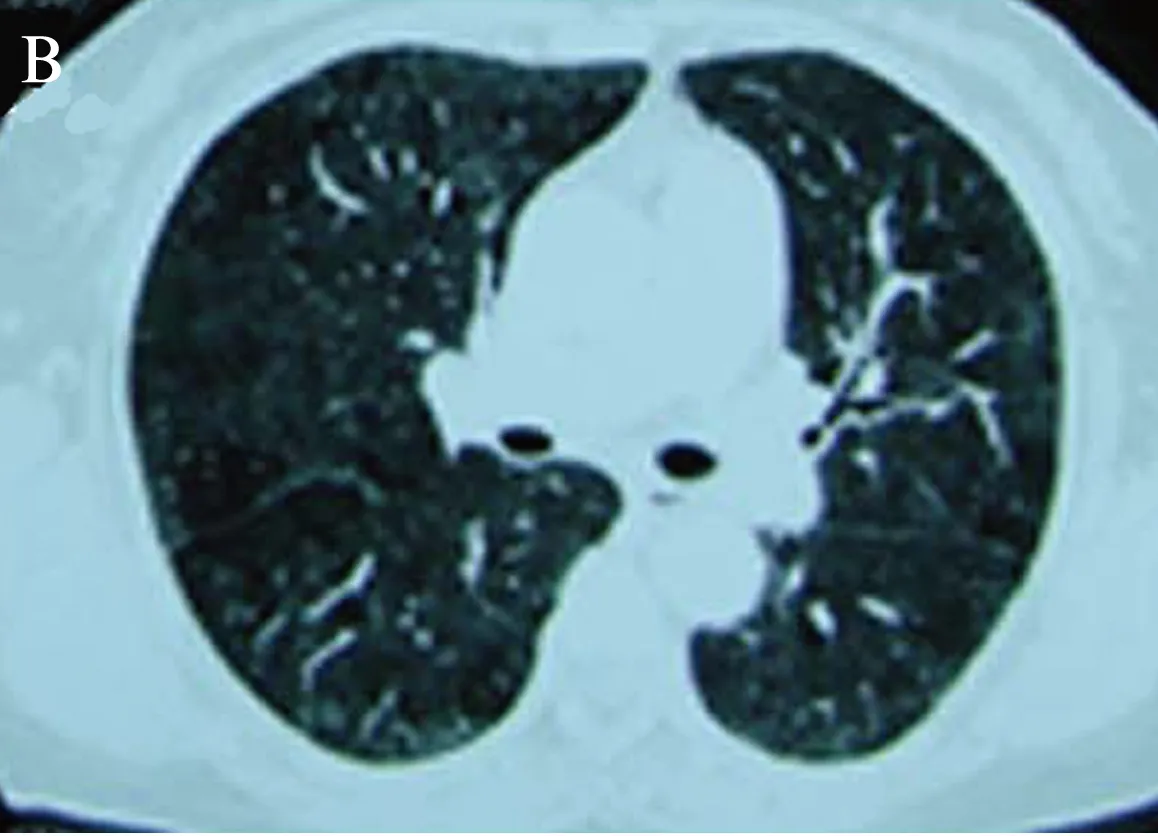
图2 为激素治疗2周后双肺磨玻璃影部分吸收Fig.2 Shows bilateral ground glass opacity partly absorbed after 2 weeks of glucocorticoids
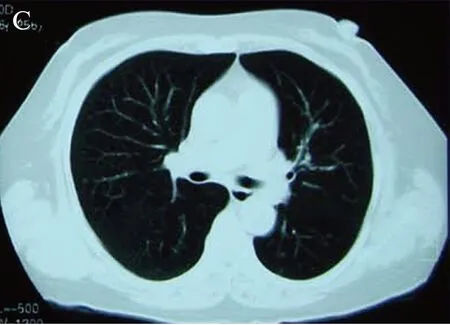
图3 为激素等治疗1个月后双肺磨玻璃影基本吸收Fig.3 Shows bilateral ground glass basic absorption after 1 month of glucocorticoids
2.3 组织化学与免疫组化
组织化学网状纤维染色能很好显示上皮样肉芽肿形成;分枝杆菌抗酸染色阴性,六胺银和PAS染色未显示真菌染色。免疫组化结果,增生的肺泡上皮显示CK和CK7表达,增生的(肌)纤维母细胞和胶原纤维显示Vimentin表达,浸润的淋巴细胞显示LCA阳性,肺泡腔内和肺间质浸润的巨噬细胞为CD68阳性反应,多核巨细胞显示CD68和Vimentin表达。
2.4 治疗与随访
确诊后主要行糖皮质激素治疗和对症治疗,并要求患者脱离过敏原。随访时间12个月至6年不等,随访记录症状和体征、肺功能状况、胸片和/CT表现。随访结果: 显效16例(表现为症状消失,复查胸部CT病灶吸收),好转5例(表现为病灶部分吸收),其中3例复发,重新出现新病灶。现门诊随访中。见图4~6。

图4 显示肺泡壁结构大致正常,部分区域毛细血管轻度扩张充血,可见小结节灶HE×40Fig.4 Shows the structure of alveolar wall are normal,part regions emerge angiotelectasis, small nodules can be seen HE×40
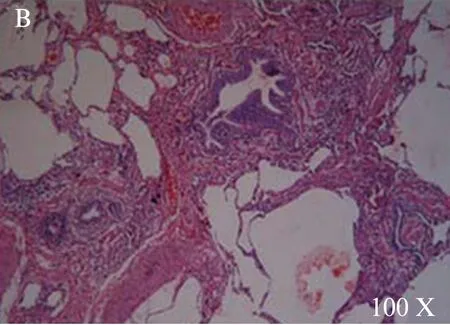
图5 显示病变以细支气管为中心,主要为淋巴细胞浸润,纤维组织轻度增生HE×100Fig.5 Shows bronchiolitis, mainly interstitial lymphocytic infiltrates, mere slight interstitial fibrosis HE×100
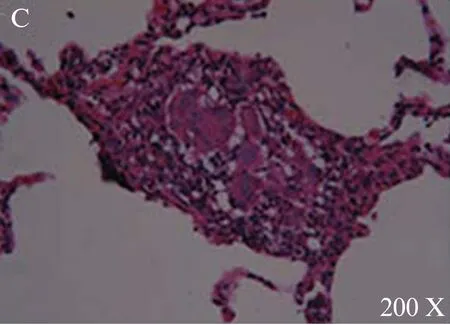
图6 显示结节灶为肉芽肿结节,主要由类上皮细胞和多核巨细胞以及淋巴细胞构成HE×200Fig. 6 Shows that nodule is granuloma,consisting of epithelioid cells, multinucleated giant cell and lymphocyte. HE×200
3 讨 论
EAA是一种少见的间质性肺病,是机体反复吸入各种有机物或化学活性物质所引起的变态反应所致的肺部疾病,致病物质可以是微生物、动植物、低分子化合物或者药物,鸟型结核分支杆菌复合物也可致病[1]。EAA患者门急诊多以感染收治,并多予抗生素抗感染治疗,由于治疗效果不佳才进一步询问病史有过敏原接触史从而诊断本病[2]。本组患者14例有过敏原接触史(占66.7%): 7例为有机和无机物接触,包括油漆、醇类、尘螨、汽油和金属加工等;5例有养猫、狗和鸽子史,2例有羊毛和皮革化纤接触史。其中9例分别误诊细菌性肺炎、肺结核和真菌感染。故而,作为一种过敏性疾病,EAA的诊断过程中重要的环节是详细询问病史,特别是环境和职业暴露史,过敏原暴露史和时间上相关的呼吸道症状是诊断EAA的重要依据,有助于避免漏诊和误诊。
EAA根据病程长短可分为急性、亚急性和慢性三种类型,本组病例主要为慢性和亚急性患者,因为急性病例很少肺活检。急性EAA患者常在吸入变应原后4~8h出现发热、咳嗽、呼吸困难等症状,病理改变表现为,肺间质多量中性粒细胞、嗜酸性粒细胞浸润及小血管炎,肺泡腔内炎性渗出、水肿和肺透明膜形成。CT表现为病变区模糊,细结节影及气腔实变影,Lynch[3]认为CT上小叶中心结节和磨玻璃影的同时存在,被认为是急性EAA的特征性表现。亚急性EAA多数由急性EAA发展而来,表现为持续的咳嗽咳痰、进行性呼吸困难或发绀,多有白粘痰。病理表现除肺间质慢性炎症细胞浸润、细支气管周围炎和形成不良的非坏死性肉芽肿外,常合并机化性肺炎和富于细胞性或混合性非特异性间质性肺炎(nonspecific interstitial pheumonia, NSIP)样改变。
慢性EAA多数由于长期反复接触过敏原,呼吸道症状进行性加重,逐渐发展为慢性肺间质纤维化,常常合并呼吸衰竭。胸部HRCT显示不规则索条影、灶性纤维化、蜂窝肺及支气管扩张,或伴局部磨玻璃样变。本组病例胸部CT显示均有双肺弥漫性或者片状磨玻璃影,纤维性病变多分布在中下肺野,重者伴有纤维条索影。其小结节影边缘模糊,具有明显的小叶中心性分布特征。慢性EAA胸部CT缺乏特征性,特别是要注意与特发性肺纤维化/普通型间质性肺炎(idiopathic pulmonary fibrosis/usual interstitial pneumonia, IPF/UIP)进行鉴别。不同的是IPF病变常分布在两下肺及胸膜下,而EAA主要累及中肺野或全肺,肺尖、肺底、肋膈角区域相对正常[4]。由于EAA与IPF有着不同的预后,故两者的鉴别诊断是至关重要的。本组病例有9例临床初诊分别误诊为细菌性肺炎、肺结核和真菌感染等,说明EAA的临床表现和影像学缺乏特征性。
在病理学上,EAA的形态特点是细支气管炎,肺间质淋巴细胞浸润,非干酪性上皮样肉芽肿形成。非干酪性上皮样肉芽肿是具有相对特征性的病变,结节一般位于细支气管壁和临近的肺泡间隔。慢性EAA常有支气管腔内新生纤维息肉样组织形成,间质纤维化,甚至终末肺改变[4]。而小叶中心性纤维化和桥接纤维化(bridging fibrosis),以及细支气管炎、肉芽肿、多核巨细胞形成是慢性期EAA区别于IPF的重要特征[5]。本组病例均显示有不同程度的细支气管炎和肺间质淋巴细胞浸润以及DIP样改变,仅1/3的患者可见具有病理诊断意义的非干酪性上皮样肉芽肿。然而,66.7%的患者可见上皮样细胞聚集或者多核巨细胞,提示上皮样细胞聚集或者多核巨细胞的出现,具有重要的病理诊断价值。出现DIP样改变则需要注意与DIP和呼吸性细支气管炎伴间质性肺病相鉴别。在鉴别诊断上,除了询问病史外,可以结合影像学的表现。
Churg[6]等学者建议慢性EAA活检病理表现可分为三个不同的纤维化类型: (1) 类似普通型间质性肺炎(UIP)样表现的UIP样型;(2) 类似非特异性间质性肺炎(NSIP)样表现的NSIP样型;(3) 病 变不规则的分布于细支气管周边的管周纤维化型。这个分型更能反映EAA的病理形态学特点,有助于病理诊断和鉴别诊断,与特发性间质性肺炎相鉴别[7];另一方面,说明EAA的形态具有多样性,增加了病理诊断的难度。本组手术肺组织活检中,8例为斑片状分布,5例呈弥漫性分布;NSIP样纤维化型5例,UIP样纤维化型3例,管周纤维化样型3例,2例为混合型表现,支持这种病理形态分型。需要指出的是,穿刺小活检显示的病理形态表现有限,不适宜这种分型。
EAA的根本治疗措施是脱离接触过敏环境。多数轻症患者脱离环境接触后通常可在几日内自行缓解,严重者常需应用糖皮质激素治疗,待症状和体征消失,影像学肺部病灶吸收后逐渐减量至停药。急性期病灶吸收较快,慢性EAA急性加重者也可部分吸收,在病灶吸收阶段肺部CT上逐渐出现边界清楚的且最终可吸收的网格状条索影。而慢性EAA已形成间质纤维化病例,糖皮质激素的疗效相对较差。早期使用糖皮质激素可以减轻免疫炎症反应,促进早期纤维化病灶的吸收。本组病例随访显示,脱离过敏原后辅以糖皮质激素和对症治疗,效果良好,但有不同程度的复发。其中一例复发者为鸽子饲养者,其肺活检显示为UIP样型,这似乎符合文献报道所称。有学者认为,较其他类型EAA患者,养鸽者的过敏性肺泡炎的预后相对较差[8]。但需更多的样本分析才能得到准确的结论。
综上所述,EAA是一个复杂的疾病,病变累及肺泡、肺间质和气道。临床诊断需要综合临床症状和体征、影像学表现、特异性抗原接触或吸入史,结合实验室检查可以诊断本病。在诊断过程中应注意和其他疾病如感染性疾病、结节病、支气管哮喘等加以鉴别诊断,最终可通过试验性糖皮质激素治疗有效得到确诊。对于临床和影像学表现不典型的病例,需要肺活检病理诊断。
[1] Gondouin A, Dalphin JC. Hypersensitivity pneumonitis [J]. La Revue du praticien, 2014,64(7): 949-950.
[2] Cormier Y. Hypersensitivity pneumonitis (extrinsic allergic alveolitis): a Canadian historical perspective[J]. Canadian respiratory journal, 2014,21 (5): 277-278.
[3] Kligerman SJ, Groshong S, Brown KK,et al. Nons-pecific interstitial pneumonia: radiologic, clinical, and pathologic considerations[J]. Radiographics, 2009,29(1): 73-87.
[4] Myers JL. Hypersensitivity pneumonia: the role of lung biopsy in diagnosis and management [J]. Modern pathology,2012,25 (Suppl 1): S58-67.
[5] Takemura T, Akashi T, Kamiya H, et al. Pathological differentiation of chronic hypersensitivity pneumonitis from idiopathic pulmonary fibrosis/usual interstitial pneu-monia[J]. Histopathology, 2012,61(6): 1026-1035.
[6] Churg A, Muller NL, Flint J, et al. Chronic hyper-sensitivity pneumonitis[J]. The American journal of surgical pathology, 2006,30(2): 201-208.
[7] 易祥华.特发性间质性肺炎合并肺癌的研究进展[J].同济大学学报: 医学版,2009,30(6): 1-4.
[8] Churg A, Sin DD, Everett D,et al. Pathologic patterns and survival in chronic hypersensitivity pneumonitis[J]. The American journal of surgical pathology, 2009,33(12): 1765-1770.
Clinicopathological features of extrinsic allergic alveolitis: an analysis of 21 cases
LUOBen-tao1,2,YUXiao-ting2,YIXiang-hua2
(1.Dept. of Medicine, Zhangwan Hospital, Xiangyang 441104, Hubei Province, China; 2. Dept. of Pathogy, Tongji Hospital, Tongji University, Shanghai 200065, China)
Objective To analyze the clinicopathologic features of extrinsic allergic alveolitis (EAA). Methods The clinical, radiologic and pathological data of 21 patients with biopsy-diagnosed EAA were retrospectively reviewed. Results In 21 cases 14 were females and 7 were males, aged 24-79 years (median 51y). Fourteen cases(66.7%)had allergic history, including 7 cases exposed to organic and inorganic allergens, 5 exposed to domestic cats, dogs and pigeons, 2 exposed to wool and synthetic leather. Among remaining 7 cases, 4 cases(19.0%)had no allergic history, 3 cases(14.3%)were unknown. The clinical manifestations mainly included intermittently cough,production of sputum and asthma. Chest CT showed bilateral pulmonary diffuse or patchy ground glass opacities. The lung samples were taken by video-assisted thoracoscope/small incision thoracotomy lung biopsy in 13 cases and by transbronchil lung biopsy (TBLB) in 8 cases. The pathological morphology presented with bronchiolitis, interstitial infiltration of lymphocytes, epithelioid cells or multinucleated giant cell aggregation (14 cases, 66.7%), non-caseous granuloma formation (8 cases, 38.1%).Nine cases were misdiagnosed as bacterial pneumonia, tuberculosis and fungal infection. The patients had a favorable outcomes with glucocorticoid therapy and avoiding allergens. Conclusion The clinical manifestations and imaging characteristics of EAA are unspecific, diagnosis requires the integration of exposure history, clinical, radiographic and pathological findings.
hypersensitivity pneumonitis; extrinsic allergic alveolitis; pulmonary fibrosis; diagnosis
10.16118/j.1008-0392.2015.03.014
2014-04-12
上海市卫生局医学重点专项基金(20134034);上海市科学技术委员会医学重点科技攻关专项基金(09411951600)
罗本涛(1972—),男,主治医师,学士.E-mail: 838901105@qq.com
易祥华.E-mail: yixhxf1959@126.com
R 563.1
A
1008-0392(2015)03-0063-05
