维生素D通过调节NF-κB活性对局灶性脑缺血大鼠的保护作用研究
2015-07-12李想田步先闵连秋
李想,田步先,闵连秋
(辽宁医学院附属第一医院 神经内科,辽宁 锦州 121001)
维生素D通过调节NF-κB活性对局灶性脑缺血大鼠的保护作用研究
李想,田步先,闵连秋
(辽宁医学院附属第一医院 神经内科,辽宁 锦州 121001)
目的 探讨维生素D(VD)通过调控NF-κB活性对局灶性脑缺血大鼠的保护作用。方法 72只SD大鼠随机均分为假手术组、对照组、VD缺乏组和VD治疗组,每组18只。假手术组及对照组均给予正常饲料喂养。VD缺乏组给予维生素D缺乏饲料喂养。VD治疗组给予补充维生素D饲料喂养。共喂养10周。除假手术组外,其余各组均建立局灶性脑缺血模型。对各组大鼠进行神经行为学评分。HE染色观察梗死中心区及海马CA1区神经细胞数目及形态。免疫组化检测细胞凋亡。电泳及免疫印迹观察NF-κB蛋白的表达。结果 与假手术组相比较,对照组、VD缺乏组及VD治疗组的海马CA1区NF-κB p65活性明显升高(P<0.01);与对照组相比,维生素D缺乏组NF-κB p65表达明显增强(P<0.01),维生素D治疗组NF-κB p65表达减弱(P<0.01)。结论 维生素D对大鼠局灶性脑缺血损伤具有保护作用,其机制可能是通过抑制NF-κB活化发挥抗炎作用而实现的。
维生素D;脑缺血;NF-κB
近年来,随着脑卒中疾病发病率逐年升高,发病年龄逐年下降,人们对脑卒中防治的研究逐步深入。有文献报道,缺血性脑卒中患者约占脑卒中患者总数的80%。寻找到行之有效的减少或减慢脑缺血形成的措施,对于脑缺血的防治具有十分重要的临床应用意义。NF-κB是一种普遍存在的细胞转录因子,是由NF-κB/Rel蛋白家族成员组成的同源或异源二聚体。Nurmi等[1]研究证实,脑缺血发生后,NF-κB可被激活,促进炎症的发生、诱导细胞调亡、介导自由基的损伤,进而加重脑缺血损伤。
维生素D是一种具有生物活性的脂溶性类固醇衍生物,包括维生素D2(麦角骨化醇)及维生素D3(胆骨化醇)2者。其中在人类和动物体内发挥主要生物作用的是维生素D3。此次研究应用于治疗组中的骨化三醇即为有活性的维生素D3。维生素D不仅在多种生理学过程起到关键的中介作用,而且对多种慢性疾病的发生发展起到调节作用[2]。近年来已有流行病学及临床研究证实,人体内维生素D水平与心血管疾病的发生发展息息相关[3-4]。维生素D缺乏,可导致包括动脉粥样硬化在内的心血管疾病风险增加[5]。最新研究证实,维生素D缺乏可能对心脑血管的功能产生不利影响,但并没有结论性的研究支持这一观点,心脑血管疾病的发生与维生素D含量关系的研究仍处于探索阶段[6]。因此,本研究拟通过建立大鼠大脑中动脉局灶性脑缺血模型,探讨维生素D能否通过调节NF-κB活性对局灶性脑缺血大鼠发挥脑保护作用。
1 材料与方法
1.1 动物及主要试剂 采用健康成年SD雄性大鼠72只,体质量250~280 g,由辽宁医学院实验动物中心提供,动物合格证号:SCXK(辽)2003-0007。骨化三醇由上海罗氏制药有限公司提供。NF-κB P65兔抗大鼠抗体及免疫组化染色试剂盒由北京博奥森生物技术有限公司提供。蛋白定量试纸盒等免疫印迹试验试剂购于上海锐赛生物技术有限公司。
1.2 方法
1.2.1 动物分组及给药:72只实验大鼠适应性饲养1周后,将其随机分成4组:假手术组、对照组、VD缺乏组和VD治疗组,每组18只。VD治疗组除给予正常鼠粮外,每天给予骨化三醇 0.3 μg/(kg·d)溶于丙二醇溶媒[7]灌胃。VD缺乏组给予维生素D缺乏饲料(包括:玉米面76%,小麦麸20%,碳酸钙3%,碘化盐1%,赖氨酸0.5%),确保其中维生素D不超过20 IU/kg,并每天给予等剂量的蒸馏水灌胃。假手术组及对照组给予正常鼠粮及等剂量蒸馏水灌胃饲养。采用清洁饮用水,无紫外光的白炽灯光照,光暗周期12 h:12 h,饲养环境清洁。饲养10周。末次给药后30 min建立脑缺血模型。
1.2.2 局灶性脑缺血模型的建立:在Longa[8]提出大脑中脉闭塞(MCAO)模型基础上,采用其改进方案[9]制备大鼠局灶性脑缺血模型。实验大鼠末次给药30 min后,腹腔注射10%水合氯醛350 mL/kg麻醉。大鼠取仰卧位固定,行颈正中切口,依次钝性分离左侧颈总动脉(CCA)、颈外动脉(ECA)、颈内动脉(ICA)。结扎左侧CCA近心端和ECA分叉部,动脉夹暂时夹闭ICA远心端。在距CCA分叉处近心端约5 mm处剪口。选用头端烧成光滑杵状的国产尼龙线(直径0.235 mm,长6 cm)插入,系牢栓线。松开动脉夹。线栓进入深度以颈总动脉分叉处计算为(18.0±0.5)mm,此时轻推尼龙线有阻力感,即已到达大脑中动脉起始部,实现了对左侧大脑中动脉血流的阻断。假手术组仅不插入线栓,余手术步骤同前。
参考Zea Longa法[10]对术后大鼠进行神经功能缺失评分。评分于大鼠清醒后的24 h内进行3次,最终取其平均值。
建模成功判断标准[10]:①大鼠出现同侧Horner征;②神经功能缺失评分为1~3分者。剔除建模未成功的实验大鼠,并于后续实验中补充合格大鼠,以保证每组实验用鼠数目。
1.2.3 脑组织病理学标本制备:分别在4个实验组中,随机各取出9只大鼠。于建模成功24 h后,以10%水合氯醛350 mL/kg进行腹腔麻醉。经对侧颈总动脉,先输注冰生理盐水50 mL及4%多聚甲醛50 mL,进行灌流内固定。立即断头取脑,并将脑组织在4%多聚甲醛中继续固定24 h。制备冠状脑片,选择梗死中心进行常规酒精脱水及石蜡包埋。制成4~6 μm厚的切片,行苏木素-伊红(HE)染色。观察梗死中心区及海马CAl区存活的神经细胞数目。
1.2.4 免疫组化测定NF-κB阳性细胞数:石蜡切片经脱蜡至水及微波修复抗原。兔抗鼠NF-κB抗体,在4 ℃下孵育24 h。严格遵照SP法免疫组化试剂盒要求进行操作,DAB显色。以正常兔血清代替一抗作为阴性对照。光镜下观察大脑海马CA1区NF-κB阳性表达细胞,染色阳性反应物为棕黄色颗粒。每只大鼠取1张相同部位缺血侧大脑海马CA1区切片进行观察。计算10个有代表性的高倍视野下阳性细胞数目。CIAS-1000型图像分析仪计算NF-κB的阳性细胞数,并取平均值。
1.2.5 Western blot检测大鼠海马CA1区NF-κB蛋白的表达:取每组剩余的9只已成功建模的大鼠,断头取脑。将脑组织5 mg加入100 uL裂解液中,剪碎并机械匀浆。以4 ℃、17000 r/min离心20 min,取上清液,弃沉淀。用BCA法进行蛋白定量。取50 μg蛋白上样进行12%SDS-聚丙烯酰胺凝胶电泳。湿转法将电泳后的蛋白质转膜至PVDF膜上。5%脱脂奶粉封闭,抗体孵育。洗膜后进行增强化学发光显色。以凝胶成像分析系统摄像分析测定目标带的密度值(density value,DV),计算出各组目标带与β-actin DV比值。
2 结果
2.1 各组大鼠神经行为学评分比较 造模成功后对各组大鼠进行评分:假手术组大鼠无明显神经功能缺损,其余3组均有不同程度的神经功能缺损,其中以VD缺乏组神经功能缺损最严重,评分最高;VD治疗组神经功能缺损较对照组明显减轻,评分低于对照组(P<0.01)。见表1。
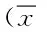
表1 VD对局灶性脑缺血大鼠神经行为学影响±s)
**P<0.01与 假手术组相比,compared with sham-operative group;##P<0.01,与对照组相比, compared with control group;△△P<0.01,与VD缺乏组相比,compared with VD-deficient group
2.2 各组大鼠脑组织的病理学特征 光学显微镜下观察HE染色切片,假手术组仅可见正常神经元细胞形态,其余3组均可见正常及不同损伤程度神经元细胞混杂出现。正常神经元,核圆形,边界及核仁清楚。损伤神经元,胞核肿大,偏位,核仁消失,胞浆着色浅、苍白或核浓缩、深染,细胞呈三角形缺血性坏死变化。4组中,对照组及VD缺乏组损伤神经元显著增多,且以VD缺乏组的损伤神经元特点表现的最为明显;VD治疗组中,维生素D能够一定程度上改善神经细胞的核深染、核固缩程度,减少细胞及间质的水肿,使胞膜清楚、形态正常、核仁清晰可见的神经细胞数目增多。见图1。
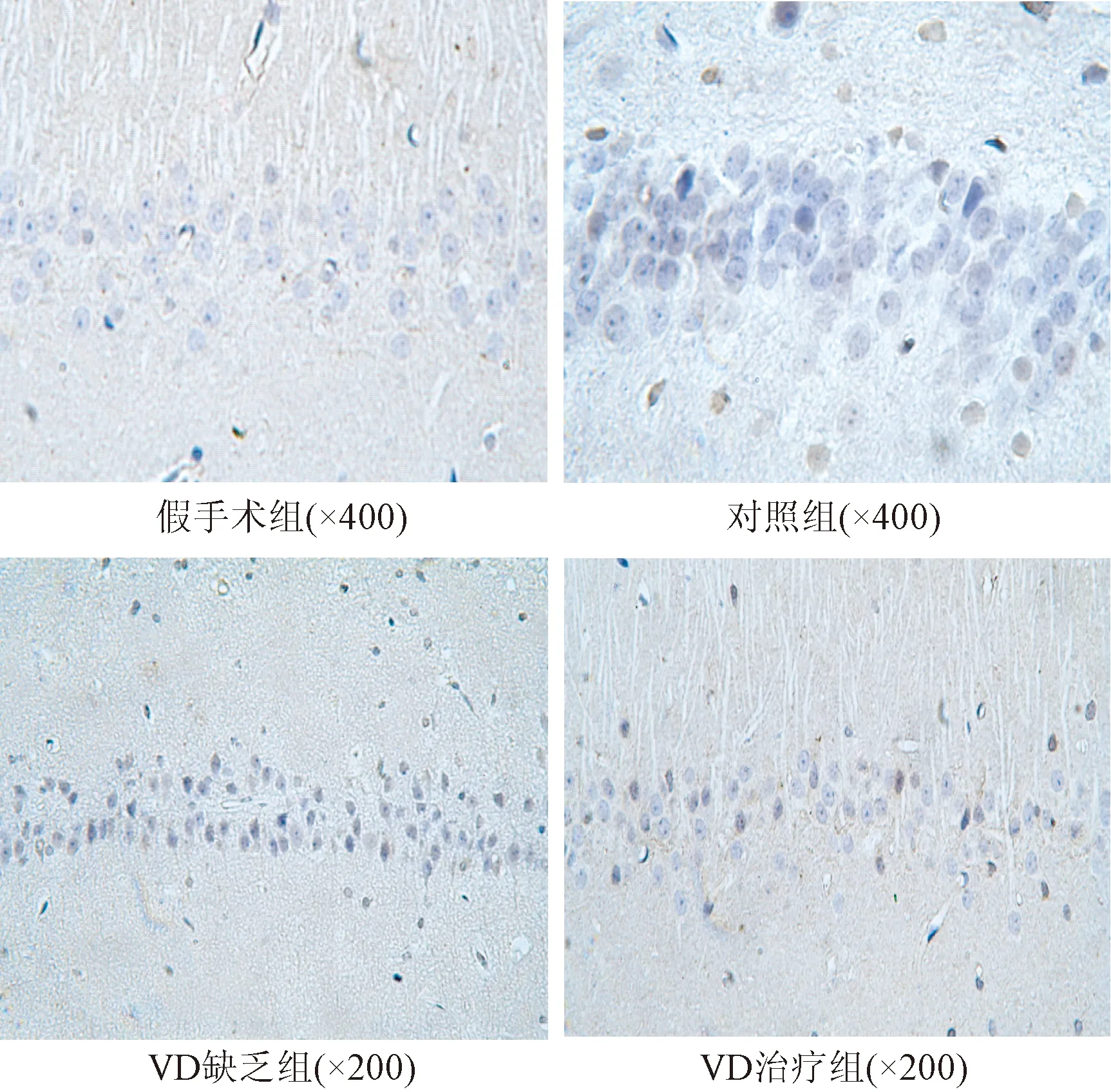
图1 大鼠脑组织HE染色Fig.1 HE staining results of rat brain tissue
2.3 各组大鼠脑组织切片免疫组化染色结果比较 脑组织切片中如NF-κB p65蛋白阳性表达,则胞浆或胞核中会显示明显棕褐色颗粒。在假手术组中,阳性表达不明显,仅在海马皮质神经元内偶见;对照组中,阳性表达细胞数目较假手术组上升,且有统计学意义(P<0.01);VD缺乏组中,阳性表达细胞数目明显高于其他各组,差异均有统计学意义(P<0.01),图像显示在皮层、海马区神经元胞内均可见大量棕褐色颗粒,其中部分细胞核和细胞质可见阳性反应物;VD治疗组中,阳性表达细胞数目低于对照组和VD缺乏组,但高于假手术组(P<0.01)。见图2、表2。

图2 各组大鼠CA1区NF-κB p65蛋白表达的免疫组化染色结果(×400) Fig.2 Immunohistochemical staining results of NF-κB p65 protein expression in CA1 region of each group(×400)

组别例数NF-κBp65蛋白(/HPF)假手术组910.11±1.05对照组951.22±3.23**VD缺乏组972.22±4.66**##VD治疗组923.56±3.64**##△△
**P<0.01与假手术组相比,compared with sham-operative group;##P<0.01,与对照组相比, compared with control group;△△P<0.01,与VD缺乏组相比,compared with VD-deficient group
2.4 Western-blot法检测NF-κB蛋白表达水平 与假手术组相比较,对照组、VD缺乏组及VD治疗组NF-κB蛋白表达明显升高(P<0.01)。与对照组相比,VD缺乏组NF-κB蛋白表达明显升高(P<0.01),VD治疗组NF-κB蛋白表达降低(P<0.01)。见图3、表3。
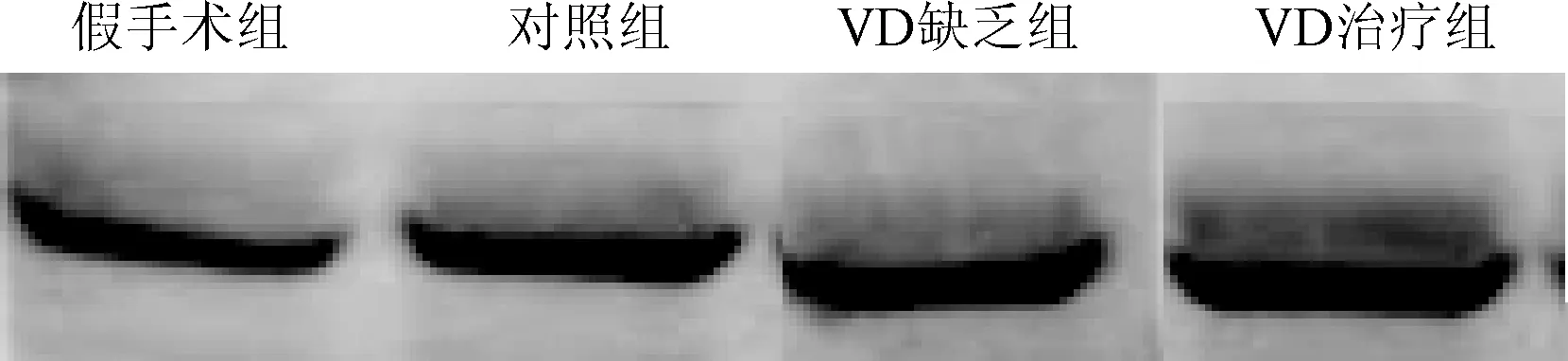
图3 VD对大鼠脑缺血后海马CA1区NF-кB表达的影响Fig.3 Effect of VD on NF-κB p65 protein expression in CA1 region of focal cerebral ischemia rats
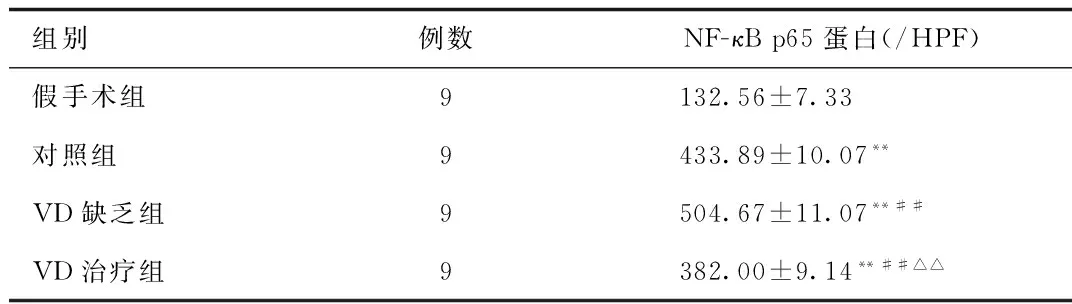
组别例数NF-κBp65蛋白(/HPF)假手术组9132.56±7.33对照组9433.89±10.07**VD缺乏组9504.67±11.07**##VD治疗组9382.00±9.14**##△△
**P<0.01与 假手术组相比,compared with sham-operative group;##P<0.01,与对照组相比, compared with control group;△△P<0.01,与VD缺乏组相比,compared with VD-deficient group
3 讨论
维生素D作为一种脂溶性维生素,不仅可以调节钙磷代谢,还可以通过对细胞增殖、分化的调节,以及维持脑部细胞的发育及功能,进而参与脑血管病的病理生理过程。在哥本哈根城市心脏研究中,经过历时30年的随访观察,最终于2013年发表的研究结果表明:随着血清中维生素D3浓度的减少,缺血性症状性脑卒中风险逐步增加。血清维生素D3水平最低的5%的个体较平均水平之上的个体发生缺血性脑卒中的风险高出82%[11];而血清中维生素D3浓度与出血性脑卒的发病率并无明显相关性。类似的结论在Gotaro Kojima等[12]的夏威夷心脏研究项目中也有相似的发现。研究证实,低水平的维生素D3是致死性脑卒中的独立预测因素[13]。本实验发现,维生素D缺乏组大鼠局灶性脑缺血后,神经功能评分明显高于其他组别,且HE染色脑片中可见明显核浓缩、深染,并出现较多三角形缺血性坏死细胞,表明维生素D的缺乏与脑缺血的发生有可能存在相关性。而接受维生素D治疗的大鼠,神经功能行为学评分要优于对照组,且HE染色中神经细胞核深染、核固缩的程度明显改善,细胞及间质的水肿较对照组有所减轻,部分细胞可见胞膜或核仁清晰、形态正常,表明维生素D的干预可减轻或预防脑缺血的症状或发生,进而证实了维生素D对缺血性脑卒中的保护作用。
NF-κB几乎存在于所有细胞中,是一种普遍存在的转录因子。主要是多肽p50及p65亚基形成的同源及异源二聚体,其中p65亚基具有转录激活功能,在细胞转化、调控细胞增殖及凋亡过程中发挥重要作用。在神经系统中,NF-κB主要存在于脑血管内皮细胞、神经元及神经胶质细胞中。有研究显示,NF-κB是血管内皮受损的始动机制之一。Clemens实验证实,脑缺血发生后,在脑梗死病灶及周围,不仅处于静息状态下的NF-κB被激活,而且也增强了NF-κB在转录及翻译水平上的表达[14]。脑缺血时,炎症细胞因子高表达,活化的NF-κB诱导细胞因子、黏附因子、炎性酶类的表达[15]、氧自由基形成及钙超载,引起炎症级联反应,进而加重脑损伤。
Giarratana等[16]应用胰岛细胞进行实验,发现维生素D类似物能够通过下调IκBα的转录及NF-κB P65核移位,进而显著下调促炎趋化因子的生成,抑制炎症反应。本研究也发现,通过免疫组化及Western blot,假手术组NF-κB p65阳性表达不明显,而对照组、VD缺乏组及VD治疗组均有不同程度的阳性表达,支持目前已有研究结论,即脑缺血时NF-κB被激活。与对照组相比较,维生素D缺乏组NF-κB p65阳性表达细胞数目明显升高,而维生素D治疗组阳性表达细胞数目较对照组有所下降,证实缺乏维生素D时,可加重NF-κB的激活,进而加重脑缺血损伤;而接受维生素D干预的大鼠,NF-κB激活数目有所减少,提示维生素D可抑制NF-κB被激活,抑制炎症反应过程,进而通过对NF-κB通路的阻碍对脑缺血大鼠起到保护作用。
随着对维生素D作用机制的深入研究,有望为缺血性脑损伤的治疗开辟新的途径,为其防治缺血性脑血管病提供理论依据。
[1] Nurmi A,Lindsberg PJ,Koistinaho M,et al.Nuclear factor-kappa B contributes to infarction after permanent focal ischemia[J].Stroke,2004,25(4):987-991.
[2] Pilz S,Marz W,Wellnitz B,et al.Association of vitamin D deficiency with heart failure and sudden cardiac death in a large cross-sectional study of patients referred for coronary angiography[J].Clin Endocrinol Metab,2008,93(5):3927-3935.
[3] Kenrick J,Targher G,Smits G,et al.25-Hydroxyxyvitamin D deficiency is independently associated with cardiovascular disease in the Third National Health and Nutrition Examination Survey[J].Atherosclerosis,2009,205(32):255-260.
[4] Hu P,Hu B,Wang J,et al.Modulation of vitamin D signaling is a potential therapeutic target to lower cardiovascular risk in charomic kidney disease[J].Med Sci Monit,2011,17(6):HY14-20.
[5] Poole KE,Loveridge N,Barker PJ,et al.Reduced vitamin D in acute stoke[J].Stoke,2006,37(8):243-245.
[6] Wang TJ,Pencina MJ,Booth SL,et al.Vitamin D deficiency and risk of cardiovascular disease[J] .Circulation,2008,117(4):503-511.
[7] Li F,Liu P,Zhang X,et al.1,25(OH)2D3-media amelioration of aortic injury in streplozototocin-induced diabetic rats[J].Inflammation,2013,36(6):1334-1343.
[8] Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(5):84-91.
[9] Kuluz JW,Prado RJ,Dietrich WD,et al.The effect of nitric oxide synthase inhibition on infarct volume after reversible focal cerebral ischemia in conscious rats[J].Stroke,1993,24(6):2023-2029.
[10] Gupta YK,Briyal S,Animal models of cerebral ischemia for evaluation of drugs[J].Indian J Physiol Pharmacol,2004,48(3):379-394.
[11] Brondum-Jacobsen P,Nordestgaard BG,Schnohr P,et al.25-hydroxyvitamin D and symptomatic ischemic stroke:an original study and meta-analysis[J].Ann Neurol,2013,73(1):38-47.
[12] Kojima G,Bell C,Abbott RD,et al.Low dietary vitamin D predicts 34 year incident stroke.The Honolulu Heart Program[J].Stroke,2012,43181:2163.
[13] Pilz S,Dobnig H,Fischer JE,et al.Low vitamin D levels predict stroke in patients referred to coronary angiography[J].Stroke,2008,39(9):2611-2623.
[14] Clemens JA,Slephenson DT,Dixon EP,et al.Global cerebral ischemia activates nuclear factor-kappa B prior to evidence of DNA fragmenlalion[J].Brain Res Mol Brain Res,1977,18(2):187-196.
[15] Clemena JA,Cerebral ischemia:gene activation,neuronal injury,and the protective role of antioxidants[J].Free Radic Riol Med,2000,28(10):1526-1531.
[16] Giarratana N,Penna G,Amuchastegui S,et al.A vitamin D analog down-regulates proinflammatory chemokine production by pancreatic islets inhibiting T cell recruitment and type 1 diabetes development[J].Immunol,2004,173(23):2280-2287.
(编校:吴茜)
Protective effect of Vitamin D on focal cerebral ischemia rats by regulating the activity of NF-κB
LI Xiang,TIAN Bu-xian,MIN Lian-qiu
(Department of Neurology, The First Affiliated Hospital of Liaoning Medical College, Jinzhou 121001, China)
ObjectiveTo investigate the protective effect of vitamin D on focal cerebral ischemia rats by regulating the activity of NF-κB.Methods72 male SD rats were randomly divided into sham-operative group, control group, VD-deficient group and VD-sufficient group,each had 18 rats.Rats in sham-operative group and control group received normal diet.Rats in VD-deficient group received VD-deficient diet.Rats in VD-sufficient group received VD-sufficient diet.The MCAO model was made after each group pretreated for 10 weeks.Surgical procedures of sham-operative group was the same as the above, but no thread inserted.Neuroethology evaluations for each group of rats and the cerebral pathological conformation were observed by HE staining.The expressions of nuclear factor-kappa B(NF-кB)detected by immunohistochemical and Western blot.ResultsThe neurological severity score in VD-sufficient group was lower than that in control group(P<0.01); the expression of NF-кB in VD-deficient group was highest than others (P<0.01), and the expression of NF-кB in VD-sufficient group was lower than that in control group (P<0.01). ConclusionVD has the protective effect on focal cerebral ischemia rats, and the mechanism may be related with the decreasing of NF-кB expression.
vitamin D; cerebral ischemia; NF-κB
辽宁省自然科学基金(20092192);辽宁省科学计划项目(2012225019)
李想,女,在读硕士,研究方向:脑缺血的基础研究,E-mail:mia.1988@live.cn;闵连秋,通讯作者,女,硕士,教授、主任医师,研究方向:脑血管疾病,E-mail:minlianqiu@163.com。
R743.31
A
1005-1678(2015)01-0006-04
