年龄和血清HBsAg、HBV DNA预测慢性乙型肝炎肝组织病理状态的研究
2015-07-10张占卿王雁冰周新兰冯艳玲
张占卿, 陆 伟, 王雁冰, 周新兰, 沈 芳, 冯艳玲
(1. 上海市公共卫生临床中心肝炎二科,上海 201508; 2. 上海市公共卫生临床中心检验科,上海 201508; 3. 上海市公共卫生临床中心病理科,上海 201508)
·临床研究·
年龄和血清HBsAg、HBV DNA预测慢性乙型肝炎肝组织病理状态的研究
张占卿1, 陆 伟1, 王雁冰1, 周新兰1, 沈 芳2, 冯艳玲3
(1. 上海市公共卫生临床中心肝炎二科,上海 201508; 2. 上海市公共卫生临床中心检验科,上海 201508; 3. 上海市公共卫生临床中心病理科,上海 201508)
目的 构建基于年龄和血清HBsAg、HBV DNA诊断慢性乙型肝炎肝组织不同病理状态的Logistic回归模型,优化血清HBsAg、HBV DNA诊断肝组织不同病理状态的效能。方法 经肝组织活检的慢性乙型肝炎患者472例,其中HBeAg阳性279例,HBeAg阴性193例。血清HBsAg和HBeAg采用Abbott Architect I2000及其配套试剂检测,血清HBV DNA采用实时荧光定量PCR检测。统计分析采用SPSS 13.0软件。结果 HBeAg阳性患者的血清HBsAg和HBV DNA与病理学分级和分期均呈显著负相关(P<0.05);HBeAg阴性患者的血清HBV DNA与病理学分级和分期呈显著正相关(P<0.01)。预测HBeAg阳性和阴性患者不同病理状态的回归模型的预测概率诊断不同病理状态的ROC曲线下面积均显著大于对角参考线下面积(P<0.01)。对HBeAg阳性患者,预测进展期纤维化的回归模型的预测概率和血清HBsAg诊断进展期纤维化的最佳截断值分别为≥0.185和≤3.797 log10IU/ml,其对应的灵敏度、特异度、准确度分别为0.886、0.646、0.706和0.800、0.660、0.695;对HBeAg阴性患者,预测显著纤维化的回归模型的预测概率和血清HBV DNA诊断显著纤维化的最佳截断值分别为≥0.603和≥3.095 log10IU/mL,其对应的灵敏度、特异度、准确度分别为0.636、0.720、0.668和0.669、0.653、0.663。结论 基于年龄和血清HBsAg、HBV DNA构建的Logistic回归模型可提升血清HBsAg、HBV DNA诊断肝组织不同病理状态的效能。
乙型肝炎表面抗原; 乙型肝炎病毒DNA; 定量检测; 慢性乙型肝炎;肝纤维化; Logistic回归分析
血清乙型肝炎表面抗原(hepatitis B surface antigen, HBsAg)水平在慢性乙型肝炎病毒(hepatitis B virus, HBV)感染自然史不同阶段的变化已引起肝病研究者和实践者的关注。血清HBsAg定量检测正逐步用于慢性HBV感染状态的评估[1-3],但是否可用于慢性乙型肝炎(chronic hepatitis B, CHB)肝组织病理状态的预测很少有文献报道[4]。最近有研究指出,血清HBV DNA载量对CHB肝组织病理状态有一定的预测价值[5];年龄不仅是影响慢性HBV感染状态的一个重要因素,而且对CHB肝组织病理状态有一定的预测和判别意义[6-7]。本研究就472例CHB患者血清HBsAg和HBV DNA定量检测的结果,结合患者年龄,参照肝组织病理学诊断,采用二分类Logistic回归建立基于年龄和血清HBsAg、HBV DNA的预测肝组织炎症活动度和纤维化程度回归模型,并采用ROC曲线法评价回归模型的预测概率、血清HBsAg、血清HBV DNA预测肝组织炎症活动度和纤维化程度的效能。
1 资料与方法
1.1 一般资料
2011年1月至2012年12月上海市公共卫生临床中心住院的CHB患者472例,其中乙型肝炎e抗原(hepatitis B e antigen, HBeAg)阳性和阴性患者分别为279例和193例。诊断符合2010年中华医学会肝病学分会、感染病学分会联合修订的《慢性乙型肝炎防治指南》中的标准。HBeAg阳性患者中,男195例,女84例,男∶女=2.3∶1;年龄12~76岁,平均(34.2±11.3)岁;HBeAg阴性患者中,男124例,女69例,男∶女=2.1∶1;年龄19~78岁,平均(43.8±11.8)岁。所有患者均无失代偿性肝病的临床表现和实验室依据。合并其他病毒性肝炎、药物性肝病、遗传性肝病、血吸虫性肝病以及自身免疫性疾病、内分泌与代谢疾病、血液系统疾病的患者被排除,接受过干扰素-α类、核苷(酸)类、甾体激素类药物治疗的患者被排除。
1.2 病理学诊断
患者在接受肝组织活检前常规签署知情同意书。肝组织活检采用1秒钟经皮肝穿刺法,标本采集后立即置塑料标本管内冰冻送检。肝组织置塑料包埋盒中,进行中性甲醛固定、梯度乙醇脱水、二甲苯透明、石蜡浸入和包埋、切片,苏木素-伊红染色和网状纤维染色。肝组织标本的质量评价和肝组织病理学诊断由1名有经验的病理学医师独立完成。肝组织病理学诊断参照2000年西安全国病毒性肝炎及肝病学术会议修订的标准。肝组织病理学分级包括G0、G1、G2、G3、G4五级,分期包括S0、S1、S2、S3、S4五期;其中病理学分级≥G2、≥G3、≥G4分别被定义为显著炎症、严重炎症和进展期炎症,病理学分期≥S2、≥S3和≥S4分别被定义为显著纤维化、严重纤维化和进展期纤维化。
1.3 血清HBsAg和HBV DNA检测
所有患者于肝穿刺前后1周内早晨空腹采集静脉血,分离血清。血清HBsAg和HBeAg采用Abbott Architect I2000及其配套试剂检测,正常参考值下限分别为0.05IU/ml和1.0S/CO;如果血清HBsAg>250IU/ml,则使用专用试剂进行500倍稀释后进行二次测定。HBV DNA实时荧光定量PCR检测,检测范围5×102~5×107IU/ml。血清HBsAg和HBV DNA定量检测得到了上海市公共卫生临床中心伦理委员会的批准(批件号: 2013-K008)。
1.4 统计学处理
数据处理和统计分析采用SPSS 13.0软件。年龄和血清HBsAg、HBV DNA与肝组织病理学分级和分期之间的相关性采用Spearman等级相关分析。年龄和血清HBsAg、HBV DNA在肝组织不同病理学分级和分期之间的差异比较采用单因素方差分析。基于年龄和血清HBsAg、HBV DNA预测显著、严重和进展期炎症活动度和纤维化程度的回归模型的构建采用二分类Logistic逐步回归分析。年龄和血清HBsAg、HBV DNA和回归模型预测显著、严重和进展期炎症活动度和纤维化程度的评价采用ROC曲线法,年龄和血清HBsAg、HBV DNA和回归模型预测显著、严重和进展期炎症活动度和纤维化程度的ROC曲线下面积(area under ROC curve, AUROC)之间的比较采用Z检验。
2 结 果
2.1 年龄和血清HBsAg、HBV DNA在HBeAg阳性和阴性患者之间的差异
HBeAg阳性和阴性患者之间年龄和血清HBsAg、HBV DNA差异均有统计学意义(P<0.01),见表1。

表1 HBeAg阳性、阴性患者年龄、血清HBsAg、HBV DNA的比较
2.2 年龄和血清HBsAg、HBV DNA与肝组织病理学分级和分期之间的相关性
HBeAg阳性患者,年龄与病理学分级和分期呈显著正相关(P<0.05),血清HBsAg、HBV DNA与病理学分级和分期呈显著负相关(P<0.05)。HBeAg阴性患者,年龄和HBV DNA与病理学分级和分期呈显著正相关(P<0.01),血清HBsAg与病理学分级和分期均无显著相关性(P>0.05),见表2。

表2 年龄和血清HBsAg、HBV DNA与肝组织病理学分级和分期之间的Spearman相关系数
2.3 基于年龄和血清HBsAg、HBV DNA构建的预测肝组织不同炎症活动度和纤维化程度的Logistic回归模型
以年龄和血清HBsAg、HBV DNA作为自变量,以肝组织不同炎症活动度和纤维化程度作为因变量,进行Logistic逐步回归分析。结果显示,HBeAg阳性患者,只有血清HBsAg符合预测显著炎症、显著纤维化的模型纳入自变量的标准,年龄和血清HBsAg符合预测严重炎症、严重纤维化和进展期肝纤维化的模型纳入自变量的标准。HBeAg阴性患者,年龄和血清HBV DNA符合预测显著炎症、显著纤维化、严重炎症、严重纤维化的模型纳入自变量的标准,只有年龄符合预测进展期肝纤维化的模型纳入自变量的标准,见表3、4。
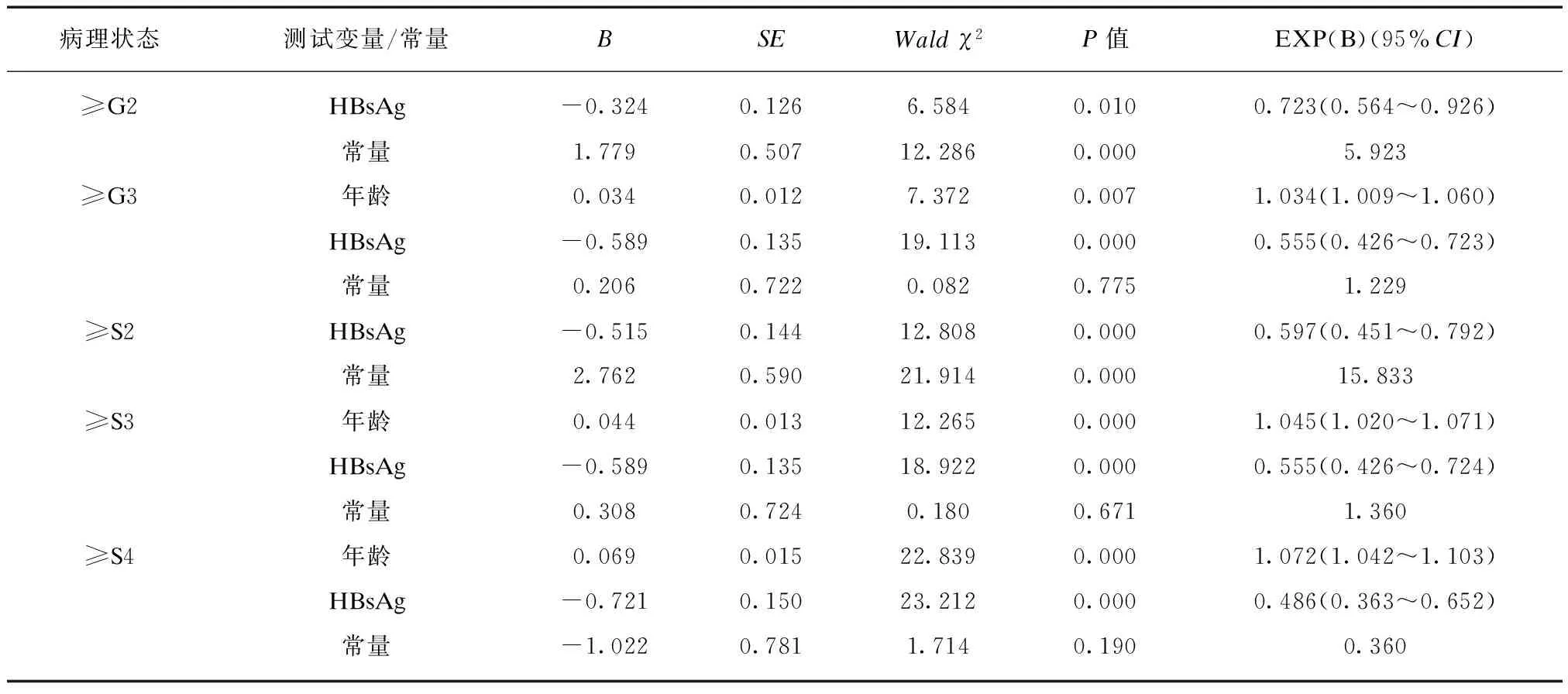
表3 HBeAg阳性患者年龄和血清HBsAg、HBV DNA预测肝组织不同病理状态的Logistic逐步回归分析

表4 HBeAg阴性患者年龄和血清HBsAg、HBV DNA预测肝组织不同病理状态的Logistic逐步回归分析
2.4 Logistic回归模型的预测概率和年龄、血清HBsAg、HBV DNA诊断肝组织不同炎症活动度和纤维化程度的ROC曲线
对于HBeAg阳性患者,诊断显著炎症回归模型中预测概率(PP-sig-i)的AUROC显著大于年龄的AUROC;诊断严重炎症、严重纤维化和进展期肝纤维化回归模型中预测概率(PP-sev-i、PP-sev-f、PP-adv-f)的AUROC显著大于血清HBV DNA的AUROC。PP-adv-f的AUROC的95%CI的下限>0.700,血清HBsAg的AUROC的95%CI上限<0.300,见表5。
对于HBeAg阴性患者,诊断显著炎症和纤维化、严重炎症和纤维化、进展期肝纤维化的回归模型中PP-sig-i、PP-sig-f、PP-sev-i、PP-sev-f、PP-adv-f的AUROC均显著大于血清HBsAg的AUROC。诊断显著肝纤维化的PP-sig-f的AUROC最大,见表6。
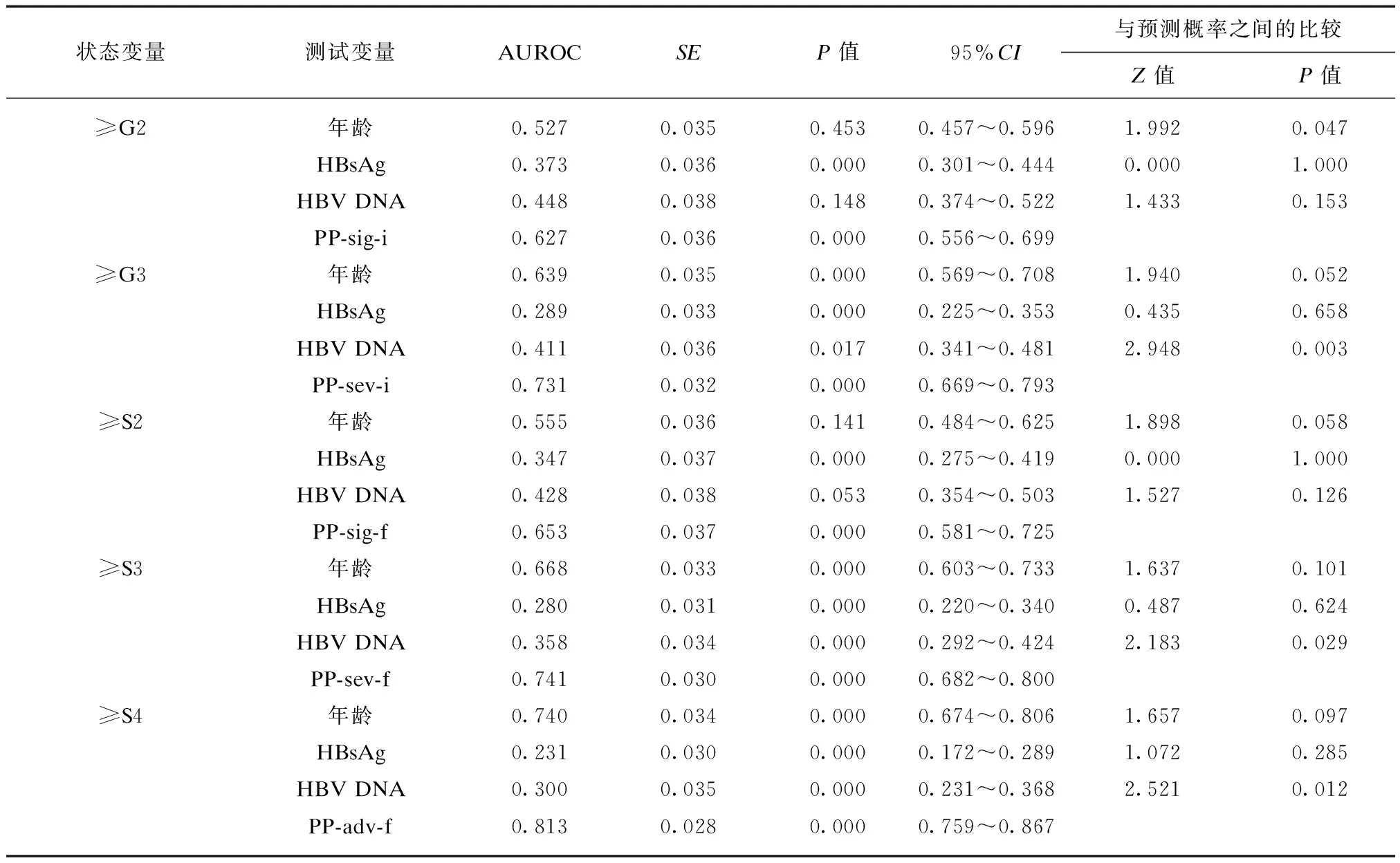
表5 HBeAg阳性患者年龄、血清HBsAg、血清HBV DNA和回归模型的预测概率诊断肝组织不同病理状态的AUROC

表6 HBeAg阴性患者年龄、血清HBsAg、血清HBV DNA和回归模型的预测概率诊断肝组织不同病理状态的AUROC
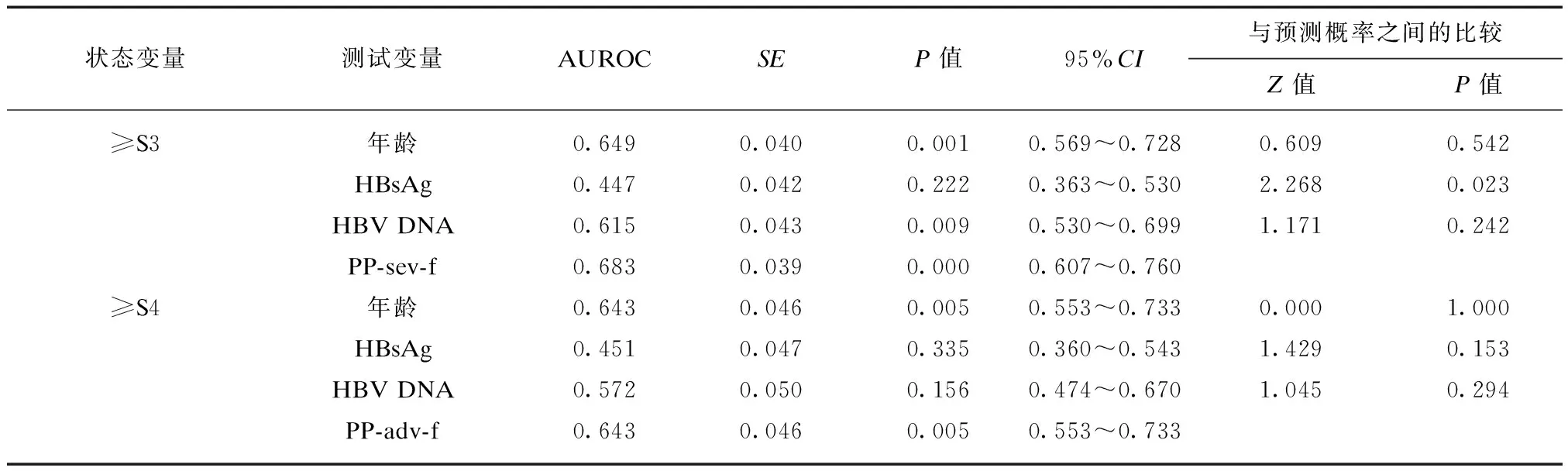
(续表6)
2.5 Logistic回归模型预测肝组织不同炎症活动度和纤维化程度的评价
比较HBeAg阳性和阴性患者预测肝组织不同炎症活动度和纤维化程度回归模型的预测概率和年龄、血清HBsAg、HBV DNA预测肝组织不同炎症活动度和纤维化程度的AUROC,对HBeAg阳性患者预测效能最大的预测指标为回归模型和血清HBsAg,预测效能最大的病理状态为进展期纤维化;对HBeAg阴性患者预测效能最大的预测指标为回归模型和血清HBV DNA,预测效能最大的病理状态为显著纤维化。HBeAg阳性患者的PP-adv-f和血清HBsAg预测进展期纤维化、HBeAg阴性患者的PP-sig-f和血清HB DNA预测显著纤维化的最佳截断值及其对应的诊断参数见表7。

表7 优选的Logistic回归模型及其构件指标诊断优选的病理状态的最佳截断值及其对应的诊断参数
3 讨 论
多数学者认为,慢性HBV感染经历免疫耐受期、免疫激活期和免疫控制期,其中部分患者经历免疫逃逸期[8]。长期持续存在的或反复出现的不充分的免疫激活或逃逸是CHB及其相关肝硬化、肝脏失代偿和肝细胞癌发病和进展的主要机制。初步的研究结果显示,血清HBsAg定量检测对慢性HBV感染的免疫耐受状态和免疫控制状态有一定预测意义[1-3]。免疫激活和逃逸不仅造成肝组织损伤,而且也导致HBV复制及其抗原表达水平的变化。因此,理论上讲,血清HBsAg水平和血清HBV DNA载量与肝脏组织学变化可能存在相关性,对肝组织病理学状态有潜在的预测意义。
Seto等[9]根据140例HBeAg阳性CHB患者血清HBsAg定量检测的结果,探讨了血清HBsAg水平对HBeAg阳性患者肝组织病理学状态的预测价值。血清HBsAg水平采用Elecsys Ⅱ检测;肝组织炎症活动度和纤维化程度分别采用Knodell HAI评分和Ishak纤维化评分表示,其中Knodell HAI评分≤4和Ishak纤维化评分≤1分别被定义为非显著炎症和非显著纤维化。血清HBsAg水平与肝组织炎症活动度和纤维化程度均呈显著负相关。血清HBsAg诊断非显著炎症和非显著纤维化的AUROC分别为0.55(95%CI: 0.44~0.65)和0.77(95%CI: 0.69~0.85);基于Youden指数确定的血清HBsAg诊断非显著纤维化的最佳截断值为≥2.75×104IU/ml,对应的灵敏度和特异度分别为0.86和0.83。曾达武等[10]根据165例CHB患者血清HBsAg定量检测的结果,调查了血清HBsAg水平对HBeAg阳性CHB患者肝组织病理学状态的预测意义。血清HBsAg水平采用Abbott Architect I2000检测。肝组织炎症活动度和纤维化程度采用Scheuer评分表示。根据ROC曲线分析,血清HBsAg诊断严重炎症(≥G3)、进展期炎症(≥G4)和显著纤维化(≥S2)、严重纤维化(≥S3)、进展期纤维化(≥S4)的AUROC分明别为0.61、0.67、0.68、0.67、0.70。以血清HBsAg≤3.30×104IU/ml为截断值,其诊断进展期纤维化的灵敏度和特异度分别为0.36和0.95。提示血清HBsAg定量检测对HBeAg阳性CHB患者肝组织炎症活动度和纤维化程度有一定预测价值。
Martinot-Peignoux等[11]根据101例HBeAg阳性和305例HBeAg阴性CHB患者血清HBsAg定量检测的结果,研究了血清HBsAg水平对肝组织纤维化程度的预测效能。血清HBsAg水平采用Elecsys Ⅱ检测;肝组织纤维化程度采用METAVIR评分表示,其中纤维化评分≤F1和≥F2被定义为非显著和显著纤维化。HBeAg阳性患者的血清HBsAg水平与纤维化程度呈显著负相关,但HBeAg阴性患者的血清HBsAg水平与纤维化程度无显著相关性。血清HBsAg诊断HBeAg阳性患者显著纤维化的AUROC为0.77(95%CI: 0.67~0.87),基于Youden指数确定的血清HBsAg诊断显著纤维化的最佳截断值为≤7.08×103IU/ml,对应的灵敏度和特异度分别为1.00和0.83。提示血清HBsAg定量检测对HBeAg阳性患者肝组织纤维化程度有一定预测意义,但对HBeAg阴性患者肝组织纤维化程度无预测价值。
为提升血清HBsAg、HBV DNA预测CHB肝组织不同炎症活动度和纤维化程度的效能,本文采用二分类Logistic回归建立了基于年龄和血清HBsAg、HBV DNA的预测肝组织不同炎症活动度和纤维化程度回归模型。对HBeAg阳性和阴性患者预测肝组织不同炎症活动度和纤维化程度回归模型的预测概率和年龄、血清HBsAg、血清HBV DNA诊断肝组织不同炎症活动度和纤维化程度的AUROC之间的比较结果指出,对HBeAg阳性患者诊断效能最大的预测指标为回归模型的预测概率和血清HBsAg,诊断效能最大的病理状态为进展期纤维化;对HBeAg阴性患者诊断效能最大的预测指标为回归模型的预测概率和血清HBV DNA,预测效能最大的病理状态为显著纤维化。
慢性HBV感染自然史三个阶段的划分没有涵盖免疫清除期。事实上,免疫清除期是慢性HBV感染走向终结的必经之路。虽然血清HBsAg消失并不完全意味着HBV感染的彻底终结,但慢性HBV感染者出现血清HBsAg消失之后发生失代偿性肝病和肝癌的机会显著降低[12-13]。慢性HBV感染免疫清除期表现为血清HBsAg和HBeAg阴性,血清HBV DNA在通常不可检测。最近有研究指出,血清HBsAg定量检测对慢性HBV感染的免疫清除走向有一定的预测意义[14-15]。
本研究显示,血清HBsAg水平和HBV DNA载量在HBeAg阳性与阴性患者之间的差异有统计学意义;HBeAg阳性患者血清HBsAg水平和HBV DNA载量均与肝组织病理学分级和分期均呈显著负相关,HBeA阴性患者血清HBsAg水平和HBV DNA载量与肝组织病理学分级和分期分别无显著相关和显著正相关。提示HBeAg阳性和阴性CHB患者的发病和进展机制可能不同: HBeAg阳性患者的免疫激活可能起因于机体免疫耐受的自发性解除,持续存在的免疫激活导致HBV复制及其抗原表达水平下降、同时伴随肝组织进行性损伤和纤维化进展,直到实现免疫控制;HBeAg阴性患者的免疫逃逸期可能起因于HBV复制及其抗原表达的机会性上升,反复出现的免疫逃逸导致HBV复制及其抗原表达水平再下降、同时伴随肝组织再损伤和纤维化再进展,直到实现免疫清除。
[1] Chan HL, Wong VW, Wong GL, et al. A longitudinal study on the natural history of serum hepatitis B surface antigen changes in chronic hepatitis B[J]. Hepatology, 2010,52(4): 1232-1241.
[2] Nguyen T, Thompson AJ, Bowden S, et al. Hepatitis B surface antigen levels during the natural history of chronic hepatitis B: a perspective on Asia[J]. J Hepatol, 2010,52(4): 508-513.
[3] Kim YJ, Cho HC, Choi MS, et al. The change of quantitative HBsAg level in the natural course of chronic hapatitia B[J]. Liver Int, 2011,31(6): 817-823.
[4] Martinot-Peignoux M, Lapalus M, Asselah T, et al. The role of HBsAg quantification for monitoring natural history and treatment outcome[J]. Liver Int, 2013,33(Suppl 1): 125-132.
[5] Sanai FM, Helmy A, Bzeizi KI, et al. Discriminant value of serum HBV DNA levels as predictors of liver fibrosis in chronic hepatitis B[J]. J Viral Hepat, 2011,18: e217-225.
[6] 张占卿,陆伟,王雁冰,等.性别和年龄对慢性乙型肝炎肝组织病理学状态的判别价值[J].现代中西医结合杂志,2011,20(32): 4050-4052.
[7] 张占卿,陆伟,王雁冰,等.性别和年龄对慢性乙型肝炎肝组织病理学状态的预测作用[J].世界感染杂志,2011,11(2): 108-111.
[8] Chu CM, Liaw YF. Predictive factors for reactivation of hepatitis B following hepatitis B e antigen seroconv-ersion in chronic hepatitis B[J]. Gastroenterology, 2007,133(5): 1458-1465.
[9] Seto WK, Wong DKH, Fung J, et al. High hepatitis B surface antigen levels predict insignificant fibrosis in hepatitis B e antigen positive chronic hepatitis B[J]. PLoS One, 2012,7(8): e43087.
[10] 曾达武,董菁,陈丽红,等.免疫清除期慢性乙型肝炎患者血清HBsAg水平与肝组织炎症分级及纤维化分期的关系[J].中华肝脏病杂志,2012,20(10): 746- 750.
[11] Martinot-Peignoux M, Carvalho-Filho R, Lapalus M, et al. Hepatitis B surface antigen serum level is associated with fibrosis severity in treatment-naïve, e antigen-positive patients[J]. J Hepatol, 2013,58(6): 1089-1095.
[12] Yuen MF, Wong DK, Sablon E, et al. HBsAg seroclearance in chronic hepatitis B in the Chinese: virological, histological, and clinical aspects[J]. Hepatology, 2004,39(6): 1694-1701.
[13] Yuen MF, Wong DK, Fung J, et al. HBsAg Seroclearance in chronic hepatitis B in Asian patients: replicative level and risk of hepatocellular carcinoma[J]. Gastroenterology, 2008,135(4): 1192-1199.
[14] Tseng TC, Liu CJ, Su TH, et al. Serum hepatitis B surface antigen levels predict surface antigen loss in hepatitis B e antigen seroconverters[J]. Gastroente-rology, 2011,141(2): 517-525.
[15] Tseng TC, Liu CJ, Yang HC, et al. Determinants of spontaneous surface antigen loss in hepatitis B e antigen-negative patients with a low viral load[J]. Hepatology, 2012,55(1): 68-76.
Logistic regression model for prediction of liver tissue pathological status in patients with hepatitis B
ZHANGZhan-qing1,LUWei1,WANGYan-bing1,ZHOUXin-lan1,SHENFang2,FENGYan-ling3
(1. Dept. of Hepatology, Shanghai Public Health Clinical Center of Fudan University, Shanghai 201508, China; 2. Dept. of Clinical Laboratory, Shanghai Public Health Clinical Center of Fudan University, Shanghai 201508, China; 3. Dept. of Pathology, Shanghai Public Health Clinical Center of Fudan University, Shanghai 201508, China)
Objective To construct a Logistic regression model based on age and serum HBsAg, HBV DNA for prediction of liver tissue pathological states in patients with chronic hepatitis B. Methods Total 472 consecutive chronic hepatitis B patients with pathological diagnoses of liver tissues, including 279 HBeAg-positive and 193 HBeAg-negative patients, were enrolled in present study. Serum HBsAg and HBeAg were determined by Abbott Architect I2000 and auxiliary reagents, serum HBV DNA was determined by real-time fluorescence quantitative PCR. SPSS 13.0 software was used for statistical analyses. Results In HBeAg-positive patients, serum HBsAg and HBV DNA were negatively correlated with pathological grading and staging(P<0.05). In HBeAg-negative patients, serum HBV DNA was positively correlated with the pathological grading and staging(P<0.01). In both HBeAg-positive and HBeAg-negative patients, the area under ROC curve of the regression model for predicting different pathological states was significantly larger than that of the diagonal reference(P<0.01). In HBeAg-positive patients, the optimal cut-offs of predictive probability in the regression model for predicting advanced fibrosis and serum HBsAg for diagnosis of advanced fibrosis were ≥0.185 and ≤3.797 log10IU/ml respectively, and the corresponding sensitivities, specificities, accuracies were 0.886, 0.646, 0.706 and 0.800, 0.660, 0.695 respectively. In HBeAg-negative patients, the optimal cut-offs of predictive probability in the regression model for predicting significant fibrosis and serum HBV DNA for diagnosis of significant fibrosis were ≥0.603 and ≥3.095 log10IU/ml respectively, and the corresponding sensitivities, specificities, accuracies were 0.636, 0.720, 0.668 and 0.669, 0.653, 0.663, respectively. Conclusion Logistic regression models based on age and serum HBsAg, HBV DNA can enhance the efficacy of serum HBsAg and HBV DNA for diagnosis of pathological states in patients with chronic hepatitis B.
hepatitis B surface antigen; hepatitis B virus DNA; quantitative detection; chronic hepatitis B; fibrosis; Logistic regression analysis
10.16118/j.1008-0392.2015.01.012
2014-07-01
上海市卫计委项目(20134032)
张占卿(1964—),男,主任医师,硕士.E-mail: doctorzzqsphc@163.com
R 575.2
A
1008-0392(2015)01-0050-08
