血管紧张素Ⅱ对人脐静脉内皮细胞分泌NO和ET1的影响
2015-07-10姚义安
齐 元, 姚义安
(同济大学附属东方医院心内科,上海 200120)
·基础研究·
血管紧张素Ⅱ对人脐静脉内皮细胞分泌NO和ET1的影响
齐 元, 姚义安
(同济大学附属东方医院心内科,上海 200120)
目的 通过体外细胞实验研究血管紧张素Ⅱ(Ang Ⅱ )对人脐静脉内皮细胞(HUVECs)分泌NO和ET1的影响,探讨其可能的机制。方法 体外培养HUVECs,对其进行不同浓度Ang Ⅱ 刺激(1×10-9、1×10-8、1×10-7、1×10-6mol/L刺激组),及相同浓度不同作用时间Ang Ⅱ 刺激(1×10-7mol/L刺激2、6、12、18、24h),并应用不同的受体阻断剂(AT1R阻断剂替米沙坦、AT2R阻断剂PD123319)及信号通路阻断剂(Erk1/2阻断剂PD98059、P38 MAPK阻断剂SB203580、PKC阻断剂Staurosporine)观察Ang Ⅱ 的作用通路,用ELISA法检测细胞分泌的内皮素1(ET1),用Griess法检测一氧化氮(NO),用RT-PCR方法检测eNOS/ET1 mRNA水平。结果 Ang Ⅱ 对血管内皮细胞的刺激作用有浓度效应,Ang Ⅱ 越高,eNOS mRNA表达和NO水平越低,而ET1 mRNA表达与蛋白水平越高;Ang Ⅱ 对内皮细胞功能的影响有时间效应,Ang Ⅱ 作用时间越长,NO/ET1水平越低;替米沙坦、PD98059和SB203580能阻断Ang Ⅱ 的效应;而PD123319和Staurosporine不能阻断Ang Ⅱ 的效应。结论 Ang Ⅱ 可损伤内皮细胞的分泌功能,表现为NO降低而ET1升高,其通过AT1R发挥,用并可能通过Erk1/2及MAPK信号通路途径起作用。
血管紧张素Ⅱ; 内皮细胞功能; 信号通路
动脉粥样硬化的发生是一个多层次的、各种因素和细胞成分相互影响的瀑布式发展过程。内皮细胞功能紊乱是动脉粥样硬化形成的决定性因素。近年来,研究[1]发现血管紧张素Ⅱ(Ang Ⅱ )能诱导内皮功能障碍,导致内皮素分泌增加,NO分泌减少,促进血栓形成,参与动脉粥样硬化事件的发生发展,而替米沙坦等AT1受体阻断剂可改善内皮功能,但其作用途径及信号转导机制尚不明确。
Ang Ⅱ 的受体主要有血管紧张素受体1(AT1R)和血管紧张素受体2(AT2R),Ang Ⅱ 主要通过AT1R发挥生理效应,替米沙坦是AT1R特异受体阻断剂,而PD123319是AT2R特异阻断剂。本实验通过研究Ang Ⅱ 对人脐静脉内皮细胞分泌NO及ET1的影响,并对其可能的作用机制进行研究,进而探讨Ang Ⅱ 在动脉粥样硬化发生发展过程中的作用。
1 材料与方法
1.1 材料
健康新生儿脐带取自同济大学附属东方医院妇产科;Ⅰ型胶原酶、Angiotensin、PD123319、SB203580、PD98059、Staurosporine购自上海拜力生物科技有限公司;替米沙坦购自北京万生药业有限责任公司;RPMI1640、DMEM培养基购自Gibcol公司;ET1试剂盒购自R&D Systems公司,NO试剂盒购自晶美生物技术有限公司;β-actin、eNOS及ET1引物购自上海生工生物工程技术服务有限公司;胎牛血清购自杭州四季青公司;恒温CO2培养箱购自Revco公司;超净工作台购自Forma Scientific公司;酶标仪(CliniBio 128C型)购自CliniBio公司;PTC200 PCR仪购自Opticon公司;Coic倒置显微镜购自重庆电子仪器厂。
1.2 HUVEC培养及鉴定
无菌取分娩4h内健康新生儿脐带,用PBS缓冲液冲洗干净。以Ⅰ型胶原酶于37℃恒温箱中消化15 min,加入M200培养基终止反应,收集消化液,离心半径10cm,1000r/min,离心5min,弃去上清液,收集细胞,加入M200培养液悬浮细胞,计数细胞数量,放入37℃、5%CO2的恒温培养箱中培养。培养所得HUVEC细胞形态学符合内皮细胞特征(使用相差倒置显微镜观察血管内皮细胞的形态),见图1。选择生长良好的第2~4代细胞用于实验。
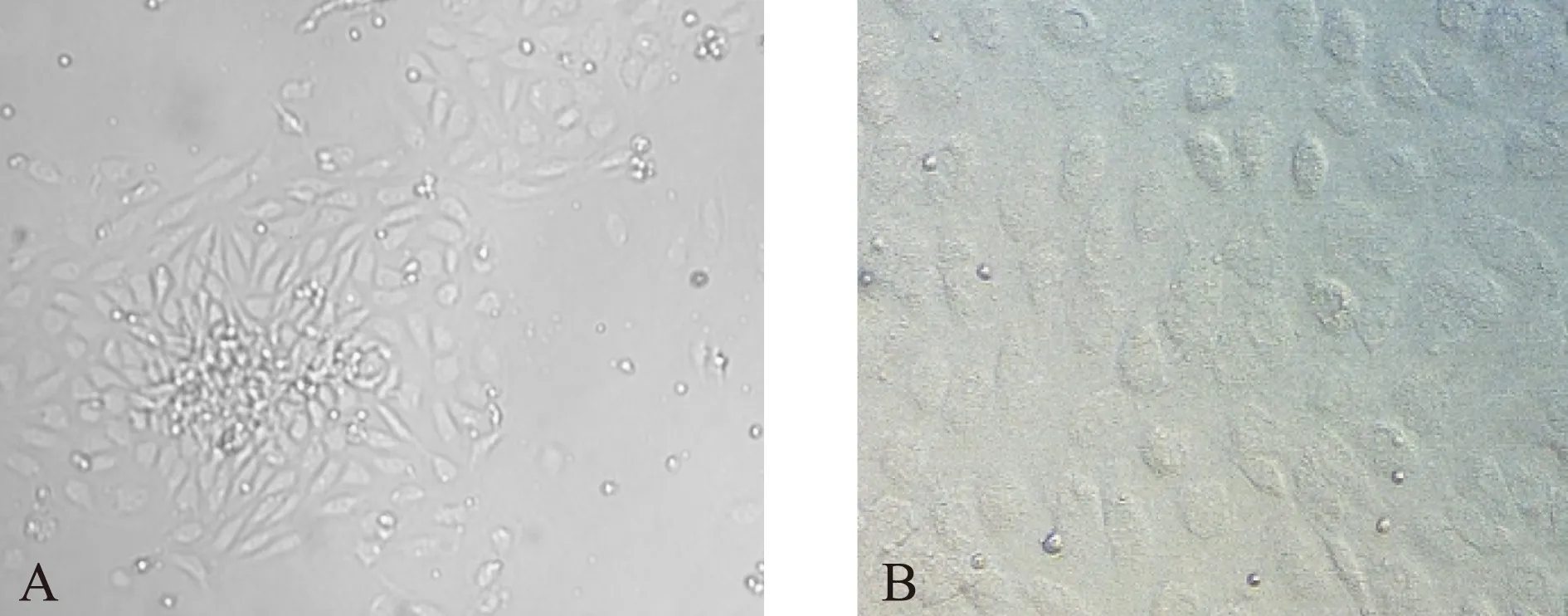
图1 原代HUVEC镜下形态Fig.1 Cellular morphology of primary HUVEC under optical microscopyA(×10): 原代HUVEC培养第2天,可见HUVEC从贴壁的细胞团中向外生长,呈多边形,集落样;B(×100): 原代培养第2代,细胞呈圆形,铺路石样排列
1.3 实验分组
细胞长至亚融合后,无血清同步6h,实验共分14组,其中包括对照组(培养基不加影响药物),相同浓度不同时间Ang Ⅱ刺激组[1×10-7mol/L浓度下分别刺激2、6、12、18及24h(Ⅰ、Ⅱ、Ⅲ、Ⅳ和Ⅴ组)],不同浓度Ang Ⅱ刺激组[1×10-9、1×10-8、1×10-7、1×10-6mol/L(Ⅵ、Ⅶ、Ⅷ和Ⅸ组)]及经过1×10-7mol/L Ang Ⅱ 预刺激0.5h后加入不同阻断药物作用组[1×10-5mol/L替米沙坦,1×10-7mol/L PD123319,1×10-7mol/L PD98059,1×10-7mol/L PD203580,1×10-7mol/L Staurosporine作用组(Ⅹ、Ⅺ、Ⅻ、ⅩⅢ和ⅩⅣ组)](信号通路主要有ERK1/2、p38 MAPK、PKC途径,其阻断剂分别为PD98059、SB203580、Staurosporine)。
1.4 ELISA法测定NO及ET1
各组培养作用结束后收集细胞上清液,严格按照ELISA试剂盒操作步骤进行,用Clini Bio 128C型酶标仪检测NO及ET1水平。
1.5 RT-PCR检测eNOS及ET1表达
收集细胞,TRIzol法提取总RNA,紫外分光光度计准确定量其浓度和纯度,所用RNA的A260/A280均为1.8~2.0,反转录合成cDNA。eNOS PCR扩增引物序列: 正义链5′-GTTTGTCTG-CGGCGATGT-3′,反义链5′-GTGCGTATGCGGCT-TGTC-3′,退火温度为58℃,ET1 PCR扩增引物序列: 正义链5′-CGTGAGAATAGATGCCAATGTG-3′,反义链5′-ACCAATGTGCTCTCGGTTGTG-3′,退火温度为56℃,β-actin引正义链5′-CGCACCA-CTGGCATTGTCAT-3′,反义链5′-TTCTCCTTGAT-GTCACGCAC-3′,退火温度为57℃;然后以PCR扩增目的基因进行扩增,94℃变性2min后进行以下循环: 94℃变性40s,退火40s,72℃延长1min,循环34次,最后72℃延长5min。取PCR产物10μl行1.5%琼脂糖凝胶电泳,溴乙锭染色后UVP凝胶成像系统扫描观察摄影,以β-actin的吸光度作为内参照,根据目的基因与内参照电泳条带点密度的比值进行eNOS及ET1 mRNA表达水平的半定量分析。
1.6 统计学处理
2 结 果
2.1 Ang Ⅱ对NO及ET1分泌的影响
2.1.1 不同浓度Ang Ⅱ对NO及ET1分泌的影响 Ang Ⅱ 浓度越高,对内皮细胞分泌NO、ET1及NO/ET1的影响越大,表现为随着Ang Ⅱ浓度的增加NO的分泌减少,当达到1×10-7mol/L时变化最大,NO及NO/ET1水平与对照组差异有统计学意义(P<0.05),见表1。
2.1.2 相同浓度Ang Ⅱ不同时间对NO及ET1的影响 考虑到随着培养时间的延长,细胞数量也随之增多,分泌的NO与ET1也会随之增加,但NO/ET1是不受细胞数量的影响的,因此选择NO/ET1进行分析。结果发现: 作用时间越长,1×10-7mol/L Ang Ⅱ对NO/ET1的影响越显著,表现为随着作用时间的延长,NO/ET1显著降低,以24h时变化最为显著(P<0.05),见表2。
表1 不同浓度Ang Ⅱ对NO及ET1分泌的影响
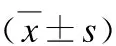
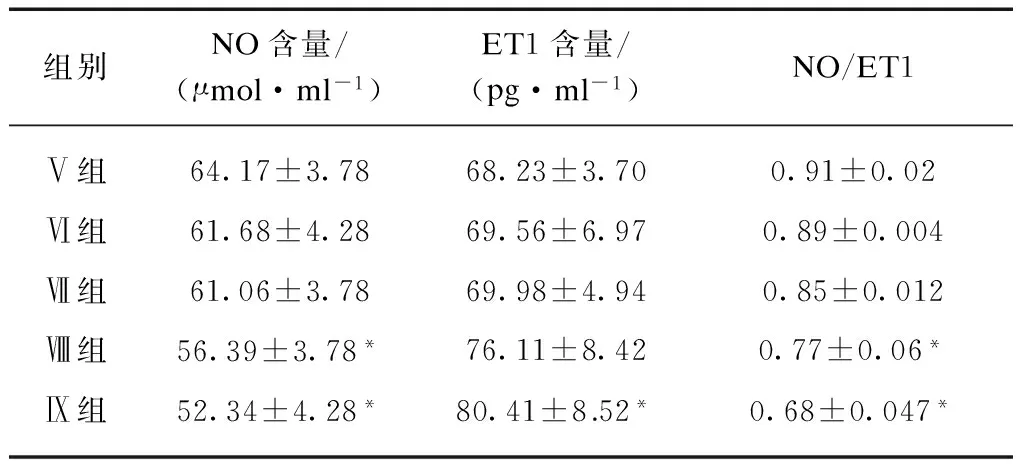
组别NO含量/(μmol·ml-1)ET1含量/(pg·ml-1)NO/ET1Ⅴ组64.17±3.7868.23±3.700.91±0.02Ⅵ组61.68±4.2869.56±6.970.89±0.004Ⅶ组61.06±3.7869.98±4.940.85±0.012Ⅷ组56.39±3.78*76.11±8.420.77±0.06*Ⅸ组52.34±4.28*80.41±8.52*0.68±0.047*
与对照组相比,*P<0.05
表2 相同浓度、不同时间Ang Ⅱ对NO及ET1的影响
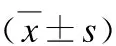

组别NO含量/(μmol·ml-1)ET1含量/(pg·ml-1)NO/ET1Ⅰ组34.89±2.8641.92±1.070.87±0.05Ⅱ组40.81±2.8648.54±3.090.85±0.03Ⅲ组45.48±3.2858.34±4.920.81±0.03Ⅳ组47.35±3.0059.5±1.460.78±0.04Ⅴ组56.39±3.7876.11±8.420.77±0.06*
与2h相比,*P<0.05
2.1.3 Ang Ⅱ受体拮抗剂及3种信号通路阻断剂对Ang Ⅱ作用于内皮功能的影响 1×10-7mol/L Ang Ⅱ对内皮细胞分泌的NO、ET1及NO/ET1均有影响,较对照组差异均有统计学意义(P<0.05)。而在替米沙坦、PD98059和SB203580分别与Ang Ⅱ的联合作用组,其NO、ET1及NO/ET1与对照组差异无统计学意义(P>0.05);在PD123319及Staurosporine分别与Ang Ⅱ的联合作用组,与对照组相比,NO降低,ET1升高而NO/ET1降低(P<0.05),见表3。提示AT1R可以阻断血管紧张素对内皮细胞的损伤,而AT2R不能(P<0.05);信号通路MAPK与ERK阻断剂能阻断其对内皮细胞的损伤,而PKC信号通路阻断剂不能阻断(P<0.05)。
表3 ATR受体阻断剂及某些信号通路阻断剂对血管紧张素作用的影响
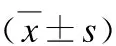
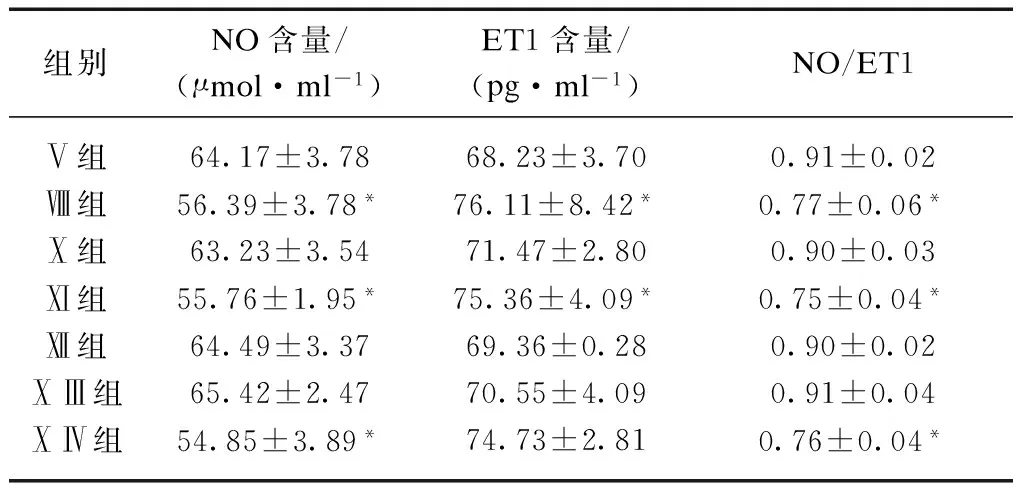
组别NO含量/(μmol·ml-1)ET1含量/(pg·ml-1)NO/ET1Ⅴ组64.17±3.7868.23±3.700.91±0.02Ⅷ组56.39±3.78*76.11±8.42*0.77±0.06*Ⅹ组63.23±3.5471.47±2.800.90±0.03Ⅺ组55.76±1.95*75.36±4.09*0.75±0.04*Ⅻ组64.49±3.3769.36±0.280.90±0.02ⅩⅢ组65.42±2.4770.55±4.090.91±0.04ⅩⅣ组54.85±3.89*74.73±2.810.76±0.04*
与对照组相比,*P<0.05
2.2 不同Ang Ⅱ刺激后内皮细胞RT-PCR结果
随着浓度的升高,Ang Ⅱ的刺激会导致eNOS降低、ET1升高和eNOS/ET1降低;而随着时间的延长,相同浓度的Ang Ⅱ刺激会导致eNOS进一步降低,ET1进一步升高和eNOS/ET1进一步降低。替米沙坦、SB203580和PD98059分别联合Ang Ⅱ刺激后,RT-PCR结果差异无统计学意义,PD123319和Staurosporine单独联合Ang Ⅱ刺激后,eNOS降低、ET1升高和eNOS/ET1降低,差异有统计学意义(P<0.05),见图2、表4~6。

图2 各组RT-PCR结果Fig.2 RT-PCR results in different groups
表4 不同浓度Ang Ⅱ对内皮细胞eNOS、ET1 mRNA 表达的影响
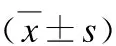

组别eNOS/actin值ET1/actin值eNOS/ET1值Ⅴ组0.81±0.070.77±0.061.05±0.07Ⅵ组0.76±0.070.79±0.040.97±0.06Ⅶ组0.74±0.060.81±0.030.91±0.06Ⅷ组0.69±0.05*0.87±0.06*0.79±0.06*Ⅸ组0.64±0.03*0.88±0.10*0.73±0.08*
与对照组相比,*P<0.05
表5 不同时间Ang Ⅱ对内皮细胞eNOS、ET1 mRNA表达的影响
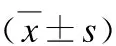
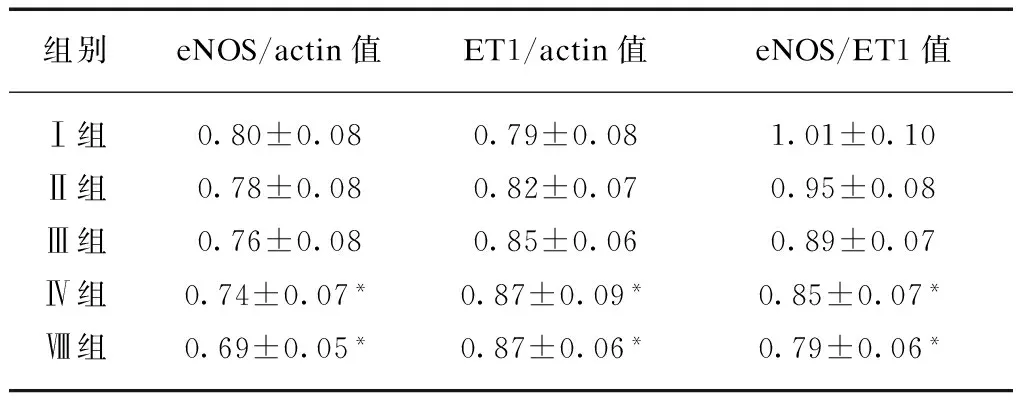
组别eNOS/actin值ET1/actin值eNOS/ET1值Ⅰ组0.80±0.080.79±0.081.01±0.10Ⅱ组0.78±0.080.82±0.070.95±0.08Ⅲ组0.76±0.080.85±0.060.89±0.07Ⅳ组0.74±0.07*0.87±0.09*0.85±0.07*Ⅷ组0.69±0.05*0.87±0.06*0.79±0.06*
与2h相比,*P<0.05
表6 ATR及不同信号通路阻断剂对Ang Ⅱ作用后的内皮细胞eNOS、ET1 mRNA表达的影响
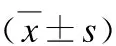
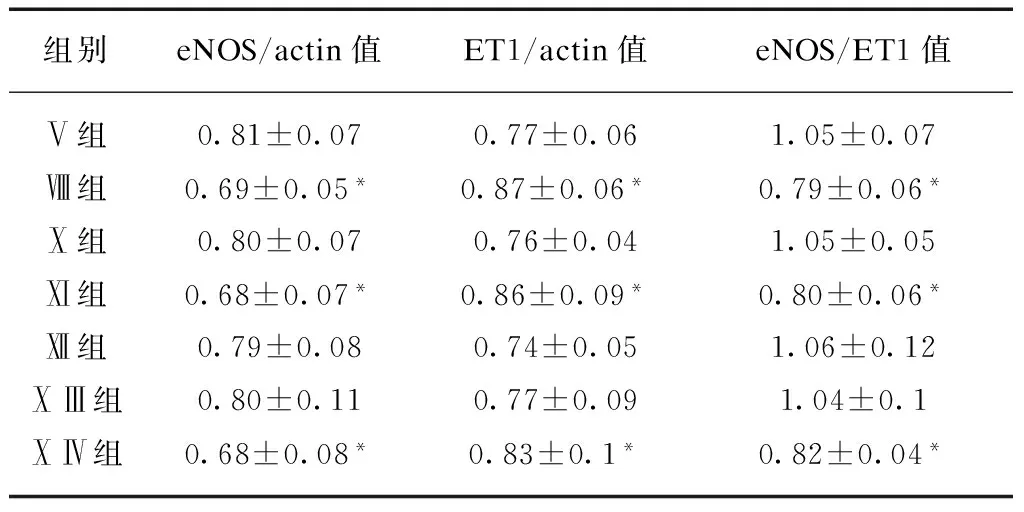
组别eNOS/actin值ET1/actin值eNOS/ET1值Ⅴ组0.81±0.070.77±0.061.05±0.07Ⅷ组0.69±0.05*0.87±0.06*0.79±0.06*Ⅹ组0.80±0.070.76±0.041.05±0.05Ⅺ组0.68±0.07*0.86±0.09*0.80±0.06*Ⅻ组0.79±0.080.74±0.051.06±0.12ⅩⅢ组0.80±0.110.77±0.091.04±0.1ⅩⅣ组0.68±0.08*0.83±0.1*0.82±0.04*
与24h相比,*P<0.05
3 讨 论
Ang Ⅱ是一种重要的血管收缩剂,可诱导醛固酮的分泌,保钠保水,增加循环血容量和维持正常血压。Ang Ⅱ不仅可以调节血压,还可以诱导重要的炎症反应和氧化应激,与动脉粥样硬化和急性冠脉综合征密切相关。
本研究结果显示,Ang Ⅱ可显著抑制HUVEC eNOS mRNA的表达,进而抑制NO的分泌。Ang Ⅱ对eNOS的抑制作用呈剂量依赖性,在生理浓度(1×10-9mol/L)时即对eNOS的表达有抑制作用,这种作用在1×10-6mol/L时最明显,但是在1×10-7mol/L时变化最为明显。另一方面,Ang Ⅱ还可显著上调ET1 mRNA水平,使ET1的蛋白水平相应增加。同样,这种作用也存在剂量依赖性。这两种作用的结果导致NO/ET1的平衡失调,显著降低。本研究与国内外大部分研究[2- 3]结果相似,但与个别研究[4]不一致,其认为Ang Ⅱ是通过AT2R增加内皮细胞NO的分泌。本研究与之不同之处在于,在研究[5]中,Ang Ⅱ作用时间较短,仅15min左右即观察结果,而本研究中,作用时间为2~24h,增加了实验的整体可靠性和准确性。在血管系统中,AT1R主要在血管平滑肌细胞表达,参与血管的收缩、增殖和促炎作用[5],在内皮细胞中诱导氧化LDL受体表达与活性氧的产生[6]。而AT2R的作用与AT1R相反,多表现为保护性作用。AT2R的作用时间较短,起效较快,而AT1R作用时间长,起效较慢。虽有研究认为Ang Ⅱ是通过AT2R增加内皮细胞NO的分泌,但由于本研究作用时间较长,Ang Ⅱ通过AT1R产生的活性氧物质增多抵消了通过AT2R产生的NO升高。且本研究阻断AT1R后,Ang Ⅱ诱导的NO降低作用消失也说明了这点。另一些研究也表明,AT1R阻断剂可改善内皮功能,这与本研究结果相一致,提示Ang Ⅱ受体阻断剂可改善内皮功能,也为沙坦类药物应用于冠心病患者奠定了基础。
国外研究[7-8]表明,AT1R是一个G蛋白耦联受体,能激活多种细胞内信号通路,如PKC、MAPK及酪蛋白激酶等发挥生理作用。MAPK信号通路能活化转录因子2、心肌增强因子2C及NF-κB等,促进细胞增殖、分化与凋亡,引起细胞功能的变化,发挥生物学效应[9]。本研究还表明,阻断MAPK的信号通路ERK1/2或p38MAPK后,Ang Ⅱ的作用则被抑制,而阻断PKC信号通路Ang Ⅱ的作用仍然存在,这提示Ang Ⅱ可能是通过MAPK信号通路发挥其降低eNOS和ET1分泌作用的。当然,这只是一个初步的结果,还需要进一步检测其内在的MAPK信号通路蛋白的表达量来证实。
本研究结果表明AT1R阻断剂替米沙坦能有效阻断Ang Ⅱ的作用,升高NO,降低ET1,并使eNOS的mRNA表达增加而ET1 mRNA表达降低,且阻断MAPK信号通路也能阻断Ang Ⅱ的效应。这些结果提示我们,替米沙坦能阻断Ang Ⅱ通路,改善内皮功能,是治疗冠心病的有效药物之一。
[1] Satoh M, Haruna Y, Fujimoto S,et al. Telmisartan improves endothelial dysfunction and renal autoregu-lation in Dahl salt-sensitive rats[J]. Hypertens Res, 2010,33(2): 135-142.
[2] Wong WT, Tian XY, Xu A, et al. Angiotensin Ⅱ type 1 receptor-dependent oxidative stress mediates endoth-elial dysfunction in type 2 diabetic mice[J]. Antioxid Redox Signal, 2010,13(6): 757-768.
[3] Yung LM, Wong WT, Tian XY,et al. Inhibition of renin-angiotensin system reverses endothelial dysfunc-tion and oxidative stress in estrogen deficient rats[J]. PLoS One, 2011,6(3): e17437.
[4] Yayama K, Hiyoshi H, Imazu D, et al. Angiotensin Ⅱ stimulates endothelial NO synthase phosphorylation in thoracic aorta of mice with abdominal aortic banding via type 2 receptor[J]. Hypertension, 2006,48(5): 958-964.
[5] Dandona P, Dhindsa S, Ghanim H, et al. Angiotensin Ⅱ and inflammation: the effect of angiotensin-converting enzyme inhibition and angiotensin Ⅱ receptor blockade[J].J Hum Hypertens, 2007,21(1): 20-27.
[6] Gryglewski RJ, Palmer RM, Moncada S. Superoxide anion is involved in the breakdown of endothelium-derived vascular relaxing factor[J].Nature, 1986,320(6061): 454-456.
[7] Mehta PK, Griendling KK. Angiotensin Ⅱ cell signa-ling: physiological and pathological effects in the cardiovascular system[J]. Am J Physiol Cell Physiol, 2007,292(1): C82-97.
[8] Xu L, Liu Y. Administration of telmisartan reduced systolic blood pressure and oxidative stress probably through the activation of PI3K/Akt/eNOS pathway and NO release in spontaneously hypertensive rats[J]. Physiol Res, 2013,62(4): 351-359.
[9] Kaminska B. MAPK signalling pathways as molecular targets for anti-inflammatory therapy—from molecular mechanisms to therapeutic benefits[J]. Biochim Biophys Acta, 2005,1754(1-2): 253-262.
Effects of angiotensin Ⅱ on secretion of NO and ET1 in cultured human umbilical vein endothelial cells
QIYuan,YAOYi-an
(Dept. of Cardiology, East Hospital, Tongji University, Shanghai 200120, China)
Objective To investigate the effects of angiotensin Ⅱ(Ang Ⅱ) on secretion of nitric oxide (NO) and endothelin 1(ET1) in cultured human umbilical vein endothelial cells (HUVECs) and the underlying mechanisms. Methods HUVECs were treated with Ang Ⅱ in different concentrations (1×10-9,1×10-8,1×10-7,1×10-6mol/L) or same concentration for different lengths of time (1×10-7mol/L for 2,6,12,18 and 24h), with or without Ang Ⅱ type 1 receptor (AT1R) blocker Telmisartan, Ang Ⅱ type 2 receptor (AT2R) blocker PD123319, or different kinase inhibitors PD98059(inhibitor of ERK1/2 MAP kinase), SB203580(inhibitor of ERK1/2 MAP kinase) and Staurosporine (phosphatidylinositol 3-kinase). Endothelin1(ET1) and NO in the medium were measured by ELISA and Griess reagent, respectively; and eNOS/ET1 mRNA expression was measured by RT-PCR. Results Ang Ⅱ up-regulated ET-1 protein level and down-regulated NO concentration, and decrease the NO/ET1 ratio in HUVECs in a dose-and time-dependent manner within 24h. Telmisartan, PD98059 and SB203580 blocked this effect, but PD123319 and Staurosporine had no blockage effect. Conclusion Ang Ⅱ can decrease the level of NO and increase the level of ET1, this effect were partly through AT1R and MAPK and Erk1/2 signal cell pathway.
angiotensin Ⅱ; endothelial cell function; cell signal pathway
10.16118/j.1008-0392.2015.01.006
2014-02-17
齐 元(1986—),女,硕士研究生.E-mail: qiyuanqifang929@126.com
姚义安.E-mail: yaoyian2004@126.com
R 543.5
A
1008-0392(2015)01-0024-05
