肌肽对大鼠脑片缺氧缺糖/再灌损伤的保护作用
2015-07-07方超李晴鲁美丽黄国兴杨菁
方超,李晴,鲁美丽,黄国兴,杨菁
(辽宁医学院 辽宁省心脑血管药物基础研究重点实验室,辽宁 锦州 12100)
肌肽对大鼠脑片缺氧缺糖/再灌损伤的保护作用
方超,李晴,鲁美丽,黄国兴,杨菁Δ
(辽宁医学院 辽宁省心脑血管药物基础研究重点实验室,辽宁 锦州 12100)
目的 在离体脑片缺氧缺糖/再灌损伤模型上,评价肌肽对脑组织的保护作用。方法 肌肽预处理后,用缺氧缺糖/再灌(oxygen glucose deprivation/reperfusion,OGD/RP)来制备大鼠离体脑片损伤模型。以2,3,5-三苯基氯化四氮唑(2,3,5-triphenyl tetrazolium chloride,TTC)染色法检测脑片活性;HPLC法检测海马脑片中ATP、ADP、AMP含量;荧光法检测脑组织活性氧(reactive oxygen species,ROS)。 结果 与对照组相比,缺氧缺糖/再灌损伤可以明显损伤大鼠海马脑片,TTC染色颜色变浅,A490 nm明显下降,ATP和ADP含量明显降低,而AMP含量明显升高,ROS明显升高,差异均具有统计学意义(P<0.01)。与模型组相比,缺氧缺糖/再灌损伤前预先加入1000、200、40 μg/mL肌肽预处理15 min可显著抑制缺氧缺糖/再灌引起的损伤,TTC染色颜色加深,A490 nm明显升高,ATP、ADP、AMP含量升高,ROS含量降低,差异均具有统计学意义(P<0.01)。结论 肌肽可减轻缺氧缺糖/再灌导致的损伤,其机制可能与其改善脑组织能量代谢,增强抗氧化能力有关。
肌肽;脑片;缺氧缺糖/再灌注损伤;能量代谢;氧化应激
脑缺血在临床上较多见,多发生于心脏呼吸骤停、重症休克等造成的脑部血流低灌注。随着急救水平的提高,抢救成功后继发脑缺血再灌成为研究重点。因此,筛选出具有相关疗效的药物已经成为21 世纪世界生命科学研究的热点之一[1]。
肌肽是一种由β-丙氨酸和L-组氨酸组成的水溶性二肽,主要存在于脊柱动物的骨骼肌中,在脑组织及心肌中含量也很高[2-3]。肌肽是目前为止发现的结构最为简单的生物活性肽之一,具有抗氧化、抗炎、清楚自由基、免疫调节等功能[4-5]。
本研究通过制备缺糖缺氧/再灌损伤大鼠海马组织模型,观察肌肽对脑片缺糖缺氧/再灌损伤的影响,探讨肌肽的保护作用及可能机制,为其治疗缺血性脑血管疾病提供实验依据。
1 材料与方法
1.1 材料
1.1.1 实验动物:雄性SD大鼠4只,体质量90~110 g,由辽宁医学院实验动物中心提供,动物合格证号:SCXK(辽)2011~2018。
1.1.2 试剂与药物:肌肽(纯度≥99%)、ATP、ADP、AMP、二甲基亚砜(DMSO)均购自Sigma公司;2,3,5-三苯基氯化四氮唑,分析纯,国药集团化学试剂有限公司;色谱甲醇购自天津四友精细化学品有限公司;其余试剂均为国产分析纯。
1.1.3 实验仪器:LC-10Avp高效液相色谱仪购自日本岛津公司。荧光酶标仪购自美国PerkinElmer公司。ZQP-86型振动切片机购自上海之信仪器有限公司。
1.2 方法
1.2.1 模型的制备及分组[6-7]:每次取SD大鼠2只,用颈部脱臼方法处死后,迅速取出海马,放入预冷的人工脑脊液(artificial cerebrospinal fluid,ACSF)中。将海马横切为350 μm脑片。迅速将脑片放到4 ℃并预先通以混合氧气(95%O2+5% CO2)的ACSF中恢复1 h。然后将脑片转移到培养瓶中,用预先通以混合氧气饱和的ACSF灌流,流速0.5 mL/min,温度(35.0±0.5) ℃。稳定30 min后将脑片进行随机分组,每组含12片脑片。对照组,继续用预先通以混合氧气饱和的ACSF灌流2 h45 min。模型组,继续用预先通以混合氧气饱和的ACSF灌流15 min后,再用预先通以混合氮气(95%N2+5%CO2)的无糖ACSF孵育30 min,随后恢复为混合氧气饱和的ACSF灌流2 h。肌肽保护组,分别用预先通以混合氧气饱和内含1000、200、40 μg/mL肌肽的ACSF灌流15 min,随后应用预先通以混合氮气(95%N2+5% CO2)的饱和内含1000、200、40 μg/mL肌肽的无糖ACSF孵育30 min,随后恢复为混合氧气饱和的ACSF灌流2 h。单纯肌肽组,用预先通以混合氧气饱和内含1000 μg/mL肌肽的ACSF灌流45 min,随后恢复为混合氧气饱和的ACSF灌流2 h。
ACSF的成分如下:NaCl:124 mmol/L;KCl:4.4 mmol/L;CaCl2:2.5 mmol/L; MgSO4:1.3 mmol/L;NaH2PO4:1 mmol/L; NaHCO3:26 mmol/L;葡萄糖:10 mmol/L[6]。
无糖ACSF的成分,将ACSF中的葡萄糖换成等摩尔浓度的蔗糖。
需按以上方法重复制备模型,模型结束后样品分别用于TTC染色、ATP、ADP和AMP含量及活性氧的检测。实验均重复一次。
1.2.2 检测指标
① TTC染色:每组取4片脑片,与1.5 mL 2% 2,3,5-三苯基氯化四氮唑(2,3,5-triphenyl tetrazolium chloride,TTC)溶液在 35 ℃条件下避光孵育30 min后,取出,生理盐水漂洗后拍照。然后再用滤纸吸去表面水分,称湿重后每个单独以每克脑片20 mL的比例加入抽提液(乙醇:二甲亚砜=1:1),避光24 h,按皮质脑片每孔200 μL,海马脑片每孔100 μL的量加入到96孔板,酶标仪测定各孔在490 nm处吸光度值(A490 nm)。损伤后脑片TTC染色的A490 nm值下降,按下列公式计算组织损伤百分率:组织损伤百分率=(1-A损伤/A对照) ×100%[8]。
② 海马组织ATP、ADP和AMP含量测定:每组取海马脑片4片,滤纸吸干后称重,加4 ℃预冷的0.4 mmol/L的高氯酸1 mL,于超声波细胞粉碎机中粉碎,制成匀浆。15000×g,4 ℃,离心30 min。取上清液,加入4 ℃预冷的2.0 mmol/L氢氧化钠溶液200 μL。混匀后,用0.45 μm微孔滤膜过滤,即为供试品溶液。采用Kromasil C18色谱柱(200 mm×4.6 mm,5 μm),柱温33 ℃。检测波长254 nm。流动相为100 mmol/L磷酸盐缓冲液,pH为6.5。进样 2 μL。采用外标法定量。
③ 脑组织活性氧ROS的检测:取海马脑片4片,按照每100 mg加入1 mL的组织匀浆液比例加入组织匀浆液, 用超声组织匀浆器在4 ℃,冰浴匀浆,12000×g 离心10 min取上清液, 用BCA试剂盒测定其蛋白浓度。取脑组织匀浆上清液190 μL,加入1 mmol/L DCFH-DA 探针10 μL, 同时用10 μL PBS代替探针的本底作为对照。混匀后37 ℃孵育30 min, 荧光酶标仪测定荧光值(激发波长484 nm,发射波长530 nm)。通过标准曲线计算出最终结果, 即pmol DCF formed/min/mg(protein)[9]。
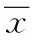
2 结果
2.1 肌肽对TTC法检测的缺氧缺糖/再灌脑片损伤程度的影响 从TTC染色的照片可以看出,对照组脑片被染成红色,而模型组颜色明显变浅,说明正常组脑片代谢正常,模型组的损伤程度明显。随着肌肽浓度的升高,肌肽保护组脑片的颜色加深,说明肌肽对缺氧再灌损伤具有保护作用。单纯肌肽组染色的程度略高于对照组。见图1。

图1 肌肽对海马脑片缺血缺氧/再灌损伤TTC染色的影响A:对照组; B:模型组;C:1000 μg/mL肌肽保护组;D:200 μg/mL肌肽保护组;E:40 μg/mL肌肽保护组;F:单纯肌肽组Fig.1 Effect of carnosine on the TTC staining of oxygen-glucose deprivation/reperfusion induced brain slicesA:Control group; B:Model group; C:1000 μg/mL carnosine protection group; D:200 μ g/mL carnosine protection group; E:40 μg/mL carnosine protection group; F:Simple carnosine group
从A490nm的吸光度值来看,模型组的吸光度值明显降低,缺氧再灌对脑片组织的损伤率为56%。肌肽保护组的组织损伤率明显降低(P<0.01)。单纯肌肽组吸光度比对照组的吸光度增加了6%。见表1。
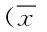
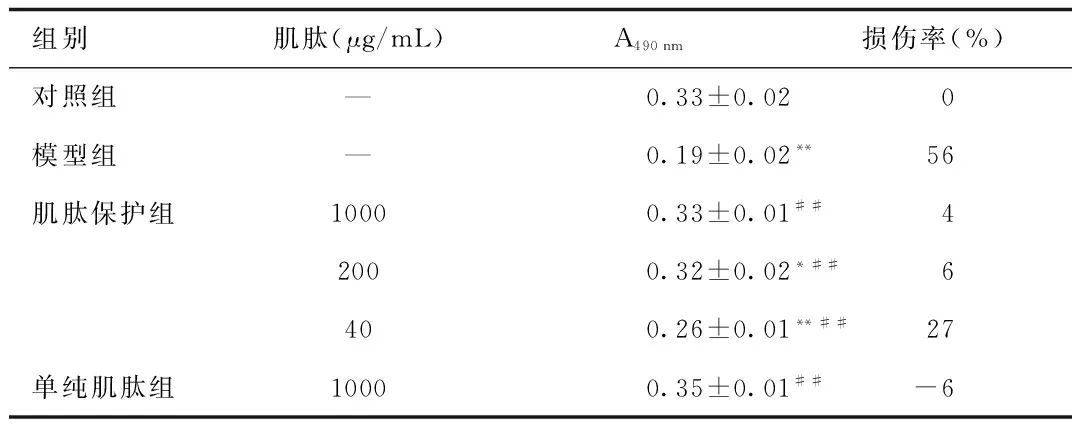
组别肌肽(μg/mL)A490nm损伤率(%)对照组—0.33±0.02 0模型组—0.19±0.02**56肌肽保护组10000.33±0.01##42000.32±0.02*##6400.26±0.01**##27单纯肌肽组10000.35±0.01##-6
**P<0.01, 与对照组相比,compared with control group;##P<0.01, 与模型组相比,compared with model group
2.2 肌肽对缺氧缺糖/再灌损伤海马脑片ATP、ADP和AMP含量的影响 与对照组相比较,模型组脑组织中ATP、ADP含量显著降低(P<0.01),而单纯肌肽组含量明显升高(P<0.01、P<0.05)。与模型组相比,肌肽保护组脑组织中ATP、ADP含量均明显升高(P<0.01),ATP、ADP含量随着肌肽剂量的增加而增加。与对照组相比较,模型组脑组织中AMP含量显著升高(P<0.01),单纯肌肽组含量变化不明显。与模型组相比,肌肽保护组脑组织中AMP含量均明显升高(P<0.01),AMP含量随着肌肽剂量的增加而增加。见表2。

表2 肌肽对缺氧缺糖/再灌损伤海马脑片ATP、ADP和AMP含量的影响Tab.2 Effects of carnosine on ATP,ADP and AMP content of OGD rat hippocampal slices ±s)
**P<0.01,与对照组比较,compared with control group;#P<0.05,##P<0.01,与模型组比较,compared with model group
2.3 肌肽对缺氧缺糖/再灌损伤海马脑片ROS含量的影响 与对照组相比,模型组脑组织ROS含量显著升高(P<0.01),单纯肌肽组组织ROS含量降低,但差异无统计学意义。与模型组相比,肌肽保护组ROS含量明显降低,随着肌肽含量的增加,ROS含量降低的更加明显。结果表明肌肽可以明显抑制脑组织ROS的产生。见表3。
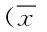
表3 肌肽对缺氧缺糖/再灌损伤海马脑片ROS含量的影响±s,n=8)Tab.3 Effects of carnosine on ROS content of OGD rat hippocampal slices ±s,n=8)
*P<0.05,**P<0.01,和对照组比较,compared with control group;#P<0.05,##P<0.01,与模型组相比,compared with injury group
3 讨论
由于离体脑片保持了脑组织形态学完整性,因此具有在体实验的特点,同时它又克服了在体实验,如血管或者其它整体系统,难于控制的缺点,因此越来越多地被用于脑功能和药物作用机制的研究[10]。TTC是无色的化合物,可以被细胞线粒体中的琥珀酸脱氢酶还原成红色的结晶产物,应用它来染色及提取后的比色测定已被有效的应用在检测脑片的损伤程度方面[11]。选择缺糖缺氧30 min,复氧2 h来制备脑片损伤模型,结果表明,和对照组相比,TTC的染色后模型组染色明显减轻,可见模型组损伤明显。和模型组相比,肌肽保护组脑片染色随着肌肽含量逐步升高,颜色逐渐加深,说明肌肽对缺糖缺氧再灌造成的损伤具有保护作用。在此基础上,对染色的脑片进行了有机提取,并测定提取液在490 nm的吸光度,结果表明,模型组脑组织损伤率为56%,而1000、200、40 μg/mL肌肽保护组的损伤率分别降低为4%、6%和27%,该结果和目测脑片的颜色结果相似,但结果更加量化。
能量代谢障碍是脑缺血损伤的基础。ATP和ADP均为高能磷酸化合物,为脑组织的主要能量来源。AMP为ADP和ATP的主要分解产物。肌肽可以降低培养的皮层星形胶质细胞氧气的消耗量,而在缺氧的情况下提高ATP的含量[12]。和对照组相比,模型组脑片组织ATP和ADP的含量显著降低,而AMP的含量明显升高。这些变化与缺氧缺糖有关,物质代谢的原料葡萄糖含量减少,代谢途径也由有氧氧化转换成糖酵解。和模型组相比,肌肽保护组的ATP、ADP和AMP的含量均明显升高,说明不同浓度的肌肽均可改善脑组织能量代谢,该结果和文献相似[11]。
氧化应激是指机体活性氧(reactive oxygen species,ROS)产生过多或清除能力,氧化系统和抗氧化系统失衡,从而导致潜在性损伤的病理过程。其中ROS 包括超氧阴离子、过氧化氢和羟自由基等。氧化应激损伤是脑缺血/再灌注损伤的重要原因[13]。ROS能与生物膜中不饱和脂肪酸形成过氧化脂质,引起细胞膜损伤。结果表明,与对照组相比,模型组ROS含量明显升高;而肌肽可以抑制缺血缺氧再灌引起的ROS的升高。
本实验结果表明,肌肽能够减轻缺氧缺糖/再灌所致大鼠海马脑片损伤,增强机体的抗氧化能力,从而改善脑组织的能量代谢,这可能是肌肽发挥保护的主要机制。本研究也为肌肽的进一步应用提供了重要的实验数据。
[1] Wang Y, Jia J,Ao G,et al. Hydrogen sulfide protects blood-brain barrier integrity following cerebral ischemia[J].J Neurochem,2014,129(5):827-838.
[2] Boldyrev AA, Aldini G, Derave W. Physiology and pathophysiology of carnosine[J].Physiol Rev,2013, 93(4):1803-1845.
[3] 杨菁,吴国强,白剑,等.邻苯二甲醛柱前衍生化高效液相色谱法测定组织中肌肽含量[J].中国生化药物杂,2009,30(4):258-260.
[4] Albayrak S, Atci IB, Kalayci M, et al. Effect of carnosine, methylprednisolone and their combined application on irisin levels in the plasma and brain of rats with acute spinal cord injury[J]. Neuropeptides, 2015,52(1):47-54.
[5] 李宗泽,杨清俊,朱艳凌,等. 肌肽对高糖诱导SH-SY5Y细胞凋亡的保护作用[J].中国药理学与毒理学杂志,2013,27(5):795-800.
[6] De La Cruz JP, Del Rio S, Arrebola MM, et al al.Effect of virgin olive oil plus acetylsalicylic acid on brain slices damage after hypoxia-reoxygenation in rats with type 1-like diabetes mellitus[J]. Neurosci Lett, 2010,471(2):89-93.
[7] Huang X, Li Q, Zhang Y, et al. Neuroprotective effects of cactus polysaccharide on oxygen and glucose deprivation induced damage in rat brain slices[J]. Cell Mol Neurobiol,2008,28(4):559-568.
[8] Yu BW,Xue QS,Xia M,et al. The influence of propofol on diferent kinds of brain injuries in rat brain slices[J].Natl Med J China,2003,83(10):1176-1179.
[9] Shinomol GK, Muralidhara. Differential induction of oxidative impairments in brain regions of male mice following subchronic consumption of Khesari dhal (Lathyrus sativus) and detoxified Khesari dhal [J]. Neurotoxicology, 2007, 28(4): 798-806.
[10] Taylor CP, Burke SP, Weber ML.Hippocampal slices: glutamate overflow and cellular damage from ischemia are reduced by sodium-channel blockade[J]. J Neurosci Methods,1995,59(1): 121-128.
[11] Preston E, Webster J. Spectrophotometric measurement of experimental brain injury[J].J Neurosci Methods, 2000, 94(2):187-192.
[12] Shen Y, Tian Y, Yang J, et al. Dual effects of carnosine on energy metabolism of cultured cortical astrocytes under normal and ischemic conditions[J]. Regul Pept, 2014,192-193:45-52.
[13] Candelario-Jalil E. Injury and repair mechanisms in ischemic stroke: considerations for the development of novel [J]. Curr Opin Investig Drugs, 2009,10(7): 644-654
(编校:谭玲)
Neuroprotective of carnosine on oxygen-glucose deprivation/reperfusion induced injury in rat brain slices
FANG Chao, LI Qing, LU Mei-li, HUANG Guo-xing, YANG JingΔ
(Provincial key laboratory of cardiovascular and cerebrovascular drug basic research, Liaoning Medical University, Jinzhou 121001, China)
ObjectiveTo investigate effect of carnosine on oxygen glucose deprivation/reperfusion (OGD/RP) induced injury in rat brain slices.MethodsInjury of brain slices was determined by TTC methods.The contents of ATP, ADP and AMP were determined by high performance liquid chromatography.Reactive Oxygen species (ROS) were determined by fluorescence methods.ResultsCompared with control group, rat hippocampal slices were significantly damaged by OGD/RP, indicated by light color and decreased A490 nmvalue of TTC staining.Meanwhile the contents of ATP and ADP were significantly decreased, and the content of AMP and ROS were significantly increased, the difference between two group was significant (P<0.01).Pre-incubation with Carnosine (1000, 200, 40 μg/mL) significantly inhibited the light color and decreased A490 nmvalue of TTC staining, increased the contents of ATP, ADP and AMP, and decreased the content of ROS, the difference between two group was significant (P<0.01).ConclusionCarnosine can protect rat hippocampal slices against injury induced by OGD/RP, which may relate to improve the energy metabolism and strengthen the ability of anti-oxidative stress.
carnosine; brain slices; OGD/RP ; energy metabolism; oxidative stress
辽宁省科技项目(2013225305);辽宁医学院“校长基金”奥鸿博泽基金医药创新基金(XZJJ20130103-01)
方超,男,学士,研究方向:生化药物,E-mail:fangchao.loving@qq.com;杨菁,通讯作者,男,博士后,教授,研究方向:神经生物学及相关药物,E-mail:jzyj126@126.com。
R963, R971
A
1005-1678(2015)09-0041-04
