回回甘松饮含药血清对高糖诱导的肾小球系膜细胞外基质堆积的影响
2015-07-07南一马丽杰袁玲
南一,马丽杰,袁玲
(1.宁夏医科大学 中医学院,宁夏 银川 750004;2.宁夏医科大学 回医药现代化省部共建教育部重点实验室,宁夏 银川 750004;3.宁夏医科大学 药学院,宁夏 银川 750004;4.宁夏回药现代化工程技术研究中心,宁夏 银川 750004;5.宁夏回医药协同创新中心,宁夏 银川 750004)
回回甘松饮含药血清对高糖诱导的肾小球系膜细胞外基质堆积的影响
南一1,2,马丽杰1,袁玲2,3,4,5Δ
(1.宁夏医科大学 中医学院,宁夏 银川 750004;2.宁夏医科大学 回医药现代化省部共建教育部重点实验室,宁夏 银川 750004;3.宁夏医科大学 药学院,宁夏 银川 750004;4.宁夏回药现代化工程技术研究中心,宁夏 银川 750004;5.宁夏回医药协同创新中心,宁夏 银川 750004)
目的 探讨回回甘松饮(Hui-hui Gan-song Yin,HGY)含药血清对高糖诱导的大鼠肾小球系膜细胞(mesangial cells,MCs)外基质堆积的影响。方法 健康雄性SD大鼠40只随机分为正常对照组(蒸馏水)、格列喹酮组(10 mg/kg)、HGY(5、10 g/kg)组,每组各10只,每天给药2次,连续3 d后制备含药血清用于体外培养大鼠MCs,分为正常对照组(10%正常对照组大鼠血清)、高糖组(30 mmol/L葡萄糖+10%正常大鼠血清)、格列喹酮组(30 mmol/L葡萄糖+10%格列喹酮组大鼠血清)、HGY高剂量组(30 mmol/L葡萄糖+10%HCY高剂量组大鼠血清)、HGY低剂量组(30 mmol/L葡萄糖+10%HCY低剂量组大鼠血清)。细胞培养结束后,采用Western blot方法检测纤维连接蛋白(fibronectin,FN)、Ⅰ型胶原蛋白(ColⅠ)及Ⅳ型胶原蛋白(ColⅣ)含量。结果 与空白对照组比较,高糖组FN、ColⅠ及ColⅣ表达量上调(P<0.01);HGY含药血清可降低在高糖诱导的MCs中FN、ColⅠ及ColⅣ表达量(P<0.05)。结论 HGY含药血清可降低MCs在高糖环境下的FN、ColⅠ及ColⅣ蛋白表达水平,从而减少了ECM堆积,保护肾小球,延缓糖尿病肾病进程。
回回甘松饮;肾小球系膜细胞;细胞外基质堆积;纤维连接蛋白;ColⅠ;ColⅣ
肾脏由固有细胞和细胞外基质构成,细胞外基质是支撑肾脏的基础,固有细胞是肾脏的功能构成。肾脏固有细胞包括:内皮细胞、上皮细胞、肾小球系膜细胞、肾小管上皮细胞和间质成纤维细胞,而肾小球系膜细胞(mesangial cells, MCs)能合成和分泌多种细胞外基质蛋白,对肾小球毛细血管网起到支撑作用,在肾小球中反应最活跃。糖尿病肾病(diabetic kidney disease,DKD)最早出现且最明显的变化就是MCs增生,细胞外基质增多,肾小球增大,从而出现肾小球高滤过现象[1]。
“回回甘松饮”(Hui-hui Gan-song Yin,HGY)是在回族医学典籍《回回药方》原方“甘松丸子”基础上,基于“四性学说”[2]理论,根据益禀补肾、化痰通络的治则,选用甘松、木香、茴香、丁香等13味药物组成的特色“香药”[3]方剂。前期研究已证实[4-6]:HGY对DKD大鼠的肾脏具有保护作用,并可使MCs细胞周期在高糖环境下发生G1/S期阻滞,抑制MCs细胞增殖。本实验通过血清药理学的方法,研究HGY含药血清对高糖诱导的MCs细胞外基质堆积的影响,探讨HGY在治疗DKD中的药理作用机制。
1 材料与方法
1.1 材料
1.1.1 动物:健康雄性Sprague-Dawley(SD)大鼠40只,6~7周龄,体质量180~200 g, SPF级,购自北京大学医学部实验动物科学部,许可证号:SCXK(京)2011-0012。实验期间大鼠自由摄食和饮水,严格遵循《实验动物保护条例》相关规定。
1.1.2 细胞株:大鼠肾小球系膜细胞株(HBZY-1)购于中国医学科学院基础医学研究所基础医学细胞中心,资源编号:3111C0001CCC000375。
1.1.3 药物与试剂:HGY(专利号:ZL201310205739.1)由甘松10 g、枸杞15 g、茴香12 g、木香9 g、丁香6 g、藿香3 g、松蕈5 g、菟丝子10 g、大黄5 g、芦荟8 g、人参15 g、肉苁蓉10 g、红花5 g组成。方中各药材经宁夏医科大学中医学院鉴定并按照原方配比,70%乙醇提取,石油醚萃取,大孔树脂富集分离、浓缩,用蒸馏水配制成实验所需生药浓度为0.5、1 g/mL的药液。格列喹酮(gliquidone),北京万辉双鹤药业有限责任公司生产,批号:1120536,临用前用蒸馏水配制成浓度为1 mg/mL药物溶液。MEM-EBSS培养基(美国,Gibco公司),胎牛血清(美国,Gibco公司),细胞培养瓶(板)(美国,Corning公司),纤维连接蛋白(fibronectin,FN)一抗(美国,Abcam公司),Ⅰ型及Ⅳ型胶原蛋白(ColⅠ、ColⅣ)一抗(美国,Abcam公司),山羊抗兔IgG(H+L)二抗(上海基因公司)。
1.1.4 仪器:SW-CJ-1FD型超净工作台(中国苏洁净化公司),5804R型超速低温冷冻离心机(德国Eppendorf公司),电泳仪(北京六一仪器厂),电泳槽(北京君意东方电泳设备有限公司)XP205分析天平(瑞士Mettler Toledo),CKX41型倒置相差显微镜(日本OLYMPUS公司),Allgre 21R高速冷冻离心机(美国Beckman公司),FlexStation-3多功能酶标仪(美国Molecular Devices公司)。
1.2 方法
1.2.1 含药血清的制备[7]:健康雄性SD大鼠40只,随机分为4组,即正常对照组、格列喹酮组(10 mg/kg)、HGY(5、10 g/kg)组各10只。HGY组和格列喹酮组大鼠每天分别按照相应剂量灌胃给药,正常对照组灌胃给予等体积的蒸馏水,每天给药2次,连续3 d,于末次给药1 h后股动脉取血,离心,取血清,56 ℃水浴30 min灭活补体,过滤除菌后,分装冻存于-20 ℃。
1.2.2 细胞培养:采用含10%胎牛血清的MEM-EBSS培养基,于37 ℃、5%CO2饱和湿度培养箱中常规培养。
1.2.3 实验分组:选取第3~8代细胞进行实验,共分为5组:①正常对照组(NG):给予10%正常对照组大鼠血清;②高糖组(HG):给予30 mmol/L葡萄糖+10%正常对照组大鼠血清;③格列喹酮组(HG+Gli):给予30 mmol/L葡萄糖+10%格列喹酮(10 mg/kg)组大鼠血清;④HGY-H组(HG+HGY):给予30 mmol/L葡萄糖+10%HGY(10 g/kg)组大鼠血清;⑤HGY-L组:30 mmol/L葡萄糖+10%HGY(5 g/kg)组大鼠血清。
1.2.4 药物干预:待生长至70%~80%细胞融合时,采用0.05%胰酶消化,制成细胞悬液,并常规进行细胞传代,于37 ℃、5%CO2恒温培养24 h后,吸取上清液,加入无胎牛血清的MEM-EBSS培养液,37 ℃、5%C02恒温培养24 h,使细胞同步于G0期;同步化后,将细胞分为上述5组,每组设置3孔重复,为减少实验误差,将制备的大鼠含药血清按组别富集合并,按照上述分组方法进行干预,干预过程中均采用只含有大鼠血清的MEM-EBSS培养基培养,在培养结束时取样本进行检测。
1.2.5 Western blot法检测FN、ColⅠ及ColⅣ蛋白表达的影响:提取各组细胞总蛋白,通过BCA法检测总蛋白含量后,以RIPA调整蛋白浓度,加入5×样品缓冲液后样品蛋白终浓度为2 mg/mL。煮沸变性5 min,进行10% SDS-PAGE胶电泳分离蛋白样本,细胞样品的上样量为10 μg/孔,电泳(浓缩胶恒压90 V,约20 min;分离胶恒压160 V,约80 min),后经转膜仪(恒流300 mA,2.5 h)转膜完成后丽春红染色试剂对膜进行染色,将膜在室温中封闭30 min。用3% BSA-TBST稀释FN(1:4000)、ColⅠ(1:5000)及ColⅣ(1:1000)一抗,于4 ℃孵育过夜,TBST洗膜5次,每次3 min。用5%脱脂奶粉-TBST稀释HRP标记的山羊抗兔IgG(H+L)二抗(1:20000),室温反应40 min。TBST洗膜6次,每次3 min。ECL加到膜上后反应3~5 min,胶片曝光10s~5 min(曝光时间随光强度调整),显影2 min,定影,进行胶片扫描。采用Bio-Rad图像分析系统扫描目的条带印迹,然后用Quantity One软件对内参条带的光密度值进行分析,目的蛋白表达量的改变用相对光密度进行检测,最后采用目的条带光密度值与内参条带光密度值的比值来计算蛋白的相对表达量。

2 结果
2.1 Western blot检测HGY对高糖诱导的MCs中FN蛋白表达的影响 Western blot检测结果表明,5组间MCs中FN蛋白表达水平差异有统计学意义(F=7.654,P<0.01)。与正常对照组(1.000±0.224)MCs比较,高糖组(2.506±0.357)MCs中FN蛋白表达水平显著升高(P<0.01);与高糖组比较,给予格列喹酮(1.959±0.362)含药血清干预后,MCs中FN蛋白的表达水平虽有所降低,但未见显著性差异;给予HGY高(1.585±0.251)、低剂量(1.599±0.478)含药血清干预后,FN蛋白的表达水平下降明显(P<0.01)。由此可知,HGY含药血清可以下调高糖诱导的MCs中FN蛋白表达水平,且HGY优于格列喹酮含药血清的作用。见图1。
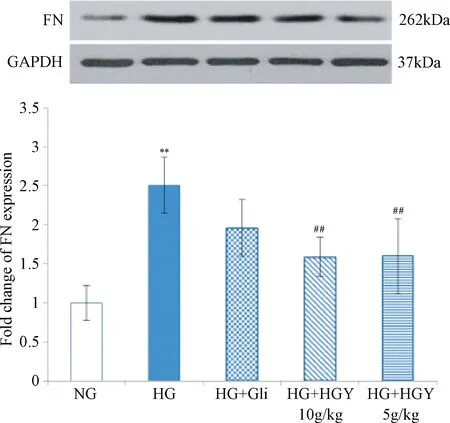
图1 HGY对高糖诱导的MCs中FN蛋白表达的影响**P<0.01,与NG组比较;##P<0.01,与HG组比较Fig.1 FN protein expressions in high glucose- induced MCs(±s,n=3)**P<0.01,compared with NG group;##P<0.01,compared with HG group
2.2 Western blot检测HGY对高糖诱导的MCs中ColⅠ蛋白表达的影响 Western blot检测结果表明,5组间MCs中ColⅠ蛋白表达水平差异有统计学意义(F=9.774,P<0.01)。与正常对照组(1.000±0.089)MCs比较,高糖组(2.141±0.302)MCs中ColⅠ蛋白表达水平显著升高(P<0.01);与高糖组比较,给予格列喹酮(1.650±0.225)含药血清干预后,MCs中ColⅠ蛋白的表达显著降低(P<0.01);给予HGY高(1.683±0.237)、低剂量(1.724±0.225)含药血清干预后,ColⅠ蛋白的表达亦显著降低(P<0.01)。由此可知,HGY含药血清可以下调高糖诱导的MCs中ColⅠ蛋白表达水平,且HGY与格列喹酮含药血清的作用相近。见图2。
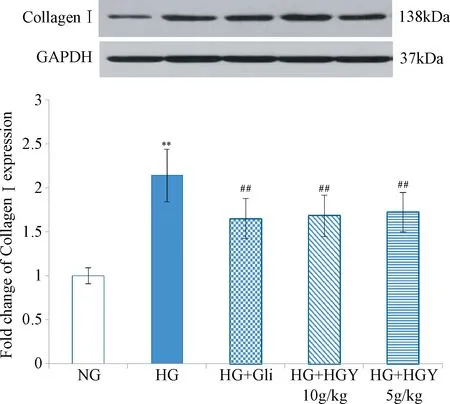
图2 HGY对高糖诱导的MCs中CollagenⅠ蛋白表达的影响**P<0.01,与NG组比较;##P<0.01,与HG组比较Fig.2 ColⅠ protein expressions in high glucose-induced MCs(±s,n=3)**P<0.01,compared with NG group; ##P<0.01,compared with HG group
2.3 Western blot检测HGY对高糖诱导的MCs中ColⅣ蛋白表达的影响 Western blot检测结果表明,5组间MCs中ColⅣ蛋白表达水平差异有统计学意义(F=16.128,P<0.01)。与正常对照组(0.999±0.209)MCs比较,高糖组(4.035±0.644)MCs中ColⅣ蛋白表达水平显著升高(P<0.01);与高糖组比较,给予格列喹酮(2.204±0.463)含药血清干预后,MCs中ColⅣ蛋白的表达显著降低(P<0.01);给予HGY高(2.322±0.478)、低剂量(2.790±0.466)含药血清干预后,ColⅣ蛋白的表达亦显著降低(P<0.01)。由此可知,HGY含药血清可以下调高糖诱导的MCs中ColⅣ蛋白表达水平,且HGY与格列喹酮含药血清的作用相近。见图3。

图3 HGY对高糖诱导的MCs中CollagenⅣ蛋白表达的影响**P<0.01,与NG组比较;##P<0.01,与HG组比较Fig.3 ColⅣ protein expressions in high glucose-induced MCs(±s,n=3)**P<0.01,compared with NG group;##P<0.01,compared with HG group
3 讨论
糖尿病肾病是指由糖尿病(diabetic mellitus,DM)引起的慢性肾脏疾病[8],DKD是DM的主要(重要)并发症之一,高血糖与DKD的发生、发展有着重要的联系,很多研究,如著名的“糖尿病干预和并发症研究”(epidemiology of diabetes interventions and complications,EDIC)、“糖尿病控制与并发症实验”(diabetes control and complications trial,DCCT)都证明了合理有效地控制高血糖的发生可以降低DKD并发症的危险系数[9-10]。DKD临床主要表现为糖尿病性肾小球硬化症,而肾小球硬化主要是由于肾小球细胞外基质(extracellular matrix,ECM)堆积所造成。因此,阻止或延缓DKD发生、发展进程最有效的途径就是减少ECM堆积[11]。
MCs是研究肾脏疾病发生发展机制的常用细胞模型[12-13],在DKD的病理改变中起到举足轻重的作用。MCs增殖是DKD发生、发展的病理基础,该细胞外的基质堆积严重影响着肾小球硬化的进程。高糖环境可以刺激MCs增殖,引起细胞外基质堆积。通过体外培养MCs进行研究,不仅可以探索DKD细胞生物学基础,还可为探讨相关的药理作用机制提供方便。因此,深入研究HGY对高糖条件下MCs的ECM堆积发生的药理作用机制,对防治DKD具有重要意义。
格列喹酮是WHO推荐的肾功能损害DM患者的首选药之一。格列喹酮的体内代谢产物95%不经肾脏排泄,是具有良好的保护肾脏的口服降糖药。其在降低血糖的同时,还可以减少肾脏组织中炎症反应的发生,减少尿蛋白生成,并能够改善肾小球基底膜及足细胞的损伤程度[14],其与HGY治疗DKD的药理作用基本一致,故在本研究中选用格列喹酮作为阳性对照药。
在生理状态下,肾组织借助降解酶系统而维持ECM降解的动态平衡;在病理状态下,一方面,ECM降解酶系统失衡以及相关调控机制紊乱,可导致肾小球ECM降解减少,形成肾小球硬化或肾纤维化;另一方面,即ECM的组成成分合成增加所致[15]。本实验研究主要从ECM合成增加这一角度考察细胞外基质堆积的机制。
细胞外基质蛋白是ECM的主要成分,主要包括纤维连接蛋白(fibronectin,FN)和胶原蛋白(collagen,Col)等。FN是一种糖蛋白,由肾小球固有细胞分泌,是构成细胞外基质的重要组成成分。正常情况下,FN以非可溶性形式,存在于细胞外基质中,与整合素结合影响细胞外基质的生理功能。DKD发生后,FN过度积聚在系膜区,可以加速肾小球硬化,被认为是加速肾纤维化及硬化的重要因素。由于在DKD的发生及发展过程中,FN含量的升高出现得早而明显,所以FN被认为是反映肾小球病变的客观指标[16]。胶原蛋白是一种纤维状的蛋白质,主要存在于细胞外基质和基底膜中,其中Ⅰ型胶原属于纤维形成胶原蛋白,Ⅳ型胶原蛋白为基底膜胶原蛋白,分布于肾小球和肾小管基底膜及系膜基质中。前期研究发现[6]:在高糖诱导条件下,MCs中Ⅰ型及Ⅳ型胶原蛋白的mRNA水平明显升高,此效应可能是多元醇通路活性增强、蛋白激酶C激活的结果。在高血糖条件下,葡萄糖可不依赖胰岛素调节进入细胞内,使细胞内葡萄糖浓度增高,从而激活醛糖还原酶,促使葡萄糖转变为山梨醇,在山梨醇氧化成果糖过程中,激活蛋白激酶C,而蛋白激酶C可使胶原蛋白合成增加[17]。所以,早期检测FN及Col能较好地判断ECM堆积情况,并能作为衡量肾小球硬化的重要指标。
在体外实验研究中发现:在高糖诱导的条件下,MCs中纤维连接蛋白及胶原蛋白的含量均增加(P<0.01);给药干预后,HGY含药血清能明显降低高糖诱导条件下的MCs中FN、ColⅠ及ColⅣ的蛋白表达量(P<0.01),且在调节FN、ColⅠ及ColⅣ的蛋白表达水平上,基本与格列喹酮含药血清的作用相当,这可能是其抑制细胞外基质堆积,保护肾小球的重要机制之一。ECM堆积可以是合成增加的结果,亦可以是降解减少的结果。HGY延缓DKD进程,保护肾脏的药理作用机制可能是抑制ECM的合成增加,亦有可能是促进ECM的降解,本研究的不足之处在于未检测高糖诱导条件下MCs中ECM降解酶系统的水平,当然这还需要进一步研究去证实。
综上所述,HGY可通过调节FN、ColⅠ及ColⅣ的蛋白表达水平,减少ECM堆积,从而减轻DKD肾小球硬化的程度,延缓DKD的发生发展进程,保护肾脏功能。
[1] Daroux M,Prevost G,Maillard-Lefebvre H,et al.Advanced glycation end-products: implications for diabetic and non-diabetic nephropathies[J].Diabetes Metab,2010,36(1):1-10.
[2] 袁玲,南一,牛阳.从“四性学说”谈“回回体质假说”的建立[J].宁夏医科大学学报,2010,69 (2):159-160.
[3] 南一,牛阳,郑海生,等.浅论回族医学的用药特色——“香药”[J].宁夏医科大学学报,2010,32(3):320.
[4] 袁玲, 南一, 徐俊, 等. 回回甘松饮对早期糖尿病肾病大鼠的肾脏保护作用[J]. 中国实验方剂学杂志,2014,20(3):109-113.
[5] 袁玲, 李静远, 黄秀兰. 回回甘松饮对糖尿病肾病大鼠肾脏保护作用的实验研究[J]. 北京中医药,2013,32(11):873-875.
[6] 袁玲, 南一, 吴宥熹, 等. 回回甘松饮含药血清对大鼠肾小球系膜细胞增殖、周期及FN,Col1α1,Col4α1基因表达的影响[J]. 中国实验方剂学杂志,2014,20(4): 135-140.
[7] 殷敏, 陈香美, 魏日胞, 等. 中药血清药理学在肾脏实验研究中的应用及展望[J]. 中国中西医结合肾病杂志, 2009,10(6):545-547.
[8] National Kidney Foundation.KDOQI clinical practice guidelines and clinical practice recommenddations for diabetes and chronic kidney disease[J].Am J Kidney Dis,2007,49(2 Suppl 2):S1-18.
[9] Nathan DM, Cleary PA, Backlund JY, et al. Intensive diabetes treatment and cardiovascular disease in patients with type 1 diabetes[J]. N Engl J Med Overseas Ed, 2005,353(25):2643-2653.
[10] The Diabetes Control and Complications Trial Research Group.The effect of intensive treatment of diabetes on the development and progression of long-term complications in insulin-dependent diabetes mellitus[J]. N Engl J Med Overseas Ed, 1993,329(14):977-986.
[11] Hu C, Sun L, Xiao L, et al. Insights into the Mechanisms Involved in the Expression and Regulation of Extracellular Matrix Proteins in Diabetic Nephropathy[J]. Curr Med Chem, 2015,22(24):2858-2870.
[12] Huang X, Su YX, Deng HC, et al. Suppression of mesangial cell proliferation and extracellular matrix production in streptozotocin-induced diabetic mice by adiponectin in vitro and in vivo[J]. HormMetab Res, 2014,46(10):736-743.
[13] 顾利青, 许英, 吕金宝. 芦丁对高糖模型大鼠肾小球系膜细胞的保护作用[J]. 中国药房, 2014,25(35):3278-3281.
[14] Ke JT, Li M, Xu SQ, et al. Gliquidone decreases urinary protein by promoting tubular reabsorption in diabetic Goto-Kakizakirats[J]. J Endocrinol,2014,220(2):129-141.
[15] Sen U, Pushpakumar S. Diabetic renal complications: a potential stinky remedy[J]. Am J Physiol Renal Physiol, 2015.DOI: 10.1152/ajprenal.00299.2015.
[16] Soldatos G,Cooper ME.Diabetic nephropathy:important pathophysiologic mechanisms[J].Diabetes Res Clin Pract,2008,82(Suppl1):S75-79.
[17] Gnudi L, Thomas SM, Viberti G. Mechanical forces in diabetic kidney disease: a trigger for impaired glucose metabolism[J]. J Am SocNephrol, 2007,18(8):2226-2232.
(编校:王俨俨)
Effects of Hui-hui Gan-song Yin on accumulation of extracellular matrix of glomerular mesangial cells induced by high glucose
NAN Yi1,2, MA LI-jie1, YUAN Ling2,3,4,5Δ
(1. School of Traditional Chinese Medicine, Ningxia Medical University, Yinchuan 750004, China; 2. Key Laboratory ofHui Medicine Modernization, Ministry of Education, Ningxia Medical University, Yinchuan 750004, China; 3. College of Pharmacy, Ningxia Medical University, Yinchuan 750004, China; 4. Ningxia Engineering and Technology Research Center of Hui Medicine Modernization,Yinchuan 750004, China; 5. Ningxia Collaborative Innovation Center of Hui Medicine, Yinchuan 750004, China)
ObjectiveTo investigate the effects of Hui-hui Gan-song Yin(HGY) on the accumulation of extracellular matrix of rat glomerular mesangial cells(MCs) induced by high glucose.MethodsThe 40 SD rats were randomly divided into normal control group(distilled water), glurenorm group(10 mg/kg), HGY high-dose group(10 g/kg) and HGY low-dose group(5 g/kg), 10 rats in each group. The rats in each group were treated with corresponding drugs, twice a day. After 3 days, the serum containing each drug were prepared to culture rat MCsinvitro. The MCs were divided into the normal control group(10% serum of rats in normal control group), high glucose group(30 mmol/L glucose+ 10% serum of rats in normal control group), glurenorm group(30 mmol/L glucose+ 10% serum of rats in glurenorm group), HGY high-dose group(30 mmol/L glucose+ 10% serum of rats in HGY high-dose group) and HGY low-dose group(30 mmol/L glucose+ 10% serum of rats in HGY low-dose group). The fibronectin(FN), ColⅠand ColⅣ levels were detected by Western blot.ResultsCompared with normal control group, the expression of FN, ColⅠand ColⅣ in high glucose group increased(P<0.01). The HCY suppressed the protein expression of FN, ColⅠand ColⅣ significantly(P<0.05).ConclusionThe serum containing HGY could suppressed protein expression of FN, ColⅠand ColⅣ and inhibit the accumulation of extracellular matrix of MCs induced by high glucose, which could protect glomerulus and delay the development of diabetic nephropathy.
Hui-hui Gan-song Yin; glomerular mesangial cell; accumulation of extracellular matrix; fibronectin;ColⅠ; ColⅣ
2012国家自然科学基金(No.81202774)
南一,男,博士,副教授,硕士生导师,研究方向:糖尿病及其并发症的中医药防治研究,E-mail:nanyiailing@sina.com;袁玲,通信作者,女,博士,讲师,研究方向:中药药理学研究,E-mail:nxykdx@qq.com。
R692.6
A
1005-1678(2015)11-0015-04
