吡嘧司特钾鼻喷剂的制备与质量控制研究
2015-07-07曲晓宇宋燕青赵宏伟张四喜
曲晓宇,宋燕青,赵宏伟,张四喜
(吉林大学第一医院 药学部,吉林 长春 130021)
吡嘧司特钾鼻喷剂的制备与质量控制研究
曲晓宇,宋燕青,赵宏伟,张四喜Δ
(吉林大学第一医院 药学部,吉林 长春 130021)
目的 本文制备适应症为过敏性鼻炎的吡嘧司特钾鼻喷剂并制定制剂的质量控制标准。方法 根据吡嘧司特钾的理化性质以及鼻腔给药特点优化处方组成,并根据《中国药典》2010年版二部附录中对鼻用制剂及喷雾剂的要求,对制剂pH、性状、装量、每瓶总喷次、每喷喷量、沉降体积比及含量测定方法等进行考察,制定质量控制标准。结果 吡嘧司特钾鼻喷剂的处方为:0.1%吡嘧司特钾,0.8%羧甲基纤维素钠,0.01%苯扎溴铵,pH调节剂为冰醋酸,溶剂为5%甘露醇溶液。该制剂为白色混悬液,pH值为7.0。平均装量为(25.12±0.16)mL,各瓶装量均大于23.75 mL(95%);各瓶总喷次均大于160喷,每喷喷量均大于0.1400 g/揿;沉降体积比为1,以上检测项目等均符合规定,质量可控。吡嘧司特钾对照品的标准曲线为Y=81 085X+15 264,r=0.999 8,线性范围为0.5~25.0 μg/mL。吡嘧司特钾对照品的鼻喷剂样品平均回收率为99.39%、精密度符合要求。吡嘧司特钾鼻喷剂供试品中吡嘧司特钾的含量为标示量的99.2%。结论 本文制备得到的制剂制备方法简单,稳定性好,使用方便,质量可控,为进一步开发该药的鼻腔局部给药制剂提供了研究基础。
吡嘧司特钾;鼻喷剂;制备;质量控制
吡嘧司特钾为肥大细胞稳定剂,能够抑制Ⅰ型变态反应介导的过敏反应,本品可抑制人肥大细胞发生反应引起的炎性介质和嗜酸细胞介质释放的作用[1-2]。目前吡嘧司特钾上市剂型包括治疗过敏性结膜炎的滴眼剂与治疗过敏性鼻炎、哮喘的口服制剂。目前对于过敏性鼻炎的治疗以局部喷鼻最为流行,因此本研究拟将吡嘧司特钾开发为鼻喷剂以治疗过敏性鼻炎,该制剂能够使药物立即抵达过敏部位从而快速发挥疗效,并且能够避免口服给药血药浓度个体差异大、起效慢、增加副作用等缺点[3]。本文对吡嘧司特钾鼻喷剂的处方组成进行考察,并制定制剂的质量控制标准,为进一步开发吡嘧司特钾鼻用制剂提供实践依据。
1 材料与方法
1.1 药品与试剂 吡嘧司特钾原料药(鲁南贝特制药有限公司,批号:140101);吡嘧司特钾对照品(经HPLC检测,其纯度为99.9%);20%甘露醇注射液(吉林康乃尔药业有限公司,批号:S13082107-1);羧甲基纤维素钠(国药集团化学试剂有限公司,批号:F20041213);1%苯扎溴铵溶液(山东利尔康医疗科技有限公司,批号:141022R);冰醋酸(广东省台山市新宁制药有限公司,批号:20100115),以上材料均为分析纯。甲醇(美国TEDIA公司)为色谱纯。
1.2 仪器 FA2004电子天平(上海舜宇恒平仪器公司,200 g/0.1mg);Shimadzu 16-A型高效液相色谱仪(日本岛津公司);PHS-25C数显酸度计(上海宇隆仪器有限公司);30 mL象鼻式喷瓶(吉林大学第一医院制剂室)。
1.3 方法
1.3.1 喷鼻器的选择:本文采用30 mL象鼻式喷瓶为药物容器与使用器具(如图1),象鼻式喷瓶可将喷口伸入鼻腔中,药品直达患处,减少药物的损失,并且喷瓶易于装卸,清洗方便,具有帽盖,减少污染。

图1 30 mL象鼻式喷瓶Fig.1 The 30mL trunk type spray bottle
1.3.2 处方的制定:本处方中将主药吡嘧司特钾浓度拟定为0.1%(w/v),与吡嘧司特钾滴眼剂的使用浓度相同,在此浓度下能够有效的发挥疗效。抑菌剂选择为苯扎溴按,浓度拟定为0.01%[4]。渗透压调节剂确定为甘露醇,为与鼻黏膜细胞渗透压相等,采用5%甘露醇作为溶剂[5]。pH调节剂确定为冰醋酸。本文采用羧甲基纤维素钠(CMC-Na)作为增粘剂并重点考察其用量。经查阅文献可知,CMC-Na为鼻喷制剂处方中常用的增粘剂,其具有增粘效果良好、毒性小等优点,对于混悬液尚具有助悬作用,故本处方采用羧甲基纤维素钠作为增粘剂[6]。
1.3.3 制备流程:配制5%的甘露醇溶液,取1%苯扎溴按溶液1 mL、吡嘧司特钾原料药0.1g,加入处方量的CMC-Na(待考察)后加5%甘露醇溶液至100 mL,在室温下静置6 h,最后以冰醋酸调节pH至7.0即可,最后将25 mL药液灌装与象鼻式喷瓶中,即得吡嘧司特钾鼻喷剂。
1.3.4 增粘剂用量的考察:增粘剂可以增加药物在鼻粘膜的滞留时间,减少药液因流出而造成的损伤,从而更好地发挥药效,而增粘剂用量过大可显著增加药物黏度,易造成堵塞喷嘴、每喷喷量不稳定等问题,因此,本研究重点考察增粘剂用量,以获得最佳用量。
按照吡嘧司特钾鼻喷剂的制备工艺方法,分别制备含增粘剂羧甲基纤维素钠0.3%、0.4%、0.5%、0.6%、0.7%、0.8%、0.9%、1.0%浓度的供试品溶液,对0.3%~1%浓度的羟丙甲基纤维素钠供试品溶液进行每喷喷量测定,考察其每喷喷量的均匀度,通过计算数据得出不同浓度下的平均每喷喷量、相对标准偏差(RSD%)。
1.3.5 质量控制研究
① 性状:将本品倾注于洁净的透明玻璃容器中观察其性状。
② pH值:按《中国药典》2010年版二部附录中有关pH的测定方法[7]检测样品溶液。
③ 装量检查:按《中国药典》2010年版二部附录中对装量的检查要求[7],取供试品6瓶,开启时避免损失,将内容物转移至预经标化的干燥量入式量筒中(量具的大小应使待测体积至少占其额定体积的40%),读出每个容器内容物的装量,要求平均装量不得少于25 mL,每瓶装量不得少于标示量的95%,即不少于23.75 mL。
④ 每瓶总喷次:按《中国药典》2010年版二部附录中对每瓶总喷次的检查要求[7],取供试品4瓶,除去帽盖,充分振摇,在通风橱内,分别按压阀门连续喷射于已加入适量吸收液的容器内,每次喷射间隔不少于5 s并充分振摇,直至喷尽为止,分别计算喷射次数,要求每瓶总喷次均不得少于160喷。
⑤ 每喷喷量:按《中国药典》2010年版二部附录中喷射实验的检查要求[7],取本品供试品4瓶,除去帽盖,分别揿压试喷数次后,擦净,揿压喷射5次,擦净,分别精密称定,重复实验3次,计算每瓶每揿平均喷射量不得小于标示量。本品每喷喷量应不得小于0.140 0 g/揿。
⑥ 沉降体积比:按《中国药典》2010年版二部附录中沉降体积比的检查要求[7],用具塞量筒量取吡嘧司特钾供试品30 mL,塞好瓶塞,上下用力振摇1 min,记录混悬液的初始高度H0,静置3 h记录供试品的高度H,计算沉降体积比=H/H0,按要求,鼻腔喷雾剂沉降体积比不得小于0.9。
1.3.6 含量测定
① 色谱条件:色谱柱:Thermo公司,Hypersil GOLD ODS-C18(250 mm×4.6 mm,5 μm);流动相:甲醇:水(50:50);柱温:室温;检测波长:357 nm;流速:1.0 mL/min;进样量:20 μL。
② 线性范围:精密称取吡嘧司特钾对照品适量,加蒸馏水溶解并稀释成0.05 mg/mL的溶液作为储备液。精密量取储备液0.1、0.5、1.0、2.5、5.0 mL分别置于10 mL容量瓶中,加水稀释至刻度,摇匀。在上述色谱条件下,进样并记录色谱图。以吡嘧司特钾浓度为横坐标,峰面积为纵坐标,进行线性回归。
③ 加样回收率:加入处方量的各辅料,分别制备含高(120%)、中(100%)、低(80%) 3种浓度吡嘧司特钾对照品的鼻喷剂样品,各浓度的对照品分别称取3份,按⑤项下操作,计算平均回收率。
④ 精密度:分别取③项下的样品,每个样品在同一日进样5次测定日内精密度,每个样品在5个工作日内每日进样1次测定日间精密度。
⑤ 供试品含量测定:精密量取吡嘧司特钾鼻喷剂溶液适量,加蒸馏水稀释为5.0 μg/mL的溶液,摇匀,过滤,得到吡嘧司特钾供试品溶液。另取吡嘧司特钾对照品加蒸馏水溶解并稀释成5.0 μg/mL的对照品溶液。分别取对照品溶液和供试品溶液各20 μL注入高效液相色谱仪,得到峰面积图像。
2 结果
2.1 不同浓度增粘剂对每喷喷量的影响 增粘剂浓度在0.3%~0.8%时,每喷喷量的RSD%值均在2%以下,当增粘剂浓度大于等于0.9%时,每喷喷量的RSD%值显著增大,因此将增粘剂CMC-Na的浓度确定为0.8%,在此浓度下能够使鼻喷剂每喷喷量稳定且黏度最大。见图2。
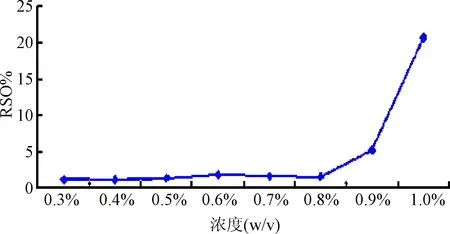
图2 含不同浓度羧甲基纤维素钠的样品每喷喷量均匀度检查结果Fig.2 Investigation of spray amount uniformity with different concentrations of CMC-Na
2.2 质量控制研究
2.2.1 性状及pH值:本品为白色混悬溶液,pH值为7.0。
2.2.2 装量检查:平均装量为(25.12±0.16) mL,6瓶装量分别为标示量的25.0(100 %)、25.0(100 %)、25.2(100.8 %)、 25.0(100%)、 25.4(101.6 %)、 25.1 mL(100.4 %),均大于23.75 mL(95%),符合质控标准要求。
2.2.3 每瓶总喷次:4瓶总喷次分别为 163、162、164、162喷,均大于160喷,符合质控标准要求。
2.2.4 每喷喷量:4瓶检测3次的每喷喷量分别为(0.144±0.002)、(0.143±0.003)、(0.145±0.003)、(0.144±0.003)g/揿,均大于0.1400 g/揿,符合质控标准要求。
2.2.5 沉积体积比:经测定,本吡嘧司特钾鼻喷剂的沉降体积比为1,符合质控标准要求。
2.3 含量测定
2.3.1 吡嘧司特钾的回归方程为:Y=810 85X+152 64,r=0.999 8,说明吡嘧司特钾在0.5~25.0 μg/mL浓度范围内,峰面积(A)与浓度(C)的线性关系良好,见图3。
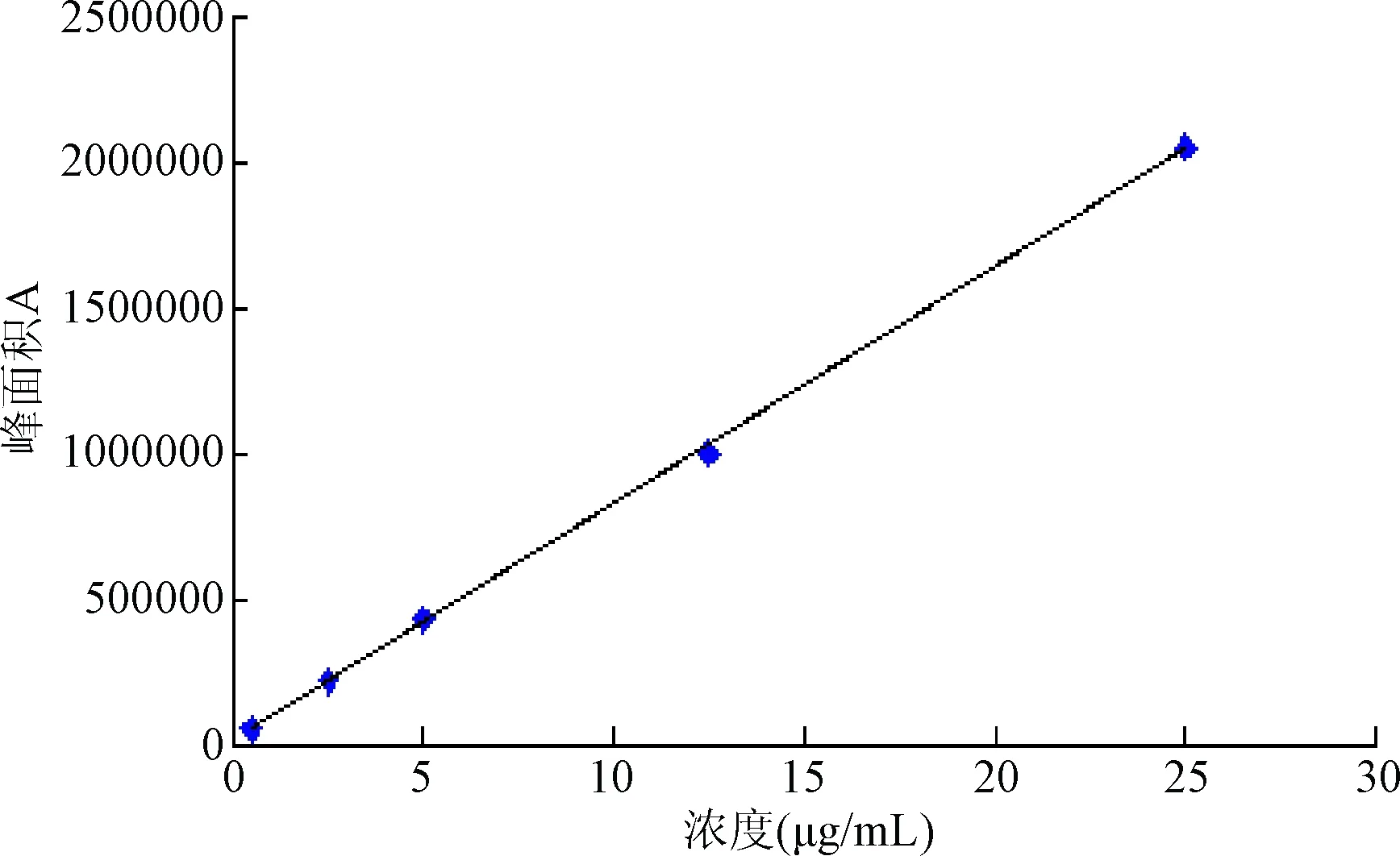
图3 吡嘧司特钾对照品工作曲线Fig.3 Work linear chart of series content of pemirolast potassium
2.3.2 加样回收率及精密度检测结果:高(120%)、中(100%)、低(80%) 3种浓度吡嘧司特钾对照品的鼻喷剂样品平均回收率为99.39%,精密度均符合要求。见表1。

表1 吡嘧司特钾鼻喷剂的回收率与精密度测定Tab.1 Data of recovery test and precision test for pemirolast potassium nasal spray
2.3.3 供试品含量测定:供试品高效液相色谱图见图4,按照外标法计算供试品溶液中吡嘧司特钾的含量。经检测,吡嘧司特钾鼻喷剂供试品中吡嘧司特钾的含量为标示量的99.2%。

图4 吡嘧司特钾供试品(A)与对照品液相色谱图(B)Fig.4 HPLC chart of pemirolast potassium nasal spray sample (A) and pemirolast potassium control solution (B)
3 讨论
过敏性鼻炎的发生主要是由于鼻腔粘膜Th2免疫反应失调引起,这种鼻腔粘膜的异常免疫所引的过敏反应表现出鼻痒、流鼻涕、鼻塞、打喷嚏等鼻炎症状,严重影响患者的生活质量[8]。鼻腔内局部用药治疗过敏性鼻炎等疾病时,可以减少药物剂量且具有起效迅速的优点,局部应用即可控制鼻腔局部的变态反应,避免了长期口服给药产生的副作用,因此鼻腔给药用于治疗鼻腔、鼻窦内疾病日益受到关注。本研究考察了Ⅰ型变态反应抑制剂吡嘧司特钾的鼻喷剂的处方组成并且制定了相应的质量标准,重点考察了增粘剂的使用比例,使药物能够产生最大黏性而又稳定喷射,并且制得的混悬液性状稳定。局部应用治疗过敏性结膜炎的吡嘧司特钾滴眼剂经临床多年应用证明疗效确切,吡嘧司特钾口服制剂对过敏性鼻炎的临床疗效也得到证明[9],而目前该药治疗过敏性鼻炎只有口服给药途径,因此,本研究为进一步开发吡嘧司特钾的鼻用制剂提供了研究基础。
[1] 徐勤娥,林子萍,李泽卿.两种剂量的吡嘧司特钾片临床研究报告[J].中国临床药理学与治疗学,2007,12(4):465-469.
[2] 苏梅,蒋敏.特异性Ⅰ型变态反应抑制剂吡嘧司特钾[J].中国新药杂志,2009,18(22):2099-2111.
[3] 王东兴,高永良.鼻腔给药新剂型研究进展[J].中国新药杂志,2002,11(8):589-592.
[4] 梁光江,王彦东.滴眼剂中几种常用抑菌剂的兔眼刺激性实验[J].中国药房,2010,21(21):1963-1966.
[5] 刘宏娟,刘德华,钟建江.不同渗透压调节剂对Candida krusei生理代谢的影响[J].微生物学通报,2005,32(6):35-38.
[6] 袁华,虞秋燕.丙酸氟替卡松鼻喷剂处方工艺研究[J].中国卫生产业,2012,9(16):29-30.
[7] 国家药典委员会.中华人民共和国药典二部[M].北京:中国医药科技出版社,2010:附录44,附录13,附录14,附录17.
[8] 孙小青,殷敏,程雷.鼻内糖皮质激素在过敏性鼻炎治疗中的合理应用[J].中华临床免疫和变态反应杂志,2010,4(3):216-220.
[9] 邓智建,曹冬梅,卢振民.吡嘧司特钾片治疗过敏性鼻炎疗效观察[J].中国药师,2010,13(7):1008-1009.
(编校:王俨俨)
Preparation and quality control of pemirolast potassium nasal spray
QU Xiao-yu, SONG Yan-qing, ZHAO Hong-wei, ZHANG Si-xiΔ
(Department of Pharmacy, The First Hospital of Jilin University, Changchun 130021, China)
ObjectiveTo prepare pemirolast potassium nasal spray which could be used in treatment of allergic rhinitis and make a quality control standard for the preparation.MethodsThe preparation materials of nasal spray was selected which could meet the physical and chemical properties of pemirolast potassium as well as the characteristics of intranasal administration.The quality control standards for pemirolast potassium nasal spray was made according to the nasal spray quality standards for the formulation pH, property, loading capacity, total bottle spray times, puff volume, sedimentation volume ratio and detection of content of “Chinese Pharmacopoeia” two section (2010 edition).ResultsThe formulation prescription of pemirolast potassium nasal spray was: 0.1% potassium pemirolast, 0.8% CMC-Na, 0.01% benzalkonium bromide, glacial acetic acid (pH adjusting agent) and the solution was 5% mannitol.The formulation was a white suspension, pH=7.The mean value of installed capacity was (25.12±0.16) mL and installed capacity of each bottle was above 23.75 mL(95%); total spray times of each bottle was above 160 sprays and spray volume was above 0.140 0 g/press; sedimentation volume ratio was 1, the above testing programmes of quality standard met the requirements and were controlled.The standard curve of pemirolast potassium reference substance wasY=81085X+15264(r=0.999 8), linearity range was 0.5~25.0 μg/mL.The average recovery rate of pemirolast potassium sample was 99.39%, and precision met the requirements.The pemirolast potassium content of test sample was 99.2% of labeled amount.ConclusionThe formulation prescription of pemirolast potassium nasal spray is suitable and the preparation is possessed several advantages such as stability, well-distributed spray, application convenience and quality controlled.Therefore, nasal administrated formulation of pemirolast potassium is potentially in further.
pemirolast potassium; nasal spray; preparation; quality control
曲晓宇,男,硕士,主管药师,研究方向:药物制剂学,E-mail:quxiaoyuhaha@163.com;张四喜,通讯作者,男,硕士,主管药师,研究方向:医院药学,E-mail:zhsixi@163.com。
R927.2
A
1005-1678(2015)06-0154-03
