维生素B4片溶出度方法学研究
2015-07-07林燕琼李彩霞林惠武
林燕琼,李彩霞,林惠武
(1.厦门大学附属第一医院 药学部, 福建 厦门 361003;2.厦门大学附属第一医院思明分院 药学部,福建 厦门 361000)
维生素B4片溶出度方法学研究
林燕琼1,李彩霞1,林惠武2Δ
(1.厦门大学附属第一医院 药学部, 福建 厦门 361003;2.厦门大学附属第一医院思明分院 药学部,福建 厦门 361000)
目的 建立维生素B4片溶出度检测方法。方法 采用桨法,以900 mL pH6.8磷酸盐缓冲溶液为溶出介质,温度37.0 ℃,转速为50 r/min,选取时间为45 min,经0.45 μm微孔滤膜过滤,取续滤液,采用紫外分光光度法测定维生素B4片的溶出量,检测波长为262 nm,溶出限度为标示量的80%。结果 维生素B4浓度在4~16 μg/mL范围内与吸光度呈良好的线性关系,r=0.9999(n=5),平均回收率为100.1%,RSD=1.0%(n=9)。结论 该方法简便、灵敏、准确,对不同生产企业的处方、工艺有一定考察作用,可用于维生素B4片的溶出度测定。
维生素B4片;溶出度;紫外分光光度法
维生素B4片又名磷酸氨基嘌呤,可以作为RNA和DNA的组成物质应用于蛋白质生物合成的过程中,主要用于预防治疗各种原因引起的白细胞减少症、急性粒细胞减少症[1]。其为高溶解性、高渗透性药物,分子结构式见图1。

图1 维生素B4片结构式Fig.1 Vitamin B4 structural formula
其生物药剂分类系统属于BCSⅠ类药物[3]。对于BCSⅠ类药物制剂,以0.1 mol/L盐酸溶液为介质,在适当的溶出度试验条件下,15 min的溶出量大于85%时,可认为药物的生物利用度不受溶出行为的控制,即制剂的行为与溶液相似。在这种情况下,胃排空速度是药物吸收的限速步骤。如果药物溶出比胃排空时间慢,需要在多种介质中测定溶出曲线,在禁食状态下,胃内滞留(排空)T50%时间为15~20 min。该品种为2015年版《中国药典》标准提高品种,原标准只采用崩解时限检查[2],无法考察不同生产企业的处方、工艺的优劣,本文根据其生物学及药剂学特性,通过对其溶出度特性的研究,建立了溶出度检测方法。
1 材料与方法
1.1 药品与试剂 维生素B4片原料药(货号3507,天津市天厂家);维生素B4片购自5家生产企业,各3批,货号分别为:生产企业A(3501~3503)、B(3504~3506)、C(3508~3510)、D(3517~3519)、E(3541~3543);其他试剂均为分析纯。
1.2 仪器 RCZ-8M溶出试验仪(购自大天发科技有限公司),UV-2600紫外可见分光光度计(购自日本岛津公司),METTLER TOLODO SG2型酸度计(购自德国梅勒特公司)。
1.3 方法 分别选用0.1 mol/L盐酸溶液(取9 mL浓盐酸加蒸馏水稀释至1000 mL)、pH 4.5的醋酸盐缓冲溶液(取醋酸钠(三水合物)2.99 g加水溶解,加入2 mol/L醋酸溶液14.0 mL,加水稀释至1000 mL)、pH 6.8的磷酸盐缓冲溶液(取0.2 mol/L磷酸二氢钾溶液250 mL,加0.2 mol/L氢氧化钠溶液118 mL,用水稀释至1000 mL)和水(脱气)4种溶出介质[4],转速50 r/min,温度37.0 ℃的条件下,取样时间分别为5、15、30、45、60、75 min取样,取样5 mL,同时相应地补充溶液5 mL,照紫外分光光度法在(262±2)nm下测定吸光度[5],另取维生素B4原料药适量,用相应的溶出介质溶解并稀释为11 μg/mL的磷酸腺嘌呤溶液,作为对照溶液。
1.4 溶解度及稳定性研究 取磷酸腺嘌呤(维生素B4)原料药各约1 g,用4种溶出介质溶解并稀释至25 mL,并置37.0 ℃的水浴中1 h,并不断振摇制成过饱和溶液。再取原料药11 mg,用相应的溶出介质溶解并稀释为每1 mL含11 μg的磷酸腺嘌呤溶液,作为对照溶液,测定并计算过饱和溶液的溶解量,即为该物质的在溶出介质中的溶解度。
1.5 溶出曲线测定 取A厂家3501批、B厂家3504批、C厂家3508批、D厂家3517批、E厂家3541批样品各6片,分别于上述4种溶出介质中按照1.3项下的方法测定。
1.6 建立的溶出方法 取本品,按照溶出度测定法(中国药典2010年版二部附录ⅩC 第二法)[5],以磷酸盐缓冲溶液(pH 6.8)900 mL为溶出介质,转速为50 r/min,依法操作,经45 min时,取溶液适量,滤过,精密量取续滤液适量,用溶出介质定量稀释制成约含11 μg/mL的溶液,照紫外-可见分光光度法(中国药典2010年版二部附录Ⅳ A)[6],在262 nm波长处分别测定吸光度;另取本品10片,精密称定,研细,精密称取适量(相当于平均片重),用溶出介质定量稀释制成约含11 μg/mL的溶液,滤过,取续滤液,同法测定,计算每片的溶出量。限度为80.0%。
1.7 方法学验证[7]
1.7.1 辅料干扰:通过将淀粉、糊精、微晶纤维素、硬脂酸镁、羧甲淀粉钠、蔗糖按不同比例混合制备混合辅料,平均每片制剂所含的辅料量按0.09 g计算。
取1片辅料量按1.6项下溶出方法进行操作,经0.45 μm的滤膜过滤,并在220~300 nm波长范围内扫描。
1.7.2 滤膜吸附试验:选用C厂家(编号3517)的溶出溶液,采用离心(经4000 r/min,离心5 min)、过滤(经0.45 μm的滤膜)方式,对离心溶液、初滤液及续滤液进行检测。
1.7.3 试验方法准确度考察(以回收率表示):精密称定原料药(编号3507)约5、8、10 mg,按浓度50%、80%、100%各平行称取3份,分别置1000 mL量瓶中,再分别加入混合辅料(相当于1片制剂的量)约0.09 g,用pH 6.8磷酸盐缓冲溶液溶解并稀释至刻度,摇匀。经0.45 μm滤膜过滤,取滤液在262 nm波长处测定吸收度。
1.7.4 线性与范围:精密称取原料药0.01348 g至100 mL量瓶中,加入pH 6.8的磷酸盐缓冲溶液溶解、定容、摇匀;用刻度吸管精密移取上述溶液3、2、3、5、3 mL分别至25、25、50、100、100 mL量瓶中,用pH 6.8的磷酸盐缓冲溶液定容、摇匀,所得溶液浓度依次为16.176、10.784、8.088、6.740、4.044 μg/mL;照紫外光度测定法在262 nm波长处测定吸光度。
1.7.5 溶出溶液稳定性考察:选用C厂家(编号3517)的样品按1.3项下方法操作,经45、75、105、165 min取样,并经0.45 μm滤膜过滤,取滤液在262 nm波长处测定吸收度。
1.7.6 精密度试验:精密称定VB4原料药约10 mg,平行称取6份分别至100 mL量瓶中,用pH 6.8磷酸盐缓冲溶液溶解、定容、摇匀。再精密移取5 mL至50 mL量瓶中,用pH 6.8磷酸盐缓冲溶液定容、摇匀。在262 nm波长处测定吸收度。
2 结果
2.1 辅料干扰 辅料在261 nm波长处几乎无吸收,吸光值平均为0.0037(n=5)。故辅料对溶出度测定基本无干扰。
2.2 滤膜吸附试验 初滤液与离心溶液比较,吸光度下降了1.3%,续滤液与初滤液比较,吸光度未发生变化。说明经0.45 μm的滤膜过滤,滤膜对样品有吸附作用,滤膜吸附约为1.2%,溶出量减少0.03%,在允许的限度范围内。
2.3 准确度考察 维生素B4片溶出度的平均回收率100.1%(n=9),RSD=1.05%,见表1。

表1 回收率试验结果Tab.1 Results of recovery test
2.4 维生素B4片的溶解度及稳定性研究 维生素B4片的溶解度及稳定性研究结果见表2。维生素B4片在0.1 mol/L的盐酸溶液中溶解度最高,为20.3 mg/mL,稳定时间为20 h。

表2 维生素B4片在不同介质中的溶解度及稳定性Tab.2 Solubility and stability of Vitamin B4 tablets in different medium
2.5 5家生产企业分别在不同溶出介质中的溶出曲线 5家生产企业分别在不同溶出介质中的溶出曲线见图2。

图2 5家生产企业分别在4种溶出介质中的溶出曲线图比较Fig.2 Comparison of the dissolution curves of 5 production enterprises in four kinds of dissolution medium
2.6 溶出介质的选择 维生素B4片是速溶制剂, 5家生产企业在0.1 mol/L盐酸溶液中溶出比较快,5 min样品溶出量已达到85%以上,无法对生产企业的不同处方、工艺的进行区分;pH 4.5的醋酸盐缓冲溶液、pH 6.8的磷酸盐缓冲溶液及水,3种的溶出速率较缓慢,但水无酸碱缓冲能力,对于处方中所产生的酸碱度无法进行控制,故选用pH 6.8的磷酸盐缓冲溶液较好,能避免制剂对溶出介质酸碱度的干扰。在pH 6.8的磷酸盐缓冲溶液溶出介质中,有4家生产企业的样品在溶出时间30 min,样品的溶出量均达到了80%,故溶出时间设定为45 min。同一溶出介质不同生产企业的溶出曲线见图3。
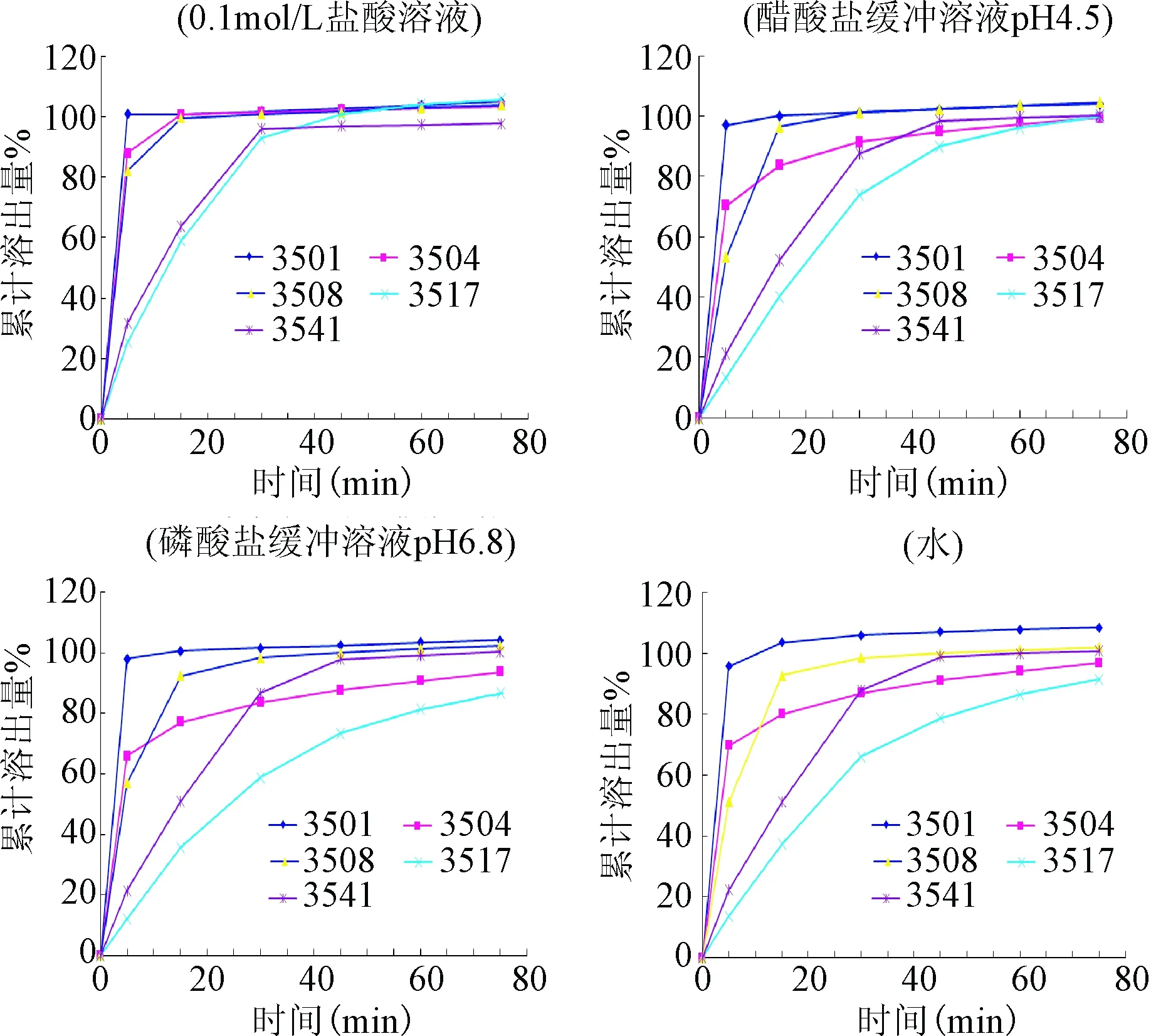
图3 同一溶出介质中不同生产企业的溶出曲线图比较Fig.3 Comparison of dissolution curves of different production enterprises in the same dissolution medium
2.7 线性与范围 磷酸腺嘌呤浓度在4~16 μg/mL的范围内呈良好的线性关系,相关系数为1,线性方程为y=0.0574C+0.0025(n=5,C为μg/mL)。
2.8 溶出溶液稳定性考察和仪器精密度试验 样品在45 min内稳定。溶液吸收系数RSD为0.29%,表明仪器的精密度良好。
2.9 验证试验 5家生产企业共15批样品按照2.6方法测定,仅有1批测定结果低于限度80%,其余14批达到限度要求,测定结果见表3。

表3 溶出度测定结果Tab.3 Results of dissolution determination
3 讨论
维生素B4属于生物分类系统BCSⅠ类药物,其体内吸收性能与溶出度方法已无相关性[8],建立体外溶出度方法的重要目的是能够保证药品批间质量的一致性。
选择释放介质的一个重要标准是漏槽条件[9],漏槽条件是指药物所处释放介质的浓度远小于其饱和浓度,生理学解释为药物在体内被迅速吸收,制剂的体外包括释放度等测定需要模仿体内生理条件的、满足药物溶解、吸收的过程,漏槽条件起到了修正作用。因此测定药物在不同介质中的溶解度可以初步拟定其制剂的释放介,故选择pH 6.8的磷酸盐缓冲溶液作为体外溶出介质。在pH 6.8的磷酸盐缓冲溶液中维生素B4片的溶出速率较缓慢,对处方工艺有一定区分度,并避免由于片剂本身处方工艺中辅料对溶出介质的酸碱度干扰[10]。
实验结果显示D厂家的3517批样品在45 min时未达到标示量的80%,但该厂家其余2批(批号3518、3519)达到溶出限度,由此可猜测D厂家对其生产工艺进行了调整,由此可看出选择pH 6.8的磷酸盐缓冲溶液作为溶出介质对于维生素B4片的体外溶出度测定达到了有效的质量一致性考察目的。
[1] 卫生部药典委员会编.中华人民共和国卫生部药品标准.化学药品及制剂[S].第一册.北京:化学工业出版社,1989:137.
[2] 姜德长.维生素B4片溶出度测定方法研究[J].中国药业,2007,16(2):31-32.
[3] Amidon GL,Lennern H,Shah VP.A theoretical basis for a biophannaceutie drug classification:the correlation of in vitro drug product dissolution and in varo bioavailabilit [J].Pharm Res,1995,12(3):413-420.
[4] 谢沐风.如何科学、客观地制订溶出度试验质量标准[J].中国医药工业杂志,2012,43(3):243-252.
[5] 国家药典委员会.中国药典[M].2010版二部:附录:85.
[6] 国家药典委员会.中国药典[M].2010版二部:附录:23.
[7] 周海燕,朱晓玲,蔡纪青,等.紫外分光光度法测定维生素B4片含量[J].中国现代应用药学, 2001, 18(2):138.
[8] 张宁,平其能.生物药剂分类系统(BCS)及应用进展介绍[J].中国新药杂志,2008,17(19):1655-1658.
[9] 石雷,范长春.辛伐他汀凝胶骨架缓释片制备工艺与体外释放考察[J].中国医药导报,2011,26(8):76-78.
[10] 李芳美.影响片剂溶出度的因素探讨[J].广东药学,2005,5(15):19-21.
(编校:王冬梅)
Study on dissolution method of Vitamin B4 tablets
LIN Yan-qiong1,LI Cai-xia1,LIN Hui-wu2Δ
(1.Department of Pharmacy, The First Affiliated Hospital of Xiamen University, Xiamen 361003, China; 2.Department of Pharmacy, Siming Branch of the First Affiliated Hospital of Xiamen University, Xiamen 361000, China)
ObjectiveTo establish a test method for determining the vitamin B4 tablets dissolution. MethodsPaddle method was used to 900 mL pH6.8 phosphate buffer solution as the dissolution medium, the temperature of 37 ℃, the speed of 50 r/min, take time for 45 min. Taking the filtrate through the 0.45 μm microporous membrane filtration, vitamin B4 tablets dissolution quantity determined by ultraviolet spectrophotometry, determined the wavelength of 262 nm, dissolution limit for 80% of the labeled amount. ResultsVitamin B4 concentration had a good linear relationship with the absorbance in 4~16 μg/mL,r=0.9999 (n=5), the average recovery was 100.1%, RSD=1.0% (n=9). ConclusionThe method is simple, sensitive and accurate, has certain effect on prescription and study of the process of different production enterprises, can be used for the dissolution determination of vitamin B4 tablets.
Vitamin B4 tablets;dissolution;UV spectrophotometry
林燕琼,女,大专,副主任药师,研究方向:医院药学,E-mail:doctorlinyq@163.com;林惠武,通讯作者,男,本科,副主任药师,研究方向:临床药学,E-mail:fjxmlhw361@163.com。
R927.2
A
1005-1678(2015)06-0147-04
