重组人血管内皮抑制素联合肝动脉化疗栓塞后肝癌患者血清VEGF、HIF-1α、OPN、CTGF水平变化
2015-07-07吴占庆马强高玉风
吴占庆,马强,高玉风
(青海大学附属医院 腹部外科,青海 西宁 810001)
重组人血管内皮抑制素联合肝动脉化疗栓塞后肝癌患者血清VEGF、HIF-1α、OPN、CTGF水平变化
吴占庆,马强,高玉风
(青海大学附属医院 腹部外科,青海 西宁 810001)
目的 探讨肝癌患者重组人血管内皮抑制素联合肝动脉化疗栓塞后血清血管内皮生长因子(vascular endothelial growth factor,VEGF)、乏氧诱导因子-1α(hypoxia inducible factor-1 alpha,HIF-1α)、骨桥蛋白(osteopontin,OPN)及结缔组织生长因子(connective tissue growth factor,CTGF)的变化及临床意义。方法 选取青海大学附属医院收治的中晚期原发性肝癌患者90例,随机分为对照组和观察组,每组各45例,对照组实施常规肝动脉化疗栓塞治疗,观察组实施重组人血管内皮抑制素注射液联合肝动脉化疗栓塞治疗;于治疗前、术后3、5 d,用酶联免疫吸附法动态监测分析血清中VEGF、HIF-1α、OPN、CTGF的水平,并分析相关性。结果 对照组和观察组术后3、5 d与术前比较,VEGF、HIF-1α、OPN、CTGF水平均明显升高(P<0.05)。2组术后5 d与术后3 d比较,VEGF、HIF-1α、OPN、CTGF水平均显著下降(P<0.05)。观察组患者术后5 d除HIF-1α外,VEGF、OPN、CTGF水平均显著低于同期对照组(P<0.05)。90例肝癌患者外周血清中VEGF与HIF-1α、OPN、CTGF浓度水平显著正相关(r=0.985、0.995、0.959,P<0.05),HIF-1α与OPN、CTGF浓度水平高度正相关(r=0.842、0.874,P<0.05),OPN与CTGF浓度水平中度正相关(r=0.755,P<0.05)。结论 重组人血管内皮抑制素联合肝动脉化疗栓塞治疗原发性肝癌的临床疗效明显,肝癌患者外周血清VEGF、HIF-1α、OPN及CTGF密切相关,可以反映临床疗效。
重组人血管内皮抑制素;肝癌;化疗栓塞;血管内皮生长因子;乏氧诱导因子-1α;骨桥蛋白;结缔组织生长因子
肝癌是肝脏部位的恶性肿瘤,其中原发性肝癌是起源于肝脏上皮或间叶组织的肝脏恶性肿瘤,发病率很高,其预后较差,对患者的生命健康造成重大威胁[1]。手术是治疗肝癌的首选,也是最有效的治疗方法,而对不能手术直接切除的肝癌可根据患者疾病的具体情况,采用术中肝动脉结扎、肝动脉化疗栓塞、射频、冷冻等治疗方法[2]。近年来,相关报道[3]指出重组人血管内皮抑制素联合动脉化疗栓塞术的临床疗效显著,但是国内关于此方面的研究还不够明确[4],故本研究对常规肝动脉化疗栓塞治疗与重组人血管内皮抑制素联合肝动脉化疗栓塞治疗进行比较。现报道如下。
1 资料与方法
1.1 一般资料 选取2012年4月~2014年4月期间,青海大学附属医院收治的90例中晚期原发性肝癌患者,随机分为对照组与观察组。对照组45例,其中男23例,女22例,年龄34~77岁,平均年龄(55.78±6.23)岁,实施常规肝动脉化疗栓塞治疗;观察组45例,其中男21例,女24例,年龄33~76岁,平均年龄(56.32±6.03)岁,实施重组人血管内皮抑制素联合肝动脉化疗栓塞治疗。本次临床研究由本院医学伦理委员会批准同意,符合伦理要求,准予实施,并且所有患者均签署知情同意书。
1.2 诊断及排除标准 根据中国抗癌协会肝癌专业委员会《原发性肝癌诊断标准和原发性肝癌分期标准(2001年修订)》,所有患者均经B超、CT、MRI等影像学相关检测以及血清甲胎蛋白(alpha fetoprotein,AFP)检测或组织病理活检等确诊,且均为首次入院治疗患者;排除合并患有门静脉完全栓塞、肝功能严重受损、肿瘤广泛转移、肝性脑病等其他重大脏器严重疾病[5]。
1.3 治疗方法 观察组实施重组人血管内皮抑制素联合肝动脉化疗栓塞手术:采用Seldingers法通过右侧大腿股动脉进行穿刺,沿着导丝置入5F鞘和5F肝管,插管直到肝固有动脉或肝固有动脉分支以后进行数字减影血管造影(digital subtraction angiography,DSA),通过造影确定肝肿瘤供血动脉分布情况、肿瘤的大小及数目。在情况明确之后进行超选择性插管,首先灌注重组人血管内皮抑制素注射液(烟台麦得津生物工程股份有限公司,国药准字S20050088)15 mg、5-氟脱氧尿核苷(5’-deoxy-5-fluorouridine,5’-DFUR,上海罗氏制药有限公司,国药准字H19990343)0.5~1.0g、羟基喜树碱(hydroxycamptothecin,HCPT,费森尤斯卡比医药有限公司,国药准字H20030314)20~40 mg,再把吡柔比星(浙江海正药业股份有限公司,国药准字H20045983)20~50 mg与碘化油(浙江医药股份有限公司新昌制药厂,国药准字H33021061)3~20 mL 2者充分混匀,制成乳剂缓慢注入,充分栓塞瘤灶,直到出现血管铸型为止,最后再加少量明胶海绵颗粒栓塞供血动脉[6]。
对照组实施肝动脉化疗栓塞手术:只进行肝动脉化疗栓塞治疗,碘化油乳化时不联合重组人血管内皮抑制素注射液治疗,其他手术操作以及药物与观察组相同。
1.4 采血及检测指标 在患者知情同意的情况下于肝动脉化疗栓塞术前、术后3 d及术后5 d采集患者外周血5 mL,放于4 ℃条件下24 h,之后1000 r/min离心20 min,取上清于EP管内保存于-8 ℃条件下,用酶联免疫吸附法(318-MICROPLATE READER酶标仪,上海三科仪器有限公司)检测患者血清中血管内皮生长因子(vascularendothelial growth factor,VEGF)、乏氧诱导因子-1α(hypoxia inducible factor-1alpha,HIF-1α)、骨桥蛋白(osteopontin,OPN)、结缔组织生长因子(connective tissue growth factor,CTGF)的水平,并进行相关分析。

2 结果
2.1 2组患者一般资料比较 观察组与对照组患者在性别、年龄、肝炎病史、肿瘤大小、肿瘤结节数量、转移情况、术前AFP水平、肝功能等一般情况方面比较差异无统计学意义,见表1。
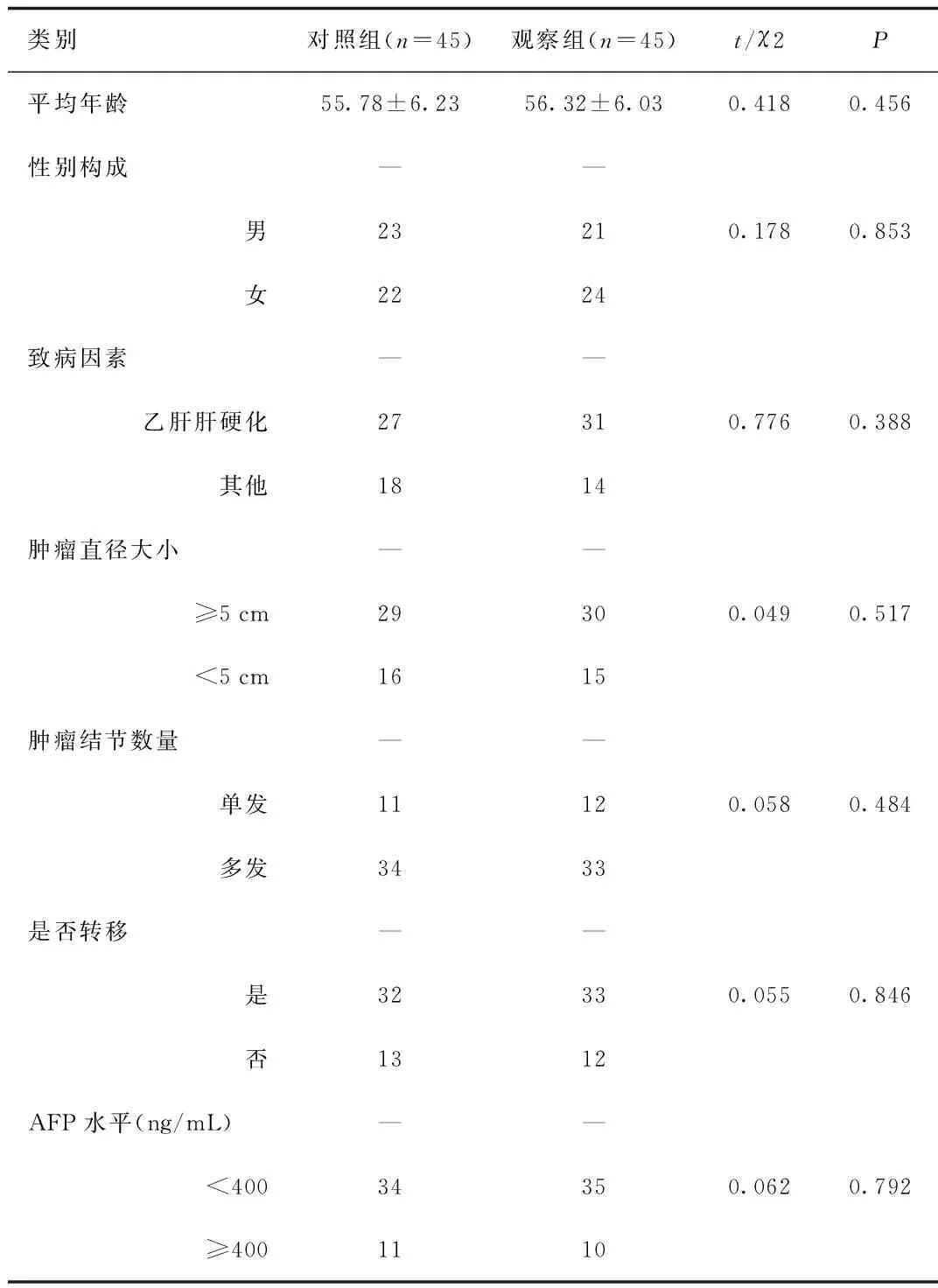
表1 2组患者一般资料比较Tab.1 Comparison of general information between two groups
2.2 对照组与观察组不同阶段血清VEGF、HIF-1α、OPN及CTGF水平比较 对照组和观察组术后3 d、术后5 d与术前比较VEGF、HIF-1α、OPN、CTGF水平均明显升高(P<0.05),对照组和观察组术后5 d与术后3 d相比较VEGF、HIF-1α、OPN、CTGF水平均显著下降(P<0.05),观察组患者术后5 d除HIF-1α外,VEGF、OPN、CTGF水平均显著低于同期对照组(P<0.05),见表2。

表2 2组患者不同阶段血清VEGF、HIF-1α、OPN、CTGF水平比较Tab.2 Comparison of serum VEGF, HIF-1α, OPN and CTGF levels between two groups at different ±s,ng/L)
*P<0.05,与同组术前比较,compared with preoperation in same group;#P<0.05,与术后3 d比较,compared with postoperative day 3;△P<0.05,与对照组同期比较,compared with control group at same stage
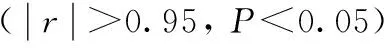
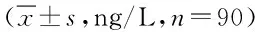
表3 肝癌患者中血清VEGF、HIF-1α、OPN、CTGF水平相关性分析Tab.3 Correlations of serum VEGF, HIF-1α, OPN, CTGF levels in patients with liver ±s,ng/L,n=90)
3 讨论
原发性肝癌的致病因素与分子机制目前未十分明确,目前医学界认为肝癌的病因是多方面的,其致病过程也是漫长复杂的,受遗传基因与环境双重因素影响[7]。从目前已经掌握的流行病学资料以及实验相关研究表明[8],导致肝癌的主要致病因素包括乙型肝炎病毒(HBV)和丙型肝炎病毒(HCV)感染、黄曲霉素、酒精、肝硬化等。早期肝癌无明显特异性症状与体征,中晚期肝癌的临床症状相对较多,主要出现的是消化系统症状或全身性症状,以及明显的进行性肝大或上腹部包块等体征[9]。因此应根据肝癌患者所处的阶段不同以及个体差异制定个体化综合治疗方案,治疗方法包括手术、肝动脉结扎、肝动脉化疗栓塞以及化疗和放疗等一系列有效的治疗手段。相关报道表明[10],重组人血管内皮抑制素联合肝动脉化疗栓塞治疗原发性肝癌的疗效明显,重组人血管内皮抑制素注射液为血管抑制类新生物制品。重组人血管内皮抑制素的分子机制主要是作用于VEGF的受体,抑制形成血管的内皮细胞迁移,阻止VEGF与内皮细胞结合,抑制肿瘤新生血管的生成,从而阻断了肿瘤的营养供给,进而达到抑制肿瘤增殖或转移的目的[11]。HIF-1α在人体内广泛存在,只有缺氧时才能稳定表达,因此当肝动脉化疗栓塞时即形成了一种缺氧的局部环境,其表达会显著增高[12]。OPN是骨基质中分离出来的一种磷酸化糖蛋白,分子中包含有RDG序列,通过粘附功能改变相关细胞的结构与功能,从而促进细胞的迁移,广泛存在于各组织中,在病理状态下其表达会显著升高。CTGF由349个氨基酸组成,是富含半胱氨酸的分泌肽,目前该家族共有CTGF/fisp-12、cef10/Cyr61和Nov 3个成员;CTGF对成纤维细胞具有趋化及促有丝分裂作用,同时还具有促细胞增殖、迁移及分化等作用[13]。
本次临床研究结果表明:对照组和观察组术后3 d、术后5 d与术前相比较VEGF、HIF-1α、OPN、CTGF水平均明显升高(P<0.05),对照组和观察组术后5 d与术后3 d相比较VEGF、HIF-1α、OPN、CTGF水平均显著下降(P<0.05),说明重组人血管内皮抑制素联合肝动脉化疗栓塞治疗原发性肝癌可以有效降低患者术后VEGF、HIF-1α、OPN、CTGF水平,效果优于单纯肝动脉化疗栓塞,重组人血管内皮抑制素通过作用于VEGF的受体,阻止VEGF 与内皮细胞结合,达到抑制肿瘤新生血管生成的目的,治疗肿瘤的疗效显著,这与国外学者Farris等[14]的研究结果相一致。观察组患者术后5 d除HIF-1α外,VEGF、OPN、CTGF水平均显著低于同期对照组(P<0.05),说明当肝动脉化疗栓塞时即形成了一种缺氧的局部环境,因此HIF-1α表达会显著增高且在缺氧环境持续存在条件下将持续表达,这与国外学者Dufour等[15]报道的结果相近。90例肝癌患者外周血清中VEGF与HIF-1α、OPN、CTGF浓度水平显著正相关(r≥0.95,P<0.05),HIF-1α与OPN、CTGF浓度水平高度正相关(r≥0.8,P<0.05),OPN与CTGF浓度水平中度正相关(0.5≤r<0.8,P<0.05)。说明VEGF的表达上升,可调控一系列基因的表达,其中HIF-1α又是肿瘤细胞缺氧调节的重要因子,其表达增强后与受体结合可促进下游基因的转录,因此VEGF、HIF-1α、OPN、CTGF之间存在密切相关性,临床上可以通过检测相关因子反映临床疗效,在临床上具有重要参考意义。
综上所述,重组人血管内皮抑制素联合肝动脉化疗栓塞治疗原发性肝癌的临床疗效明显、效果良好,可以通过检测相关因子反映临床疗效,该方法治疗原发性肝癌值得在临床上进一步推广。
[1] Xu XS,Chen W,Zhang LQ,et al.Prognostic significance of neutrophil to lymphocyte ratio in patients with hepatocellular carcinoma after transcatheter arterial chemoembolization[J].Chin Med J (Engl),2014,127(24):4204-4209.
[2] Shi M,Chen JA,Lin XJ,et al.Transarterial chemoembolization as initial treatment for unresectable hepatocellular carcinoma in southern China[J].World J Gastroenterol,2010,16(2):264-269.
[3] Wei K,Piecewicz SM,McGinnis LM,et al.A liver Hif-2α-Irs2 pathway sensitizes hepatic insulin signaling and is modulated by Vegf inhibition[J].Nat Med,2013,19(10):1331-1337.
[4] 周荣伟,肖永奇,郭永红,等.恩度联合TACE在中晚期原发性肝癌中的应用研究[J].中国医药指南,2013,11(29):12-13.
[5] Guo JH,Zhu X,Li XT,et al.Impact of Serum Vascular Endothelial Growth Factor on Prognosis in Patients with Unresectable Hepatocellular Carcinoma after Transarterial Chemoembolization[J].Chin J Cancer Res,2012,24(1):36-43.
[6] Weintraub JL,Salem R.Treatment of hepatocellular carcinoma combining sorafenib and transarterial locoregional therapy:State of the science[J].J Vasc Interv Radiol,2013,24(8):1123-1134.
[7] Liu J,Yi J.Relationship between the Changes of VEGF Level and Dendritic Cells in Peripheral Blood of Patients with Hepatocellular Carcinoma after Transcatheter Arterial Chemoembolization[J].J Huazhong Univ Sci Technolog Med Sci,2007,27(1):58-60.
[8] Kudo M,Ueshima K.Positioning of a molecular-targeted agent,sorafenib,in the treatment algorithm for hepatocellular carcinoma and implication of many complete remission cases in Japan[J].Oncology,2010,78(Suppl.1):154-166.
[9] Bao Y,Feng WM,Tang CW,et al.Endostatin inhibits angiogenesis in hepatocellular carcinoma after transarterial chemoembolization[J].Hepatogastroenterology,2012,59(117):1566-1568.
[10] Pawlik TM,Reyes DK,Cosgrove D,et al.Phase II Trial of Sorafenib Combined With Concurrent Transarterial Chemoembolization With Drug-Eluting Beads for Hepatocellular Carcinoma [J].J Clin Oncol,2011,29(30):3960-3967.
[11] Chao Y, Wu CY, Kuo CY,et al.Cytokines are associated with postembolization fever and survival in hepatocellular carcinoma patients receiving transcatheter arterial chemoembolization[J].Hepatol Int,2013,7(3):883-892.
[12] Xiao EH,Guo D,Bian DJ,et al.Effect of preoperative transcatheter arterial chemoembolization on angiogenesis of hepatocellular carcinoma cells[J].World J Gastroenterol,2009,15(36):4582-4586.
[13] Kudo M.Future treatment option for hepatocellular carcinoma:a focus on brivanib [J].Dig Dis,2011,29(3):316-320.
[14] Farris AB,Dursun N,Dhanasekaran R,et al.Tumoral and angiogenesis factors in hepatocellular carcinoma after locoregional therapy[J].Pathol Res Pract,2012,208(1):15-21.
[15] Dufour JF,Hoppe H,Heim MH,et al.Continuous administration of sorafenib in combination with transarterial chemoembolization in patients with hepatocellular carcinoma:results of a phase I study[J].Oncologist,2010,15(11):1198-1204.
(编校:王俨俨)
Changes of VEGF, HIF-1α, OPN and CTGF levels in serum of HCC patients after recombinant human endostatin combined with transcatheter arterial chemoembolization
WU Zhan-qing, MA Qiang, GAO Yu-feng
(Abdominal Surgery, The Affiliated Hospital of Qinghai University, Xining 810001, China)
ObjectiveTo explore the effect of recombinant human endostatin combined with transcatheter arterial chemoembolization on vascular endothelial growth factor (VEGF), hypoxia inducible factor-1 alpha(HIF-1α), osteopontin (OPN) and connective tissue growth factor (CTGF) levels in serum of HCC patients.Methods90 cases of primary liver cancer patients were randomly divided into control group and observation group, 45 cases in each group.The control group received the routine chemotherapy of hepatic artery embolization, and the observation group received recombinant human vascular endostatin combined with hepatic arterial chemoembolization.The serum levels of VEGF, HIF-1α, OPN, and CTGF were detected by enzyme-linked immunosorbent assay before treatment, 3 days and 5 days after operation, then the correlations were analyzed.ResultsThe VEGF, HIF-1α, OPN, CTGF levels after 3 days and 5 days were higher than those before surgery in control group and observation group (P<0.05), the above indexes after 5 days were lower than those after 3 days in both groups (P<0.05), and VEGF, OPN and CTGF levels except for HIF-1α in observation group were significantly lower than those in control group after 5 days (P<0.05).There existed significant positive correlation between serum VEGF and HIF-1α, OPN, CTGF concentration levels(r=0.985, 0.995, 0.959,P<0.05) in 90 cases of liver cancer patients, highly positive correlation between HIF-1α and OPN, CTGF levels (r=0.842,0.874,P<0.05), and moderately positive correlation between OPN and CTGF concentrations (r=0.755,P<0.05).ConclusionThe efficacy of recombinant human vascular endostatin combined with transcatheter arterial chemotherapy and embolization in the treatment of primary hepatocellular carcinoma is good.There exsits closely correlation of VEGF, HIF-1α, OPN and CTGF levels in serum, which could reflect clinical efficacy.
recombinant human vascular endostatin; liver neoplasms; chemoembolization; vascular endothelial growth factor; hypoxia inducible factor-1 alpha; osteopontin; connective tissue growth factor
吴占庆,男,本科,副主任医师,研究方向:腹部急诊、肿瘤、严重创伤,E-mail:wuzq281@126.com。
R735.7
A
1005-1678(2015)06-0098-04
