来氟米特对EAE豚鼠外周血CD28/CTLA-4共刺激分子表达的影响
2015-07-07吕志宇袁正洲荣本兵李作孝
吕志宇,袁正洲,荣本兵,李作孝
(泸州医学院附属医院 神经内科,四川 泸州 646000)
来氟米特对EAE豚鼠外周血CD28/CTLA-4共刺激分子表达的影响
吕志宇,袁正洲,荣本兵,李作孝Δ
(泸州医学院附属医院 神经内科,四川 泸州 646000)
目的 通过观察来氟米特对实验性变态反应性脑脊髓炎(experimental allergic encephalomyelitis,EAE)豚鼠外周血CD28/CTLA-4共刺激分子表达的影响,探讨来氟米特对EAE的防治作用及免疫学机制。方法 将50只成年雌性豚鼠随机分为5组,每组各10只,分别为正常对照组、EAE对照组、低剂量、治疗组、中剂量治疗组和高剂量治疗组。低、中、高剂量治疗组于造模前7 d始按体质量分别予来氟米特10、20、40 mg/(kg·d)灌胃,均1次/天,至实验终止。流式细胞术检测各组外周血CD4+T细胞膜上CD28、CTLA-4共刺激分子表达情况并记录豚鼠发病情况。结果 高、中剂量治疗组较EAE对照组潜伏期延长、进展期缩短、神经功能障碍评分降低,差异有统计学意义(P<0.05),以高剂量治疗组最明显 (P<0.05)。EAE对照组较正常对照组发病高峰期外周血CD4+T细胞膜上CD28分子表达升高(P<0.05),而CTLA-4表达下降(P<0.05);高、中剂量治疗组较EAE对照组CD28分子表达下调(P<0.05),而CTLA-4表达升高(P<0.05);各治疗组间CD28分子的表达以高剂量治疗组下调最显著(P<0.05),CTLA-4分子的表达以高剂量治疗组上调显著(P<0.05)。相关分析显示EAE对照组、各治疗组外周血CD28/CTLA-4比值与神经功能障碍评分均呈正比(r=0.85,P=0.002;r=0.77,P=0.000)。结论 来氟米特可减轻EAE豚鼠神经功能缺损症状,且剂量越高效果越好。其作用机制可能是通过下调外周血CD4+T细胞上CD28分子,上调CTLA-4分子的表达,使EAE豚鼠免疫失衡重新达到平衡,从而减轻炎性反应,调节免疫应答,减轻临床症状。
来氟米特;实验性变态反应性脑脊髓炎;多发性硬化;共刺激分子;CD28;CTLA-4
实验性变态反应性脑脊髓炎(experimental allergic encephalomyelitis,EAE)是由T细胞介导的自身免疫性疾病,是研究人类多发性硬化(multiple sclerosis, MS)疾病的理想动物模型[1]。CD28、CTLA-4是CD4+T细胞表面重要的共刺激分子,在T细胞激活始动阶段发挥关键作用,研究发现EAE及MS发病机制与CD28、CTLA-4异常表达有关[2]。
来氟米特(leflunomide,LEF)及其衍生物是一类新型、高效的免疫调节性药物,已在类风湿性关节炎中广泛使用[3]。本研究通过观察来氟米特对EAE豚鼠的神经功能障碍评分的影响及对EAE豚鼠外周血CD4+T细胞表面CD28、CTLA-4表达的影响,探讨LEF治疗EAE的效果及免疫机制,为寻求MS新药提供实验依据。
1 材料与方法
1.1 实验动物 体质量为250~300 g的成年雌性豚鼠50只和健康的SD大鼠10只,均为一级合格动物(来源于泸州医学院实验动物中心)。
1.2 试剂和仪器 来氟米特(由苏州长征-欣凯制药有有限公司提供,规格:20 mg/片),异硫氰酸荧光素(FITC)标记的抗鼠CD4单克隆抗体,藻红蛋白(PE)标记的抗鼠CD28、CTLA-4单克隆抗体为美国Ebioscience公司产品。福氏完全佐剂,为sigma公司产品。流式细胞仪为美国BD公司产品。
1.3 方法
1.3.1 免疫原合成及EAE模型制作:将SD大鼠处死后,迅速取出脊髓,用匀浆器制成50%的匀浆与等量的弗氏完全佐剂(卡介苗10 mg/mL)混合,用注射器抽打至油包水乳剂,制成粗制髓鞘碱性蛋白(crude myelin basic protein, cMBP)。将其注入豚鼠双侧后足掌皮下各0.3 mL制作EAE模型。
1.3.2 实验分组:将50只豚鼠随机分为5组,每组各10只,正常对照组不经免疫诱导,其中4组制作EAE模型,分为EAE对照组及低、中、高剂量治疗组 。低、中、高剂量治疗组于造模前7d始按体质量分别予来氟米特10、20、40 mg/(kg·d)灌胃,EAE对照组和正常对照组均予等量生理盐水灌胃,均1次/天,至实验终止。
1.3.3 神经功能障碍评分:每天上午10:00观察各组豚鼠临床表现,记录EAE神经功能障碍评分。神经功能障碍评分标准[4]:0分,无明显异常;1分,后肢不全瘫痪;2分,后肢完全瘫痪;3分,后肢不全瘫痪且前肢完全瘫痪;4分,四肢完全瘫痪或死亡。
1.3.4 实验终止:将四肢瘫痪、死亡或连续3 d症状评分无加重时作为发病的高峰期,在发病高峰期处死动物;未发病的动物观察2个月后处死;正常对照组4周后处死。
1.3.5 外周血CD4+T细胞膜上CD28、CTLA-4分子的检测:采用流式细胞仪全血直标法检测。肝素抗凝(25 u/mL)的静脉血100 μL,分装于2个检测管,分别加入20 μL FITC-CD4+20 μL PE-CD28,20 μL FITC -CD4+20 μL PE-CD152。混匀后室温避光放置20 min;加入甲酸溶血素650 μL,室温避光放置10 min;1500 r/min低温离心5 min,弃上清;用4 ℃ PBS液2 mL洗涤,1500 r/min低温离心5 min,弃上清,重复该步骤2次;加入PBS 300 μL及固定剂4%多聚甲醛200 μL,充分混匀,4 ℃暗室保存。上流式细胞仪检测。

2 结果
2.1 临床表现 正常对照组豚鼠未见发病,其它各组有不同程序的发病,如:精神萎靡、活动减少、毛发不光滑、体质量下降以及摄食减少,注射抗原部位皮肤出现红肿、破溃以及四肢不同程度的瘫痪、尿便失禁,重者死亡。高、中剂量治疗组较EAE对照组潜伏期延长、进展期缩短、神经功能障碍评分降低,差异有统计学意义(P<0.05),以高剂量治疗组最明显(P<0.05)。见表1。

表1 各组发病高峰期神经功能障碍评分结果±s)Tab.
*P<0.05,与EAE对照组比较,compared with EAE control group;△P<0.05,与低剂量治疗组比较,compared with low dose treatment group
2.2 5组外周血CD4+T细胞膜上CD28、CTLA-4表达的比较 EAE对照组豚鼠发病高峰期外周血CD4+T细胞膜上CD28分子表达较正常对照组升高(P<0.05),而CTLA-4较正常对照组表达下调(P<0.05);高、中剂量治疗组CD28分子表达较EAE对照组降低(P<0.05),而CTLA-4表达较EAE对照组升高(P<0.05);CD28分子的表达以高剂量治疗组下调更显著(P<0.05),而CTLA-4分子的表达较低剂量治疗组,高、中剂量治疗组均上调更显著(P<0.05),而高、中剂量治疗组之间差异无统计学意义。见表2,图1。

表2 各组外周血CD4+T细胞膜上CD28、CTLA-4表达Tab.2 Peripheral blood CD28, CTLA-4 expression in each ±s)
*P<0.05,与正常对照组比较,compared with normal control group;△P<0.05,与EAE对照组比较,compared with EAE control group;﹟P<0.05,与低剂量治疗组比较,compared with low dose treatment group
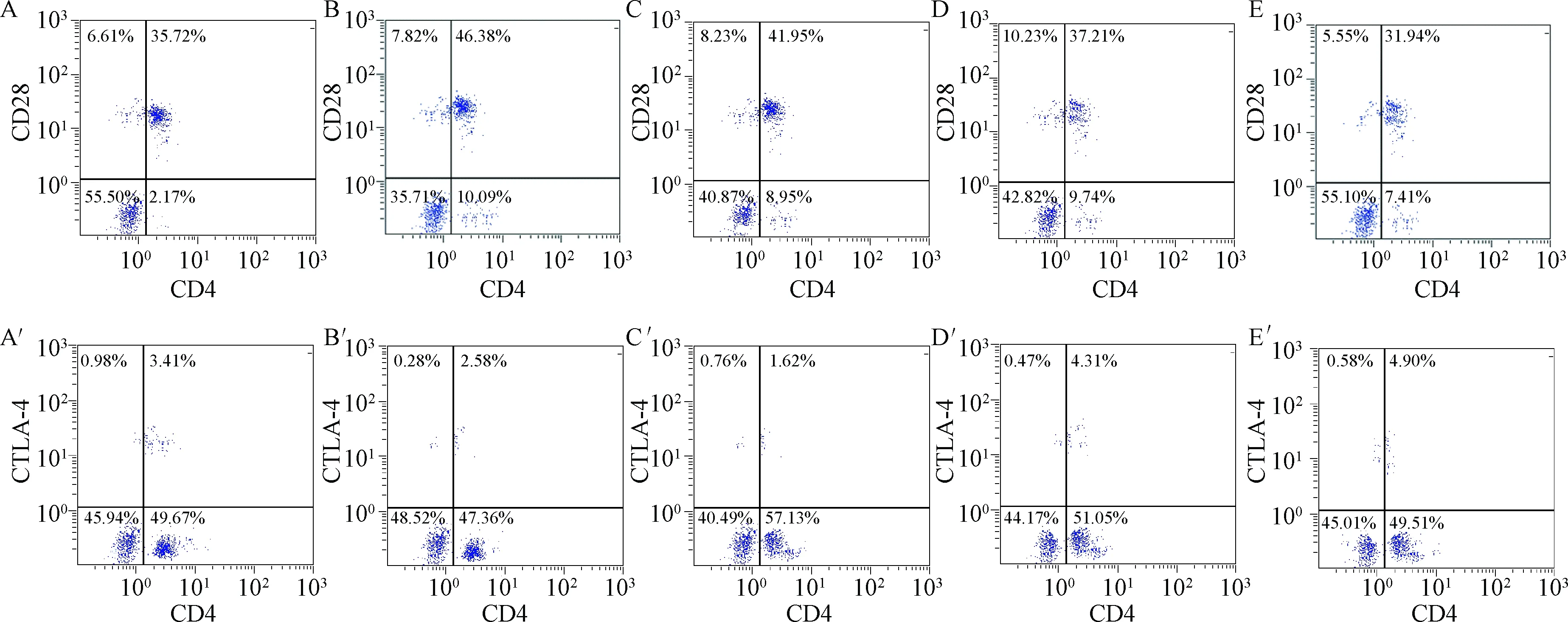
图1 流式细胞仪检测外周血CD4+T细胞膜上CD28(上图)、CTLA-4(下图)的表达情况A,A′.正常对照组;B,B′.EAE对照组;C,C′.低剂量治疗组;D,D′.中剂量治疗组;E,E′.高剂量治疗组Fig.1 Flow cytometry to detect the expression of CD28 (above) and CTLA-4 (below) in the peripheral blood CD4+T cell membraneA.control group, B.EAE control group, C.low dose treatment group, D.middle dose treatment group, E.high dose treatment group
2.3 CD28/CTLA-4比值与神经功能障碍评分相关性分析 EAE对照组豚鼠发病高峰期外周血CD4+T细胞膜上表达的CD28/CTLA-4比值与神经功能障碍评分呈正相关(r=0.85,P=0.002);各治疗组的CD28/CTLA-4比值与神经功能障碍评分亦呈正相关(r=0.77,P=0.000)。
3 讨论
MS是一种自身免疫性疾病,呈全世界分布,发病率随纬度升高而增高,好发于年轻人,男女比率约为1:1.9,大多数患者表现为反复发作的神经功能障碍,每次发作都可能残留一定的症状,导致躯体残疾,严重影响患者的生活质量,目前缺乏有效治疗措施且不良反应多[5]。以EAE为模型,探讨MS的发病机制、寻求针对MS有效的治疗方案,开发新的有效的治疗药物已经成为世界性研究热点。LEF是人工合成的异恶唑类药物,是一类新型的免疫抑制剂,其作用机制涉及多个环节。其主要特异、非竞争性地抑制线粒体内二氢乳酸脱氢酶(DHODH)活性,从而抑制嘧啶核苷酸的从头合成途径[6-7]。目前尚未见其应用于EAE和MS的研究。
CD28分子是目前所知共刺激分子CD28超家族成员中唯一表达在未致敏T细胞上的分子,而CTLA-4只表达在活化的T细胞表面,两分子具有高度的同源性,其天然配体均为B7分子[8]。在抗原提呈细胞(APC)通过抗原-MHC分子复合物特异性识别、结合T细胞表面的TCR-CD3分子,并向T细胞传递第一活化信号时,B7与表达在静止T细胞表面的CD28结合,为T细胞活化提供重要的第二信号,T细胞活化后,CTLA-4分子迅速上调,竞争性与APC上的B7分子结合,向活化的T细胞传导抑制信号,从而避免T细胞的过度激活[9-11]。因此,CD28/CTLA-4是T细胞活化启动阶段发挥重要作用的一对共刺激分子,若动态平衡受到破坏则可能诱发自身免疫性疾病[12-13]。Perrin等[14]研究发现,用抗CD28的抗体治疗EAE可以阻断其病情的进展。另有研究显示,在免疫动物时,同时给予抗CTLA-4抗体可加重EAE病情,且在疾病的恢复期间给予该抗体可导致复发[15]。
本研究发现,EAE对照组外周血CD4+T细胞膜上CD28分子的表达较正常对照组明显上调(P<0.05),提示EAE对照组外周血T细胞处于“预激活”状态,相同强度抗原刺激更容易激活EAE外周血T细胞,发生免疫应答;而起负性免疫调控作用的CTLA-4分子在EAE发病高峰期表达明显减少(P<0.05),因此对免疫反应的抑制作用减弱,不能够在T细胞活化后期适时地终结T细胞应答。EAE对照组豚鼠经免疫后均出现不同程度的神经功能障碍,且神经功能障碍评分与CD28/CTLA-4比值呈正相关(r=0.85,P=0.002),提示EAE豚鼠外周血CD4+T细胞膜上共刺激分子CD28/CTLA-4失衡的程度与神经功能障碍的程度呈正比。
本研究显示,LEF能延长EAE豚鼠发病的潜伏期,缩短病程进展期,降低神经功能障碍评分,以高剂量治疗组最显著(P<0.05)。高、中剂量治疗组外周血CD4+T细胞膜上CD28分子表达较EAE对照组下调且有统计学意义(P<0.05),低剂量治疗组与EAE对照组比较无统计学差异;而CTLA-4的表达,高、中剂量治疗组较EAE对照组上调,以高剂量组最显著(P<0.05),低剂量治疗组与EAE对照组比较无统计学差异。以上结果提示,LEF可剂量依赖性下调EAE豚鼠外周血CD4+T细胞上CD28分子的表达,上调CTLA-4分子的表达。Pearson直线相关分析显示:3个治疗组EAE豚鼠外周血CD4+T细胞膜上CD28/CTLA-4比值与其神经功能障碍评分呈正相关(r=0.77,P=0.000),表明LEF是通过上调CD28分子,下调CTLA-4分子的表达,纠正CD28/CTLA-4的失衡而发挥防治EAE的作用。
综上所述,LEF可减轻EAE豚鼠神经功能缺损症状,且剂量越高,效果越好。其作用机制是通过下调外周血CD4+T细胞上CD28分子,上调CTLA-4分子的表达,使EAE豚鼠免疫失衡重新达到平衡,从而减轻炎性反应,调节免疫应答,减轻临床症状。鉴于LEF已广泛应用于类风性性关节炎的治疗,其对EAE特异的细胞免疫的调节作用提示其可能对MS具有良好的作用。
[1] Linker RA, Lee DH.Models of autoimmune demyelination in the central nervous system: on the way to translational medicine[J].Exp Transl Stroke Med,2009,10(21):1-5.
[2] Chitnis T, Khoury SJ.Role of costimulatory pathways in the pathogenesis of multiple sclerosis and experimental autoimmune encephalomyelitis[J].J Allergy ClinImmunol,2003,112(5):837-49.
[3] Wiacek R, Kolossa K, Jankowski T, et al.The efficacy and safety of leflunomide in patients with active rheumatoid arthritis[J].Adv Clin Exp Med,2012,21(3):337-342.
[4] Schneider C, Schuetz G, Zollner TM.Acute neuroinflammation in Lewis rats-a model for acute multiple sclerosis relapses[J].J Neuroimmunol,2009,213(1-2):84-90.
[5] Compston A, Coles A.Multiple sclerosis[J].Lancet,2002,359:1221-1231.
[6] Teschner S, Burst V.Leflunomide: a drug with a potential beyond rheumatology[J].Immunotherapy,2010,2(5):637-650.
[7] Jagoda JS, Rajapakse CN.Leflunomide in clinical practice.A retrospective observational study on use of leflunomide in New Zealand[J].Int J Rheum Dis,2011,14(4):340-344.
[8] Sharpe AH, Freeman GJ.The B7-CD28 superfamily[J].Nat Rev,2002, 2(2):116-126.
[9] Peggs K, Allison J.Co-stimulatory pathways in lymphocyte regulation: the immunoglobulin superfamily[J].Br J Haematol,2005,130(6):809-824.
[10] Podojil JR, Miller SD.Targeting the B7 family of co-stimulatory molecules: successes and challenges[J].Bio Drugs,2013,27(1):1-13.
[11] Feng YL, Zhu LP, He W.Progress in the study on the molecules in CD28 family[J].Acta Academiae Medicinae Sinicae,2002,24(5):536-539.
[12] Chang TT, Kuchroo VK, Sharpe AH.Role of the B7-CD28/CTLA-4 pathway in autoimmune disease[J].Curr Dir Autoimmun,2002,5:113-130.
[13] 何广胜, 周玲, 吴德沛, 等.CD28/CTLA-4共刺激分子在再生障碍性贫血免疫发病机制中的作用[J].中华血液学杂志,2007,09:590-593.
[14] Perrin P, June C, Maldonado J, et al.Blockade of CD28 during in vitro activation of encephalitogenic T cells or after disease onset ameliorates experimental autoimmune encephalomyelitis[J].J Immunol,1999,163(3):1704-1710.
[15] Karandikar N, Vanderlugt C, Walunas T, et al.CTLA-4: a negative regulator of autoimmune disease[J].J Exp Med.1996,184(2):783-788.
(编校:谭玲)
Effect of leflunomide on peripheral blood CD28/CTLA-4 costimulatory molecules expression in guinea pig with EAE
LV Zhi-yu, YUAN Zheng-zhou, RONG Ben-bing, LI Zuo-xiaoΔ
(Department of Neurology, The Affiliated Hospital of Luzhou Medical College,Luzhou 646000, China)
ObjectiveTo investigate immunological mechanism underlying leflunomide(LEF) against experimental allergic encephalomyelitis (EAE) by studying the effects of LEF on peripheral blood CD28/CTLA-4 costimulatory molecules expression in guinea pig with EAE.Methods50 adult female guinea pigs were randomly divided into normal control group,low dose group,EAE control group,middle dose group,and high dose group, 10 guinea pigs in each group respectively.Low, medium and high dose group were treated with LEF 10 mg/kg·D, 20 mg/kg·D and 40 mg/kg·D orally, 1 times/day, to the termination of the experiment.The expression of CD28, CTLA-4 were detected by flow cytometry, incidence was recorded at the same time.ResultsCompared with EAE control group,high dose and middle dose group incubation period were prolonged, progress period were shorten and neurological dysfunction score decreased(P<0.05).Compared with normal control group, the expression of CD28 of EAE control group increased and the decreased expression of CTLA-4 (P<0.05). High, middle dose treatment group compared with EAE control group CD28 down regulated expression (P<0.05), but the expression of CTLA-4 increased(P<0.05). Among the treatment groups, of CD28 molecules with high dose group decreased significantly(P<0.05), the expression of CTLA-4 molecules with high dose treatment groups upregulated significantly (P<0.05).Correlation analysis showed that the EAE control group, the treatment group the CD28/CTLA-4 ratio in peripheral blood and nerve dysfunction score is proportional (r=0.85,P=0.002;r=0.77,P=0.000).ConclusionLEF can reduce EAE guinea pig neurological symptoms, the better and the higher dose effect.Its mechanism may be through down-regulation of CD28 molecules in peripheral blood, upregulation of the expression of CTLA-4 molecule.so as to reduce the inflammatory response, relieve the clinical symptoms.
leflunomide; experimental allergic encephalomyelitis; multiple sclerosis; costimulatory molecules; CD28; CTLA-4
泸州医学院自然科学科研项目(09012)
吕志宇,男,硕士,主治医师,研究方向:神经免疫,E-mail: tiantianxs666@163.com;李作孝,通讯作者,男,硕士,主任医师,硕士生导师,研究方向:神经免疫,E-mail: lzx3235@sina.com。
R556
A
1005-1678(2015)06-0039-04
