重组人血管内皮抑素对体外培养血管瘤内皮细胞增殖、细胞周期及VEGF、KDR/FIK-1表达的影响
2015-07-07曹江俞松吕欣
曹江,俞松,吕欣
(贵州省遵义医学院附属医院 小儿矫形外科,贵州 遵义 563003)
重组人血管内皮抑素对体外培养血管瘤内皮细胞增殖、细胞周期及VEGF、KDR/FIK-1表达的影响
曹江,俞松,吕欣
(贵州省遵义医学院附属医院 小儿矫形外科,贵州 遵义 563003)
目的 观察重组人血管内皮抑制素对血管瘤内皮细胞增殖的抑制作用,探讨其可能的作用机制。方法 体外培养的血管瘤内皮细胞受到重组人血管内皮抑制素的作用后,采用MTT法检测血管瘤内皮细胞增殖,流式细胞术检测血管瘤内皮细胞周期,实时荧光定量PCR技术检测VEGF、KDR mRNA在血管瘤内皮细胞中的表达。结果 重组人血管内皮抑制素各浓度组在24、48、72 h 3个作用时段对血管瘤内皮细胞抑制作用显著(P<0.01),并存在明显的剂量依赖关系,IC50=355 μg/mL;重组人血管内皮抑制素(250 μg/mL)干预24 h后,G0/G1期细胞比例(94.23±1.66)%较对照组(90.63±1.14)%有明显增多,差异有统计学意义(P<0.05);VEGF 与Flk-1 mRNA的表达相比对照组明显降低(P<0.05)。结论 血管瘤内皮细胞周期受到重组人血管内皮抑制素抑制作用,同时VEGF、FLK-1的表达也受到其有效抑制。
血管瘤;血管内皮细胞;重组人血管内皮抑制素;增殖;细胞周期
血管瘤(hemangioma)是婴幼儿最常见的良性肿瘤之一,发病率高达 5%~10%[1],瘤体内注射药物是目前治疗血管瘤最安全、有效的方法。随着血管生长因子和血管生长抑制剂研究的发展,许多抗肿瘤血管生长的药物被用来治疗血管瘤[2],重组血管内皮抑素(rh-endostatin-16,YH-16)一种球蛋白,在自身靶细胞附着,获取途径为表达和纯化结肠埃(舍利)希杆菌的第九氨基酸序列。最新研究表明,VEGF的信号激发直接影响血管内皮抑素的抗血管生成效应,血管内皮抑素对VEGF诱导的KDR/Flk-1的酪氨酸磷酸化存在直接抑制作用。因此,对血管内皮抑素和VEGF的信号通路关系进行深入的研究具有重要临床意义。本研究将探讨重组人血管内皮抑制素对体外培养的血管瘤血管内皮细胞的影响,及其对血管瘤内皮细胞周期的影响,并检测VEGF、KDR在血管瘤内皮细胞中的表达情况,以此为血管瘤的局部药物治疗提供实验依据。
1 材料与方法
1.1 标本来源 从1例4个月婴幼儿左肘部血管瘤中获取血管瘤标本,瘤体具有巨大的体积和较快的增长速度,患儿具有严重的瘙痒症状,家属强烈要求手术切除并同意征用标本。
1.2 主要试剂和仪器 重组人血管内皮抑制素(山东先声麦得津生物制药有限公司,国药准字S20050088)、M199培养基(美国Sigma公司)、MTT试剂盒和细胞周期检测试剂盒(南京凯基生物技术有限公司)、ELISA试剂盒(美国RnD公司)。
流式细胞仪(美国Beckman Coulter公司产品)、荧光定量PCR仪(CFX connect,BIO-RAD,美国)、全波长酶标仪(美国Thermo公司)。
1.3 细胞培养、传代和细胞接种 体外原代培养的血管瘤内皮细胞,并向培养瓶中移入悬液,在37 ℃、5%CO2培养箱内放置。定期换液(3~4天1次),待细胞汇合成片将瓶底铺满后开始传代。用2 mL 0.25%胰蛋白酶将细胞消化,待细胞皱缩呈球形时将胰蛋白酶吸出来,将10 mL 10% M199培养基加入使消化终止。对细胞进行仔细吹打使其呈细胞悬液,按1:2的比例在培养瓶中接种,放置并培养于培养箱中,CO2体积分数、温度和湿度分别为5%、37 ℃和饱和,待细胞将瓶底铺满后就可以再次传代,传代过程中应用0.25%胰蛋白酶。用0.25%胰蛋白酶消化贴壁血管瘤内皮细胞后向离心管内移送,同时将适量M199培养基加入稀释到每管7 mL,反复细致地混匀、计数,使细胞密度为8×105个/mL左右。之后在3块96孔培养板中接种细胞,将100 μL细胞悬液加入到每孔中,移入并培养于CO2体积分数为5%、温度为37 ℃、湿度饱和的培养箱中进行24 h的培养。
1.4 四甲基偶氮唑盐溶液法(MTT法)检测血管瘤内皮细胞增殖 MTT检测分为7组,分别为正常对照组、重组血管内皮抑制素处理组:15.625、31.25、62.5、125、250、500 μg/mL组。具体操作如下,在1000 μL无血清M199培养基中加入500 μL重组血管内皮抑制素稀释成所需浓度500 μg/mL,然后将其稀释成6种不同浓度,即15.625、31.25、62.5、125、250 μg/mL,配置过程中严格依据倍比稀释法。吸尽96孔板中培养基后,将上述6种不同浓度100 μL重组血管内皮抑制素加入各孔,每个浓度下8个复孔,设无细胞的空白孔和没有加药物的对照孔,然后分别于给药后24、48、72 h进行MTT实验。
取20 μL的5 mg/mL MTT加入到96孔板每孔中,在恒温孵箱中进行5 h的培养,CO2体积分数、温度分别为5%、37 ℃,培养终止,并将150 μL二甲基亚砜(DMSO)加入到每孔中,在酶标仪上振荡10min,在490 nm波长处测定各孔吸光度(OD值)。每组进行3次重复,取平均A值。用下列公式计算出各药物浓度的细胞存活抑制率:抑制率=(1-加药细胞OD值/ 对照细胞A值)×100%。然后通过药物浓度和相应抑制率计算出半抑制率IC50。
1.5 流式细胞技术检测血管内皮抑制素对血管瘤内皮细胞周期的影响 流式细胞术分对照组与干预组,其中干预组采用MTT实验最接近IC50的重组血管内皮抑制素浓度组进行。使用普通离心机调整转速1 000 r/min,离心5 min后弃上清;用PBS缓冲液洗涤细胞2次,1 000 r/min离心5 min后弃上清;在离心好的细胞中加入体积分数为70%的冷乙醇500 μL固定,-20 ℃保存;1000 r/min,离心5 min,去乙醇后再予PBS缓冲液洗涤细胞2次;加入50 μL RNase-A,并在37 ℃水浴箱中孵育30 min以完全裂解RNA;每管中加入PI染色液150 μL并轻轻吹打混匀,4 ℃避光孵育30 min。
1.6 荧光定量PCR检测血管瘤内皮细胞中VEGF、KDR mRNA表达 Trizol法提取血管瘤内皮细胞总RNA,紫外分光光度计上分别测定其260 nm和280 nm处的OD值(以DEPC水调零),以1.8≤OD260/OD280≤2.2认为RNA 纯度符合要求。将提取的RNA逆转录为cDNA,逆转录体系为20 μL,包括5×PrimeScriptTMBuffer 2 μL,Oligo dT Primer(50 μmol/L) 0.5 μL,Random 6 mers(100 μmol/L) 0.5 μL,PrimeScriptTMRT Enzyme MixⅠ 0.5 μL,总RNA 1 μg,用水补足至20 μL,条件是37 ℃ 15 min,85 ℃ 5 s。随后进行实时定量PCR扩增,体系20 μL如下,SYBR Green SupermixTM10 μL,cDNA溶液2 μL,PCR Primer 1.6 μL,RNase Free dH2O 6.4 μL,反应条件为95 ℃,3 min预变性;95 ℃,10 s变性;60 ℃×1 min退火,40循环;溶解曲线分析55 ℃ 10 s,80 Cycles。引物由大连宝生物技术有限公司设计合成,VEGF 上游5′-AGGCCAGCACATAGGAGAGA-3′, 下游3′-TTTCTTG-CGCTTTCGTTTTT-5′,扩增片段长度为133bp;Flk-1上游5′-GTGACCAACATGGAGTCGTG-3′,下游3′-TGCTTCACAGAAG-ACCATGC-5′,扩增片段长度为218bp;β-actin上游5′-GGACTTC-GAGCAAGAGATGG-3′,下游3′-AGCACTGTGTTGGCGTACAG-5′,扩增片段长度为234 bp。

2 结果
2.1 血管瘤内皮细胞增殖受到不同浓度的重组血管内皮抑制素的影响 6个浓度组的血管瘤内皮细胞均受到重组血管内皮抑制素的一定的抑制作用,抑制率随浓度和时间的增加逐渐上升,对细胞增殖的抑制作用随着浓度的升高而增大,具有剂量依赖抑制关系,IC50=355 μg/mL。

表1 不同浓度的重组血管内皮抑制素对血管瘤内皮细胞增殖的影响±s,n=8)Tab.1 Effects of different concentrations of recombinant endostatin on the proliferation of vascular tumor endothelial cells ±s,n=8)
*P<0.05,**P<0.01,与正常对照组比较,compared with control group ;△P<0.05,△△P<0.01,与15.625 μg/mL组比较,compared with 15.625 μg/mL group
2.2 流式细胞技术检测血管内皮抑制素对血管瘤内皮细胞周期的影响 IC50=355 μg/mL,因此选取250 μg/mL浓度组进行干预,重组人血管内皮抑制素干预24 h后G0/G1期细胞比例(94.23±1.66)%,较对照组(90.63±1.14)%,显著增多(t=-3.09,P<0.05)。

图1 血管内皮抑制素对血管瘤内皮细胞周期的影响±s,n=3)Fig.1 Effect of endostatin on the cell cycle of vascular tumor endothelial ±s,n=3)
2.3 Real-time PCR检测结果 重组人血管内皮抑制素(250 μg/mL)作用后的细胞中VEGF与Flk-1 mRNA的表达明显降低(P<0.05)。
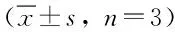
表2 Real-time PCR检测各组p57KIP2 mRNA的表达情况Tab.
#P<0.05,与对照组相比,compared with control group
3 讨论
现阶段,临床在治疗肿瘤的过程中已经极为广泛地应用了重组人血管内皮抑素[3-6],其是一种内源性血管生成抑制剂。如果血管瘤内皮细胞处于增殖状态,那么YH-16能对其进行特异抑制,但是如果内皮细胞处于静止状态或细胞起源于非内皮细胞,那么YH-16则不会对其造成影响,在抑制新生血管中有其独特优势,其通过在内皮抑素的N端加上9个氨基酸残基序列,使其较内皮抑素蛋白对酶、酸、热的稳定性更佳,据研究重组人血管内皮抑素可靶向一部分的人类基因组血管生成调节基因,抑制血管内皮的生长和迁移,促进其凋亡,以显著减少肿瘤组织内生成新血管,以此发挥抑制肿瘤生长和转移的作用[7]。临床前期相关医学学者研究显示,其在血管内皮细胞直接作用,能够对新生血管进行有效抑制,疗效及安全性均较好[8-9]。目前已有研究报道重组人血管内皮抑素可以通过影响血管瘤的凋亡进而导致血管瘤消退[10-11]。但是否通过影响细胞周期来导致血管瘤消退未见相关报道。
VEGF属于一种细胞因子,是一类糖蛋白,分子量为34~45KD,具有强大的功能,且能够产生多种生物学效应,Ferrarra在1989年将其分离纯化出来,主体为牛垂体滤泡星状细胞培养液,在血小板衍生生长因子家族中占有极为重要的地位,具有高度保守的序列,在人和动物体内的大脑、肝脏、胰腺等组织中广泛分布。VEGF具有多方面的作用,如为血管内皮细胞增殖及血管支持物生成提供良好的前提条件,促进血管通透性的增加,对肿瘤细胞的凋亡进行有效抑制等。VEGF因其能促进血管生成,故在肿瘤生长中必不可少。FLK-1结构为:细胞外7个相同的免疫球蛋白区,一个跨膜区和细胞内一个酪氨酸激酶区,FLK-1与VEGF、VEGF-B和PIGF有高度亲和力结合。VEGF在多种肿瘤组织中如胃癌、大肠癌及乳腺癌中都发现VEGF的表达与组织分化、淋巴结转移和早期死亡密切相关[12-13]。近年来,阻断VEGF作用的各种抑制剂有了长足的发展,其作用机制包括:①抑制VEGF于受体直接结合;②抑制VEGF的合成;③抑制VEGF的信号转导[14];而有研究发现重组人血管内皮抑素可以通过抑制VEGF的合成,进而导致肿瘤的消退,但重组人内皮细胞是否在血管瘤中同样通过抑制VEGF及其受体的表达进而通过影响其周期而导致血管瘤消退,未见相关报道。本实验通过利用重组人血管内皮抑制素干预血管瘤周期,并同时利用PCR检测VEGF及其受体FLK-1的表达,重组人血管内皮抑制素干预24 h后,VEGF、FLK-1的表达相比对照组,差异有统计学意义。提示:重组人血管内皮抑制素可能通过抑制VEGF的表达而抑制血管瘤的周期进而导致血管瘤消退。
本研究结果表明,YH-16各浓度组在24、48及72 h 3个作用时段对血管瘤内皮细胞抑制作用显著(P<0.01),并存在明显的剂量依赖关系;重组人血管内皮抑制素干预24 h后,G0/G1期细胞比例(94.23±1.66)%较对照组(90.63±1.14)%有明显增多,差异有统计学意义(P<0.05);VEGF的表达相比对照组,差异有统计学意义(P<0.05);FLK-1相比对照组,差异有统计学意义(P<0.05),充分说明了血管瘤内皮细胞周期受到重组人血管内皮抑制素抑制作用,同时VEGF、FLK-1的表达也受到其有效抑制,值得临床充分重视。
[1] Drolet BA, Esterly NB, Frieden IJ.Hemangiomas in Children[J].N Engl J Med,1999,341(3):173-181.
[2] Marler JJ, Rubin JB, Trede NS, et al.Successful antiangiogenic therapy of giant cell angioblastoma with interferon alpha 2b: Report of 2cases[J].Pediatrics,2002, 109(2): E37.
[3] 张宝南,魏志鹏.恩度联合肝动脉化疗栓塞对原发性肝癌血管内皮生长因子表达的影响[J].海南医学,2010,21(19):9-11.
[4] 倪庆桂,汪振诚,徐根兴,等.人内皮抑素的基因克隆及其表达产物的抗肿瘤活性[J].南京军医学院学报,2002(1):1-3.
[5] Zhang DW,LI HL,Yao Q,et al.The Synergistic Effect of Recombinant Human Endostatin(YH-16) Combined with Oxaliplatin on Human Colorectal Carcinoma[J].J Int Med Res,2010,38 (1):111-126.
[6] Huita WU,Jie DENG,Shiying YU,et al.The Inhibitory Effects of Rh-endostatin(YH-16) in Combination with Radiotherapy on Lung Adenocarcinoma A549 in Mice and the Underlying Mechanisms[J].J Huazhong Univ Sci Techno,2010,30(1):108-112.
[7] Monk BJ,Tewari KS,Koh WJ.Multimodality therapy for locally advanced cervical carcinoma:state of the art and future directions[J].J Clin Oncol,2007,25(20):2952-2965.
[8] Mendoza L, Valcárcel M, Carrascal T, et al.Inhibition of cytokine induce microvascular arrest of tumor cells by recombinant endostatin prevents experimental hepatic melanoma metastasis[J].Cancer Res,2004,64(1):304-310.
[9] Velde EA, Reijerkerk A, Brandsma D, et al.Early endostatin treatment inhibits metastatic seeding of murine colorectal cancer cells in the liver and their adhension to endostatin cells[J].Br J Cancer,2005,92(4):729-735.
[10] 张翅,金先庆.重组人血管内皮抑素对鼠血管瘤内皮细胞株EOMA增殖的影响[J].中华小儿外科杂志,2008,29(8):475-478.
[11] 段红钰,陈石海,刘柳,等.内皮抑素和平阳霉素对血管内皮细胞的作用[J].中国美容医学.2010,19(12):1815-1819.
[12] 李颖嘉,文戈,王倩.VEGF及其主要受体Flk-1/KDR在乳腺良恶性肿瘤中的 表达及其意义[J].南方医科大学学报,2009,29(1):70-74.
[13] 刘鑫,王常林,刘之彬,等.肾母细胞瘤VEGF及其受体Flk-1的表达及其临床意义[J].中华小儿外科杂志,2010,31(8):565-569.
[14] Al-Latayfeh M, Silva PS, Sun JK,et al.Antiangiogenic therapy for ischemic retinopathies[J].Cold Spring Harb Perspect Med,2012,2(6):a006411.
(编校:谭玲)
Effects of recombinant human endostatin on proliferation, cell cycle and expression of KDR/FIK-1 and VEGF in hemangioma endothelial cells in vitro
CAO Jiang, YU Song, LV Xin
(Department of Pediatric Orthopedic Surgery, Affiliated Hospital of Zunyi Medical College, Zunyi 563003, China)
ObjectiveTo observe inhibitory effect of recombinant human endostatin on the proliferation of vascular tumor endothelial cells and to investigate its possible mechanism.MethodsHemangioma endothelial cells were cultured in vitro and different concentrations of endostatin on hemangioma endothelial cell proliferation inhibition were detected by MTT method.Effect of recombinant human endostatin on endothelial cell cycle was detected by flow cytometry.The expression of VEGF, KDR mRNA in hemangioma endothelial cell were detected by Real-time RT PCR.ResultsRecombinant human endostatin concentrations in 24 h, 48 h and 72 h after three period during which the hemangioma endothelial cells inhibited significantly(P<0.01), and there was a clear dose dependence,IC50 was 355 μg/mL.Recombinant human vascular endostatin(250 μg/mL) intervented for 24 hours, the proportion of cells in G0/G1 phase(94.23±1.66)%, compared with control group (90.63±1.14)%, had significantly difference (P<0.05).Compared with the control group, the difference of the expression of vascular endothelial growth factor (VEGF) was statistically significant (P<0.05) as well as Flk-1 (P< 0.05).ConclusionRecombinant human endostatin does not only have inhibitory effect of hemangioma endothelial cell cycle, but also can inhibit the expression of VEGF and FLK-1.
hemangioma; vascular endothelial cells; recombinant human endostatin; proliferation; cell cycle
国家自然科学基金(No.81460476)
曹江,男,硕士,主治医师,研究方向:小儿血管瘤,E-mail: 448084715@qq.com。
R53
A
1005-1678(2015)06-0031-04
