甲氨蝶呤联合复方风湿宁对类风湿性关节炎滑膜成纤维细胞Treg/Th17免疫平衡的影响
2015-07-07李晓佳赵迎杰孙广臣
李晓佳,赵迎杰,孙广臣
(1.桂林医学院 免疫学教研室,广西 桂林 541000;2.山西医科大学第二临床医院 骨科,山西 太原 030001;3.桂林医学院 药学院,广西 桂林 541000)
甲氨蝶呤联合复方风湿宁对类风湿性关节炎滑膜成纤维细胞Treg/Th17免疫平衡的影响
李晓佳1,赵迎杰2,孙广臣3Δ
(1.桂林医学院 免疫学教研室,广西 桂林 541000;2.山西医科大学第二临床医院 骨科,山西 太原 030001;3.桂林医学院 药学院,广西 桂林 541000)
目的 研究复方风湿宁(compound Fengshining,FSN)联合甲氨蝶呤(methotrexate,MTX)对类风湿性关节炎(rheumatoid arthritis,RA)滑膜成纤维细胞(fibroblast-like synoviocytes,FLS)Treg/Th17免疫平衡的影响。方法 体外培养RA FLS,分别用FSN和MTX处理,分为FSN 1、2、3组(0.01、0.1、1.0 mg/mL FSN),MTX 1、2、3组(0.01、0.1、1.0 mg/mL MTX),联合1、2、3组(0.01 mg/mL FSN+0.01 mg/mL MTX、0.1 mg/mL FSN+0.1 mg/mL MTX、1.0 mg/mL FSN+1.0 mg/mL MTX),并以未加药的培养基作为对照组,共10组。采用MTT法检测各组RA FLS增殖情况,Real-time PCR法检测各组IL-10、IL-17、Foxp3、ROR-γt mRNA表达,ELISA检测各组IL-10、IL-17、IL-22水平。结果 FSN各组、MTX各组和联合各组FLS增殖OD值均低于对照组,尤以联合2组降低最显著(P<0.05)。FSN2组、MTX2组和联合2组IL-10 mRNA、Foxp3 mRNA表达均高于对照组,ROR-γt mRNA表达低于对照组,尤以联合2组变化显著(P<0.05)。FSN2组和联合2组IL-17mRNA表达均低于对照组,以联合2组降低显著(P<0.05)。FSN2组、MTX2组和联合2组IL-10水平均高于对照组、IL-22水平均低于对照组,以联合2组变化明显(P<0.05)。联合2组IL-17水平低于对照组(P<0.05)。结论 FSN联合MTX能够抑制RA FLS增殖,升高IL-10、Foxp3表达,降低IL-17、ROR-γt表达,调节Treg/Th17免疫平衡,以0.1 mg/mLFSN+0.1 mg/mL MTX的效应最为明显。
甲氨蝶呤;复方风湿宁;类风湿性关节炎;调节性T细胞
类风湿性关节炎(rheumatoid arthritis,RA)是一种慢性进行性自身免疫性疾病,以关节滑膜炎及对称性关节骨、软骨破坏为主要特征。多数患者发病时成纤维样滑膜细胞(fibroblast-like synoviocytes,FLS)存在病理性增生。RA病因尚不清楚,但多项研究表明它的发生与免疫异常有关,CD4+T细胞免疫功能紊乱是其发病的关键环节[1]。调节性T细胞(regulatory T cell,Treg)和辅助性T淋巴细胞17(T helper cell 17,Th17)是近年来发现的新型T细胞亚群,在分化、发育以及功能发挥的过程中受到Th1型、Th2型效应细胞以及自身分泌的细胞因子调节,参与自身免疫病、感染、肿瘤等疾病的发生和发展[2]。已有研究证实[3],在RA中存在一个重要平衡,即Treg/Th17 平衡,平衡一旦被破坏,将引发疾病,维持Treg/Th17的平衡对于RA 的治疗非常重要。通过对Treg和Th17分化发育和功能发挥过程中关键因子进行增强或抑制,可以调节Treg/Th17的平衡关系,用于RA预防和治疗。
复方风湿宁和甲氨蝶呤均为临床上治疗RA常用药物。其中FSN有效成分从七叶莲、宽筋藤、两面针等中药提取,具有祛风、除湿、止痛的作用,同时还能发挥活血、散瘀、解毒功能[4];MTX是一种叶酸还原酶抑制剂,能够抑制二氢叶酸还原为有生理活性的四氢叶酸,进而抑制DNA的生物合成,可有效抑制自身免疫反应过度激活[5]。FSN和MTX均为临床上治疗RA的核心药物,但其抗RA的机制是否与调节Treg/Th17免疫平衡有关目前尚未明确。为此,本课题将探讨FSN联合MTX对RA FLS Treg/Th17免疫平衡的影响及其意义。
1 材料与方法
1.1 材料 人关节滑膜组织取自桂林医学院附属医院收治并行膝关节置换术的RA患者,采集后保存于无菌含双抗Hank’s液中,并于30 min之内转移至实验室进行细胞培养。RA患者符合中华医学会风湿病学分会《类风湿关节炎诊治指南》[6]诊断标准,告知患者研究事项,且患者均签署知情同意书。收住院后完善术前检查,进行关节镜下滑膜切除术。
1.2 方法
1.2.1 仪器及试剂:低温高速离心机(TGL20M,麦尚仪器);酶标分析仪(318C,上海精科);梯度 PCR 扩增仪(600,Takara)。
甲氨蝶呤注射剂(齐鲁制药,国药准字H20045628)、复方风湿宁注射剂(广东罗浮山国药,国药准字Z20027146),溶于无菌生理盐水,调整初浓度均为10 mg/mL,临用前稀释成所需要的浓度。DMEM培养基、胎牛血清、胰蛋白酶及I型胶原蛋白酶(GIBCO);β-actin、IL-10、IL-17、Foxp3、ROR-γt引物(上海玉博生物科技有限公司);四甲基偶氮唑盐(上海生工);RNA提取试剂盒(美国Promega公司);逆转录试剂盒(美国Invitrogen公司);IL-10、IL-17、IL-22 ELISA试剂盒(CUSABIO公司)。
1.2.2 RA FLS细胞培养:滑膜组织在无菌条件下PBS液冲洗3次,剪取滑膜时剔除连带血管、脂肪及软组织,取出滑膜后用PBS液冲洗3次。将滑膜剪到最小为止,1000 r/min离心5 min,弃上清,用4 mg/mL的I型胶原蛋白酶消化120 min(37 ℃、5% CO2恒温孵育)后1000 r/min离心10 min,弃上清,用PBS重悬,再次1000 r/min离心10 min,弃上清,最终悬浮于含青-链霉素(100 U/mL)及10%FBS DMEM培养液,37 ℃、5% CO2恒温孵育。72 h后更换培养液,第一次换液时采取半量换液法,此后隔天换液,显微镜下观察细胞生长情况。当原代细胞长满瓶底时,以胰酶消化进行传代培养。并留取3~4代稳定细胞用于本次实验。
1.2.3 细胞分组及干预:取对数生长期的RA FLS,用胰酶消化,调整细胞浓度为5×104个/mL,接种于96孔板,每孔100 μL,继续培养24 h后吸弃培养基,按照不同药物处理方法设置10个分组:FSN 1、2、3组(0.01、0.1、1.0 mg/mLFSN),MTX 1、2、3组(0.01、0.1、1.0 mg/mL MTX),联合1、2、3组(0.01 mg/mL FSN+0.01 mg/mL MTX、0.1 mg/mL FSN+0.1 mg/mL MTX、1.0 mg/mLFSN+1.0 mg/mL MTX),并以未加药培养基作为对照组。
1.2.4 FLS增殖检测方法:采用MTT法测定细胞增殖能力,方法如下:给药后继续培养48 h,每孔加入5 mg/mL的MTT 20 μL,在孵箱中继续培养4 h,待培养基颜色变为深蓝色后吸除液体,加入150 μL DMSO溶液,在摇床上快速震荡10 min使细胞充分裂解,而后在酶标仪上测定570 nm处的吸光度(OD)值。计算细胞增殖抑制率:IR(%)=(1-A给药/A对照)×100%,6个复孔均值作为一组结果。
1.2.5 mRNA含量检测方法:采用RT-PCR方法检测,取对数生长期的RA FLS,调整细胞浓度为3×104个/mL,接种于24孔板,每孔500 μL,继续培养24 h后吸弃培养基加入含药培养基进行药物干预,据1.2.3结果选取联合2组,FSN2组,MTX2组及不加药培养基作为对照组,共4组。加药后继续培养24 h,后收集细胞于1.5 mL离心管中,5000 r/min 4 ℃离心5 min吸出上清液(ELISA备用),加入Trizol,严格按照试剂盒说明书提取RNA,并采用1.2%琼脂糖凝胶电泳测定其分子质量。反转录合成cDNA(严格按照试剂盒说明书操作),检测mRNA含量时,采用RT-PCR试剂盒分别扩增β-actin、IL-10、IL-17、Foxp3、ROR-γt,PCR循环扩增条件为:95 ℃ 5 min,(95 ℃ 30 s;β-actin、IL-10、IL-17、Foxp3、ROR-γt分别58 ℃、55 ℃、55 ℃、57 ℃、56 ℃1 min;72 ℃ 1 min)34个循环,72 ℃延伸10 min,4 ℃ 30 min。
所用引物序列如下:

表1 RT-PCR引物序列Tab.1 RT-PCR primers sequences
取PCR产物在1.2%琼脂糖凝胶电泳,EB染色,紫外线下识别电泳条带,用凝胶成像分析软件分析,以特异性产物扩增条带灰度值与内参条带灰度值之比为半定量数据,分析4组基因表达水平,计算目的基因mRNA的相对含量,3个均值作为一组结果。
1.2.6 IL-10、IL-17、IL-22水平:以3000 r/min离心20 min取上清液(取1.2.5中提取RNA前吸出的上清液),用ELISA法对IL-10、IL-17、IL-22水平进行检测,严格按照说明书操作,测定吸光度,根据标准曲线计算IL-10、IL-17、IL-22浓度,8个复孔均值作为一组结果。

2 结果
2.1 MTT检测OD值及抑制率比较 MTT检测结果显示,与对照组相比,FNS各组、MTX各组和联合各组FLS增殖OD值均降低(P<0.05),但以联合2组增殖OD值降低最明显(P<0.05),抑制率最高。见表2。
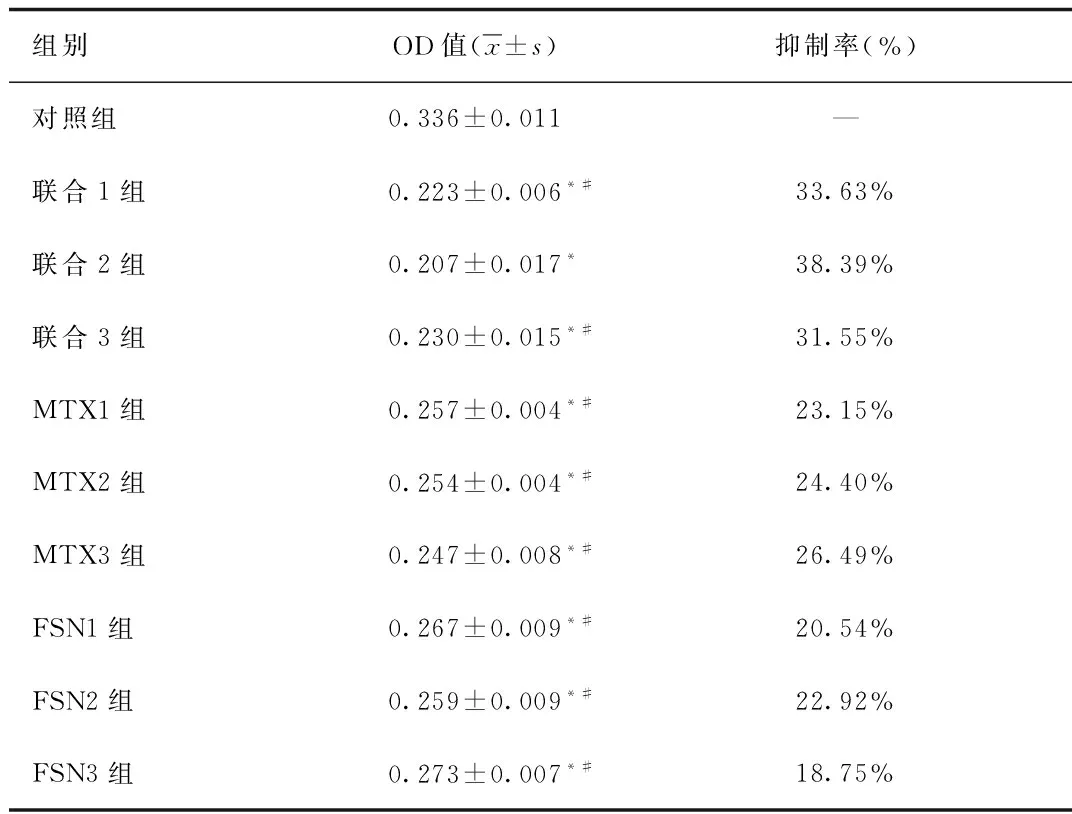
表2 各组纤维样滑膜细胞增殖OD值与抑制率比较(n=6)Tab.2 Comparison of OD values of FLS proliferation and inhibition rate(n=6)
*P<0.05,与对照组比较,compared with control group;#P<0.05,与联合2组比较,compared with combination group 2
2.2 IL-10、IL-17、Foxp3,ROR-γt的mRNA含量 各组RT-PCR凝胶电泳图见图1。与对照组比较,联合2组、MTX 2组、FSN 2组IL-10、Foxp3 mRNA含量明显升高(P<0.05);联合2组、FSN 2组IL-17、ROR-γt mRNA含量明显降低(P<0.05);MTX 2组ROR-γt mRNA 含量明显降低(P<0.05)。与联合2组比较,MTX 2组、FSN 2组IL-10、Foxp3 mRNA含量明显降低(P<0.05);IL-17、ROR-γt mRNA含量明显升高(P<0.05)。见表3。
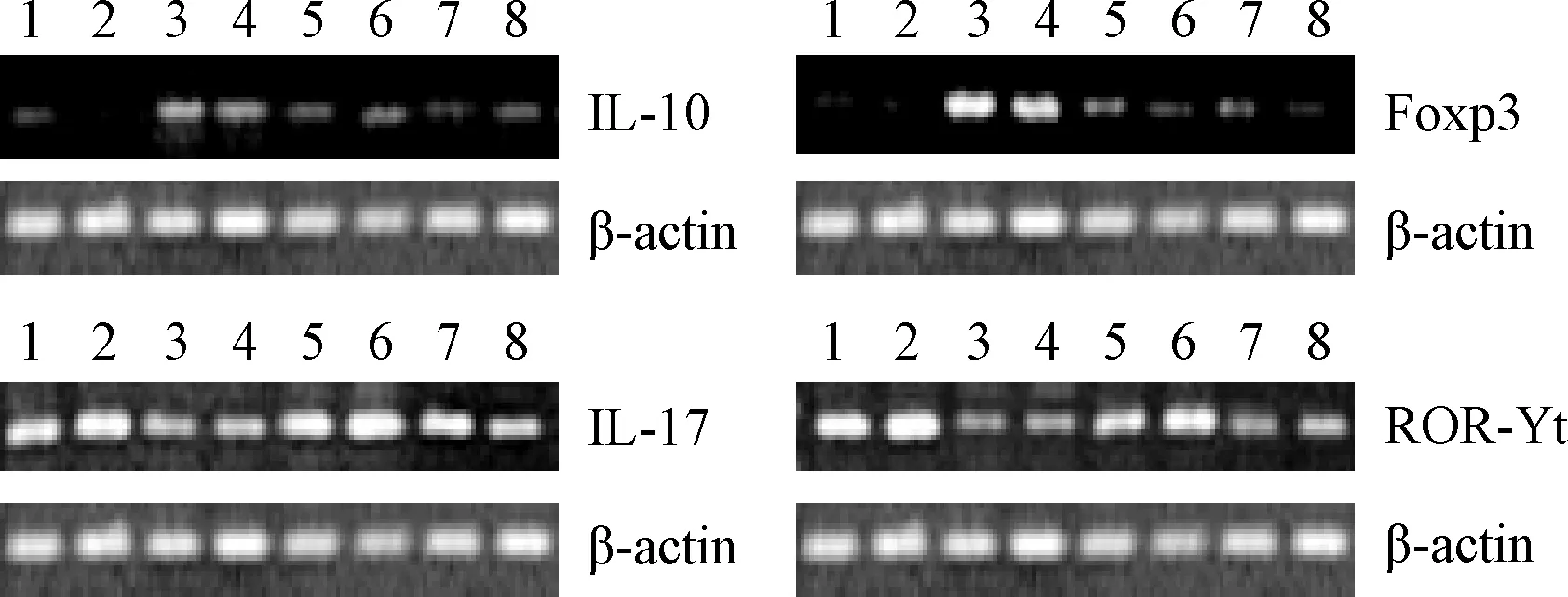
图1 各组RT-PCR凝胶电泳图1-2:对照组,3-4:联合2组,5-6:MTX2组,7-8:FSN2组Fig.1 RT-PCR gel electrophoresis figure of each group1-2:control group,3-4:combination group 2,5-6:MTX group 2,7-8:FSN group 2
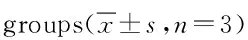
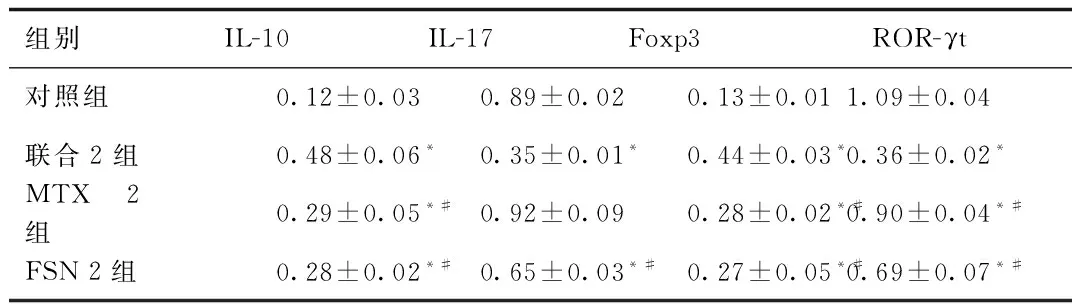
组别IL-10IL-17Foxp3ROR-γt对照组0.12±0.030.89±0.020.13±0.011.09±0.04联合2组0.48±0.06*0.35±0.01*0.44±0.03*0.36±0.02*MTX2组0.29±0.05*#0.92±0.090.28±0.02*#0.90±0.04*#FSN2组0.28±0.02*#0.65±0.03*#0.27±0.05*#0.69±0.07*#
*P<0.05,与对照组比较,compared with control group;#P<0.05,与联合2组比较,compared with combination group 2
2.3 IL-10、IL-17、IL-22水平 与对照组相比,联合2组、MTX 2组、FSN 2组IL-10水平增高(P<0.05);与联合2组相比,MTX 2组、FSN 2组IL-10水平降低(P<0.05)。与对照组相比,联合2组IL-17水平降低(P<0.05)。与对照组相比,联合2组、MTX 2组、FSN 2组IL-22水平降低(P<0.05);与联合2组相比,MTX 2组、FSN 2组IL-22水平增高(P<0.05)。见表4。
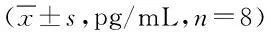
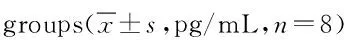
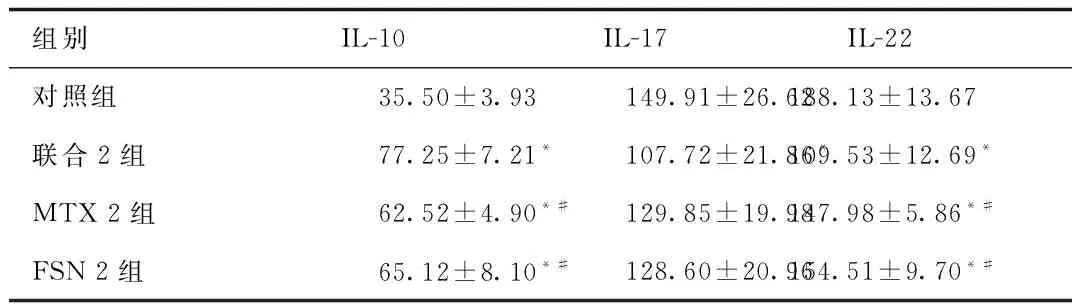
组别IL-10IL-17 IL-22对照组35.50±3.93149.91±26.62188.13±13.67联合2组77.25±7.21*107.72±21.86*109.53±12.69*MTX2组62.52±4.90*#129.85±19.98147.98±5.86*#FSN2组65.12±8.10*#128.60±20.96154.51±9.70*#
*P<0.05,与对照组比较,compared with control group;#P<0.05,与联合2组比较,compared with combination group 2
3 讨论
FLS过度增生和局部炎性反应是RA的两大临床病理特征,研究表明[7],RA发病过程中,FLS可由正常水平的1~3层细胞增至15 层以上;且增生的FLS具有类似肿瘤细胞的高侵袭性,凋亡反应受到抑制,持续分泌大量基质金属蛋白酶,破坏软骨组织。因此治疗RA最重要的是要保护滑膜。本次实验以RA FLS为研究对象,探讨FSN联合MTX是否可抑制骨破坏及其可能机制。并采用MTT法分析了滑膜细胞的增殖情况,结果显示:FSN和MTX治疗后均能抑制FLS的增殖(P<0.05),但以2者联合使用时抑制率最为明显,且以0.1 mg/mL FSN+0.1 mg/mL MTX抑制率最高。
辅助性T细胞亚群Th1和Th2是最先被认识的T细胞亚群,Th1/Th2比例失衡是导致自身免疫性疾病发生的关键环节[8]。Th1细胞所分泌的细胞因子具有促炎、加强免疫反应的作用,而Th2型细胞因子则能抑制Th1细胞的功能。RA患者多存在Th2细胞功能减弱、无法有效抑制自身免疫反应的情况[9]。Treg 和Th17细胞是新近发现的CD4+T细胞亚型,已有文献报道[13]表明,Treg和Th17细胞在RA的致病过程中发挥着极为重要的作用,调节Th17/Treg平衡已逐渐成为治疗RA的新途径,进一步推进了对RA 发病机制的研究阶段,成为治疗RA研究的又一热点。
Treg是一群包含了CD4+T细胞、CD8+T细胞以及自然杀伤细胞的一群具有免疫调节功能的T细胞亚群,其中以CD4+CD25+Treg最为重要[10]。CD4+CD25+Treg能够抑制抗原递呈细胞的功能、降低致炎因子分泌、维持免疫内环境稳定的功能[11]。Foxp3是Treg细胞表面最可靠的标志物,在绝大多数CD4+CD25+Treg细胞中均有表达[12],Foxp3发挥转录因子的作用,能够促进免疫抑制因子IL-10等的分泌,具有负性免疫调节以及维持自身免疫耐受的功能。Th17细胞是一群能够分泌白细胞介素-17的CD4+T细胞亚群,不仅可以大量分泌IL-17,还能产生IL-21、IL-22,具有极强的促炎作用,能够促进滑膜细胞分泌多种细胞因子、抑制软骨基质合成、增强破骨细胞的功能,最终造成骨质破坏[13]。在RA患者体内,ROR-γt的转录因子功能增强、IL-17含量增多,且Foxp3的转录因子功能减弱[14]。然而,目前有关FSN联合MTX治疗RA与Treg/Th17之间的关系还未见报道,为此本实验采用FSN和MTX联合干预RA FLS后,Real-time PCR法检测各组细胞IL-10及其转录因子Foxp3、IL-17及其转录因子ROR-γt的mRNA表达,并用ELISA法检测各组IL-10、IL-17水平。结果显示,MTX与FSN联合用药可以显著增加IL-10、Foxp3表达并降低IL-17、ROR-γt的表达,达到调节Treg/Th17平衡的目的。
Th17细胞分泌产生的另一种炎症因子IL-22,在炎症免疫性疾病的发病机制中介导了重要环节。IL-22能促进RA成纤维样滑膜细胞增殖及趋化因子的分泌,是RA发病中一种重要的炎性因子[15]。新近研究显示,RA患者的滑膜液中存在大量的IL-22,IL-22缺陷的CIA模型鼠,关节炎的发病率和炎症严重程度降低[16],且IL-22能促进RA滑膜细胞增殖,提示IL-22在RA中的致病性[17]。IL-22高表达还可促进纤维细胞膜表面RANKL增加,加速破骨细胞生成。故IL-22可作为RA早期骨侵蚀的血清学标志,预测发病程度。本研究在前期实验中对IL-22做过重点考察,发现MTX和FSN均能降低RAFLS IL-22 mRNA表达水平,且联合应用时效果最佳。本次实验采用ELISA法检测各组IL-22水平发现,2者联合用药显著降低IL-22水平,这与前期实验结果一致。
本实验提示,FSN联合MTX能够抑制滑膜成纤维细胞增殖,并可能通过增高IL-10、Foxp3提高Treg,降低IL-17、ROR-γt及IL-22的表达降低Th17,调节Treg/Th17免疫平衡,从而抑制破骨细胞形成,防止骨质破坏,控制RA病情,但是本实验由于样本量较小并且尚未进行动物实验对照,其作用机制有待进一步研究。
[1] 孔长旺,陈廖斌,汪晖,等.阿魏酸钠对大鼠抗原诱导性关节炎的影响[J].武汉大学学报(医学版),2011,32(1):40-43.
[2] Kleijwegt FS, Laban S, Duinkerken G, et al.Critical role for TNF in the induction of human antigen-specific regulatory T cells by tolerogenic dendritic cells[J].J Immunol,2010,185(3):1412-1418.
[3] 杨金娜,刘晓光,李覃,等.Th17/Treg平衡在类风湿关节炎中作用的研究进展[J].中国药理学通报,2013,29(8):1045-1048.
[4] 韩玉刚,王猛.风湿宁配合西药治疗类风湿性关节炎的临床应用[J].中国现代药物应用,2013,7(8):95.
[5] 庄铭城,陈荣庆.小剂量泼尼松联合甲氨蝶呤或来氟米特治疗类风湿关节炎的临床疗效[J].现代医院,2014,14(4):46-48.
[6] 中华医学会风湿病学分会.类风湿关节炎诊治指南(草案)[J].中华风湿病学杂志,2003,7(4):250-254.
[7] 姚瑶,葛卫红.来氟米特活性代谢物terifunomide联合甲氨蝶呤对类风湿性关节炎成纤维样滑膜细胞的影响[J].医药导报,2013,32(7):839.
[8] Carranza F, Falcon CR, Nunez N, et al.Helminth antigens enable CpG-activated dendritic cell to inhibit the symptoms of collagen-induced arthritis through Foxp3+ regulatory T cells[J].PLoS One,2012,7(7):e40356.
[9] 仝岩,任伟宏,赵航,等.类风湿关节炎患者外周血CD4+T细胞亚群的分析[J].细胞与分子免疫学杂志,2013,29(8):854-857.
[10] 李燕,胡俊平,巫婷婷.青蒿联合甲氨蝶呤对类风湿性关节炎患者血TNF-α、IL-10水平的影响[J].河南中医,2012,32(4):433-435.
[11] Kleijwegt FS, Laban S, Duinkerken G, et al.Critical role for TNF in the induction of human antigen-specific regulatory T cells by tolerogenic dendritic cells[J].J Immunol,2010,185(3):1412-1418.
[12] 蔡智慧,梁义娟,马幼菊,等.女性不孕患者血清、宫颈黏液中免疫性抗体及内膜组织中CD4+CD25+FoxP3调节性T淋巴细胞含量的检测[J].海南医学院学报,2015,141(2):231-233,237.
[13] 封桂英,郭明,宋鸿儒,等.以Th17/Treg为靶点治疗类风湿性关节炎的研究概述[J].时珍国医国药,2013,24(4):911-913.
[14] Matsuki F,Saegusa J,Miyamoto Y,et al.CD45RA-Foxp3(high) activated/effector regulatory T cells in the CCR7+ CD45RA-CD27+CD28+central memory subset are decreased in peripheral blood from patients with rheumatoid arthritis[J].Biochem Biophys Res Commun,2013,438(4):778-783.
[15] Zenewicz LA,Flavell RA.Recent advances in IL-22 biology[J].Int Immunol,2011,23(3):159-163.
[16] Pan HF,Li XP,Zheng SG,et al.Emerging role of interleukin-22 in Autoimmune diseases[J].Cytokine Growth Factor Rev,2013,24(1):51-57.
[17] Roeleveld DM,Marijnissen RJ,vanden Berg WB,et al.A1.22 IL-22 Drives the initiation and augmentation of TH17-dependent experimental arthritis[J].Ann Rheum Dis,2014,73(Suppl 1):A9.
(编校:王俨俨)
Effect of compound Fengshining combined with methotrexate on Treg/Th17 immune balance in fibroblast-like synoviocytes of rheumatoid arthritis
LI Xiao-jia1, ZHAO Ying-jie2, SUN Guang-chen3Δ
(1.Department of Immunology, Guilin Medical University, Guilin 541000, China; 2.Department of Orthopaedics, The Second Hospital of Shanxi Medical University, Taiyuan 030001, China; 3.College of Pharmacy, Guilin Medical University, Guilin 541000, China)
ObjectiveTo study the effect of compound Fengshining (FSN) combined with methotrexate (MTX) on Treg/Th17 immune balance in fibroblast-like synoviocytes (FLS) with rheumatoid arthritis (RA).MethodsRA FLS were cultured in vitro and treated with FSN and MTX.They were divided into ten groups: FSN 1, 2, 3 groups (0.01, 0.1, 1.0 mg/mL FSN), MTX 1,2,3 groups (0.01, 0.1, 1.0 mg/mL MTX), combination 1,2,3 groups (0.01 mg/mL FSN+0.01 mg/mL MTX, 0.1 mg/mL FSN+0.1 mg/mL MTX, 1.0 mg/mL FSN+1.0 mg/mL MTX) and the medium without drugs as control group.FLS proliferation was detected by MTT method. IL-10,IL-17, Foxp3, ROR-γt mRNA were detected by real-time PCR method. IL-10, IL-17,IL-22 levels were detected by ELISA method.ResultsOD values of FLS proliferation in FSN groups, MTX groups and combination groups were significantly lower than those in control group, especially combination 2 group changed significantly (P<0.05).IL-10 mRNA, Foxp3 mRNA in FSN 2 group, MTX 2 group and combination 2 group were higher and ROR-γt mRNA were lower than those in control group, especially combination 2 group changed significantly (P<0.05).IL-17 mRNA in FSN 2 group and combination 2 group were lower than those in control group, especially the combination 2 group changed significantly (P<0.05).IL-10 level in FSN 2 group, MTX 2 group and combination 2 group were higher and IL-22 levels were lower than those in control group, especially combination 2 group changed significantly (P<0.05).IL-17 level in combination 2 group were lower than those in control group (P<0.05).ConclusionCompound Fengshining combined with methotrexate could inhibit RA FLS proliferation, elevate IL-10 and Foxp3 expression, reduce the IL-17 and ROR-γt expression and adjust Treg/Th17 immune balance; effect of 0.1 mg/mL FSN +0.1 mg/mL MTX is the most obvious.
methotrexate; compound Fengshining; rheumatoid arthritis; regulatory T cells
国家自然科学基金(81260462,81460474)
李晓佳,女,硕士,研究方向:免疫药理,E-mail:417517652@qq.com;孙广臣,通讯作者,男,博士,研究员,研究方向:免疫药理,E-mail:sungc2004@aliyun.com。
R593.2
A
1005-1678(2015)06-0006-04
