外源NO 缓解蝴蝶兰低温胁迫伤害的生理机制研究
2015-07-05牟雪姣刘理想孟鹏鹏金克炳
牟雪姣,刘理想,孟鹏鹏,金克炳
(安徽科技学院 城建与环境学院,安徽蚌埠234000)
蝴蝶兰(Phalaenopsis spp.)又名蝶兰,兰科蝴蝶兰属植物,有“洋兰皇后”之美誉,是目前国内外花卉市场上最畅销的中高档花卉之一[1]。蝴蝶兰喜暖畏寒,冬季10 ℃以下就会停止生长,低于5 ℃容易死亡 。蝴蝶兰在中国大部分地区均需在温室内种植,且要在早春和秋冬季节加温,生产成本较高。因此,探索外源物质缓解蝴蝶兰低温胁迫伤害的生理生化机制,提高蝴蝶兰对低温胁迫的适应性已成为重要课题之一。目前,国内外已对许多植物进行了低温胁迫方面的研究,但研究对象主要集中在水稻[3]、大豆[4]、黄瓜[5]、土豆[6]等粮食作物及蔬菜上,而对蝴蝶兰等花卉类植物材料的研究相对较少。
NO 为植物体内重要的信号分子,在植物逆境条件下发挥信号传导作用,能够缓解逆境胁迫对植物造成的伤害。NO 与植物抗逆性关系的研究已成为近年来的研究热点。焦娟等[7]研究发现,外源NO 能够提高黄瓜叶片抗氧化酶的活性,缓解硝酸盐胁迫对黄瓜幼苗的伤害;Singh 等[8]报道,外源NO 能够降低Cd诱导的氧化压力和膜脂质过氧化作用,缓解Cd对小麦根的毒害作用;Liao等[9]研究结果表明,外源NO 处理能提高干旱胁迫下万寿菊的叶绿素含量及下胚轴的可溶性糖和可溶性蛋白含量,降低淀粉含量,促进不定根的生长。另外,外源NO 处理能够降低低温胁迫下番茄果实的冷损伤指数,提高抗冷转录因子(LeCBF1)基因的表达,改善番茄果实的抗寒性[10];它也能够增强低温胁迫条件下小麦幼苗叶片中果聚糖生物合成酶(FBEs)的活性,提高叶片果聚糖的含量,从而降低低温胁迫对小麦幼苗叶片的损伤[11];它还可以通过保护光合系统Ⅱ,提高叶片不饱和脂肪酸含量,降低活性氧损伤等方面提高生姜幼苗的抗寒性[12]。
目前,有关NO 与植物抗逆性关系的研究,大多侧重于外源NO 对植株抗氧化酶活性、膜脂过氧化水平或渗透调节物质含量等生理指标的影响,且主要集中在逆境胁迫中的盐胁迫、干旱胁迫或重金属胁迫等方面,而针对外源NO 缓解蝴蝶兰低温胁迫伤害方面的生理机制研究目前鲜见报道。因此,本试验以蝴蝶兰幼苗为材料,研究外源NO 对低温胁迫条件下蝴蝶兰叶片细胞膜损伤及渗透调节物质含量、抗氧化酶活性等抗逆指标的影响,旨在阐明外源NO 缓解蝴蝶兰低温胁迫伤害的生理机制,为寻找缓解蝴蝶兰低温逆境伤害的有效措施,指导其高产栽培技术体系的建立提供理论依据。
1 材料和方法
1.1 试验材料
试验所用蝴蝶兰幼苗品种为‘台湾黄金’,苗龄15个月左右,生长健壮,具有4~5片叶,由上海三益农业生物技术有限公司提供。
1.2 材料培养与处理
选用长势均一、无病虫害、健壮的蝴蝶兰幼苗,先将其置于昼/夜温度为27 ℃/22 ℃、相对湿度(RH)70%~80%、光照时间昼/夜为10h/14h、白天光强为180mol·m-2·s-1的人工气候箱中预处理3d,并保证基质湿润、含水量均匀,使各植株生长一致。本实验共设置4组处理:对照组(CK),蒸馏水+常温;常温NO 处理组(NO),SNP+常温;低温胁迫处理组(L),蒸馏水+低温;低温NO 处理组(L+NO),SNP+低温。预处理结束后,在前期试验的基础上将幼苗随机分成4组,每组30盆;两组用浓度为200μmol·L-1的硝普钠(SNP)溶液进行叶面喷施,两组用蒸馏水进行叶面喷施,每天早晨喷施1次,连喷2d;喷药结束24h后,按设计要求分别置于常温(昼/夜:27 ℃/22 ℃)和低温(昼/夜:12 ℃/7 ℃)的人工气候箱内进行培养,光照强度、光照时间及湿度同预处理;分别在培养5d和10d后剪取每株顶端第1枚成熟叶片,用蒸馏水冲洗,干净纱布擦干,进行生理指标分析。
1.3 测定指标及方法
1.3.1 pH 值 叶片pH 的测定参照Kubota等[13]的方法。在蝴蝶兰上位第2片叶上取面积1cm2的叶片组织放入具塞刻度试管内,加入3mL 蒸馏水,微波加热2min,冷却至室温后用蒸馏水补足至15 mL,用精密pH 计(Phs-3C)测定稀释液的pH 值。
1.3.2 电解质渗漏率和丙二醛含量 质膜透性和膜质过氧化水平参照Michael等[14]的方法进行测定,质膜透性以相对电解质渗漏率(%)表示,膜质过氧化水平以丙二醛(MDA)含量进行衡量。
1.3.3 渗透调节物质含量 可溶性糖含量测定采用蒽酮比色法、可溶性蛋白质含量测定采用考马斯亮蓝G-250染色法、脯氨酸含量的测定采用酸性茚三酮比色法,具体参照李合生等[15]的方法。
1.3.4 酶活性 超氧化物歧化酶(SOD;EC1.15.1.1)活性测定参照氯化硝基四氮唑蓝(NBT)还原法[16];过氧化物酶(POD;EC1.11.1.7)活性测定采用愈创木酚比色法[17];过氧化氢酶(CAT;EC1.11.1.6)活性测定采用H2O2紫外吸收法[17];抗坏血酸过氧化物酶(APX;EC1.11.1.11)活性测定采用抗坏血酸比色法[16];多酚氧化酶(PPO;EC1.10.3.1)活性测定采用儿茶酚比色法[18];苯丙氨酸解氨酶(PAL;EC4.3.1.5)活性参照Yao等[19]的方法进行测定。
1.4 数据分析
结果为3 次重复的平均值,数据用DPS 7.05软件处理,多重比较用Duncan新复极差法,用ORIGIN 8.5绘图。
2 结果与分析
2.1 外源NO 对低温胁迫下蝴蝶兰叶片质膜透性和膜脂过氧化水平的影响
由图1,A 可知,与CK 相比,L 处理组(蒸馏水+低温)蝴蝶兰叶片的电解质渗漏率显著增加(P<0.05),其在处理5d和10d的电解质渗漏率分别为CK(蒸馏水+常温)的1.80倍和3.94倍,同期L+NO 处理组(SNP+低温)的蝴蝶兰叶片电解质渗漏率分别比L处理组显著下降了23.26%和29.46%,但NO 处理组(SNP+常温)对质膜透性无显著影响。同时,图1,B 显示,L 处理组的蝴蝶兰叶片MDA 含量显著高于CK,说明低温胁迫后造成膜脂过氧化加速,过氧化产物MDA 含量显著增加;L+NO 处理组在5d和10d时的MDA 含量分别比L处理组显著下降了13.85%和35.71%,而单一NO处理对叶片MDA 含量无显著影响。以上结果说明喷施外源NO 供体SNP 能够使低温胁迫下蝴蝶兰叶片膜脂过氧化程度显著降低,缓解低温胁迫对细胞膜的伤害,保护细胞膜的完整性,显著降低低温胁迫对蝴蝶兰生长的抑制。
2.2 外源NO 对低温胁迫下蝴蝶兰叶片pH 及渗透调节物质含量的影响
由图2,A 可知,蝴蝶兰叶片的pH 在NO 处理组、L处理组和L+NO 处理组均比CK 组显著升高,而L+NO 处理组又比L 处理组显著降低,说明低温胁迫和外源NO 处理都能调节蝴蝶兰体内的生理生化变化,从而影响叶片的pH。图2,B 显示,与CK 相比,L处理、NO 处理和L+NO 处理都能够显著诱导蝴蝶兰叶片中脯氨酸(Pro)含量增加,并以L+NO 处理组增加幅度最大,在处理5d和10d时Pro含量分别比对照组增加了84.77%和155.09%,表明外源NO 处理可以通过显著提高蝴蝶兰叶片中Pro含量来减缓胁迫对其造成的伤害。
其次,与CK 组相比,NO 处理组的蝴蝶兰叶片可溶性糖含量在处理5d和10d时均显著提高,同期L和L+NO 处理组可溶性糖含量则均显著降低,但L+NO 组均显著高于L 组,能够显著抑制因低温引起的蝴蝶兰叶片中可溶性糖含量下降,即外源NO 处理能够通过提高蝴蝶兰叶片中可溶性糖含量来提升植株对低温胁迫的抗性(图2,C)。
另外,处理5d时,L+NO 处理组蝴蝶兰叶片中可溶性蛋白含量最高,其次为L 处理组,再次为NO处理组和对照组,且各组间的可溶性蛋白含量差异显著;处理10d时,与CK 相比,蝴蝶兰叶片中可溶性蛋白含量在NO 处理组变化不大,在L 处理组和L+NO 处理组显著下降,但L+NO 处理组显著高于L处理组,抑制了低温胁迫导致的可溶性蛋白含量降低,说明外源NO 处理可促进可溶性蛋白在植物体内的积累,是提高植株对低温胁迫适应性的另一重要因素(图2,D)。
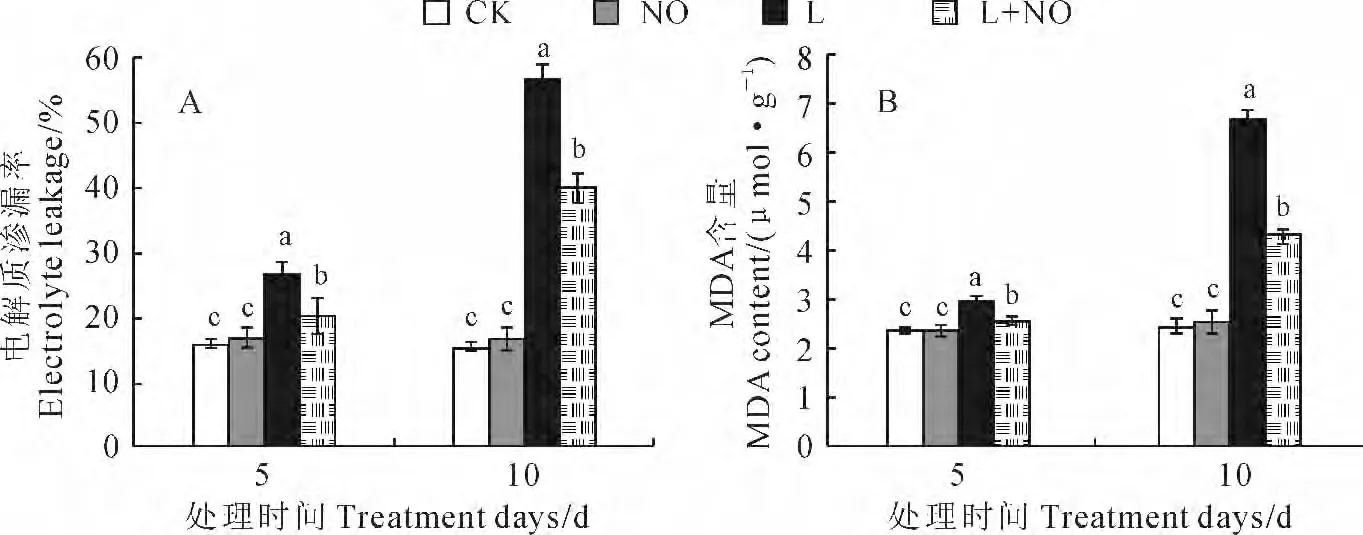
图1 外源NO 对低温胁迫下蝴蝶兰叶片电解质渗漏率和MDA 含量的影响CK、NO.叶面分别喷施蒸馏水和200μmol·L-1 SNP后常温(昼/夜:27 ℃/22 ℃)培养;L、L+NO.叶面分别喷施蒸馏水和200μmol·L-1 SNP后低温(昼/夜:12 ℃/7 ℃)培养;数据为平均值±标准差;不同小写字母表示同期处理间差异达0.05显著水平。下同Fig.1 Effects of NO on electrolyte leakage and MDA content in leaves of Phalaenopsis spp.under low temperature stress CK,NO.Cultured in ordinary temperature(day/night:27 ℃/22 ℃)after sprayed with water and 200μmol·L-1 SNP,respectively;L,L+NO.Cultured in low temperature(day/night:12 ℃/7 ℃)after sprayed with water and 200μmol·L-1 SNP,respectively;Date are the means±SD;Different normal letters indicate significant differences between treatments at the same time at 0.05level.The same as following
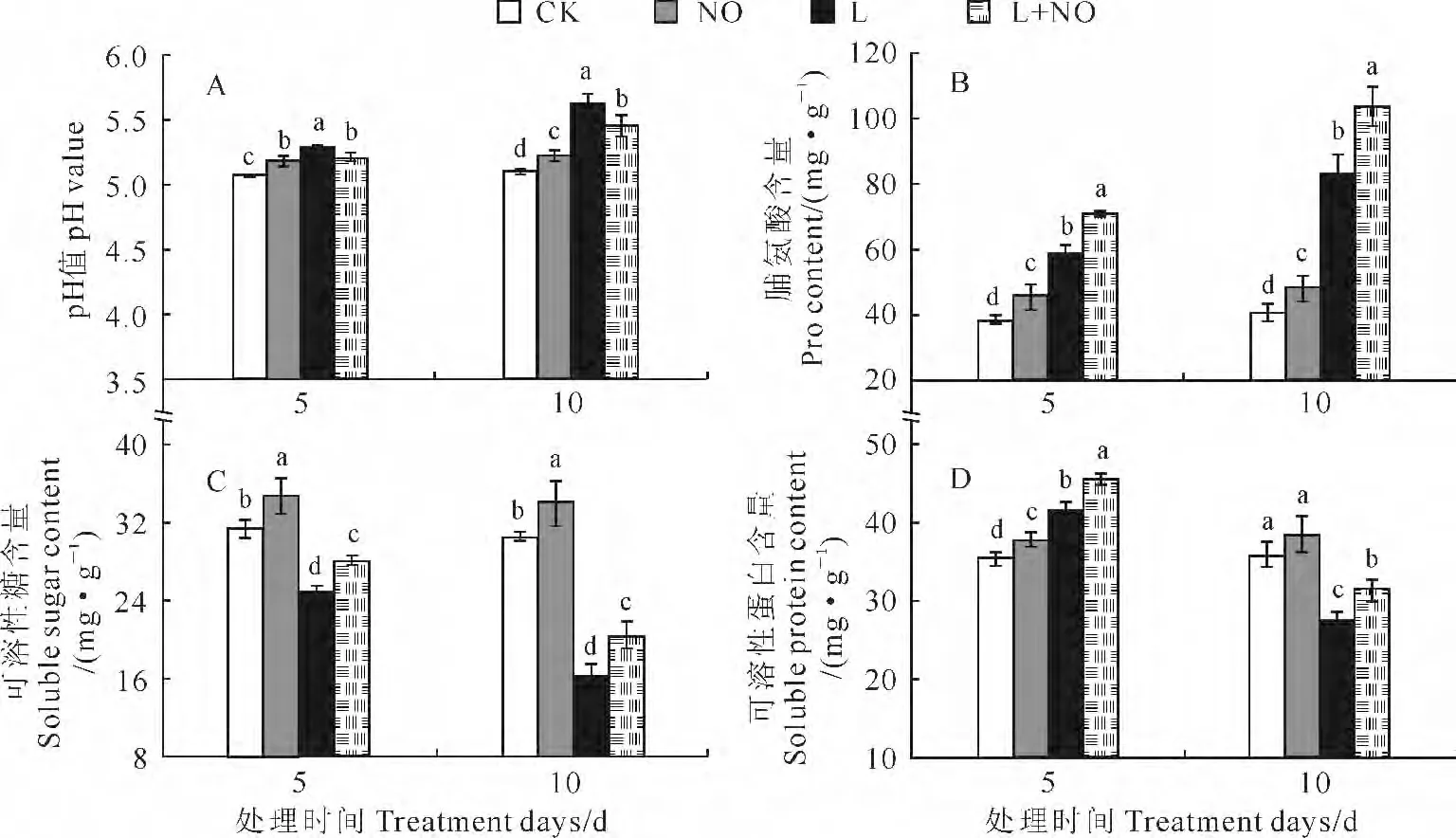
图2 外源NO 对低温胁迫下蝴蝶兰叶片pH 及渗透调节物质含量的影响Fig.2 Effects of NO on pH and osmotic adjustment substance contents in leaves of Phalaenopsis spp.under low temperature stress
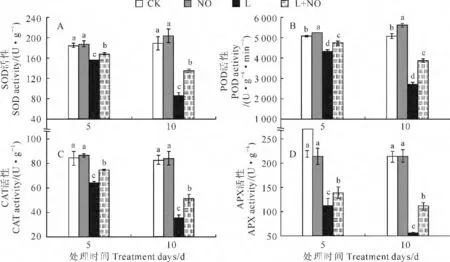
图3 外源NO 对低温胁迫下蝴蝶兰叶片抗氧化酶活性的影响Fig.3 Effects of NO on the activities of antioxidant enzymes in leaves of Phalaenopsis spp.under low temperature stress
2.3 外源NO 对低温胁迫下蝴蝶兰叶片抗氧化酶活性的影响
在处理5d和10d时,蝴蝶兰叶片的SOD 活性在L 处理组分别比CK 显著下降了15.45%和54.37%,在L+NO 处理组则比对照组分别显著下降了8.93%和28.26%,而在同期NO 处理组与对照组差异不显著(图3,A)。说明低温胁迫使蝴蝶兰幼苗受到伤害,胁迫前预施SNP处理能够通过抑制SOD 活性的降低来缓解低温胁迫的伤害。

图4 外源NO 对低温胁迫下蝴蝶兰叶片PPO 和PAL活性的影响Fig.4 Effects of NO on the activities of PPO and PAL in leaves of Phalaenopsis spp.under low temperature stress
同时,与CK 相比较,蝴蝶兰叶片的POD 活性在常温下单独NO 处理组显著升高,而在L 处理组和L+NO 处理组均显著降低。其中,L处理组幼苗POD 活性在处理5d和10d时分别比对照组下降了14.28%和48.84%,L+NO 处理组则比对照组分别下降了6.78%和23.82%,NO 处理组却分别显著增加3.05%和10.42%(图3,B)。以上结果说明,外源NO 处理能够提高蝴蝶兰幼苗叶片的POD活性,抑制低温胁迫条件下叶片POD 活性的降低,使蝴蝶兰幼苗具有更强清除H2O2的能力,能极大地降低活性氧对细胞的毒害作用。 另外,蝴蝶兰幼苗叶片的CAT 活性在L 处理组 处 理5d 和10d 时 均 比CK 显 著 下 降(P <0.05),在L+NO 处理组处理5d和10d时也呈下降趋势,但活性均显著高于L 处理组,而常温下单独NO 处理组则与对照组差异不显著(图3,C),表明低温胁迫能够对蝴蝶兰生理造成部分影响,预施SNP能够抑制低温胁迫导致的CAT 活性下降,减轻低温胁迫对蝴蝶兰造成的伤害。此外,由图3,D可知,各处理蝴蝶兰幼苗叶片APX 活性在5d和10 d时的变化趋势与SOD 和CAT 活性相似,即L 处理组的APX 活性显著降低,但L+NO 处理能够显著抑制APX 活性的降低,而常温下单独NO 处理对APX 活性无显著影响,表明低温胁迫前预施SNP处理对低温胁迫造成的蝴蝶兰叶片的过氧化伤害具有明显缓解作用。
2.4 外源NO 对低温胁迫下蝴蝶兰叶片PPO 和PAL活性的影响
处理5d时,各处理组蝴蝶兰叶片的PPO 活性表现为:L+NO>L>NO>CK(图4,A)。其中,NO、L和L+NO 处理组的PPO 活性分别比对照组(CK)显著高出25.61%、87.80%和153.66%,且各处理组间均差异显著性;处理10d时,各处理组蝴蝶兰叶片PPO 活性仍均显著高于同期对照,其在L+NO 处理组和L处理组均较5d时有所下降,但L+NO 处理组仍显著高于L处理组。这表明低温胁迫时间超过一定的期限会对蝴蝶兰叶片的PPO 产生破坏作用,但外源NO 处理对蝴蝶兰幼苗叶片PPO 活性具有促进作用,能通过提升PPO 活性以减轻低温胁迫对蝴蝶兰造成的伤害。
另外,各处理蝴蝶兰叶片PAL活性的变化趋势与PPO 相似(图4,B)。在处理5d时,NO 处理组、L处理组和L+NO 处理组PAL活性均较CK 组显著提高,并以L+NO 处理组PAL 活性最高,它比对照组显著增加了61.61%,且各处理间差异均达到显著水平。处理10d时,各处理组的PAL 活性仍显著高于对照组,只是增幅均比处理5d时减小;L+NO 处理组和L处理组的PAL活性均较5d时有所下降,但L+NO 处理组的PAL 活性仍显著高于L处理组,表明外源NO 处理可通过提高蝴蝶兰幼苗叶片中PAL的活性,从而增强其对低温胁迫的抗性,减缓低温胁迫对蝴蝶兰植株的伤害。
3 讨 论
目前普遍认为冷害会导致植物细胞膜系统受损,而MDA 的大量积累以及质膜透性的不断增大是细胞损坏的重要标志,二者可一同作为评价膜脂过氧化程度和细胞膜透性的重要指标[20]。已有研究结果表明,外源NO 可抑制低温胁迫下玉米幼苗叶片MDA 含量的上升,降低叶片质膜相对透性,提高植物抗低温胁迫的能力[21];外源NO 可以显著降低低温胁迫下香蕉幼苗叶片的质膜相对透性及丙二醛含量,缓解其遭受的冷胁迫损伤[22];叶面喷施外源NO 供体SNP能显著缓解低温对黄瓜幼苗生长的抑制作用,膜透性和MDA 含量显著降低[23]。本研究结果与前人研究结果大体相同,即低温胁迫会对蝴蝶兰叶片细胞膜的结构和功能造成伤害,具体表现为MDA 积累,电解质渗漏率增加;喷施外源NO 供体SNP可明显延缓蝴蝶兰叶片的电解质渗漏率和MDA 含量的上升,缓解低温对蝴蝶兰叶片细胞膜的伤害,说明外源NO 处理确实可在一定程度上提高植物对低温胁迫的适应性。
蝴蝶兰是具有景天酸代谢途径的植物,该类植物在逆境胁迫条件下通常体内pH 会发生变化。所以,叶片pH 值的变化可以反映出蝴蝶兰对胁迫的响应特征[24]。本研究中蝴蝶兰幼苗在低温胁迫和外源NO 供体SNP 处理后pH 值都有所升高,L+NO 处理能够抑制低温胁迫下蝴蝶兰叶片pH 值的显著升高,这很可能与低温胁迫和外源SNP处理后植物体内的一些代谢中间物及信号调节物质等的积累有关。植物叶片pH 值的变化会受到多种因素的影响,对不同品种、不同生长发育时期的蝴蝶兰来说,叶片pH 值的变化与低温胁迫的相关性仍有待进一步研究。同时,增强细胞内的渗透调节能力对植物抵御逆境胁迫具有重要作用。脯氨酸、可溶性糖和可溶性蛋白均是植物细胞内重要的渗透调节物质[25]。许多研究表明:低温胁迫下,很多植物体内会累积脯氨酸、可溶性糖和可溶性蛋白等渗透调节物质以适应寒冷,保护体内组织免受冻害[26-28]。可溶性蛋白等渗透调节物质含量变化反映了植物细胞内物质合成、代谢和抵御逆境胁迫调控的能力[20]。本研究中,低温胁迫条件下,L 处理组和L+NO 处理组蝴蝶兰叶片的脯氨酸含量呈上升趋势,可溶性糖含量呈下降趋势,可溶性蛋白含量呈前期上升后期下降趋势,但L+NO 处理组的脯氨酸、可溶性糖和可溶性蛋白等渗透调节物质的含量在2个不同处理时间均显著高于L 处理组。据此,我们推测脯氨酸、可溶性糖和可溶性蛋白等渗透调节物质含量的变化是蝴蝶兰叶片细胞在冷胁迫下的一种生理反应,这些物质含量的高低及变化趋势与低温胁迫强度和时间密切相关,外源NO 供体SNP处理能够提升常温及低温胁迫条件下蝴蝶兰叶片内的渗透调节物质含量,从而进一步提高蝴蝶兰叶片细胞渗透调节能力,更有利于蝴蝶兰在低温胁迫下维持细胞的结构和功能。
SOD、POD、CAT 等是植物细胞中内源抗氧化酶系统的重要组成部分,其活性水平在一定程度上代表了细胞清除活性氧自由基的能力,也间接反映了植物对逆境胁迫的适应能力[29]。本试验结果表明,低温胁迫处理使得蝴蝶兰叶片的几种抗氧化酶活性均呈显著下降趋势,这可能是由于胁迫强度超出蝴蝶兰植株的耐受能力,活性氧(ROS)大量生成,进而使细胞抗氧化酶系统明显受到了抑制和破坏,这与田丹青等 的研究结果相一致;低温胁迫前预施SNP处理蝴蝶兰叶片各种抗氧化酶活性相对于对照组也有小幅度的下降,但其变化幅度远远小于低温胁迫处理组。究其原因,可能是本实验SNP浓度下的NO 有类似抗氧化剂的作用,对低温胁迫产生的ROS具有一定的清除作用,从而缓解低温胁迫导致的ROS对SOD、POD、CAT、APX 等抗氧化酶系统的破坏,提高了蝴蝶兰幼苗对寒冷的适应性。
另外,PPO、PAL 作为植物体内重要的抗逆相关的防御性酶,在植物的胁迫防御过程中也起着重要的保护作用[5,31]。PPO 是引起植物组织褐变的主要因素,在植物抗逆反应中发挥着重要作用;PAL是苯丙烷类物质代谢途径的第一关键酶和限速酶,与木质素、植保素、黄酮类及酚类化合物等抗性物质的形成密切相关[32]。本试验结果表明,低温胁迫后蝴蝶兰幼苗叶片PPO、PAL活性随处理时间的延长呈先上升后下降的趋势,外源NO 处理不仅能诱导常温下PPO、PAL 活性增加,也能提高低温胁迫条件下PPO、PAL的活性。可见,在抵御低温胁迫过程中PPO 和PAL发挥了重要作用,外源NO 处理能够缓解蝴蝶兰的低温胁迫伤害,可能在一定程度上是通过诱导蝴蝶兰幼苗叶片中PPO 和PAL活性增强来实现的。
综上所述,外源NO 处理可抑制低温胁迫条件下蝴蝶兰叶片相对电解质渗漏率和MDA 含量的上升,保护蝴蝶兰幼苗的细胞膜系统,增加渗透调节物质含量,延缓低温胁迫对抗氧化酶防御系统的破坏,提高叶片抗逆相关酶的活性,从而缓解低温胁迫对蝴蝶兰幼苗造成的伤害。NO 作为一种信号分子在植物体内发挥作用是一个非常复杂的生理过程,可能会涉及许多信号转导途径和一系列复杂的生理生化过程,单一测定某一个或几个方面的生理指标,仍不能正确反映其提高植物抗寒性的实质,因此,今后应对其缓解低温胁迫的机理在分子水平上作进一步的研究。
[1] ZOU Q CH(邹清成),ZHU K Y(朱开元),et al.Effect of exogenous methyl jasmonate on chlorophyll fluorescence and antioxidant characteristics in the leaves of Phalaenopsis amabilis under abiotic stress[J].Plant Physiology Journal(植物生理学报),2011,47(9):913-917(in Chinese).
[2] 周庐萍.蝴蝶兰成花“温敏”现象消减文库的构建及相关基因的捕获[D].浙江临安:浙江农林大学,2010.
[3] HOU L G,CHEN W F,ZHAO G C,et al.Effects of phosphate fertilizer on cold tolerance and its related physiological parameters in rice under low temperature stress[J].Journal of Northeast Agricultural University(English Edition),2012,19(4):1-10.
[4] ZHANG D W(张大伟),DU X Y(杜翔宇),LIU CH Y(刘春燕),et al.Effect of low-temperature stress on physiological indexes of soybean at germination stage[J].Soybean Science(大豆科学),2010,29(2):228-232(in Chinese).
[5] XIAO CH Y肖春燕XING X CH邢潇晨LIU H F刘会芳et al.Under the influence of low NO fluorescence photosynthesis of cucumber and antioxidant properties[J].Journal of Nuclear Agricultural Science(核农学报),2014,28(6):1 083-1 091(in Chinese).
[6] WANG H,XIAO L,TONG J,et al.Foliar application of chlorocholine chloride improves leaf mineral nutrition,antioxidant enzyme activity,and tuber yield of potato(Solanum tuberosum L.)[J].Scientia Horticulturae,2010,125(3):521-523.
[7] JIAO J(焦 娟),WANG X F(王秀峰),et al.Effects of exogenous NO on the growth and antioxidant enzyme activities of cucumber seedlings under NO3-stress[J].Chinese Journal of Applied Ecology(应用生态学报),2009,20(12):3 009-3 014(in Chinese).
[8] SINGH H P,BATISH D R,KAUR G,et al.Nitric oxide(as sodium nitroprusside)supplementation ameliorates Cd toxicity in hydroponically grown wheat roots[J].Environmental and Experimental Botany,2008,63(3):158-167.
[9] LIAO W B,HUANG G B,YU J H,et al.Nitric oxide and hydrogen peroxide alleviate drought stress in marigold explants and promote its adventitious root development[J].Plant Physiology and Biochemistry,2012,58(9):6-15.
[10] ZHAO R,SHENG J,LV S,et al.Nitric oxide participates in the regulation of LeCBF1gene expression and improves cold tolerance in harvested tomato fruit[J].Postharvest Biology and Technology,2011,62(2):121-126.
[11] LI C,LI T,ZHANG D,et al.Exogenous nitric oxide effect on fructan accumulation and FBEs expression in chilling-sensitive and chillingresistant wheat[J].Environmental and Experimental Botany,2013,86:2-8.
[12] LI X,GONG B,XU K.Interaction of nitric oxide and polyamines involves antioxidants and physiological strategies against chilling-induced oxidative damage in Zingiber officinale Roscoe[J].Scientia Horticulturae,2014,170(7):237-248.
[13] KUBOTA S,HISAMATSU T,KOSHIOKA M.Estimation of malic acid metabolism by measuring pH of hot water extracts of Phalaenopsis leaves[J].Scientia Horticulturae,1997,71(3):251-255.
[14] MICHAEL P I,KRISHNASWAMY M.The effect of zinc stress combined with high irradiance stress on membrane damage and antioxidative response in bean seedlings[J].Environmental and Experimental Botany,2011,74(12):171-177.
[15] 李合生,孙 群,赵世杰.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000:182-261.
[16] QIU Z B,LI J T,ZHANG M M,et al.He-Ne laser pretreatment protects wheat seedlings against cadmium-induced oxidative stress[J].Ecotoxicology and Environmental Safety,2013,88(1):135-141.
[17] RADWAN D E M.Salicylic acid induced alleviation of oxidative stress caused by clethodim in maize(Zea mays L.)leaves[J].Pesticide Biochemistry and Physiology,2012,102(2):182-188.
[18] KANG N J.Inhibition of powdery mildew development and activation of antioxidant enzymes by induction of oxidative stress with foliar application of a mixture of riboflavin and methionine in cucumber[J].Scientia Horticulturae,2008,118(3):181-188.
[19] YAO H,TIAN S.Effects of pre-and post-harvest application of salicylic acid or methyl jasmonate on inducing disease resistance of sweet cherry fruit in storage[J].Postharvest Biology and Technology,2005,35(3):253-262.
[20] HE J(贺 嘉),WANG G D(王广东),WU ZH(吴 震).Effect of high temperature stress on morphological and antioxidant characteristics in Phalaenopsis plantlet[J].Jiangsu Agricultural Sciences(江苏农业科学),2011,1:192-196(in Chinese).
[21] CHEN Y P(陈银萍),WANG X M(王晓梅),et al.Effects of nitric oxide on seed germination and physiological reaction of maize seedlings under low temperature stress[J].Journal of Agro-environment Science(农业环境科学学报),2012,31(2):270-277(in Chinese).[22] TANG H L(汤红玲),LI J(李 江),CHEN H P(陈惠萍).Effects of exogenous nitric oxide on chilling-resistance of banana seedlings[J].Acta Bot.Boreal.-Occident.Sin.(西北植物学报),2010,30(10):2 028-2 033(in Chinese).
[23] FAN H F(樊怀福),DU CH X(杜长霞),et al.Effects of exogenous nitric oxide on plant growth,membrane lipid perox idation and photo-synthesis in cucumber seedling leaves under low temperature[J].Acta Agriculturae Zhejiangensis(浙江农业学报),2011,23(3):538-542(in Chinese).[24] 周庐萍,魏韩英,鲍腾飞,等.水分胁迫下蝴蝶兰生理生化反应[C]//中国观赏园艺研究进展2008——中国园艺学会观赏园艺专业委员会2008年学术年会论文集.北京:中国林业出版社,2008:447-452.
[25] YANG H G(杨华庚),YANG CH F(杨重法),CHEN H J(陈慧娟),et al.Response of physiology of Phalaenopsis cultivars with different heat tolerance to[J].Chinese Agricultural Science Bulletin(中国农学通报),2011,27(1):144-150(in Chinese).
[26] ZHANG K(张 凯),MU X Q(慕小倩),et al.Effects of temperature change on seed germination,seedling growth and physiological characteristics in rape and companion weeds[J].Chinese Journal of Plant Ecology(植物生态学报),2013,37(12):1 132-1 141(in Chinese).
[27] AGHDAM M S,ASGHARI M,FARMANI B,et al.Impact of postharvest brassinosteroids treatment on PAL activity in tomato fruit in response to chilling stress[J].Scientia Horticulturae,2012,144(6):116-120.
[28] FENG X B(冯献宾),DONG Q(董 倩),LI X X(李旭新),et al.Cold resistance of Pistacia chinensis and Koelreuteria integrifoliola[J].Chinese Journal of Applied Ecology(应用生态学报),2011,22(5):1 141-1 146(in Chinese).
[29] GU L Q(顾 丽 嫱).Effects of exogenous chitosan on physiological characteristics of Phalaenopsis seedlings under draught stress[J].Southwest China Journal Agricultural Sciences(西南农业学报),2011,24(1):90-93(in Chinese).
[30] TIAN D Q(田丹青),GE Y Y(葛亚英),LIU X J(刘晓静),et al.Effect of exogenous ABA on physiological indexes of Phalaenopsis under low temperature stress[J].Acta Agriculturae Zhejiangensis(浙江农业学报),2013,25(1):68-72(in Chinese).
[31] KOU J T(寇江涛),SHI SH L(师尚礼),HU G Q(胡桂馨).Effect of Odontothrips loti damage on MDA content and defensive enzyme activity in alfalfa plants[J].Plant Protection(植物保护),2013,9(5):165-171(in Chinese).
[32] FORNI C,BRAGLIA R,HARREN F J M,et al.Stress responses of duckweed(Lemna minor L.)and water velvet(Azolla filiculoides Lam.)to anionic surfactant sodium-dodecyl-sulphate(SDS)[J].Aquatic Toxicology,2012,110:107-113.
