侧向氟取代三环双酯氰基液晶的合成与性能研究
2015-07-05李楠梁晓唐洪
李楠,梁晓,唐洪
侧向氟取代三环双酯氰基液晶的合成与性能研究
李楠,梁晓,唐洪*
(清华大学化学系,北京100084)
以4-烷基苯甲酸、4-羟基苯甲醛及3-氟-4-氰基苯酚为原材料合成了4种侧向氟取代三环双酯氰基液晶化合物,通过核磁共振(NMR)、质谱(MS)、红外光谱(IR)等分析方法确定了其分子结构,并对上述化合物的相变温度、介电各向异性、光学各向异性进行了测试研究。结果表明,该类化合物在升温过程中均呈现向列相,且具有清亮点高、向列相范围宽、介电各向异性大、光学各向异性大的特点。
液晶;双酯;氟取代;氰基
1 引言
近年来,液晶显示技术得到了快速发展,随之而来的是对液晶材料提出了更多新的要求,因此设计合成更多的、性能各异的液晶材料以供混合液晶的调配就变得十分必要。液晶材料的性能主要受到下列一些物理参数的影响,如:熔点、清亮点、向列相范围、介电各向异性(Δε)、光学各向异性(Δn)等。双酯类液晶材料具有光电稳定性较好、清亮点高、相转变温度范围宽的特点[1],且由于酯基基团的偶极矩较大,使得这类液晶分子的介电各向异性值也较大。此前,VanMeter J P,Sadashiva B K等人合成了一系列的三环双酯类液晶化合物[2~5],其结构通式如下:
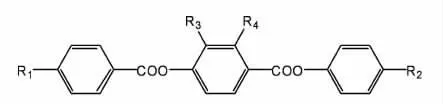
本文以4-烷基苯甲酸、4-羟基苯甲醛及3-氟-4-氰基苯酚为原材料合成了4种单体液晶化合物,通过核磁共振(NMR)、质谱(MS)、红外光谱(IR)等分析方法确定了其分子结构,并对上述化合物的相变温度及光学各向异性、介电各向异性进行了测试研究。
其中取代基R1可以为烷基(CnH2n+1)或烷氧基(OCnH2n+1),R2可以为烷基、烷氧基或氰基(CN),R3可以为甲基(CH3)或甲氧基(OCH3),R4可以为氰基。
根据现有液晶物理学和化学理论,氰基属于极性较大的一类基团,在液晶分子末端引入氰基可以有效地增加分子极性,从而增加液晶分子的介电各向异性[6];氟(F)原子具有电负性大、原子半径小的特点,在液晶分子芳香环侧向引入氟原子,可以起到扩展液晶分子向列相温度范围的效果,并且还能降低其熔点,改善其溶解性[7],因此,本文选择了末端基为氰基,且其邻位以氟原子作侧向取代基的三环双酯液晶分子结构作为研究对象。此外,Gauza S等人还在一类用于液晶显示的蓝相液晶组合物里使用了双酯类液晶化合物作为其中的高极性液晶组分[8],Xianyu H Q等人也将上述化合物用于双频液晶组合物的调配[9]。基于上述几点原因,对氟取代三环双酯氰基液晶的合成方法及各项参数进行研究就具有重要的意义。
2 实验
2.1测试仪器
Q20差示扫描量热仪(美国TA公司); Agilent 6890N气相色谱仪(美国安捷伦公司); Nicolet 6700傅里叶红外光谱仪(美国热电公司); JEOL JNM-ECX400核磁共振波谱仪(日本JEOL公司);Agilent 1100 series LC/MSD Trap高效液相色谱-离子阱质谱连用仪(美国安捷伦公司); HIOKI 3522-50LCR测试仪(日置电机株式会社); NAR-4T阿贝折射仪(ATAGO)。
2.2原料和试剂
4-烷基苯甲酸(R=C2~C5;纯度>98.0%)、3-氟-4-氰基苯酚(纯度>98.0%),上述试剂均购买自梯希爱(上海)化成工业发展有限公司;4-羟基苯甲醛(纯度>98.0%)购买自北京偶合科技有限公司;其他常用试剂均为市售,化学纯。
2.3目标化合物的合成
目标化合物4a~4d采用的合成路线如图1所示。以化合物4d为例,典型合成方法如下。

图1 化合物4a~4d的合成路线Fig.1Synthetic route of compounds 4a~4d
2.3.14-戊基苯甲酸-4-醛基苯酚酯(2d)的合成4-戊基苯甲酰氯:
向配有干燥管、回流冷凝管和磁力搅拌器的250 mL三口瓶中,加入19.2 g(0.1 mol)4-戊基苯甲酸,23.8 g(0.2 mol)二氯亚砜和120 mL苯,搅拌回流4 h。旋蒸除去反应液中溶剂,得到产物为4-戊基苯甲酰氯,收率接近100%,不经提纯直接用于下一步反应。
化合物2d:
向配有干燥管、回流冷凝管、温度计和磁力搅拌器的250 mL三口瓶中,加入制备好的4-戊基苯甲酰氯,12.2 g(0.1 mol)4-羟基苯甲醛和100 mL二氯甲烷,冰水浴维持反应温度0~5℃。通过恒压滴液漏斗滴加12.1 g(0.1 mol)三乙胺,加毕后自然升至室温,反应1 h,随后回流3 h。冷却反应液,有机相水洗至中性,旋蒸除去溶剂。所得固体用V二氯甲烷:V正己烷=1∶4的混合溶剂重结晶,最终得到白色晶体产品42.1 g,气相色谱纯度为98.5%,收率71%。m.p.34.4℃;1HNMR (CDCl3):δ=10.0(s,1H,CHO-H),8.12(d,2H,Ph-H),7.98(d,2H,Ph-H),7.41(d,2H,Ph-H),7.34(d,2H,Ph-H),2.71(t,2H,-CH2-),1.67(m,2H,-CH2-),1.37~1.32(m,4H,-CH2-),0.91(t,3H,-CH3);IR(KBr,υmax,cm-1):3 064,3 036,2 956,2 929,2 857,1 738,1 700,1 599,1 264。
化合物2a:收率69%。m.p.53.8℃;1HNMR (CDCl3):δ=10.0(s,1H,CHO-H),8.12(d,2H,Ph-H),7.97(d,2H,Ph-H),7.41(d,2H,Ph-H),7.36(d,2H,Ph-H),2.76(q,2H,-CH2-),1.29(t,3H,-CH3);IR(KBr,υmax,cm-1):3 098,3 055,2 971,2 939,2 826,1 735,1 701,1 600,1 276。
化合物2b:收率77%。m.p.46.0℃;1HNMR (CDCl3):δ=10.0(s,1H,CHO-H),8.11(d,2H,Ph-H),7.97(d,2H,Ph-H),7.40(d,2H,Ph-H),7.33(d,2H,Ph-H),2.70(t,2H,-CH2-),1.70(m,2H,-CH2-),0.97(t,3H,-CH3);IR(KBr,υmax,cm-1):3 070,3 034,2 959,2 931,2 844,1 731,1 701,1 597,1 264。
化合物2c:收率80%。m.p.48.8℃;1HNMR (CDCl3):δ=10.0(s,1H,CHO-H),8.10(d,2H,Ph-H),7.97(d,2H,Ph-H),7.40(d,2H,Ph-H),7.34(d,2H,Ph-H),2.72(t,2H,-CH2-),1.64(m, 2H,-CH2-),1.38(m,2H,-CH2-),0.94(t,3H,-CH3);IR(KBr,υmax,cm-1):3 098,3 073,2 953,2 930,2 861,1 732,1 697,1 598,1 267。
2.3.24-(4-戊基苯甲酰氧基)苯甲酸(3d)的合成[10]
向配有温度计、干燥管、回流冷凝管和磁力搅拌器的500 mL三口瓶中,加入2.4 g(7.9 mmol)4-戊基苯甲酸-4-醛基苯酚酯和350 mL丙酮,40℃下分批加入1.9(11.8 mmol)高锰酸钾,加毕后回流2.5 h。冷却、抽滤反应液,滤饼用少量丙酮和水淋洗。将滤饼用10%(V/V)盐酸酸化1.5 h,抽滤,滤饼用水淋洗至中性。将酸化所得滤饼用150 mL丙酮萃取,抽滤后将滤液旋干,所得固体用V乙酸乙酯∶V乙醇=5∶1的混合溶剂重结晶,最终得到白色晶体产品1.7 g,收率68%。m.p.176.8℃;1HNMR(DMSO-d6):δ=8.07~8.03(m,4H,Ph-H),7.45~7.41(m,4H,Ph-H),2.70(t,2H,-CH2-),1.62(m,2H,-CH2-),1.37~1.25(m,4H,-CH2-),0.87(t,3H,-CH3);IR(KBr,υmax,cm-1):3 200~2 500,3 072,2 952,2 926,2 856,1 732,1 687,1 602,1 273。
化合物3a:收率70%。m.p.201.5℃;1HNMR(DMSO-d6):δ=8.08~8.03(m,4H,Ph-H),7.47~7.41(m,4H,Ph-H),2.74(q,2H,-CH2-),1.23(t,3H,-CH3);IR(KBr,υmax,cm-1):3 200~2 700,3 062,3 032,2 968,2 932,2 875,1 735,1 692,1 603,1 265。
化合物3b:收率75%。m.p.198.0℃;1HNMR(DMSO-d6):δ=8.07~8.03(m,4H,Ph-H),7.45~7.41(m,4H,Ph-H),2.68(t,2H,-CH2-),1.63(m,2H,-CH2-),0.91(t,3H,-CH3);IR (KBr,υmax,cm-1):3 200~2 500,3 068,3 049,2 955,2 928,2 864,1 739,1 674,1 604,1 262。
化合物3c:收率72%。m.p.198.9℃;1HNMR(DMSO-d6):δ=8.07~8.03(m,4H,Ph-H),7.45~7.41(m,4H,Ph-H),2.70(t,2H,-CH2-),1.60(m,2H,-CH2-),1.32(m,2H,-CH2-),0.91(t,3H,-CH3);IR(KBr,υmax,cm-1):3 200~2 500,3 065,3 048,2 954,2 928,2870,1 737,1 673,1 604,1 262。
2.3.34-戊基苯甲酸-4-((4-氰基-3氟苯氧基)羰基)苯酚酯(4d)的合成4-(4-戊基苯甲酰氧基)苯甲酰氯:
向配有温度计、干燥管、回流冷凝管和磁力搅拌器的500 mL三口瓶中,加入29.0 g(95.0 mmol) 4-(4-戊基苯甲酰氧基)苯甲酸,22.6 g(190.0 mmol)二氯亚砜、几滴N,N-二甲基甲酰胺和200 mL苯,搅拌回流4 h。旋蒸除去反应液中溶剂,得到产物为4-(4-戊基苯甲酰氧基)苯甲酰氯,收率接近100 %,不经提纯直接用于下一步反应。
化合物4d:
向配有干燥管、回流冷凝管、温度计和磁力搅拌器的500 mL三口瓶中,加入13.0 g(95.0 mmol)3-氟-4-氰基苯酚,15.0 g(190.0 mmol)吡啶和200 mL二氯甲烷,冰水浴维持反应温度0~5℃。通过恒压滴液漏斗滴加制备好的4-(4-戊基苯甲酰氧基)苯甲酰氯与50 mL二氯甲烷配成的溶液,加毕后自然升至室温,反应2 h,随后回流2 h。冷却反应液,有机相水洗至中性,旋蒸除去溶剂。所得粗品经100~200目硅胶柱进行柱层析分离,二氯甲烷淋洗,淋洗液旋干,所得米色固体用V丙酮:V乙醇=1∶3的混合溶剂重结晶,最终得到白色晶体产品31.0 g,测得高效液相色谱(HPLC)纯度为99.0%,收率74%。1HNMR(CDCl3):δ=8.26(d,2H,Ph-H),8.12(d,2H,Ph-H),7.71(m,1H,Ph-H),7.42(d,2H,Ph-H),7.34(d,2H,Ph-H),7.26~7.20(m,2H,Ph-H),2.71(t,2H,-CH2-),1.68(m,2H,-CH2-),1.40~1.30(m,4H,-CH2-),0.90(t,3H,-CH3);MS(m/z):430[M-H]-,255,135;IR(KBr,υmax,cm-1):3 097,3 072,2 958,2 928,2 858,2 236,1 730,1 601,1 207。
化合物4a:收率74%。1HNMR(CDCl3):δ= 8.26(d,2H,Ph-H),8.13(d,2H,Ph-H),7.71(m,1H,Ph-H),7.41(d,2H,Ph-H),7.37(d,2H,Ph-H),7.25~7.20(m,2H,Ph-H),2.77(q,2H,-CH2-),1.30(t,3H,-CH3);MS(m/z):388[MH]-,135;IR(KBr,υmax,cm-1):3 100,3 070,2 972,2 935,2 877,2 236,1 728,1 601,1 207。
化合物4b:收率68%。1HNMR(CDCl3):δ= 8.26(d,2H,Ph-H),8.13(d,2H,Ph-H),7.72(m,1H,Ph-H),7.41(d,2H,Ph-H),7.35(d,2H,Ph-H),7.25~7.19(m,2H,Ph-H),2.70(t,2H,-CH2-),1.70(m,2H,-CH2-),0.98(t,3H,-CH3);MS (m/z):402[M-H]-,384,135;IR(KBr,υmax,cm-1):3 099,3 072,2 966,2 935,2 866,2 237,1 730,1 603,1 207。
化合物4c:收率78%。1HNMR(CDCl3):δ= 8.26(d,2H,Ph-H),8.12(d,2H,Ph-H),7.15(m,1H,Ph-H),7.40(d,2H,Ph-H),7.34(d,2H,Ph-H),7.25~7.20(m,2H,Ph-H),2.72(t,2H,-CH2-),1.66(m,2H,-CH2-),1.39(m,2H,-CH2-),0.95(t,3H,-CH3);MS(m/z):416[M-H]-,296,135;IR(KBr,υmax,cm-1):3 097,3 072,2 958,2 928,2 858,2 236,1 730,1 601,1 207。
3 结果与讨论
3.1系列化合物4的热性能及分析
系列化合物4的液晶相变温度通过差示扫描量热仪(DSC)进行测定,升温速率为5℃/min。通过偏光显微镜观察化合物的织构,并与液晶的标准相图对照,确定了化合物的相态。表1给出了制备的4种化合物(4a~4d)相变温度的测试结果,表2是文献中给出的类似结构液晶化合物的相变温度测试结果,作为比较分析时用。

表1 系列化合物4的相变温度Tab.1Phase transition temperature of series compounds 4

表2 类似结构化合物的相变温度Tab.2Phase transition temperature of compounds with similar structure
对表1、表2分析如下:
(1)由表1可知,化合物4a~4d均为向列相液晶,且向列相范围都较宽,全部在100℃以上;化合物4a~4d的清亮点都比较高,均高于210℃,随着末端烷基碳原子数目的增加,化合物的清亮点呈逐渐下降的趋势。
(2)由表2可知,与化合物5比较,化合物4d在分子侧向引入氟原子以后熔点及清亮点温度明显下降,这是侧向取代基带来的变化,液晶分子在侧向引入氟原子以后,由于氟原子范德华半径(0.147 nm)比氢原子的(0.120 nm)大,就会对液晶分子的堆积产生破坏,使液晶相的清亮点有所降低。
(3)通过对化合物4d及化合物6~8的相变温度进行对比可知,在分子中的桥键位置引入1个或2个酯基都可以提高分子的向列相稳定温度,但是,由于分子极性的变大也会导致熔点的相应提高,同时,还可以看出在2个桥键位置同时引入酯基要比仅在其中1个桥键位置引入酯基对清亮点的提高作用更明显。虽然桥键位置引入酯基以后分子会呈现一定的折线结构,这种折线结构本身会增加分子的宽度,但是,向列相稳定温度的提高说明酯基对分子长度的影响弥补了其对分子宽度产生的不利影响。
3.2目标化合物光学、电学参数的分析
为评价目标化合物4a~4d的光学各向异性(Δn)、介电各向异性(Δε),将它们分别与母体混合液晶(Host)按质量比10∶90加热混合均匀;利用NAR-4T型阿贝折射仪,采用钠光源(589 nm),在25℃下,测定由实验单体液晶和母体液晶(Host)组成的均匀混合物的no1,ne1,计算得到光学各向异性Δn1(Δn1=no1-ne1),再外推算出单体液晶的光学各向异性(Δn);利用HIOKI 3522-50型电容电抗测试仪,在25℃,1 kHz条件下,测定实验单体液晶化合物和母体液晶(Host)组成的均匀混合物的ε∥1和ε⊥1,计算得到的电学各向异性Δε1(Δε1=ε∥1-ε⊥1),再外推算出单体液晶的电学各向异性(Δε);母体液晶(Host)主要参数为:Tc=58.4℃,Δn=0.125,Δε=3.15;测试结果如表3。
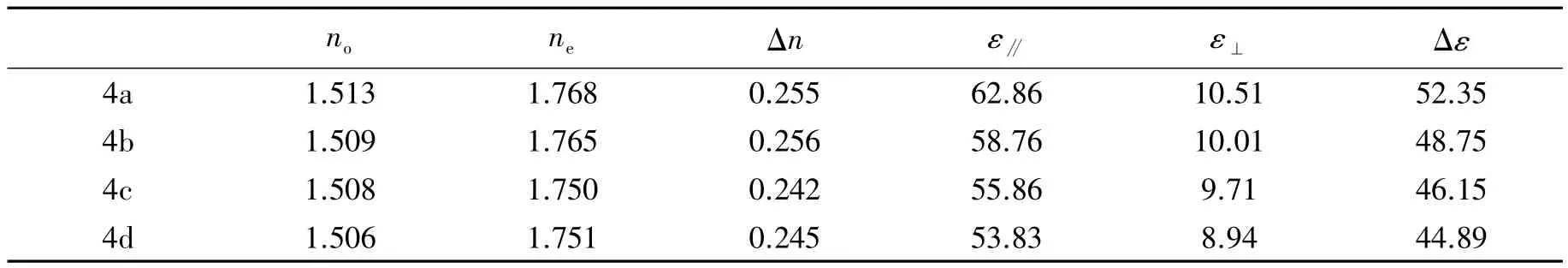
表3 相关的液晶参数Tab.3Parameters of liquid crystals
由表3可知,相对于中、低光学各向异性(Δn= 0.09~0.12)的液晶化合物而言,化合物4a~4d均具有较大的光学各向异性(Δn),这主要是因为分子中均含有3个苯环结构,且末端基团为氰基,氰基与苯环还能发生共轭,这种结构形成的极化区域大,共轭体系大,进一步提高了液晶分子的光学各向异性。此外,两个连接基团均为酯基,酯基本身与苯环是部分共轭且共面的基团,这类连接基团对相邻苯环构成的极化区破坏较小,这也是该类化合物具有较大的光学各向异性(Δn)的原因。
表3还表明,相对于大多数显示用单体液晶化合物的介电各向异性(Δε<30)而言,化合物4a~4d均具有较大的介电各向异性(Δε),这主要是因为分子结构中酯基,氰基这类强极性基团的存在造成的,分子中2个酯基基团与1个氰基基团使得平行于分子轴向的偶极矩较大,进而导致介电各向异性较大;此外,侧向的氟取代基一方面使平行于分子轴向的极性有所增加,一方面还能有助于消除末端氰基基团造成的分子反平行排列,这都是该类化合物具有较大的介电各向异性(Δε)的原因。
4 结论
以4-烷基苯甲酸、4-羟基苯甲醛及3-氟-4-氰基苯酚为原材料合成了4种单体液晶化合物,通过核磁共振(NMR)、质谱(MS)、红外光谱(IR)等分析方法确定了其分子结构,并对上述化合物的相变温度及光学各向异性、介电各向异性进行了测试研究。研究表明,该类液晶化合物具有较高的清亮点(Tc=214.8~233.5℃),较大的光学各向异性(Δn=0.242~0.256),很高的介电各向异性(Δε=44.89~52.35)。
[1]陈卫东,刘勇,张鹏云,等.新型对称联苯双酯类液晶材料的合成和晶体结构[J].有机化学,2011,31(5):677-683.Chen W D,Liu Y,Zhang Y P,et al.Synthesis and crystal structure of novel symmetrical diphenylnate liquid crystal[J].Chinese Journal of Organic Chemistry,2011,31(5):677-683.(in Chinese)
[2]Van Meter J P,Klanderman B H.p-Benzoyloxybenzoate,US3971824[P].1976-07-27.
[3]Beguin A,Zann A,Dubois J.Liquid crystal of diester type exhibiting a smectic phase,with low frequency of dielectric isotropy,and display device utilizing this crystal US4257910[P].1981-03-24.
[4]Sadashiva B K.Mesomorphic properties of a homologous series of substituted benzoyloxybenzoates[J].Molecular Crystals and Liquid Crystals,1979,53(3):253-262.
[5]Subramanya R U,Surendranath V.Phenyl-4-benzoyloxybenzoates with lateral methoxy substituent[J].Molecular Crystals and Liquid Crystals,1983,99(1):279-284.
[6]郭剑,隋岩,曹建华,等.多氟多氰类负性液晶化合物的合成[J].液晶与显示,2014,29(1):15-21.Guo J,Sui Y,Cao J H,et al.Synthesis of polyfluorinated polycyano negative dielectric anisotropy liquid crystalline compounds[J].Chinese Journal of Liquid Crystals and Displays,2014,29(1):15-21.(in Chinese)
[7]高媛媛,郑远洋,杜渭松,等.含氟液晶的性能、应用与合成进展[J].液晶与显示,2014,29(2):159-171.Gao Y Y,Zheng Y Y,Du W S,et al.Fluorinated liquid crystal properties,application and synthetic progress[J].Chinese Journal of Liquid Crystals and Displays,2014,29(2):159-171.(in Chinese)
[8]Gauza S,Wu S T,Ge Z B,et al.Liquid crystals composition and liquid crystal display with patterned electrodes:US,20110075074[P].2011-03-31.
[9]Xianyu H Q,Zhao Y,Gauza S,et al.High performance dual frequency liquid crystal compounds[J].Liquid Crystals,2008,35(9):1129-1135.
[10]Zheng M Y,Wei Y S,Fan G,et al.Organic solvent controlling the oxidativity of potassium permanganate[J].Asian Journal of Chemistry,2012,24(1):161-164.
[11]Ziobro D,Dziaduszek J,Filipowicz M,et al.Synthesis of fluorosubstituted three ring esters and their dielectric properties[J].Molecular Crystals and Liquid Crystals,2009,502(1):258-271.
[12]Aziz N,Kelly S M,Duffy W,et al.Rod-shaped dopants for flexoelectric nematic mixtures[J].Liquid Crystals,2009,36(5):503-520.
[13]Gray G W,Hird M,Lacey D,et al.The synthesis and transition temperatures of some fluoro-substituted 4-cyanophenyl and 4-cyanobiphenyl-4’-yl 4-pentyl-and 4-butoxy-benzoates[J].Molecular Crystals and Liquid Crystals,1989,172(1): 165-189.
[14]Sharma N K,Charak A,Ostereicher F.Effect of 3-fluoro-4-cyano substituted benzoates in the formation of induced smectic phases with N-(4-ethoxybenzylidene)-4'-n-butylaniline[J].Indian Journal of Chemistry,Section A,1992,31 (9):658-660.
Synthesis and properties of lateral fluorinated three-ring diester liquid crystals containing cyano group
LI Nan,LIANG Xiao,TANG Hong*
(Department of Chemistry,Tsinghua University,Beijing 100084,China)
Four lateral fluorinated three-ring diester liquid crystal compounds containing cyano group were synthesized from 4-alkylbenzoic acid,4-hydroxybenzaldehyde and 3-fluoro-4-crynophenol.Their structures were confirmed by NMR,MS and IR and the phase transition temperature,Δε and Δn of these compounds were also tested.It is found that all of these liquid crystal compounds show nematic phase during heating.The measurement of physical properties indicate that the compounds have higher clearing point,lager Δε and Δn and wider range of nematic phase.
liquid crystal;diester;fluorinated;cyano group
TN141
A
10.3788/YJYXS20153004.0559
李楠(1978-),男,北京人,硕士,工程师,主要从事液晶材料的合成及性能测试工作。E-mail:linan_chem@ mail.tsinghua.edu.cn
1007-2780(2015)04-0559-07
2014-12-06;
2015-01-05.
*通信联系人,E-mail:tanghong@mail.tsinghua.edu.cn
