乙酸铜促进的吲哚衍生物的分子内C-H活化/胺化反应
2015-07-02彭望明
王 亮,李 站,瞿 星,彭望明
(江汉大学光电化学材料与器件省部共建教育部重点实验室,湖北武汉 430056)
乙酸铜促进的吲哚衍生物的分子内C-H活化/胺化反应
王 亮,李 站,瞿 星,彭望明
(江汉大学光电化学材料与器件省部共建教育部重点实验室,湖北武汉 430056)
利用简单易得的原料设计并合成了新型的N-芳基取代的吲哚衍生物;通过C-H活化反应策略,发展了乙酸铜促进的吲哚衍生物的分子内C-H活化/胺化反应,获得了具有潜在生物活性的新型吲哚稠杂环化合物。研究了反应的底物适用范围,通过X-射线单晶衍射确定了化合物的晶体结构,提出了可能的反应机理。
乙酸铜;C-H活化/胺化;C-N键形成;吲哚稠杂环
具有C-N键结构的有机化合物是一类非常重要的化合物,不仅广泛存在于各类具有生理活性的天然产物、药物分子、农药化合物之中,也是许多功能材料的重要组分,有些更是维持生命活动必不可少的物质[1]。因此,利用结构简单的原料,通过简便、有效、绿色的方法合成C-N键结构化合物意义重大。多环吲哚是一类重要的具有C-N键结构的杂环化合物,具有显著的生理和药理活性,是许多天然产物和药物分子的核心骨架,其化学合成受到研究者的广泛关注[2]。
过渡金属催化的C-H活化反应因高原子经济性、高合成效率而备受人们关注,是现代有机合成化学的研究热点之一[3-5]。目前,通过C-H活化反应可以有效地构建C-C、C-N、C-O、C-S、C-X(X=F、Cl、Br、I)、C-P、C-B、C-Si等键[6-7];并且在构建具有生物活性的杂环化合物方面也表现出一定的优势[8]。2009年,Yamashita等[9]报道了吲哚-3-甲酸与炔烃在钯催化作用下的脱羧/C-H活化反应,成功构建了四取代咔唑类化合物。2010年,Jiao小组使用O2作为绿色的氧化剂,报道了钯催化的吲哚基亚胺与末端炔烃的分子间C-H活化/环化反应,高效合成了咔啉类化合物;但是该反应需要加入四丁基溴化铵以及分子筛作为添加剂以促进反应的进行[10]。2012年,Wang等[11]报道了Pd(OAc)2催化的区域选择性的吲哚类化合物的串联C-H烯化/环化反应,以中等到较高的收率获得相应的吲哚并喹啉类化合物,在反应过程中使用乙酸锂和乙酸钠混合碱能够显著提高反应收率。目前,利用铜促进的C-H活化反应构建多环吲哚化合物的报道还较少。作者在此以选择性的C-H活化反应为关键步骤,合理设计底物,发展乙酸铜促进的吲哚衍生物的分子内C-H活化/胺化反应,并高效构建吲哚稠杂环化合物,对其结构进行了表征,并研究了反应的底物适用范围及反应机理。
1 实验
1.1 试剂与仪器
Cu(OAc)2·H2O、铁粉、醋酸、氯化钠、无水硫酸镁、吡啶、甲苯、二甲基亚砜(DMSO)、石油醚、乙酸乙酯,天津福晨化学试剂厂;邻碘苯胺,上海阿拉丁化学试剂有限公司;吲哚,上海柏卡化学技术有限公司; CuI、碳酸铯,Alfa-Aesar试剂有限公司;无水磷酸钾,上海迈瑞尔化学技术有限公司;苯磺酰氯,萨恩化学技术(上海)有限公司。所用试剂为分析纯或化学纯,在未作特殊说明的情况下,均经过标准方法纯化后使用。
Varian-Mercury 400MHz型超导核磁共振仪,以TMS、CDCl3为内标[CDCl3:δ7.26(1HNMR);77.7 (13CNMR)];Finnigan Trace型质谱仪;Bruker Smart A-pex Area CCD型X-射线单晶衍射仪。BüCHIB-545型
1.2 合成方法
参照文献[12-13],设计如下合成路线:通过铜催化的C-N键偶联方法,利用各种取代的吲哚化合物与邻碘苯胺衍生物直接反应获得未保护的N-芳基取代的吲哚衍生物Ⅰ。然后,在吡啶的作用下与各种苯磺酰氯(如:对甲基苯磺酰氯、对氯苯磺酰氯、对硝基苯磺酰氯、对氟苯磺酰氯等)反应,成功构建具有保护基团的N-芳基取代吲哚衍生物Ⅱ。最后,利用吲哚衍生物Ⅱ,通过C-H活化策略高效构建吲哚稠杂环化合物Ⅲ。该设计方案简短、高效、适用范围广,所使用的原料简单易得、来源广泛,合成路线如图1所示。

图1 吲哚稠杂环化合物的合成路线Fig.1 Synthetic route of indole-fused heterocycles
1.2.1 具有保护基团的N-芳基取代的吲哚衍生物(Ⅱ)的合成
在干燥的10 mL Schlenk管中加入未保护的N-芳基取代的吲哚衍生物Ⅰ(1.0 mmol)以及吡啶(2.0 mL),搅拌至溶解。随后加入对氯苯磺酰氯(1.1 mmol)并置于120℃油浴中加热回流。TLC监测至反应完全,冷却至室温。将反应混合物溶解在15 mL乙酸乙酯中,用2 mol·L-1的HCl(15 mL×2)洗涤,水相用乙酸乙酯(15 mL×1)萃取,收集有机相,用无水硫酸镁干燥。过滤除去硫酸镁,再经旋转蒸发除去乙酸乙酯,剩余物经柱层析(乙酸乙酯∶石油醚=1∶8)分离提纯,真空干燥,得淡黄色固体化合物Ⅱ,收率60%~88%。
1.2.2 吲哚稠杂环化合物(Ⅲ)的合成
在干燥的10 mL Schlenk管中分别加入化合物Ⅱ(0.25 mmol,90.5 mg)以及Cu(OAc)2·H2O(0.375 mmol,72.5 mg)。氮气交换3次,然后加入DMSO(2.0 mL),将反应体系置于100℃油浴中反应。TLC监测至反应完全,冷却至室温,抽滤除去混合物中的不溶物质,用乙酸乙酯(20 mL)洗涤。有机相分别用H2O(20 mL×1)、饱和NaCl溶液(20 mL×1)洗涤后,用无水硫酸镁干燥。过滤除去硫酸镁,再经旋转蒸发除去乙酸乙酯,剩余物经柱层析(乙酸乙酯∶石油醚=1∶15)分离提纯,真空干燥,得淡黄色固体化合物Ⅲ,收率45%~84%。
2 结果与讨论
2.1 结构表征
化合物Ⅱ(R1=R2=H):收率82%;m.p.111~112℃;1HNMR(400 MHz,CDCl3),δ:7.88(d,J=8.3 Hz,1H),7.67(d,J=7.8 Hz,1H),7.23~7.13(m,3H),7.18(m,5H),7.09(t,J=7.5 Hz,1H),6.66~6.62(m,3H),6.32(s,1H),2.39(s,3H);13CNMR(100 MHz,CDCl3),δ:144.1,136.6,135.5,133.6,129.6,129.5,129.4,128.7,128.5,127.8,127.0,125.4,122.8,121.7,121.2,120.7,109.7,104.5,21.5;MS,m/z:362.2[M+]。
化合物Ⅲ(R1=R2=H):收率 80%;m.p.52~53℃;1HNMR(400 MHz,CDCl3),δ:8.03(d,J=8.0 Hz,1H),7.78(d,J=8.4 Hz,2H),7.71~7.67(m,2H),7.58(d,J=7.6 Hz,1H),7.32(t,J=7.6 Hz,1H),7.27~7.22(m,3H),7.12(d,J=8.0 Hz,2H),6.56(s,1H),2.26(s,3H);13CNMR(400 MHz,CDCl3),δ:145.5,138.6,133.2,133.1,132.2,129.7,129.5,126.9,126.7,124.9,122.8,121.5,120.9,120.5,114.8,110.5,110.3,81.8,21.5;MS,m/z:360.2[M+]。
2.2 底物适用范围
2.2.1 保护基团上取代基对反应收率的影响
在制备了一系列N-芳基取代的吲哚衍生物Ⅰ的基础上,以各种苯磺酰基为保护基的吲哚衍生物Ⅱa~Ⅱe作为模型底物、以DMSO作为溶剂,在反应温度为100℃、Cu(OAc)2·H2O用量为150%(摩尔分数,下同)的条件下,能够以较高的收率获得预期的吲哚稠杂环化合物Ⅲa~Ⅲe,反应式如下:

该反应操作简便,能直接、高效地构建吲哚稠杂环化合物,且反应过程无需加入任何添加剂(如分子筛、无机盐等)。
同时,考察保护基团上取代基对反应收率的影响,结果见表1。

表1 保护基团上取代基对反应收率的影响Tab.1 Effect of substituent group on protection group on reaction yield
由表1可知:苯磺酰基、对氯苯磺酰基、对氟苯磺酰基、对硝基苯磺酰基对反应收率影响不大,都能以中等收率获得相应的吲哚稠杂环化合物Ⅲb~Ⅲe;以对甲基苯磺酰基为保护基的反应收率最高,达到80%。2.2.2 吲哚环和苯环上取代基对反应收率的影响

以对甲基苯磺酰基为保护基的吲哚衍生物作为底物,考察吲哚环和苯环上取代基对反应收率的影响,结果见表2。

表2 吲哚环和苯环上取代基对反应收率的影响Tab.2Effect of substituent group on indole ring and benzene ring on reaction yield
由表2可知:(1)仅当吲哚环上引入供电子甲基时,反应能够顺利进行并以中等收率获得相应产物Ⅲf、Ⅲg,当甲基的位置发生变化时对反应收率没有影响;当吲哚环上引入F原子时,以较高收率获得氟取代的产物Ⅲh;当吲哚环上引入Cl原子时,得到产物Ⅲi,反应收率最高,达84%;(2)仅当苯环上引入供电子基团(如甲基、Cl原子)或吸电子基团(如CF3)时,反应都能顺利地以中等收率获得产物Ⅲj~Ⅲm;(3)当吲哚环和苯环上都引入取代基时,在Cu(OAc)2· H2O的促进下均能以中等收率获得产物Ⅲn~Ⅲp。表明,C-H活化/胺化反应过程中,底物上含有吸电子基团比供电子基团更有利于反应的发生。
2.3 晶体结构(图2)

图2 化合物Ⅲa的晶体结构Fig.2 Crystal structure of compoundⅢa
由图2可以看出:反应在Cu(OAc)2·H2O的促进下,能够选择性地活化吲哚骨架上吡咯环的C-H键,而没有活化吲哚骨架上苯环的C-H键,并通过C-N键的形成构建了新的五元杂环骨架。
2.4 反应机理研究
以具有对甲基苯磺酰基为保护基的吲哚衍生物为底物的反应机理如下:Cu(OAc)2·H2O在DMSO中与底物中含氮基团中的氮原子配位,生成中间体Ⅳ,随后选择性活化吲哚环上的邻位C-H键生成中间体Ⅴ,最后,六元环状铜络合物经过还原消除生成产物Ⅲ,并释放出Cu(Ⅰ)络合物。当使用催化量的铜参与反应时Cu(Ⅰ)会被氧化剂氧化为Cu(Ⅱ)催化剂,进入下一个催化循环。如图3所示。
3 结论
合理设计路线,制备了一系列新型的N-芳基取代
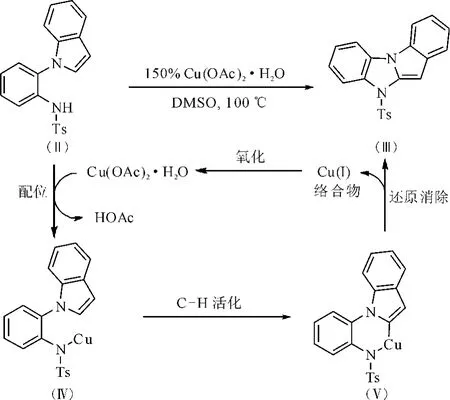
图3 反应机理Fig.3 The reaction mechanism
的吲哚衍生物,首次实现了Cu(OAc)2·H2O促进的区域选择性吲哚C-2位分子内C-H活化/胺化反应,能够高效合成一系列具有潜在应用价值的吲哚稠杂环化合物,最高收率可达84%。通过X-射线单晶衍射确定了产物的晶体结构,并推测了可能的反应机理。
[1] del AMO V,DUBBAKA SR,KRASOVSKIY A,et al.General preparation of primary,secondary,and tertiary aryl amines by the oxidative coupling of polyfunctional aryl and heteroaryl amidocuprates[J].Angewandte Chemie International Edition,2006,45(46):7838-7842.
[2] BANDINIM,EMER E,TOMMASIS,et al.Innovative catalytic protocols for the ring-closing Friedel-Crafts-Type alkylation and alkenylation of arenes[J].European Journal of Organic Chemistry,2006,(16):3527-3544.
[3] GODULA K,SAMESD.C-H Bond functionalization in complex organic synthesis[J].Science,2006,312(5770):67-72.
[4] DAVIESH M L,MANNING JR.Catalytic C-H functionalization by metal carbenoid and nitrenoid insertion[J].Nature,2008,451 (7177):417-424.
[5] LEOW D,LIG,MEIT S,etal.Activation of remotemeta-C-H bonds assisted by an end-on template[J].Nature,2012,486(7404):518-522.
[6] LYONS TW,SANFORD M S.Palladium-catalyzed ligand-directed C -H functionalization reactions[J].Chemical Reviews,2010,110 (2):1147-1169.
[7] ACKERMANN L.Carboxylate-assisted transition-metal-catalyzed CH bond functionalizations:Mechanism and scope[J].Chemical Reviews,2011,111(3):1315-1345.
[8] MCMURRAY L,O'HARA F,GAUNT M J.Recent developments in natural productsynthesisusingmetal-catalysed C-H bond functionalisation[J].Chemical Society Reviews,2011,40(12):1885-1898.
[9] YAMASHITA M,HORIGUCHIH,HIRANO K,et al.Fused ring construction around pyrrole,indole,and related compounds via palladiumcatalyzed oxidative coupling with alkynes[J].Journal of Organic Chemistry,2009,74(19):7481-7488.
[10] DING ST,SHIZ Z,JIAO N.Pd(Ⅱ)-catalyzed synthesis of carbolines by iminoannulation of internal alkynes via direct C-H bond cleavage using dioxygen as oxidant[J].Organic Letters,2010,12 (7):1540-1543.
[11] WANG L,GUOW,ZHANG X X,et al.Synthesis of indolo[1,2-a]quinoxalines via a Pd-catalyzed regioselective C-H olefination/cyclization sequence[J].Organic Letters,2012,14(3):740-743.
[12] ZHANG H,CAIQ,MA DW.Amino acid promoted CuI-catalyzed C -N bond formation between aryl halidesand aminesor N-containing heterocycles[J].Journal of Organic Chemistry,2005,70(13):5164-5173.
[13] CHEESEMAN GW H,HAWIA A.Synthesis of 5,6-dihydropyrrolo[1,2-a][3,1,6]thiadiazocines[J].Journal of Heterocyclic Chemistry,1985,22(2):423-427.
Intramolecular C-H Activation/Am ination Reaction of Indole Derivatives Promoted by Cu(OAc)2·H2O
WANG Liang,LIZhan,QU Xing,PENG Wang-m ing
(Key Laboratory of Optoelectronic Chemical Materials and Devices of Ministry of Education,Jianghan University,Wuhan 430056,China)
A series of N-aryl-substituted indole derivatives were designed and synthesized from readily available starting materials.Some novel indole-fused heterocycles compounds with potential biological activities were obtained through intramolecular C-H activation/amination reaction of N-aryl-substituted indoles derivatives promoted by Cu (OAc)2·H2O.The application scope of substrateswere studied,the crystal structure of new cyclic productwas characterized by X-ray diffraction,and themechanism was proposed.
copper acetate;C-H activation/amination;C-N bond formation;indole-fused heterocycles
O 623.11
A
1672-5425(2015)02-0025-04
10.3969/j.issn.1672-5425.2015.02.006熔点仪;DF-101S型集热式磁力搅拌器,巩义予华仪器有限公司;BSA224S型电子天平,赛多利斯;RE2000A型旋转蒸发仪,上海亚荣。
国家自然科学基金资助项目(21302064),江汉大学博士科研启动经费资助项目(2012023)
2014-11-09
王亮(1982-),男,湖北人,讲师,硕士生导师,研究方向:过渡金属催化的C-H活化反应,E-mail:wangliang1211@126. com。
