绿豆叶斑病病原鉴定及生物学特性研究
2015-07-02刘昌燕肖炎农吴小微陈宏伟刘良军万正煌
刘昌燕, 肖炎农, 吴小微, 李 莉, 陈宏伟, 刘良军, 万正煌*
(1.湖北省农业科学院粮食作物研究所/粮食作物种质创新与遗传改良湖北省重点实验室,武汉 430064;2.华中农业大学植物科学技术学院,武汉 430064)
绿豆叶斑病病原鉴定及生物学特性研究
刘昌燕1, 肖炎农2, 吴小微2, 李 莉1, 陈宏伟1, 刘良军1, 万正煌1*
(1.湖北省农业科学院粮食作物研究所/粮食作物种质创新与遗传改良湖北省重点实验室,武汉 430064;2.华中农业大学植物科学技术学院,武汉 430064)
对绿豆叶斑病菌进行形态学和分子特征鉴定,结果表明,分离物在V8培养基上菌落近圆形,菌落边缘泛紫色,分生孢子无色;用通用引物18SF和28SR扩增6个分离物的rDNA-ITS部分序列和测序,并到GenBank(登录号:KM435076)数据库进行比对,6个分离物与变灰尾孢分离物序列相似性为99%,基于形态和分子特征将绿豆叶斑病病原菌鉴定为变灰尾孢。致病性测定结果表明,6个分离物对绿豆‘中绿一号’叶片均致病且存在致病力差异。不同培养基、温度和p H对病原菌生长的影响研究表明,V8培养基最适宜该病菌生长,病菌生长的最适温度为25℃,最适p H为6。
绿豆; 叶斑病; 变灰尾孢; 鉴定; 生物学特性
绿豆叶斑病是绿豆生产上主要的真菌病害,广泛分布于我国各大绿豆产区。安徽、河南、陕西、河北等省是绿豆叶斑病的常发区,给当地的绿豆生产造成了严重损失。该病由尾孢菌属的多个种引起,其中变灰尾孢(Cercospora canescens)被认为是最主要的病原菌。病原菌主要侵染绿豆植株的叶部,严重时导致穿孔,叶片枯死[13]。一般造成20%~50%的绿豆产量损失,最高可达90%以上[46]。
绿豆叶斑病虽然造成损失严重,但我国尚缺乏对该病害的深入系统研究,该病害的发生发展没有引起足够的重视,相关参考资料很少。本研究结合传统的植物病原鉴定方法和分子生物学技术对该病害的病原菌进行了鉴定,并对其生物学特性进行了初步研究,以期为绿豆叶斑病的流行、防治、抗性资源筛选和抗病品种选育提供有价值的信息。
1 材料与方法
1.1 病原菌分离纯化
从病田采集具典型症状的病叶,用常规组织分离方法进行病原菌分离[7]。将从田间采集的发病叶片轻轻冲洗干净,从病健交界处切取3 mm×3 mm小块组织;用75%乙醇溶液浸泡2~3 s,再用1%次氯酸钠消毒3 min,后用灭菌水冲洗3次,用无菌吸水纸吸干,然后接种到V8培养基上,在28℃条件下培养;病原菌长出后转入V8培养基进一步纯化,选6个分离物用于进一步研究,编号为Cc-1~Cc-6。
1.2 病原菌形态观察
将分离物接种在V8培养基28℃培养,观察菌落形态。从绿豆叶片病斑表面刮取病菌的分生孢子和分生孢子梗,在光学显微镜下观察,并在显微照相系统100倍油镜下照相。
1.3 致病性鉴定
采用离体叶片菌丝块接种法测定病原菌的致病性[8]。6个分离物在V8培养基上25℃下培养15 d,接种前用直径6 mm的打孔器在菌落边缘打取菌饼作为接种体。挑选颗粒饱满,大小接近的‘中绿1号’绿豆种子,进行表面消毒,用75%乙醇消毒20 s,1%NaClO消毒3 min,最后用无菌水洗3次;表面消毒后的种子放在2~3层喷有水的吸水纸上,室温条件下放置12~24 h,待绿豆种子的胚芽突破种皮,胚根伸长约0.5 cm时播种。将培养土高温高压灭菌后,分装到培养盘内,整平,压实苗床,控制土壤相对含水量约70%~80%,表面消毒后的种子点播到培养盘内,用细土层覆盖种芽;12 h光照黑暗交替下培养,定期观察绿豆苗生长情况,适时浇水。取健康、位置相近的绿豆复叶叶片,用自来水冲洗叶片表面后放在塑料盒内湿润的吸水纸上,叶片的正面向上,中部稍偏叶脉部位用牙签造成小伤口,取菌饼将菌丝面朝下接种到绿豆叶片伤口之上;接种后,塑料盒用保鲜膜封紧保湿,放入温室25℃条件下培养,每天12 h光照,每个分离物做4组重复,每组重复接种3片叶,以接种V8培养基为对照。每日观察病斑扩展情况,10 d后测量病斑直径,每个病斑测量3次。
1.4 病原菌分子鉴定
1.4.1 DNA提取
分离物在V8培养基上培养2周,收集菌丝,参照易克贤等的方法[9]进行基因组DNA的提取。
1.4.2 ITS区域扩增与测序
采用真菌核糖体r DNA区通用引物18SF(5'-TCCGTAGGTGAACCTGCG-3')和28SR(5'-TATCCCTACCTGATCCGAG-3')扩增ITS1和ITS2及5.8S DNA全序列[10]。PCR反应体系包括:10× PCR缓冲液2.5μL、d NTPs各0.2 mmol/L、引物10 pmol/L、DNA模板10 ng、Taq DNA聚合酶1.0 U。同时以加无菌水为模板,其他条件不变作为对照。
PCR反应程序为:94℃预变性5 min;94℃30 s、56℃45 s、72℃1 min,35个循环;72℃延伸10 min。扩增产物在恒压150 V下用1%琼脂糖凝胶电泳检测。
利用琼脂糖凝胶DNA回收试剂盒(北京天根生化科技有限公司)回收6个分离物目标片段,纯化后由武汉擎科生物技术有限公司测序。将测序获得的分离物ITS序列直接在NCBI网站进行BLAST比对分析并提交序列。
1.5 培养基对分离物生长速率的影响
选用PDA、PSA、V8、Czapek和Richard共5种培养基,用打孔器打出6 mm的菌饼,分别接种在直径为9 cm的平板中央,在28℃恒温培养箱连续培养15 d,用十字交叉法测量菌落直径,计算菌落生长速率(mm/d),每处理5个重复[7]。生长速率=(第15天菌落直径-第7天菌落直径)/8。
1.6 温度对分离物生长速率的影响
将6 mm的菌块接种到PDA平板的中央,分别置于15、20、25、30、35、40℃的培养箱中培养,每处理5个重复。培养条件和测量方法同1.5。
1.7 p H对分离物生长速率的影响
用1 mol/L的HCl和NaOH溶液将PDA培养基的p H分别调节成2~11,在平板中央接种6 mm的菌块,置于28℃恒温培养箱中培养,每处理5重复。培养条件和测量方法同1.5。
2 结果与分析
2.1 病害症状
绿豆叶斑病菌主要危害叶片,花蕾期开始发病,最初叶片上出现2~15 mm水渍状褐色小点,扩展后形成边缘红褐色至红棕色、中间浅灰色至浅褐色近圆形病斑(图1)。湿度大时,病斑上密生灰色霉层。在绿豆开花结荚期,病斑急剧扩展融合成片,很快干枯,接着叶片枯死穿孔脱落、早衰,全株死亡。
2.2 病原菌形态鉴定
所有菌株在V8培养基上菌落近圆形,边缘光滑,气生菌丝致密,菌落边缘泛紫色。分生孢子针形或倒棍棒形,无色,直立或稍弯曲,有3至多个隔膜,领部尖细至近钝,基部倒圆锥形平截至平截。(图2)。这一观察结果与郭英兰等[11]描述的寄生在豆科植物上的尾孢菌基本一致,故确认绿豆叶斑病的病原菌为尾孢菌(Cercospora sp.)。
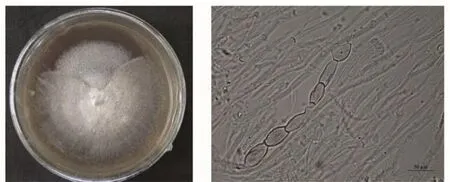
图2 绿豆叶斑病菌菌落特征及分生孢子形态Fig.2 Colonies of leaf spot cultured in V8 and conidia under microscope
2.3 致病性测定
将6个分离物分别接种在‘中绿一号’复叶叶片上,均导致绿豆叶片发病。选择部分发病植株再进行病原菌的分离,目标分离物获得率为100%。10 d后测定病斑大小,分离物Cc-5接种后产生的病斑面积最大,致病性最强;Cc-3次之,致病力稍弱;Cc-2、Cc-4、Cc-6居中;Cc-1接种后病斑面积最小,致病力最弱(图3)。

图3 不同分离物对‘中绿一号’绿豆致病力差异Fig.3 Differences in the pathogenicity of different isolates to mung bean‘Zhonglv No.1’
2.4 ITS序列分析
用r DNA-ITS通用引物18SF/28SR对6个分离物基因组DNA进行PCR扩增,扩增产物电泳结果见图4。引物18SF/28SR在6个分离物中均扩增出大小为500 bp左右的片段,双蒸水即CK-则无扩增条带。6个扩增产物经回收、测序,得到的片段大小为466 bp。将获得的分离物序列(GenBank上登录号为KM435076)在NCBI上进行BLAST分析,与C.canescens相似性达到99%。结合上述菌落和孢子形态鉴定、田间病害症状、对绿豆叶片致病性测定和ITS分子鉴定结果,将引起绿豆叶斑病的病原菌鉴定为变灰尾孢(C.canescens)。
2.5 培养基对菌丝生长的影响
以分离物Cc-5为代表进行生物学特性研究。供试分离物在5种供试培养基上的生长速率差异不显著,但在V8培养基上生长速率相对较快,菌落直径最大,培养7 d的菌落直径为23.58 mm,最适合分离物的生长(图5);分离物在Richard和Czapek培养基上菌落生长速度大于PDA和PSA培养基,但是菌落太稀疏;病原菌的颜色和形态在各培养基上存在较大差异。

图4 ITS引物18SF/28SR对6个分离物的扩增结果Fig.4 PCR amplification results of six isolates with ITS primers 18SF/28SR
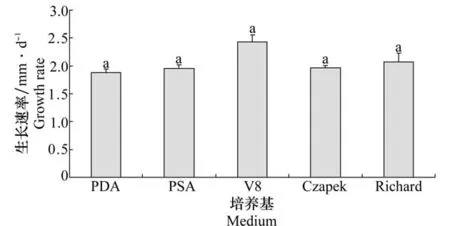
图5 培养基对菌落生长速率的影响Fig.5 Effects of culture media on colony growth rate
2.6 温度对菌丝生长的影响
温度对病原菌菌落生长的影响如图6所示。结果表明,分离物Cc-5在25℃生长最快,平均生长速率为3.42 mm/d,在温度15℃和35℃条件下生长较为缓慢,平均生长速度为0.78 mm/d和0.36 mm/d, 40℃条件未见有菌落形成。
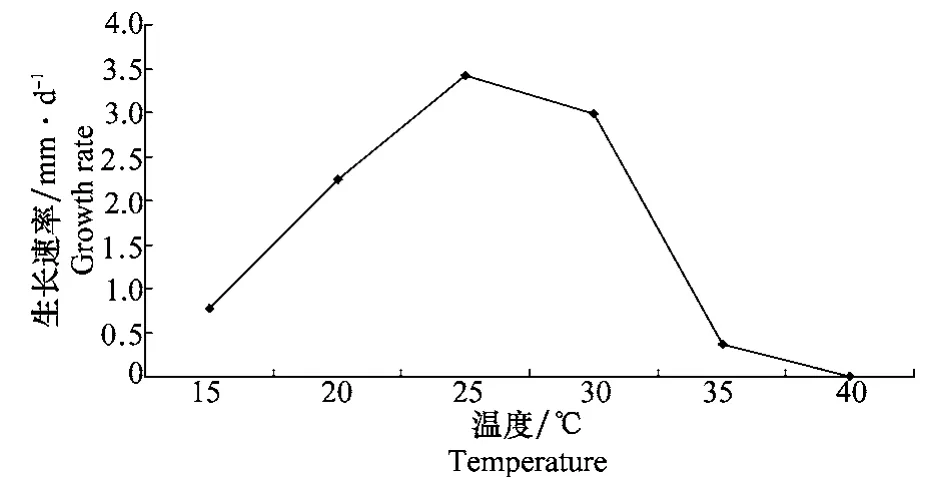
图6 温度对菌落生长速率的影响Fig.6 Effects of temperature on colony growth rate
2.7 p H对菌丝生长的影响
从图7可以看出,分离物Cc-5在p H为2~11范围内均能生长,说明该病原菌有较好的p H耐受性;在p H为6时,生长速率最快,生长速率为3 mm/d,说明该病原菌弱酸性最适宜生长。

图7 p H对菌落生长速率的影响Fig.7 Effects of p H on colony growth rate
3 讨论
李怡琳等[12]1982-1986年对绿豆叶斑病进行了研究,通过对不同地区大量标样的鉴定,确认变灰尾孢菌是引起绿豆叶斑病的病原菌。
绿豆叶斑病病原菌在培养基上生长十分缓慢,分离困难。本研究利用V8培养基能有效分离绿豆叶斑病病原菌,原因可能是V8培养基除了提供基本营养外,还可以提供多种维生素,促进了病原菌的生长。
ITS区域测序结果表明,6个分离物序列与Gen Bank中C.canescens序列相似性为99%。致病性测定表明,6个分离物可导致绿豆品种‘中绿一号’发病,且分离物间存在致病力的差异。因此,基于田间病害症状、病原菌形态学和分子生物学特征以及对绿豆的致病性,确定引起所鉴定的绿豆叶斑病病原菌为变灰尾孢(C.canescens)。这是国内首次对引起绿豆叶斑病的病原菌进行系统鉴定。
绿豆叶斑病主要发生在绿豆开花前(4~5片复叶时),并在田间多次反复侵染,在开花结荚期常造成大量落叶,致使严重减产或失收。绿豆叶斑病菌以菌丝体和分生孢子随病株在土壤内越冬,翌年随气流扩散再侵染。生长季节危害叶片,开花前后扩展较快,借风雨传播蔓延。炎热潮湿条件下,经分生孢子多次再侵染,病原菌大量积累,遇有适宜条件即流行。高温高湿有利于该病发生和流行,尤以秋季多雨、连作地或反季节栽培发病重;若少雨干旱,则发病较轻。冯耀景等[13]对绿豆叶斑病的发生调查表明,绿豆叶斑病的发病程度与空气湿度和温度有关。湿度为85%~90%、温度为25~28℃时,病情发展最快,绿豆叶片受害最重,茎、花梗也会受害[13]。该病在开花前发生,初发时,叶片上出现褐色病斑,边缘带黄圈,后期多个病斑连成直径5~10 mm的大病斑,遇炎热潮湿条件病斑会扩大至整个叶片枯死,如花荚期高温多湿气候常形成病害大发生,抑制植株光合作用[13]。
本研究表明绿豆叶斑病病原菌的生长最适温度为25℃,最适p H为6。这一结果与张益先等[15]和刘庆奎等[16]对玉米灰斑病菌的研究结果一致。变灰尾孢在人工培养条件下不容易产生分生孢子,本试验中所获菌株除了在V8培养基上产孢外,在PDA、PSA、Richard和Czapek培养基上均未能产孢。因此,还需要尝试其他不同的培养基配方,期望能找到一种有利于变灰尾孢产孢的培养基,通过研究我国绿豆叶斑病病原菌的生物学特性,在防治绿豆叶斑病方面提供一定的理论基础。目前,随着全球气候变暖,极端天气越来越多,变灰尾孢具有较大的温度范围适应特性,其引起的绿豆叶斑病可能具有加重的趋势,应该引起足够的重视,并加强防治研究。
[1] Chand R,Singh V,Pal C,et al.First report of a new pathogenic variant of Cercospora canescens on mung bean(Vigna radiata)from India[J].New Disease Reports,2012,26:6.
[2] Thakur R P,Patel P N,Verma J P.Genetical relationships between reactions to bacterial leaf spot,yellow mosaic and Cercospora leaf spot diseases in mung bean(Vigna radiata)[J].Euphytica,1977,26:765-774.
[3] Iqbal S M,Zubair M,Haqqani A M.Resistance in mung bean to Cercospora leaf spot disease[J].International Journal of Agriculture and Biology,2004,6(5):792-793.
[4] 王彦,田静,范保杰,等.小豆主要病害研究进展[J].华北农学报,2011,26(S1):197-201.
[5] 邢宝龙,冯高,郭新文,等.绿豆尾孢菌叶斑病田间药剂防治试验[J].山西农业科学,2012,40(3):264-266.
[6] 刘昌燕,仲建锋,万正煌,等.化学药剂对绿豆尾孢菌叶斑病的田间防治效果比较[J].安徽农业科学,2013,41(25):10307-10312.
[7] 方中达.植病研究方法[M].北京:农业出版社,1998:46-50.
[8] Castro M,Kramer K,Valdivia L,et al.A double-stranded RNA mycovirus confers hypovirulence-associated traits to Botrytis cinerea[J].FEMS Microbiology Letters,2003,228(1):87-91.
[9] 易克贤,黄俊生,刘国道,等.中国柱花草炭疽病原菌遗传多态性的RAPD分析[J].微生物学报,2003,43(3):379-387.
[10]杨腊英,黄华平,唐复润,等.香蕉炭疽菌rDNA ITS区的分子鉴定与检测[J].植物病理学报,2006,36(3):219-225.
[11]郭英兰,刘锡琎.中国真菌志-尾孢菌属(24卷)[M].北京:科学出版社,2005:148-150.
[12]李怡琳,李淑英.绿豆品种抗叶斑病鉴定研究[J].作物品种资源,1987(4):12-14.
[13]冯耀景,苏永福,王辉.泌阳县绿豆主要病虫害发生特点及综合防治技术[J].现代农业科技,2011(19):197-201.
[14]侯慧颖,张玉训,陈丽.绿豆病虫害发生及防治措施[J].种业导刊,2009(9):34.
[15]张益先,吕国忠,梁景颐,等.玉米灰斑病菌生物学特性研究[J].植物病理学报,2003,33(4):292-295.
[16]刘庆奎,秦子慧,张小利,等.中国玉米灰斑病病原菌的鉴定及其基本特征研究[J].中国农业科学,2013,46(19):4044-4057.
(责任编辑:田 喆)
Pathogen identification and biological characteristics of mung bean Cercospora leaf spot
Liu Changyan1, Xiao Yannong2, Wu Xiaowei2, Li Li1, Chen Hongwei1, Liu Liangjun1, Wan Zhenghuang1
(1.Institute of Food Crops,Hubei Academy of Agricultural Sciences/Hubei Key Laboratory of Food Crop Germplasm and Genetic Improvement,Wuhan 430064,China;2.College of Plant Science and Technology,Huazhong Agricultural University,Wuhan 430064,China)
The morphology and molecular characteristics of mung bean leaf spot were studied.The results indicated that the colony of isolates was circular in V8 medium,the edge was purple and the conidia were colorless.The partial r DNA-ITSsequences of six isolates were amplified with universal primers 18SF and 28SR.The obtained ITS sequences(GenBank accession No.KM435076)were aligned with Gen Bank and showed 99%similarity with isolates of Cercospora canescens.Based on morphological and molecular characteristics,the pathogen of mung bean leaf spot was identified as C.canescens.Pathogenicity test results showed that all mung bean cv‘Zhonglv No.1’leaves showed dark brown lesions when inoculated with six isolates and had virulence differences.The influences of different media,temperatures and p H values on the growth of pathogen were observed.V8 was the optimum culture medium for pathogen growth,at 25℃and p H 6.
mung bean; leaf spot disease; Cercospora canescens; identification; biological characters
S 436.43
A
10.3969/j.issn.0529-1542.2015.06.014
2014-09-22
2014-12-04
国家现代农业产业技术体系(CARS09);科技部国际合作重点项目(2011DFB31620);湖北省农业科学院青年科学基金项目(2014NKYJJ35)
*通信作者 E-mail:zhwan168@163.com
