不同胰腺提取物对大鼠骨髓间充质干细胞分泌细胞因子的影响
2015-07-01许聿新井庆平
许聿新,井庆平
(淄博市第一医院,山东淄博255200)
不同胰腺提取物对大鼠骨髓间充质干细胞分泌细胞因子的影响
许聿新,井庆平
(淄博市第一医院,山东淄博255200)
目的 探讨不同胰腺提取物对大鼠骨髓间充质干细胞分泌细胞因子的影响。方法 制备模拟胰腺微环境的大鼠正常及再生性胰腺提取物,同时分离培养鉴定大鼠骨髓间充质干细胞。分别应用正常及再生性胰腺提取物孵育间充质干细胞获得条件培养液,并设立无胰腺提取物处理的对照组;ELISA法检测三组条件培养液中胰岛素样生长因子-1(IGF-1)、肝细胞生长因子(HGF)、血管内皮生长因子(VEGF)及碱性表皮生长因子(bFGF)的含量,应用RT-PCR分析胰腺提取物对间充质干细胞中四种细胞因子 mRNA的改变。结果 三组均可以检测到IGF-1、HGF、bFGF及VEGF,其中再生性胰腺提取物处理的条件培养液组中四种细胞因子含量最高,与其他两组相比差异有统计学意义(P均<0.05)。再生性胰腺提取物处理的骨髓间充质干细胞的IGF-1、HGF、VEGF及bFGF的mRNA相对表达量与其他两组相比均明显升高(P均<0.05)。结论 模拟糖尿病胰腺微环境的再生性大鼠胰腺提取物可以促进大鼠骨髓间充质干细胞分泌更多的具有胰腺保护作用的细胞因子。
糖尿病;胰腺提取物;干细胞,骨髓;细胞因子类
糖尿病的共同发病基础是有功能的胰岛β细胞团绝对或相对不足。研究发现,移植间充质干细胞(MSCs)可以部分逆转糖尿病动物模型的高血糖状态[1,2],但其机制尚未阐明,移植到体内的MSCs是否能分化为胰岛素分泌细胞并发挥“替代补充”作用仍存在争议[3,4]。2013年8月~2014年5月,我们应用大鼠胰腺提取物(RPE)在体外模拟胰腺微环境,探讨RPE对MSCs细胞因子表达及分泌的影响。
1 材料与方法
1.1 材料 实验动物:6~8周龄雄性Wistar大鼠,体质量150~200 g,清洁级,购自山东大学实验动物中心。仪器及试剂:PCR仪(MJ Research公司,美国)、电泳成像分析系统(BIO-RAD公司,美国)、酶联免疫检测仪(INTEC公司,Reader 2010型)、流式细胞仪(BECKMAN COULTER公司)、细胞总RNA提取使用Trizol试剂(Invitrogen公司,美国)、逆转录反应试剂盒,PCR试剂盒(大连宝生物公司,中国),ELISA试剂盒(Adlitteram Diagnostic laboratories,USA)。
1.2 方法
1.2.1 RPE的制备[5]大鼠麻醉后,行胰腺大部分切除。48 h后,找到并切除残留胰腺(即再生胰腺),经匀浆化处理,离心抽滤,即再生性大鼠胰腺提取物(R-RPE)。正常胰腺提取物(N-RPE)为未行胰腺大部切除的正常胰腺直接经过匀浆处理后提取的提取液。
1.2.2 大鼠MSCs条件培养液的制备 采用全骨髓贴壁培养法分离培养大鼠MSCs,取第三代MSCs培养于含10% FBS的LG-DMEM的培养板中,细胞融合至80%后,培养基中分别加入R-RPE及N-RPE,培养7 d,去除含RPE培养液,以无血清培养液培养MSCs 48 h,收获细胞及培养上清液。根据处理方式不同分为三组:无RPE对照组(CTR-CM),N-RPE处理组(N-RPE-CM)和R-RPE处理组(R-RPE-CM)。
1.2.3 大鼠MSCs条件培养液细胞因子检测 应用ELISA法测定大鼠MSCs条件培养液上清的胰岛素样生长因子-1(IGF-1)、肝细胞生长因子(HGF)、血管内皮生长因子(VEGF)及碱性表皮生长因子(bFGF)水平,严格按说明书操作,每组设5个复孔。
1.2.4 大鼠MSCs分泌细胞因子mRNA检测 取经过R-RPE、N-RPE处理及未经处理的MSCs,计数1×106个细胞。采用TRIzol试剂一步法提取总RNA,严格按照逆转录试剂盒合成第一条cDNA,所得cDNA用于PCR扩增,设立β-actin作为内参照,引物设计参考文献[6],由上海博亚生物公司合成;2%琼脂糖凝胶电泳检测PCR产物mRNA,紫外线下观察电泳结果并照相,重复3次。
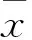
2 结果
2.1 骨髓MSCs形态及细胞表型 大鼠骨髓细胞在贴壁培养48 h后可见散在贴壁细胞。7~10 d后,贴壁细胞数目明显增多,呈梭形或长多边形,细胞排列整齐。原代培养10~14 d细胞80%~90%融合,有规律地排列成放射状或旋涡状。按1∶2的比例传代,传代后的MSCs形态与原代基本相似,经过3代后MSCs基本达到形态均一。流式细胞仪分析第三代MSCs细胞表型,细胞高表达CD44和CD90,而CD34、CD45低表达或表达阴性。
2.2 三组IGF-1、HGF、bFGF和VEGF水平比较 四种细胞因子在三组培养液上清中均可以检测到,其中R-RPE-CM组及N-RPE-CM组中四种细胞因子与CTR-CM组相比均明显升高(P均<0.05),R-RPE-CM组四种细胞因子水平高于N-RPE-CM组(P均<0.05)。见表1。
表1 三组IGF-1、HGF、bFGF和VEGF 水平比较
注:与CTR-CM组相比,#P<0.05;与N-RPE-CM组相比,*P<0.05。
2.3 三组IGF-1、HGF、bFGF和VEGF的mRNA相对表达量 半定量RT-PCR结果显示,与CTR-CM组相比,经过N-RPE和R-RPE处理MSCs的IGF-1、HGF、VEGF及bFGF的mRNA相对表达量均明显升高(P均<0.05)。R-RPE组与N-RPE组比较,IGF-1、HGF、VEGF及bFGF的mRNA相对表达量也均明显升高(P均<0.05)。见表2。
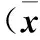
表2 三组IGF、HGF、bFGF和VEGF的mRNA 相对表达量比较±s)
注:与CTR-CM组相比,#P<0.05;与N-RPE-CM组相比,*P<0.05。
3 讨论
骨髓MSCs在体外易分离培养和扩增,植入体内仅有低免疫排斥反应,是糖尿病再生治疗研究的热点。移植到体内的MSCs定位到受损的糖尿病胰腺中可以促进宿主胰岛细胞的再生,胰岛素分泌增加,发挥降血糖作用。我们推测,MSCs可能通过分泌具有胰腺保护作用及促进胰岛细胞增生的细胞因子而发挥作用[7]。
骨髓MSCs可以分泌多种细胞因子参与细胞形态的维系及组织发育,在不同的微环境下,MSCs分泌的细胞因子具有高度的可塑性。移植MSCs入心肌梗死患者体内,可以促进心肌细胞增生,有效减少梗死面积,改善心功能[8,9]。移植MSCs至脑梗死患者,可以促进内源性神经干细胞的增殖和分化,从而改善患者神经功能[10,11]。以上研究证实了MSCs分泌的细胞因子及发挥的作用与其定位的微环境有密切关系。
通过部分胰腺切除后获得再生性胰腺,经过匀浆化处理后得到的再生性胰腺提取物,被认为可模拟受损的胰腺微环境,更接近于糖尿病患者的胰腺微环境[12,13]。我们在体外应用胰腺提取物孵育MSCs,模拟MSCs移植后定居于胰腺在胰腺微环境下MSCs分泌细胞因子的变化,结果显示,有胰腺保护作用的相关细胞因子如IGF-1、HGF、bFGF和VEGF的分泌增加,相关细胞因子基因表达明显增加,与对照组有统计学差异。并且应用再生性胰腺提取物处理后与正常胰腺提取物相比,细胞因子的分泌及基因表达升高更明显,提示模拟受损胰腺微环境的再生胰腺提取物可以改变MSCs的基因表达,有胰腺保护作用的细胞因子表达和分泌明显增加,进一步证实MSCs细胞因子的分泌与其所处的微环境密切相关。
在1型糖尿病的发生过程中,自身免疫攻击导致体内炎性细胞浸润,促进胰腺细胞坏死、凋亡,胰腺在病理情况下启动胰岛的再生。移植MSCs到糖尿病动物模型后,定居于胰岛的MSCs分泌细胞因子的能力在再生性胰岛环境下被激活,分泌具有胰腺保护作用细胞因子,发挥促进胰腺细胞再生,抑制细胞凋亡的作用,从而使胰岛细胞团数量增加,分泌胰岛素,降低血糖。MSCs在受损胰腺微环境下的旁分泌效应可能是改善糖尿病动物模型糖代谢的机制。
[1] Tang DQ, Cao LZ, Burkhardt BR, et al. In vivo and in vitro characterization of insulin-producing cells obtained from murine bone marrow[J]. Diabetes, 2004,53(7):1721-1732.
[2] Gabr MM, Zakaria MM, Refaie AF, et al. Insulin-producing cells from adult human bone marrow mesenchymal stem cells control streptozotocin-induced diabetes in nude mice[J]. Cell Transplant, 2013,22(1):133-145.
[3] Chhabra P, Brayman KL.Stem cell therapy to cure type 1 diabetes: from hype to hope[J]. Stem Cells Transl Med, 2013,2(5):328-336.
[4] Choi JB, Uchino H, Azuma K, et al. Little evidence of transdifferentiation of bone marrow-derived cells into pancreatic beta cells[J]. Diabetologia, 2003,46(10):1366-1374.
[5] Gao X, Song L, Shen K, et al. Transplantation of bone marrow derived cells promotes pancreatic islet repair in diabetic mice[J]. Biochem Biophys Res Commun, 2008,371(1):132-137.
[6] Lee J, Han DJ, Kim SC. In vitro differentiation of human adipose tissue-derived stem cells into cells with pancreatic phenotype by regenerating pancreas extract[J]. Biochem Biophys Res Commun, 2008,375(4):547-551.
[7] Li X, Zhang L, Meshinchi S, et al. Islet microvasculature in islet hyperplasia and failure in a model of type 2 diabetes[J]. Diabetes, 2006,55(11):2965-2973.
[8] Gnecchi M, Danielip P, Cervia E. Mesenchymal stem cell therapy for heart disease[J]. Vascul Pharmacol, 2012,57(1):48-55.
[9] Kuraitis D, Ruel M, Suuronen EJ. Mesenchymal stem cell therapy for cadiovascular regeneration [J]. Cardiovasc Drug Ther, 2011,25(4):349-362.
[10] Kim SJ, Choi SW, Hur KJ. Synergistic effect of mesenchymal stem cells infected with recombinant adenovirus expressing human BDNF on erectile function in a rat model of cavernous nerve injury[J]. Korean Urol, 2012,53(10):726-732.
[11]Motoyoshi YA, Tamura M, Moriyama M. Activation of cultured atrocities by amphotericin B: Stimulation of NO and cytokines production and changes in neurotrophic factors production[J]. Neurochem Int, 2013,5:232-240.
[12] Hardikar AA, Bhonde RR. Modulating experimental diabetes by treatment with cytosolic extract from the regenerating pancreas[J]. Diabetes Res Clin Pract, 1999,46(3):203-211.
[13] Choi KS, Shin JS, Lee JJ, et al. In vitro trans-differentiation of rat mesenchymal cells into insulin-producing cells by rat pancreatic extract[J]. Biochem Biophys Res Commun, 2005,330(4):1299-1305.
井庆平
10.3969/j.issn.1002-266X.2015.01.009
R587.1
A
1002-266X(2015)01-0025-03
2014-08-12)
