卒中后认知损害与动脉硬化因子的相关性研究
2015-07-01袁凤仪朱峰简文佳倪敬年魏明清时晶
袁凤仪,朱峰,简文佳,倪敬年,魏明清,时晶
(1.解放军医学院,北京 100853;2.北京中医药大学东直门医院脑病3科)
·论著·
卒中后认知损害与动脉硬化因子的相关性研究
袁凤仪1,朱峰1,简文佳2,倪敬年2,魏明清2,时晶2
(1.解放军医学院,北京 100853;2.北京中医药大学东直门医院脑病3科)
目的 评价卒中后认知功能与动脉硬化因子的相关性。方法 选取103例就诊患者,根据卒中后有无认知损害分组,纳入卒中后认知损害(CIAS)组(n=54)和卒中后无认知损害(NCIAS)组(n=49)。分别测量血液中动脉硬化因子和踝臂指数(ABI)等,并比较两组之间的是否存在统计学差异。结果 CIAS组ABI显著低于NCIAS组(P=0.002),且卒中后认知损害可能与年龄增加、低密度脂蛋白胆固醇(LDL-C)水平增高及ABI降低有关。结论 部分动脉硬化因子加重卒中后认知功能损害。
卒中;认知障碍;动脉硬化
缺血性脑卒中后一年内仍有68.8%的患者存在血管性认知损害(VCI),究其原因多责之于脑缺血的部位、数量及缺血损伤时间等因素[1]。然而,动脉粥样硬化是否对卒中后认知损害发生有协同或叠加作用,目前仍然尚存争议。本研究旨在评价卒中后认知功能与动脉硬化因子的相关性,对于认知功能障碍的预防和治疗有重要意义。
1 资料与方法
1.1 一般资料 病例源自于2012年6月至2013年5月期间,在北京中医药大学东直门医院脑病科就诊患者。
1.2 纳入标准 ⑴有缺血性卒中病史,或CT/MRI检查发现有责任缺血病灶;⑵有足够的视觉和听觉分辨力接受神经心理学测试;⑶有一定文化程度,既往能阅读简单的文章和书写简单的句子;⑷同意接受踝臂指数测量及神经心理学检查。
1.3 排除标准 ⑴CT或MRI检查提示为脑出血和(或)其他非血管性疾病(如肿瘤);⑵抑郁状态(HAMD>12分),或其他精神障碍;⑶有酗酒或精神类物质滥用史;⑷有其他引起中枢神经损伤的疾病或病史,如肿瘤、感染、一氧化碳中毒、中枢神经脱髓鞘疾病和变性疾病、脑外伤、神经外科手术史等;⑸有严重的神经功能缺损以至于不能完成相关检查者,如便利手偏瘫、各种失语、视听障碍等;⑹因截肢、外伤等原因不宜或不能测量踝臂指数(ABI)的患者;⑺已进行下肢动脉血运重建治疗的患者;⑻目前参与其他临床试验。
1.4 认知功能检查 由具备心理学资质的医师在独立房间对受试者进行认知功能检查,这些检测包括简易精神状态检查(MMSE),总分0~30分。临床痴呆分级量表(CDR),符合纳入、排除标准的患者,且CDR=0分为认知功能正常组即NCIAS组,CDR≥0.5分为认知功能异常组即CIAS组。
1.5 踝臂指数(ABI)测量 使用北京鑫悦琦科贸有限责任公司生产的动脉硬化检测仪。受试者休息至少5 min,采用标准仰卧位,双手掌面朝上,双足稍外旋,臂部、踝部和足部充分暴露。根据美国心脏病协会(AHA)[2]推荐的测算方法进行测算:先测量双侧肱动脉收缩期血压并取其平均值,若两侧血压差值大于10 mm Hg,则以高值作为肱动脉收缩压,再测同侧胫后动脉和足背动脉,取其中的高值作为踝部收缩压,最后用选定的踝部收缩压除以选定的肱动脉收缩压,所得的值即为这一侧的踝臂指数(ABI)。双侧的ABI均需测量,选择较低的ABI值作为受试者的ABI。ABI异常定义为ABI≤0.90。
1.6 调查方法 本研究采用横断面调查的方法。
1.7 统计学处理 采用SPSS18.0统计软件,组间均值比较采用独立样本t检验,多组均值多重比较采用单因素方差分析,若变量不满足正态分布和方差齐性,则采用非参数检验,样本率比较采用χ2检验。相关性采用Logistic回归分析,并计算比值比(OR)和95%置信区间。
2 结果
2.1 调查结果 本研究共纳入103例患者,其中49例为卒中后无认知损害(NCIAS),54例为卒中后认知损害(CIAS)。两组间除年龄[(64.7±11.2)岁比(72.4±8.5)岁,F=-3.881,P=0.000]、性别[77.6%(男性百分比)比53.7%(男性百分比),χ2=5.420,P=0.020]差异有统计学意义外(P<0.05),体质量指数(BMI)、合并症(高血压、糖尿病、脂代谢异常和冠状动脉粥样硬化性心脏病)之间均差异无统计学意义。
NCIAS组MMSE得分为(27.98±2.24)分,显著高于CIAS组(22.23±6.29)分(F=-6.366,P<0.01)。两组间血糖(Glu)、总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、血叶酸(FOL)、血维生素B12(Vit B12)和同型半胱氨酸(HCY)间均差异无统计学意义(P>0.05)。NCIAS组的ABI为1.05±0.11,CIAS组的ABI为0.96±0.17,两组间差异有统计学意义(F=-3.049,P<0.01)。
2.2 CIAS发病与动脉硬化相关因素的Logistic分析 将NCIAS和CIAS作为因变量,年龄、ABI、Glu、TC、TG、LDL-C、HDL-C、HCY、FOL、Vit B12作为自变量,采用Logistic回归分析,结果如表1所示。以上因素中,年龄是CIAS发病的危险因素。较高水平的LDL-C患者有更高的CIAS的患病风险。ABI与CIAS的发病有关(P=0.045),ABI越低,则越易患CIAS。胆固醇与CIAS的发病呈负相关,胆固醇水平越低则越易患CIAS。
2.3 ABI与实验室指标的相关性 ABI与HDL-C呈正相关(P=0.004),与HCY呈负相关(P=0.010)。ABI 与Glu、TC、TG、LDL-C、FOL、Vit B12均无相关性。
2.4 ABI正常组和异常组之间总体认知功能的比较 ABI正常组(0.90 表1 CIAS发生与动脉硬化因素的Logistic回归分析 表2 踝臂指数与实验室指标的相关性 卒中后认知损害包括血管性痴呆(VaD)和血管性认知损害未达到痴呆诊断标准者,即血管性认知损害非痴呆(VCIND)。目前研究多认为动脉粥样硬化与VaD的病因密切相关,而动脉粥样硬化的危险因素,如糖尿病、脂代谢异常、吸烟等都有可能增加VaD发生的概率。 ABI是踝部动脉收缩压与双侧肱动脉收缩压的最高值之比,是诊断外周动脉缺血的最佳无创指标[3-4]。 有研究显示,ABI能够提示广泛的动脉粥样硬化[5],是脑血管意外的预测因子[6-7],且与认知功能有相关性[8-9]。ABI降低(<0.90)可以作为认知功能障碍和痴呆的独立的预测指标[8]。本研究对卒中后NCIAS的患者和CIAS患者的ABI进行了比较,结果显示,CIAS组患者的ABI显著低于NCIAS组,组间有统计学差异(P=0.002)。ABI异常组的MMSE得分显著低于ABI正常组,组间差异有统计学意义(P=0.027)。但对受试者的一般临床资料和MMSE进行多因素相关分析后,未提示MMSE与ABI有相关性,可能与本研究样本量偏小有关,需要进一步研究。 本研究结果亦显示,胆固醇与CIAS的发病呈负相关,胆固醇水平越低,则越易患VCI,其机制尚不明确。 研究显示,高同型半胱氨酸血症是AD的独立危险因子[10],此外还与VaD显著相关[11],对健康老年人的认知功能[12]和AD的病情进展有显著关系[13]。Hcy与ABI都是动脉粥样硬化的危险因子,但两者之间有无相关性目前认识尚不统一。本研究结果显示,ABI与Hcy呈负相关,相关系数为-2.732,P=0.010。 [1] Rasquin SM,Verhey FR,van Oostenbrugge RJ,et al.Demographic and CT scan features related to cognitive impairment in the first year after stroke[J].J Neurol Neurosurg Psychiatry,2004,75(11):1562-1567. [2] Greenland P,Abrams J,Aurigemma GP,et al.Prevention Conference V: Beyond secondary prevention: identifying the high-risk patient for primary prevention: noninvasive tests of atherosclerotic burden: Writing Group III[J].Circulation,2000,101(1): E16-E22. [3] Van Exel E,Gussekloo J,Houx P,et al.Atherosclerosis and cognitive impairment are linked in the elderly.The leiden 85-plus study[J].Atherosclerosis,2002,165(2): 353-359. [4] Ouriel K.Peripheral arterial disease[J].Lancet,2001,358(9289): 1257-1264. [5] Fowkes FG.The measurement of atherosclerotic peripheral arterial disease in epidemiological surveys[J].Int J Epidemiol,1988,17(2): 248-254. [6] Heald CL,Fowkes FG,Murray GD,et al.Risk of mortality and cardiovascular disease associated with the ankle-brachial index: Systematic review[J].Atherosclerosis,2006,189(1): 61-69. [7] Fowkes FG,Murray GD,Butcher I,et al.Ankle brachial index combined with Framingham Risk Score to predict cardiovascular events and mortality: a meta-analysis[J].JAMA,2008,300(2): 197-208. [8] Guerchet M,Aboyans V,Nubukpo P,et al.Ankle-brachial index as a marker of cognitive impairment and dementia in general population.A systematic review[J].Atherosclerosis,2011,216(2): 251-257. [9] Johnson W,Price JF,Rafnsson SB,et al.Ankle--brachial index predicts level of,but not change in,cognitive function: the edinburgh artery study at the 15-year follow-up[J].Vasc Med,2010,15(2): 91-97. [10] Burns A,O'Brien J,Auriacombe S,et al.Clinical practice with anti-dementia drugs: a consensus statement from british association for psychopharmacology[J].J Psychopharmacol,2006,20(6):732-755. [11] Homocysteine Studies Collaboration.Homocysteine and risk of ischemic heart disease and stroke: a meta-analysis[J].JAMA,2002,288(16): 2015-2022. [12] McCaddon A,Hudson P,Davies G,et al.Homocysteine and cognitive decline in healthy elderly[J].Dement Geriatr Cogn Disord,2001,12(5): 309-313. [13] Oulhaj A,Refsum H,Beaumont H,et al.Homocysteine as a predictor of cognitive decline in Alzheimer's disease[J].Int J Geriatr Psychiatry,2010,25(1): 82-90. The correlation between post-stroke cognitive impairment and the arteriosclerosis factors YuanFengyi*,ZhuFeng,JianWenjia,NiJingnian,WeiMingqing,ShiJing (*MedicalCollegeofPLA,Beijing100853,China) ShiJing,Email:shijing87@hotmail.comThecorrelationbetweenpost-strokecognitiveimpairmentandthearteriosclerosisfactorsYuanFengyi*,ZhuFeng,JianWenjia,NiJingnian,WeiMingqing,ShiJing Objective To evaluate the relationship between post-stroke cognitive impairment and atherosclerotic indicators.Methods 103 cases of acute ischemic stroke patients were included and divided into cognitive impairment after stroke (CIAS) group (n=54) and non cognitive impairment after stroke (NCIAS) group (n=49)according to their cognition level.Serum arteriosclerotic indicators and ankle brachial index (ABI) of two groups were analyzed.Results The ABI of CIAS group was (0.96±0.17)significantly lower than that of NCIAS group (1.05±0.11) (P=0.002);The post-stroke cognitive impairment correlated with increased with age (OR=1.145,P=0.017) and elevated low density lipoprotein cholesterol levels (OR=46.933,P=0.033).Conclusion:The atherosclerotic indicators have impacts on the declined post-stroke cognitive function. Stroke;Cognition disorders;Vascular stiffness 北京市科委慢性病的二级预防研究(Z111107056811043);高等学校学科创新引智基地计划(B08006);北京中医药大学神经变性病创新团队项目(2011-CXTD-21) 袁凤仪,副主任医师,Email:22940494@qq.com 时晶,博士,主任医师,shijing87@hotmail.com R743.3 A 10.3969/J.issn.1672-6790.2015.05.006 2014-12-02)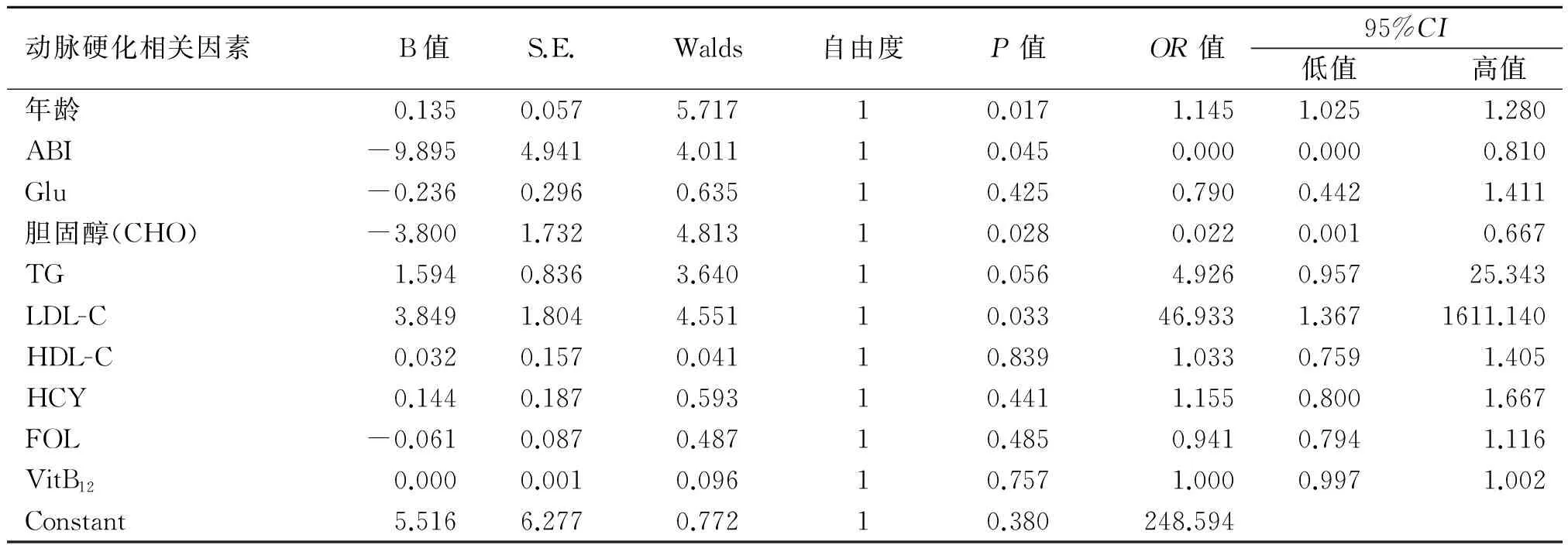

3 讨论
