FTY720对急性脊髓损伤大鼠神经功能及血脊髓屏障的影响
2015-06-28岳妍谭波涛刘媛伍亚民贾功伟蒋玮虞乐华殷樱
岳妍,谭波涛,刘媛,伍亚民,贾功伟,蒋玮,虞乐华,殷樱
FTY720对急性脊髓损伤大鼠神经功能及血脊髓屏障的影响
岳妍,谭波涛,刘媛,伍亚民,贾功伟,蒋玮,虞乐华,殷樱
目的 观察新型免疫抑制剂FTY720对急性脊髓损伤后大鼠神经功能和血脊髓屏障的影响。方法 成年SD大鼠144只,随机分为4组(n=36)。正常对照组(NG):不做任何处理;假手术组(SO):单纯咬除椎板暴露脊髓,不予损伤处理;损伤对照组(HS):脊髓右半侧横切损伤后腹腔注射生理盐水;FTY720治疗组(FTY720):脊髓右半侧横切损伤后30min给予腹腔注射FTY720[1mg/(kg·d)],连续7d。术后不同时间点行行为学检测,包括BBB运动功能评分和水平网格检测;行神经电生理运动诱发电位(MEP)N1波和感觉诱发电位(SEP) P1波潜伏期检测;对脊髓组织行苏木精-伊红(HE)染色及Evans Blue(EB)血脊髓屏障渗透性检测。分析FTY720治疗效果。结果 半横切损伤后,HS组和FTY720组大鼠损伤侧脊髓神经功能下降,至28d时仍未恢复至NG 组和SO组水平。行为学检测和神经电生理检测结果显示,FTY720组大鼠运动功能恢复速度比HS组更快;损伤7、14、28d时,两组大鼠BBB评分和SEP P1波潜伏期检测差异有统计学意义(P<0.05);损伤14、28d时,两组大鼠水平网格检测和MEP N1波潜伏期检测差异有统计学意义(P<0.05)。组织学检测结果显示,各时间点NG 组和SO组大鼠脊髓结构均完整;损伤14d时,FTY720组脊髓损伤处慢性炎症细胞浸润,胶质化反应程度小于HS组;损伤28d时,FTY720组损伤处空洞残存面积小于HS组,再生纤维排列较HS组有序。血脊髓屏障渗透性检测结果发现,损伤后7d内,HS组和FTY720组大鼠血脊髓屏障EB渗出量较NG组和SO组明显增加;各时间点FTY720组EB渗出面积均小于HS组(P<0.05),其中损伤3d时差异最为明显。结论 FTY720能显著降低脊髓损伤急性期血脊髓屏障渗透性,有效促进急性期后神经功能的恢复,为损伤组织提供一定的神经保护作用。
免疫抑制剂;FTY720;急性脊髓损伤;神经保护药
急性脊髓损伤是一类严重的中枢神经系统创伤性疾病,可引起脊髓组织内血管破损,神经细胞快速死亡。局部血脊髓屏障(blood-spinal cord barrier,BSCB)结构破坏会引发一系列细胞化学级联反应,加重损伤程度[1]。因此,促进急性期BSCB结构和功能的修复,对改善局部微环境,降低继发性损伤程度有重要意义[2]。
FTY720(Fingolimod)是由从冬虫夏草中提取的免疫相关成分经化学修饰后合成的新型免疫抑制剂,通过结合1-磷酸鞘氨醇(sphingosine 1-phosphate,S1P)受体发挥调节作用[3-4]。FTY720因其能功能性拮抗淋巴细胞膜上的1-磷酸鞘氨醇受体1(S1P1),可在不影响免疫监督的情况下减少外周淋巴细胞对中枢神经系统的浸润及炎性介质的释放而被用于多发性硬化症的临床治疗[5]。近年来许多研究发现,除免疫系统调节作用外,FTY720还能发挥上调脑源性神经营养因子表达、促髓鞘再生等更多的神经保护作用[6-10]。
本研究采用脊髓半横切损伤模型,观察FTY720对大鼠急性脊髓损伤后神经功能及BSCB的影响。
1 材料与方法
1.1 实验动物及分组 清洁级成年SD大鼠144只,雌雄各半,体重220~250g(由第三军医大学大坪医院动物中心提供)。FTY720(美国Selleckchem公司),Evans Blue(美国Sigma公司)。实验大鼠随机分为4组(n=36)。正常对照组(normal control group,NG 组):不做任何处理;假手术组(sham-operated group,SO组):单纯咬除椎板暴露脊髓,不予损伤处理;损伤对照组(hemisection group,HS组):制作脊髓右半侧横切损伤模型后腹腔注射生理盐水;FTY720治疗组(FTY720 treated group,FTY720组):脊髓右半侧横切损伤后腹腔注射FTY720治疗。FTY720组大鼠腹腔注射FTY720生理盐水溶液[1mg/ (kg·d)],连续7d,首次给药为术后30min;HS组大鼠按体重每日腹腔注射等量生理盐水[11-12]。
1.2 脊髓半横切模型建立 SD大鼠称重,1%戊巴比妥钠腹腔注射麻醉(40mg/kg)。麻醉大鼠俯卧位固定于手术板上,腰背部脱毛,常规消毒铺巾。以T10棘突体表标志点为中心行背部正中切口,暴露并小心咬除T9-T11椎板。打开硬脊膜暴露脊髓后以正中动脉为标志,用眼科手术尖刀横断T10右半侧脊髓,完全切断并清除残留的纤维组织。切割时鼠尾痉挛性摆动、右下肢回缩扑动后瘫痪作为造模成功的标志。术后逐层缝合硬脊膜、肌肉、皮肤组织,肌内注射青霉素2万U(2次/d)抗感染,连续3d[13]。术后各组大鼠分笼常规饲养,根据情况定时膀胱按压促排尿至自主排尿功能恢复,观察大鼠饮食及恢复情况。
1.3 检测指标
1.3.1 行为学检测 各组大鼠分别于术后1、3、7、14、28d依据改良BBB评分(Basso Beattie Bresnahan locomotor rating scale,BBB)标准进行评分[14],以反映大鼠损伤侧后肢运动功能的恢复情况。7、14、28d时加做水平网格检测:将大鼠置于1cm×1cm大小的水平网格上自由活动4min,计数损伤侧后足踩空的步数与总步数,并计算踩空步数占总行走步数的比例[15]。BBB评分和网格计数均采用双盲法,由非课题组的经专业训练的实验人员负责记录。检测前排空大鼠膀胱。
1.3.2 神经电生理检测 各组大鼠分别于术后7、14、28d采用Powerlab/16SP(澳大利亚,ADI公司)多导生理记录仪检测运动诱发电位(MEP)和感觉诱发电位(SEP)。MEP检测方法:将直径1mm的银球电极(刺激电极正极)置于感觉运动皮层区表面,负极置于大鼠下颚,保持湿润;银质双保护电极(记录电极)置于右侧坐骨神经处,正负极相距2mm;参考电极置于椎旁肌处。SEP检测方法:刺激电极与MEP记录电极位置相反,刺激电极负极置于颅顶切口右侧皮下肌层,保持湿润;参考电极位置不变[16]。刺激参数:频率4Hz,波宽0.2ms,强度10~40mV,信号经前置放大器放大10万倍,计算机叠加256次后进行平均[16]。记录MEP和SEP的波形曲线并计算MEP N1波和SEP P1波的峰潜时。
1.3.3 组织学检查 各组大鼠分别于术后14d和28d灌注取材,损伤段脊髓组织置于4%多聚甲醛中充分固定后常规石蜡包埋。行连续横断面石蜡切片,切片厚度5μm,标本每隔10张取1张行HE染色。每个标本取5张贴片备用。采用Nikon病理图像分析采集系统留图分析。
1.3.4 血脊髓屏障渗透性检测 各组大鼠分别于术后1、3、7d检测损伤段脊髓组织内Evans Blue(EB)染液的渗出量。标准曲线的绘制:用二甲基甲酰胺(DMF)配制20μg/ml Evans Blue溶液,全波长扫描测定其光密度(A)值,确定最大吸收峰在635nm波长处。将DMF倍比稀释配制成20、10、5、2.5、1.25、0.625、0.3175μg/ml浓度的标准液,分别检测各梯度浓度标准液在635nm处的光密度(A635)值,计算回归方程,绘制标准曲线。
组织切片及荧光检测:1%戊巴比妥钠腹腔注射麻醉大鼠,经股静脉缓慢推注2.5% Evans Blue生理盐水溶液(4ml/kg),持续10s以上,循环30min后灌注取材。称取损伤段组织湿重后按100mg/3ml的量加入DMF匀浆,37℃避光水浴48h后,离心取上层萃取液检测A635值,DMF作空白调零。记录数据,根据标准曲线计算脊髓组织中的EB渗出量(μg/g)。每组另取5个组织于冰冻切片机(CM1900型,德国,Leica公司)上行连续矢状面冰冻切片,切片厚度20μm,中性树脂封固后于荧光显微镜下550nm激发光下观察各组大鼠EB渗出情况,并采用Image-Pro Plus 6.0图片分析软件对目标区域荧光强度进行半定量分析。
1.4 统计学处理 所有数据使用SPSS 13.0统计软件进行分析。正态分布的计量数据均以±s表示,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 行为学检测结果
2.1.1 BBB评分结果 术后1d时,HS组死亡3只,FTY720组死亡2只;3d时,HS组死亡1只,FTY720组死亡1只;5d时,HS组死亡1只,均对各组缺失进行补充。NG组大鼠在各时间点BBB评分为21分;术后7d内,SO组大鼠较NG组大鼠评分有轻度下降,随后逐渐恢复,7d时与NG组比较差异已无统计学意义(P>0.05)。HS组及FTY720组大鼠损伤后1d,右后肢运动功能基本丧失,3d后评分逐渐上升,FTY720组上升速度大于HS组,7~28d,两组评分差异有统计学意义(P<0.05,表1)。
2.1.2 网格实验结果 各时间点NG 组和SO组大鼠均可在水平网格上协调活动,后足能抓握于网格间,踩空比例小,两组比较差异无统计学意义(P>0.05)。术后7d内,HS组和FTY720组大鼠网格上协调活动能力差,右后足踩空比例明显增加;随着功能的恢复,踩空比例逐渐下降,FTY720组大鼠下降速度大于HS组,术后14d和28d时,两者比较差异有统计学意义(P<0.05,图1)。
表1 大鼠不同时间点BBB评分表(n=5,±s)Tab. 1 BBB score of rats evaluated at respective time points (n=5,±s)
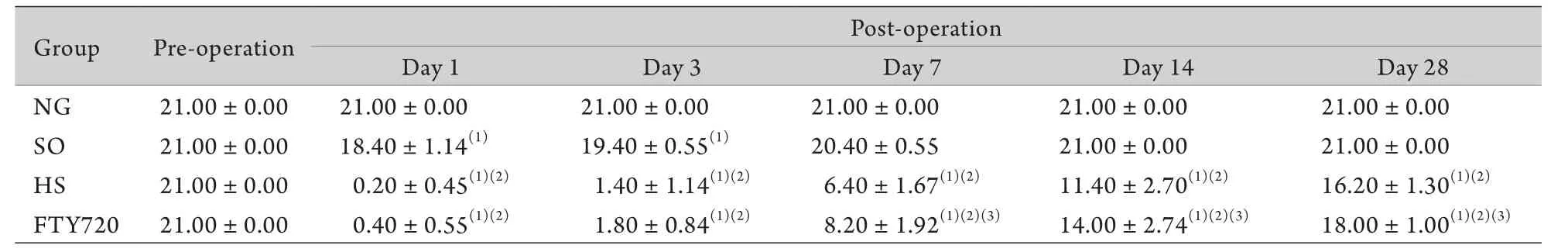
表1 大鼠不同时间点BBB评分表(n=5,±s)Tab. 1 BBB score of rats evaluated at respective time points (n=5,±s)
(1)P<0.01 compared with NG group; (2)P<0.01 compared with SO group; (3)P<0.05 compared with HS group
?
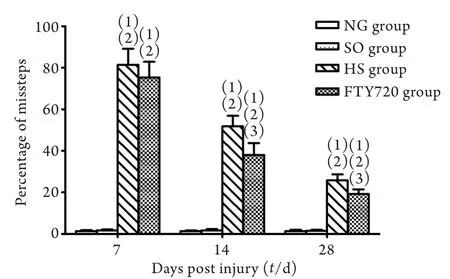
图1 大鼠不同时间点网格检测情况Fig.1 Grid walking test of rats evaluated at respective time points
2.2 神经电生理检测结果 术后各时间点,NG 组和SO组大鼠MEP的N1波与SEP的P1波潜伏期的差异无统计学意义(P>0.05);HS组大鼠和FTY720组大鼠损伤侧MEP N1波和SEP P1波波幅下降,潜伏期明显延长;FTY720组大鼠较HS组大鼠MEP N1波及SEP P波潜伏期延长,但幅度小,术后7d两组P1波潜伏期差异有统计学意义(P<0.05),术后14d 和28d两组P1波和N1波潜伏期差异均有统计学意义(P<0.05,表2、3)。
2.3 脊髓组织学检测结果 NG组及SO组大鼠脊髓组织结构完整,神经细胞胞体分布清楚,胞体间结构排列有序。损伤后14d,HS组大鼠损伤周围神经组织大面积坏死,大量淋巴细胞和单核细胞浸润吞噬,坏死组织周围胶质化反应明显;FTY720组大鼠神经组织坏死面积小于HS组,炎性细胞浸润数量较HS组少。损伤后28d,HS组大鼠损伤坏死处由胶质细胞填充,组织结构排列紊乱,灰质残留较大空腔;FTY720组大鼠灰质残留空腔较HS组小,组织结构排列较紧密(图2)。
表2 大鼠不同时间点MEP N1峰潜时检测表(n=5,±s)Tab. 2 The N1 latency of MEP at respective time points (n=5,±s, ms)
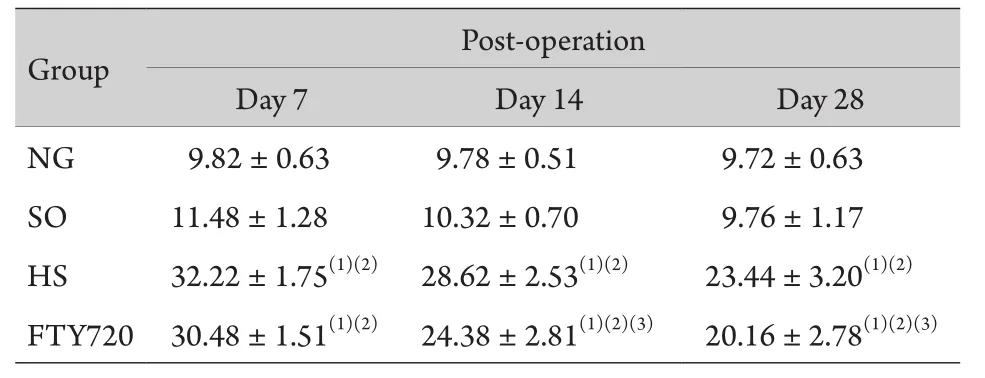
表2 大鼠不同时间点MEP N1峰潜时检测表(n=5,±s)Tab. 2 The N1 latency of MEP at respective time points (n=5,±s, ms)
(1)P<0.01 compared with NG group, (2)P<0.01 compared with SO group, (3)P<0.05 compared with HS group
?
表3 大鼠不同时间点SEP P1峰潜时检测表(n=5,±s)Tab. 3 The P1 latency of SEP at respective time points (n=5,±s, ms)
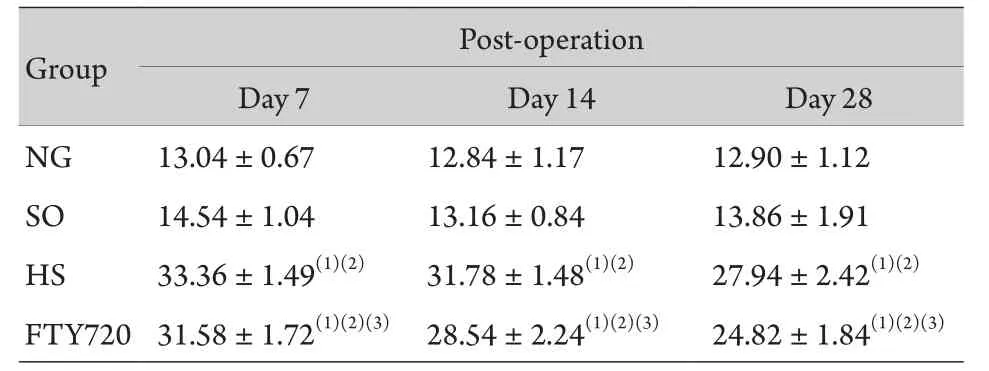
表3 大鼠不同时间点SEP P1峰潜时检测表(n=5,±s)Tab. 3 The P1 latency of SEP at respective time points (n=5,±s, ms)
(1)P<0.01 compared with NG group, (2)P<0.01 compared with SO group, (3)P<0.05 compared with HS group
?
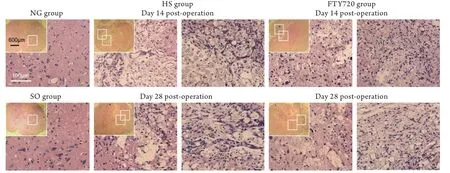
图2 大鼠脊髓组织学观察结果(HE染色)Fig. 2 Histological results of spinal tissues of rats (HE stainning)
2.4 血脊屏障渗透性检测结果 术后1、3、7d, NG 组及SO组大鼠脊髓内几乎无EB渗出,HS组和FTY720组大鼠脊髓EB渗出量明显增加(P<0.05);损伤前3d,HS组大鼠脊髓EB渗出量呈上升趋势,随后下降,而FTY720组大鼠无上升趋势,各时间点两组比较结果差异均有统计学意义(P<0.05,图3、4,表4)。
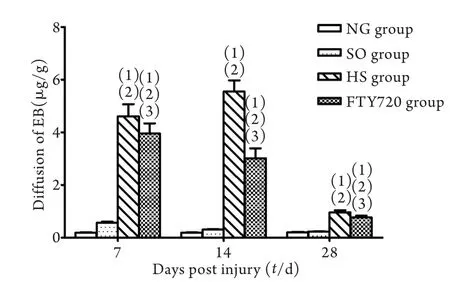
图3 4组大鼠不同时间点Evans Blue渗出量Fig. 3 Diffusion of fluorescent Evans Blue in injured spinal cord tissue of rats at respective time points
表4 大鼠不同时间点损伤段平均荧光强度值比较(n=5,±s)Tab. 4 Mean fluorescence intensity of Evans Blue at respective time points (n=5,±s)
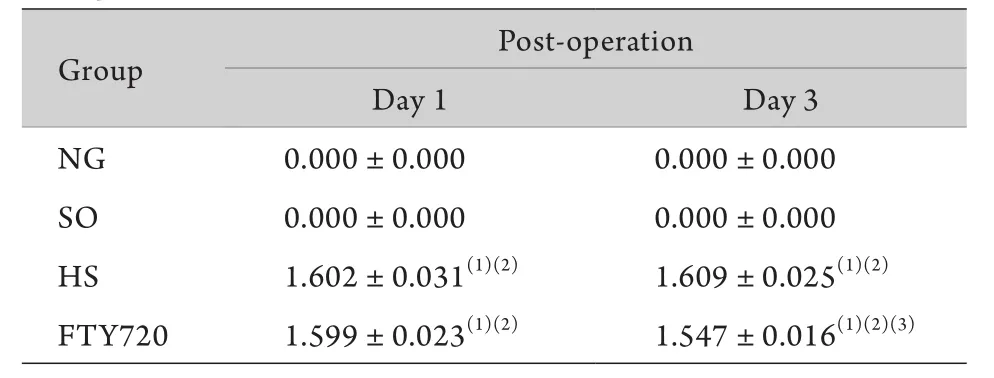
表4 大鼠不同时间点损伤段平均荧光强度值比较(n=5,±s)Tab. 4 Mean fluorescence intensity of Evans Blue at respective time points (n=5,±s)
(1)P<0.01 compared with NG group, (2)P<0.01 compared with SO group, (3)P<0.05 compared with HS group
?
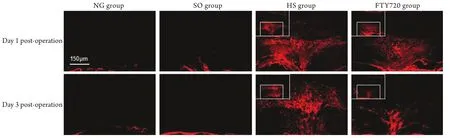
图4 大鼠脊髓损伤处Evans Blue溶液的渗出情况(荧光显微镜)Fig. 4 Diffusion of fluorescent Evans Blue in injured spinal cord tissue of rats (Fluorescence microscope)
3 讨 论
Norimatsu等[17]通过行为学检测发现,FTY720在脊髓损伤亚急性早期(损伤后7~14d)对运动功能恢复有促进作用,而Lee等[12]研究认为FTY720对运动功能的影响在亚急性期后(损伤28d后)更为明显。我们利用行为学指标和神经电生理技术对大鼠脊髓半横切损伤后患肢功能恢复情况进行检测发现,半切损伤后7d,FTY720治疗组大鼠BBB运动功能评分已大于损伤组,MEP N1波和SEP P1波潜伏期也较损伤组缩短,说明急性期末,经FTY720治疗的大鼠损伤侧神经传导束功能已优于未经治疗大鼠。亚急性期内,随着患侧肌力增加,患肢运动功能进一步恢复,治疗组大鼠运动协调性和抓握能力均明显改善。急性脊髓损伤后,T细胞在急性期后期反应性浸润,并以高水平维持到损伤后数周。持续的T细胞水平增高会对脊髓组织内残存神经元造成进一步损伤[18-19]。然而,有研究发现,FTY720对损伤处T细胞数量的抑制作用在损伤后亚急性期最明显[17]。本研究也通过HE染色进行了损伤脊髓的组织学观察,结果显示,FTY720治疗能减轻伤后14d时损伤周围脊髓组织内淋巴细胞和单核细胞的浸润,显著减少神经细胞坏死面积。结合行为学和神经电生理检测结果,我们推测在损伤急性期内,FTY720还存在其他可能的神经保护效应。
BSCB是调节脊髓正常代谢,维持脊髓内环境稳定的重要结构。急性脊髓损伤后,局部屏障功能直接破坏[20],损伤周围脊髓组织暴露于循环中的内源性免疫炎性因子、毒性因子和外源性病原体中。内皮细胞和神经细胞免疫性损伤加重,使得BSCB急性期内持续开放,渗出增加,内环境失衡,从而引起不可逆性损伤[21-23]。研究发现,FTY720能维持葡萄球膜炎中血-眼屏障的完整性,抑制血管内皮生长因子(vascular endothelial growth factor,VEGF)诱导的微血管渗透性增加,并能通过诱导血管内皮钙黏蛋白和β连环蛋白的整合形成新的内皮间连接,提示其对微血管系统也有调节作用[24-25]。我们利用血脊髓屏障Evans Blue渗出实验发现,半切损伤后,损伤段脊髓组织内EB渗出量明显增加,损伤后3d达高峰,急性期后期开始减少,FTY720治疗能显著减少早期EB的渗出,减轻局部水肿,荧光显微镜下对组织切片的观察结果一致。该结果提示,FTY720对创伤性病理条件下的微血管功能也有调节作用。有研究者指出,FTY720能下调损伤早期脊髓神经元上凋亡基因caspase-3的表达水平,发挥抗凋亡作用[26]。但体外实验发现FTY720并不能增加毒性因子作用下神经元的存活数量[13]。结合本实验研究结果,我们认为,FTY720可能是通过降低BSCB渗透性,减少炎性因子浸润和改善局部微循环的方式减少神经细胞的坏死凋亡,进而为神经功能的恢复提供有利因素。免疫抑制剂甲泼尼松龙的使用是目前临床常采取的治疗手段之一,它可以稳定细胞膜,抑制局部出血、水肿、微循环障碍和炎性反应,但使用激素具有治疗窗短、剂量需求大、副反应重的限制[27-28]。FTY720为脊髓损伤早期药物治疗提供了新的选择。我们也将继续通过对损伤侧远端脊髓运动神经元自发放电检测等实验途径进一步明确FTY720对运动功能的影响。
此外,本实验HE染色还发现FTY720能有效减轻亚急性期损伤周围胶质化反应程度。有研究指出,FTY720对反应性星形胶质细胞增生的抑制作用与淋巴细胞抑制机制相同[29-30]。然而,星形胶质细胞是BSCB的重要组成成分,对BSCB结构完整性和物质转运有重要作用[21]。急性期后,微血管再生和星形胶质细胞增生明显,因此长期使用FTY720治疗是否有利于BSCB结构功能的重建和神经功能的恢复还需进一步研究。
[1] Oudega M. Inflammatory response after spinal cord injury[J].Exp Neurol, 2013, 250: 151-155.
[2] Yu DS, Cao Y, Mei XF, et al. Curcumin improves the integrity of blood-spinal cord barrier after compressive spinal cord injury in rats[J]. J Neurol Sci, 2014, 346(1-2): 51-59.
[3] Zheng MK, Xiao H, Li Y, et al. A novel immunosuppressant fingolimod: research advances[J]. J Int Pharm Res, 2013, 40(1): 100-104.[郑明克, 肖鹤, 黎燕, 等. 新型免疫抑制剂芬戈莫德的研究进展[J]. 国际药学研究杂志, 2013, 40(1): 100-104.]
[4] Zhang CH, Li Y, Chen W, et al. Apoptosis of K562 cells induced by a new immunosuppressive agent FTY720 and its mechanism[J]. J Jilin Univ (Med Ed) 2014, 40(6): 1161-1165.[张宸豪, 李妍, 陈为, 等. 新型免疫抑制剂FTY720诱导K562细胞凋亡及其机制[J]. 吉林大学学报(医学版), 2014, 40(6): 1161-1165.]
[5] Pelletier D, Hafler DA. Fingolimod for multiple sclerosis[J]. N Engl J Med, 2012, 366(4): 339-347.
[6] Deogracias R, Yazdani M, Dekkers MP, et al. Fingolimod, a sphingosine-1 phosphate receptor modulator, increases BDNF levels and improves symptoms of a mouse model of Rett syndrome[J]. Proc Natl Acad Sci USA, 2012, 109(35): 14230-14235.
[7] Doi Y, Takeuchi H, Horiuchi H, et al. Fingolimod phosphate attenuates oligomeric amyloid beta-induced neurotoxicity via increased brain-derived neurotrophic factor expression in neurons[J]. PLoS One, 2013, 8(4): e61988.
[8] Miron VE, Ludwin SK, Darlington PJ, et al. Fingolimod (FTY720) enhances remyelination following demyelination of organotypic cerebellar slices[J]. Am J Pathol, 2010, 176(6): 2682-2694.
[9] Zhou H, Li S, Niu X, et al. Protective effect of FTY720 against sevoflurane-induced developmental neurotoxicity in rats[J]. Cell Biochem Biophys, 2013, 67(2): 591-598.
[10] Asle-Rousta M, Kolahdooz Z, Oryan S, et al. FTY720 (fingolimod) attenuates beta-amyloid peptide (Abeta42)-induced impairment of spatial learning and memory in rats[J]. J Mol Neurosci, 2013, 50(3): 524-532 .
[11] Huang P, Yu Y, Wang YT, et al. The establishment and certification of animal model of hemisected spinal cord injury in rats[J]. J Pract Med, 2011, 27(6): 954-956. [黄鹏, 余瑛, 王永堂, 等. 大鼠脊髓半横切损伤动物模型的建立与神经功能评价[J]. 实用医学杂志, 2011, 27(6): 954-956.]
[12] Lee KD, Chow WN, Sato-Bigbee C, et al. FTY720 reduces inflammation and promotes functional recovery after spinal cord injury[J]. J Neurotrauma, 2009, 26(12): 2335-2344.
[13] Wei Y, Yemisci M, Kim HH, et al. Fingolimod provides longterm protection in rodent models of cerebral ischemia[J]. Ann Neurol, 2011, 69(1): 119-129.
[14] Basso DM, Beattie MS, Bresnahan JC. A sensitive and reliable locomotor rating scale for open field testing in rats[J]. J Neurotrauma, 1995, 12(1): 1-21.
[15] Wang YT, Lu XM, Zhu F, et al. The use of a gold nanoparticlebased adjuvant to improve the therapeutic efficacy of hNgRFc protein immunization in spinal cord-injured rats[J]. Biomaterials, 2011, 32(31): 7988-7998.
[16] Hou T, Wu Y, Wang L, et al. Cellular prostheses fabricated with motor neurons seeded in self-assembling peptide promotes partial functional recovery after spinal cord injury in rats[J]. Tissue Eng Part A, 2012, 18(9-10): 974-985.
[17] Norimatsu Y, Ohmori T, Kimura A, et al. FTY720 improves functional recovery after spinal cord injury by primarily nonimmunomodulatory mechanisms[J]. Am J Pathol, 2012, 180(4): 1625-1635.
[18] Donnelly DJ, Popovich PG. Inflammation and its role in neuroprotection, axonal regeneration and functional recovery after spinal cord injury[J]. Exp Neurol, 2008, 209(2): 378-388.
[19] Zhang N, Yin Y, Xu SJ, et al. Inflammation & apoptosis in spinal cord injury[J]. Indian J Med Res, 2012, 135(3): 287.
[20] Wang ZQ, Xie P, Zhang S. Clinical research on the effect of neurotropin combined with methylprednisolone in the treatment of acute spinal cord injury[J]. J Logist Univ PAPF (Med Sci), 2014, 23(8): 664-666. [王志强, 谢鹏, 张赛. 神经妥乐平联合甲基泼尼松龙治疗急性脊髓损伤的临床研究[J]. 武警后勤学院学报(医学版), 2014, 23(8): 664-666.]
[21] Whetstone WD, Hsu JY, Eisenberg M, et al. Blood-spinal cord barrier after spinal cord injury: relation to revascularization and wound healing[J]. J Neurosci Res, 2003, 74(2): 227-239.
[22] Bartanusz V, Jezova D, Alajajian B, et al. The blood-spinal cord barrier: morphology and clinical implications[J]. Ann Neurol, 2011, 70(2): 194-206.
[23] Figley SA, Khosravi R, Legasto JM, et al. Characterization of vascular disruption and blood-spinal cord barrier permeability following traumatic spinal cord injury[J]. J Neurotrauma, 2014, 31(6): 541-552.
[24] Copland DA, Liu J, Schewitz-Bowers LP, et al. Therapeutic dosing of fingolimod (FTY720) prevents cell infiltration, rapidly suppresses ocular inflammation, and maintains the blood-ocular barrier[J]. Am J Pathol, 2012, 180(2): 672-681.
[25] Patel CB, Cohen DM, Ahobila-Vajjula P, et al. Effect of VEGF treatment on the blood-spinal cord barrier permeability in experimental spinal cord injury: dynamic contrast-enhanced magnetic resonance imaging[J]. J Neurotrauma, 2009, 26(7): 1005-1016.
[26] Yang L, Lü DC, Zheng LJ, et al. Neuroprotective effects of the immunodepressant FTY720 on caspase-3 expression and neural apoptosis in a rat model of acute spinal cord injury [J]. Neural Regen Res, 2010, 5(9): 700-705.
[27] Qian T, Guo X, Levi AD, et al. High-dose methylprednisolone may cause myopathy in acute spinal cord injury patients[J]. Spinal Cord, 2005, 43(4): 199-203.
[28] Miekisiak G, Kloc W, Janusz W, et al. Current use of methylprednisolone for acute spinal cord injury in Poland: survey study[J]. Eur J Orthop Surg Traumatol, 2014, 24(Suppl 1): S269-S273.
[29] Choi JW, Gardell SE, Herr DR, et al. FTY720 (fingolimod) efficacy in an animal model of multiple sclerosis requires astrocyte sphingosine 1-phosphate receptor 1 (S1P1) modulation[J]. Proc Natl Acad Sci U S A, 2011, 108(2): 751-756.
[30] Brunkhorst R, Kanaan N, Koch A, et al. FTY720 treatment in the convalescence period improves functional recovery and reduces reactive astrogliosis in photothrombotic stroke[J]. PLoS One, 2013, 8(7): e70124 .
Effects of FTY720 on neurological function and blood-spinal cord barrier of rats with acute spinal cord injury
YUE Yan1, TAN Bo-tao1, LIU Yuan2, WU Ya-min2, JIA Gong-wei1, JIANG Wei1, YU Le-hua1, YIN Ying1*1Department of Rehabilitation Medicine,Second Affiliated Hospital, Chongqing Medical University, Chongqing 400010, China
2Third Department of Institute of Field Surgery, Daping Hospital, Third Military Medical University, Chongqing 400042, China
*
, E-mail: yinying@cqmu.edu.cn
This work was supported by the National Natural Science Foundation of Chongqing (cstc2012jjA10058)
ObjectiveTo investigate the effects of a novel immunomodulator FTY720 (Fingolimod) on nerve function and blood-spinal cord barrier (BSCB) of rats with acute spinal cord injury.MethodsOne hundred and forty-four adult Sprague-Dawley (SD) rats were randomly divided into four groups with 36 each: normal control group (NG Group): rats without any treatment; sham-operated group (SO Group): rats' spinal cords were exposed by laminectomy without injury; hemisection group (HS Group): rats underwent spinal cord hemisection followed by intraperitoneal injection of normal saline; FTY720 treatment group (FTY720 Group): rats underwent spinal cord hemisection followed by intraperitoneal injection of FTY720 [1mg/(kg.d)] for 7 days. The neurological function was assessed by Basso Beatlie Bresnahan (BBB) scores, grid walking, N1 and P1 delay of motor evoked potential (MEP) and somatosensory evoked potentials (SEP), histological evaluation with light microscope with HE staining, and determination of blood-spinal cord barrier permeability with EB at different time points after injury.ResultsThe nerve function of rats in HS group and FTY720 group was impaired after hemisection injury without signs of recovery up to Day 28 after damage as compared with NG group or SO group. The recovery of motor function in FTY720 treatment group was earlier than in HS group. The BBB scores, the results of grid walking test, and the latent period of SEP-P1 showed statistically significant difference between FTY720 group and HS group from Day 7 to 28 after injury (P<0.05). Comparing the pathological picture at Day 14 and Day 28 afterinjury, the number of chronic inflammatory cells, the degree of glial cell reaction, and the size of syringomyelia cavities in gray matter in FTY720 group were significantly less than those in HS group. In addition, the leakage of EB from the damaged BSCB increased in HS group and FTY720 group than in NG group and SO group through 7 days after injury (P<0.01), while at each time point the leakage of EB was less in FTY720 group than in HS group (P<0.05), and the most significant difference was observed on Day 3 after injury.ConclusionFTY720 can lower the permeability of blood-spinal cord barrier at acute phase of spinal cord injury, effectively promotes the recovery of nerve function after acute injury phase, and it provides certain potential neuroprotective effects.
immunosuppressive agents; FTY720; spinal cord injuries; neuroprotective agents
R651.2
A
0577-7402(2013)03-0200-06
10.11855/j.issn.0577-7402.2015.03.06
2014-11-07;
2015-02-13)
(责任编辑:沈宁)
重庆市自然科学基金计划项目(cstc2012jjA10058)
岳妍,硕士研究生。主要从事神经康复方面的研究
400010 重庆 重庆医科大学附属第二医院康复医学科(岳妍、谭波涛、贾功伟、蒋玮、虞乐华、殷樱);400042 重庆第三军医大学大坪医院野战外科研究所三室,创伤、烧伤与复合伤国家重点实验室(刘媛、伍亚民)
殷樱,E-mail: yinying@cqmu.edu.cn
