隐匿性乙型肝炎病毒感染患者S基因突变特点分析
2015-06-28陈建宏刘妍许智慧思兰兰戴久增李奇王帅李进韩聚强徐东平
陈建宏,刘妍,许智慧,思兰兰,戴久增,李奇,王帅,李进,韩聚强,徐东平
论 著
隐匿性乙型肝炎病毒感染患者S基因突变特点分析
陈建宏,刘妍,许智慧,思兰兰,戴久增,李奇,王帅,李进,韩聚强,徐东平
目的 分析1例血清HBV DNA长期阳性但HBsAg阴性的隐匿性乙型肝类病毒感染(OBI)患者HBV S基因突变特点,揭示S基因突变与OBI发生及肝脏疾病进展的关系。方法 收集该患者不同时间点的4份血清样本,扩增HBV S基因并进行克隆测序,挑选代表性突变株病毒基因构建重组载体并进行表型分析。结果 从该患者4份血清样本中检出多种S基因突变形式,包括前S1区大片段缺失、s126–127“RPCMNCTI”插入突变、sQ129N、s131–133 TSM→NST和经典的sG145R突变等,其中s131–133 TSM→NST在前后4份动态样本的检测病毒克隆中所占比例分别为0%、26%、59%和74%;前S1区大片段缺失在4份样本检测病毒克隆中始终存在,所占比例分别为26%、17%、15%和21%。表型分析发现,sQ129N和s131–133 TSM→NST可以降低抗体对HBsAg的亲和力,增加病毒分泌;与野生株相比,前S1区大片段(nt 3046–3177)缺失病毒株复制力下降了43.7%,表面抗原启动子Ⅱ(SPⅡ)活性下降了97.2%;sG145R可降低病毒的分泌能力。结论 此例HBV感染患者的长期OBI临床表现是由于其感染有多种S基因突变病毒株引起,其中一些S基因突变可以影响病毒的表型特点,可能与肝脏疾病进展密切相关。
肝炎病毒,乙型;突变;肝炎表面抗原,乙型
传统观点认为HBsAg转阴和抗-HBs抗体的出现是HBV完全清除的标志,自20世纪70年代以来,随着病毒检测技术的进步,特别是PCR技术的不断成熟,不断有研究发现在HBsAg阴性者的血清或肝组织中仍可检测到HBV DNA的存在[1-2],这种状态被称为隐匿性乙型肝炎病毒感染(occult hepatitis B virus infection,OBI)。有研究认为OBI的发生与宿主免疫功能低下和HBV极低水平复制和表达有关[3-5],也有研究认为其与HBV S基因突变有关[6-7]。过去一些OBI病例的出现是由于检测方法的灵敏性不够引起的[8],包括HBsAg检测下限较低以及不能检出sG145R等经典突变型HBsAg。近年随着检测技术的进步,临床上OBI越来越少见。本研究纵向观察1例OBI患者疾病进展过程中的4份血清样本,以期阐明HBV S基因突变与OBI发生及肝脏疾病进展的关系。
1 资料与方法
1.1 研究对象 男,63岁,2002年体检时发现血清HBsAg阳性,血清HBV DNA数值不详,因无症状而未接受任何治疗。2011年开始出现乏力伴纳差,无发热、咳嗽、咳痰,仍未重视。2012年5月因低热、纳差就医,检查显示血清HBsAg阴性,HBV DNA 5.23×104拷贝/ml。随后服用阿德福韦酯(ADV),但并未控制疾病进展,最后因肝功能衰竭死亡。采集该患者4次住院期间血清,–40℃冻存。样本信息如表1所示。4份血清中HBsAg的检测值均为阴性(化学发光法HBsAg<1.0U/ml),但血清中HBV DNA均为阳性,且病毒载量随病程进展而逐渐升高。
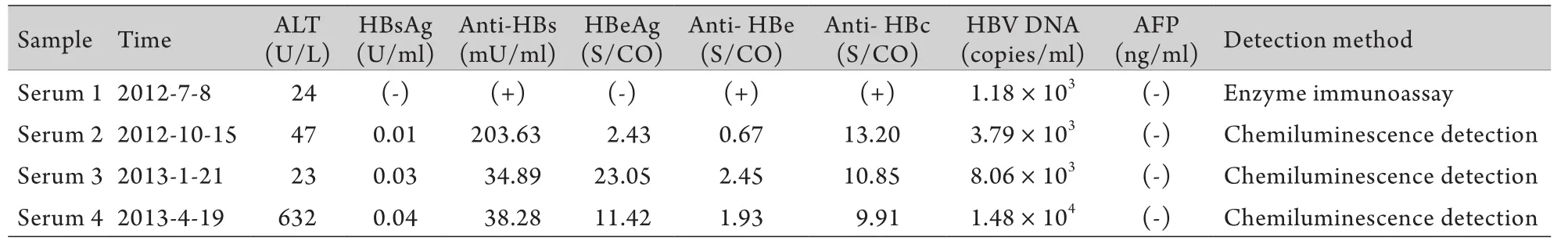
表1 OBI患者4份血清的临床检测指标Tab.1 Clinical parameters of four serums in one patient with OBI
1.2 主要试剂 病毒DNA提取试剂盒购自北京天恩泽公司;胶回收试剂盒购自美国QIAGEN公司;pGEM-Teasy载体、JM109感受态细胞、荧光素酶表达载体和检测试剂盒购自美国Promega公司;pTriEx-1.1HBV表达载体由法国里昂大学Zoulim教授惠赠;BstEⅡ、SphⅠ、EcoRⅠ、KpnⅠ、BglⅡ购自日本TaKaRa公司;BspQⅠ和ScaⅠ购自美国NEB公司;真核细胞表达载体pcDNA3.1(-)/myc-His A购自美国Invitrogen公司;DMEM培养基购自美国Gibco公司;转染试剂X-tremeGENE HD、地高辛标记检测试剂盒购自德国Roche公司;实时荧光定量检测试剂盒购自上海复兴公司;尼龙膜购自美国安玛西亚公司;HBsAg鼠单克隆抗体购自美国Santa公司;His标签蛋白鼠单克隆抗体、β-actin抗体及二抗购自北京康为世纪公司。引物合成和基因测序由北京天一辉远公司完成。
1.3 实验方法
1.3.1 巢氏PCR扩增HBV S基因及克隆测序 采用病毒DNA提取试剂盒提取4份血清HBV DNA,采用巢式PCR方法扩增HBV S基因(前S1+前S2+S)。第一轮上下游引物分别为PSup3,SB1R;第二轮上下游引物为PSup4,SB2R(表2)。将PCR产物纯化、胶回收后与pGEM-Teasy载体连接,转化JM109感受态细胞,挑选阳性克隆抽提质粒进行测序。采用Mega 4进化树软件对克隆测序结果进行分析。
1.3.2 HBV S基因突变相关载体构建 采用Mega 4软件分析HBV基因型,挑选标准序列用NTI软件比对分析S基因突变,挑取代表性突变克隆和野生型克隆构建相关载体以进行功能学实验。
1.3.2.1 pTriEx-1.1HBV重组载体构建 提取野生型和突变型克隆T-easy质粒,用BstEⅡ和SphⅠ分别双酶切质粒和pTriEx-1.1HBV载体,将S基因替代到pTriEx-1.1HBV载体上,然后对重组质粒进行测序鉴定。鉴定成功后提取转染级质粒备用。
1.3.2.2 pcDNA3.1(-)/myc-His A重组载体构建 以提取的野生型和突变型T-easy质粒为模板,PCR扩增HBsAg编码区S区,所用引物为HIS-UP(上游引物),其中包含EcoRⅠ酶切位点;HIS-DOWN(下游引物),其中包含KpnⅠ酶切位点(表2)。将PCR产物纯化胶回收,用EcoRⅠ和KpnⅠ同时双酶切胶回收产物和载体,连接并转化JM109感受态细胞,抽提质粒测序鉴定,鉴定成功后提取转染级质粒备用。
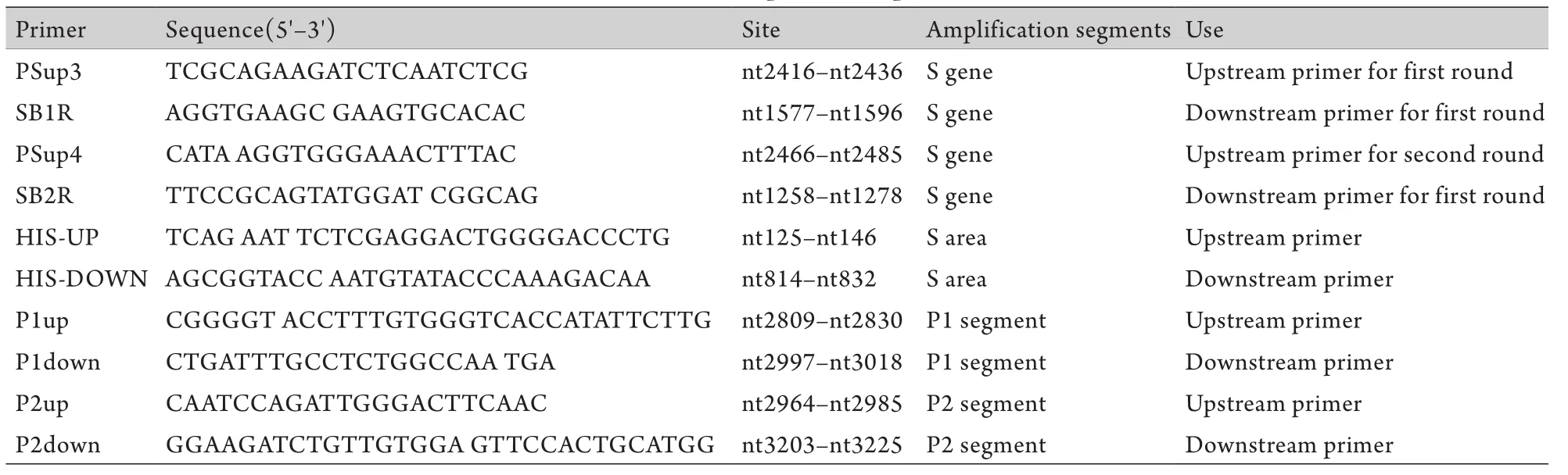
表2 PCR扩增所用引物Tab.2 PCR amplification primers
1.3.2.3 HBV pGL3-SPⅡ荧光素酶表达载体构建因前S1大片段缺失与HBV SPⅡ启动子区域重叠,而SPⅡ启动子启动2.1kb mRNA,编码中、主蛋白,因此构建HBV pGL3-SPⅡ荧光素酶表达载体检测缺失株对SPⅡ启动子活性的影响。采用重组PCR方法获得野生型SPⅡ对照。以缺失株的T-easy质粒为模板,以P1up,P1down为上下游引物,扩增获得P1段;以野生株的T-easy质粒为模板,以P2up,P2down为上下游引物扩增获得P2段;用P1、P2作为模板,分别以P1up和P2down为上下游引物扩增获得野生型的SPⅡ对照;以缺失株的T-easy质粒为模板,以P1up和P2down为上下游引物扩增获得缺失性的SPⅡ(表2)。将重组PCR获得的SPⅡ野生型、缺失型和pGL3-Basic载体分别用KpnⅠ和BglⅡ双酶切,胶回收后连接并转化JM109感受态细胞,挑取阳性菌落,测序鉴定,测序成功后提取转染级质粒备用。
1.3.3 上清HBsAg定量检测 将HepG2细胞在含10%胎牛血清(FBS)的DMEM培养液中传代培养至最佳状态,细胞以4×105/孔分到6孔板,于分板后16~18h用X-tremeGENE HD转染试剂将pTriEx-1.1HBV重组载体按1μg/孔进行转染,3d后收集上清进行HBsAg定量检测(罗氏cobas E601)。
1.3.4 荧光定量及Dot blotting分析上清HBV和细胞内核心颗粒 细胞培养及转染同上,3d后收集上清,DNA酶消化过夜,用于实时荧光PCR检测HBV载量[9-10]。核心颗粒的提取方法参考文献[11],–40℃储存用于实时荧光PCR定量和Dot blotting检测。Dot blotting分析:采用BspQⅠ和ScaⅠ双酶切本课题组以前得到的C2基因型全长克隆,胶回收全长DNA片段,用于地高辛标记探针的制备。取3μl核心颗粒点到尼龙膜上,紫外交联5min,用DIG Easy Hyb 42℃预杂交1h后用含地高辛标记探针的DIG Easy Hyb 42℃杂交过夜,洗膜,封闭,与anti-Digoxigenin-AP Fab孵育,用CSPD化学发光法检测,Tanon 5200全自动化学发光成像分析系统进行分析。
1.3.5 Western blotting分析细胞内重组HBsAg的表达 细胞培养及转染方式同上,将pcDNA3.1(-)/ myc-His A重组载体按2μg/孔进行转染,3d后用1×PBS洗板2次,加入细胞裂解液(按100:1的比例加入蛋白酶抑制剂混合物),收集蛋白,煮沸10min充分变性,以β-actin为内参调整蛋白上样量,用10% SDS-PAGE凝胶电泳分离蛋白,转膜后分别以anti-HBsAg和anti-His鼠单克隆抗体为一抗4℃孵育过夜,洗膜后以带有HRP的羊抗鼠单克隆抗体为二抗室温孵育2h,用Tanon 5200全自动化学发光成像分析系统进行显色分析。
1.3.6 双荧光素酶报告基因检测前S1大片段缺失突变对SPⅡ启动子活性的影响 细胞培养同上,将细胞以3×105/孔分到24孔板,于分板后16~18h将HBV pGL3-SPⅡ荧光素酶表达载体与内参pRL-TK载体按30:1的比例共转染,表达载体0.3μg/孔,内参0.01μg/孔,设置pGL3-Basic为阴性对照,pGL3-Control为阳性对照,48h后裂解细胞,进行荧光素酶活性检测,并用内参校正,分析前S1区大片段缺失对启动子活性的影响。
2 结 果
2.1 4份血清克隆测序结果分析 测序分析结果显示,绝大多数序列为Y18856C2基因型,以该序列为标准序列用NTI软件进行比对分析。4份血清96个克隆中仅1株为野生序列(WT),其余全部存在S基因突变,主要位于MHR,特别是a决定簇内(表3)。其中前S1区大片段缺失株在4份血清中始终稳定存在,所占比例分别为26%、17%、15%、21%,M2随着病情的加重所占比例越来越大,分别为0%、26%、59%、74%。
2.2 上清HBsAg定量 HBsAg定量检测结果如图1所示。与野生株相比,M1–M5的上清HBsAg定量值分别下降了84.1%、85.6%、51.2%、83.4%、98.3%(P<0.05)。
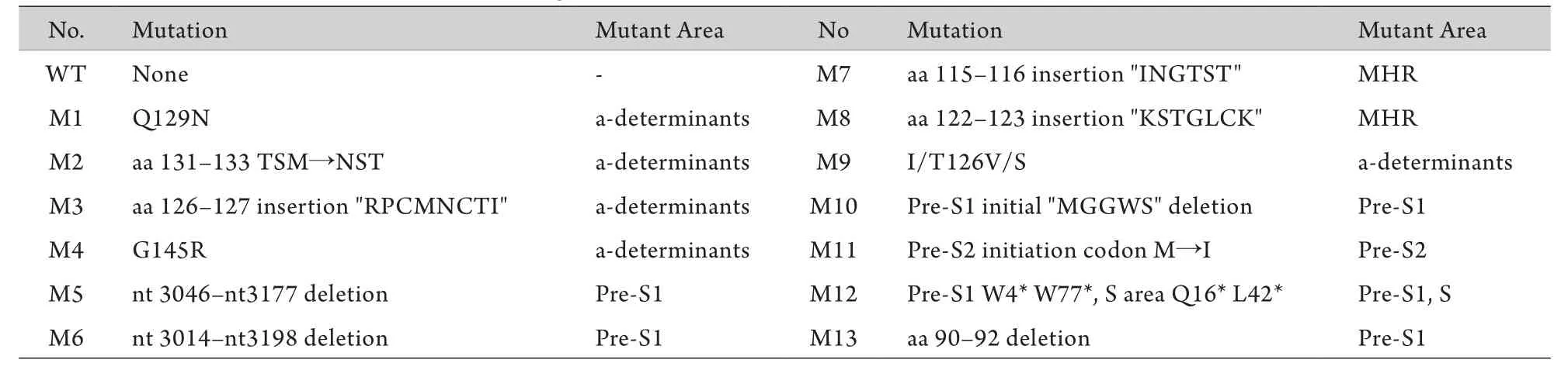
表3 OBI患者4份血清S基因突变形式Tab.3 S gene mutations of four serums in patient with OBI
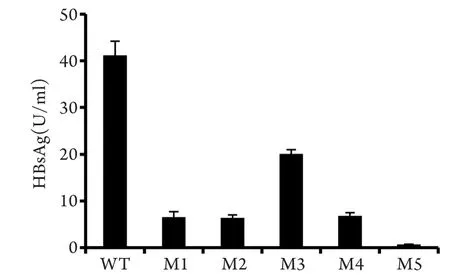
图1 上清HBsAg定量(罗氏cobas E601)Fig.1 Quantitation of supernatant secreted HBsAg(Roch cobas E601)
2.3 细胞内重组HBsAg表达 Western blotting检测结果表明,M1、M2可以降低HBsAg与抗体的亲和力,尤其是M2突变株表达的HBsAg几乎无法被其抗体结合,M3、M4对HBsAg和抗体亲和力的影响不明显(图2)。
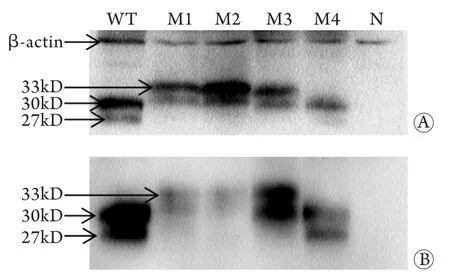
图2 重组表达载体胞内HBsAg表达的Western blotting分析Fig.2 Western blotting analysis of intracellular recombinant HBsAg expression
2.4 上清HBV定量和复制力检测 胞内HBV定量结果显示,M5的复制力与野生株相比下降了43.7%(P<0.05),其他几种突变形式对病毒的复制力无明显影响(图3A、B)。上清中HBV定量结果显示,与野生株相比M2、M3上清中HBV载量分别升高了53.4%和60.7%,M4、M5分别下降了41.9%和33.5%,M3几乎无变化(图3C)。
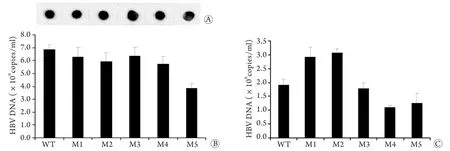
图3 核心颗粒HBV及培养上清HBV的实时荧光PCR检测及Dot blotting分析Fig.3 Real-time PCR detection and dot blotting of core particles and supernatant HBV
2.5 前S1大片段缺失突变对SPⅡ启动子活性的影响 结果显示,野生株表达的相对荧光素酶活性倍数(萤火虫荧光素酶与内参表达的海肾荧光素酶比值)为26.69±1.33,nt 3046–3177缺失株为0.75±0.02,较野生株下降了97.2%(P<0.01)。
3 讨 论
H BV包膜蛋白由S基因编码,S基因包括前S1、前S2和S三个区[12],有2个串联的启动子SPⅠ(nt2219–2780)和SPⅡ(nt2809–3152),前者调节2.4kb mRNA转录,编码大蛋白;后者调节2.1kb mRNA转录,编码中蛋白和主蛋白。主蛋白即HBsAg,包括糖基化的GP27和非糖基化的P24,分子量分别为27kD和24kD。GP27的N端146位的门冬酰胺上连接一种复杂的糖基,形成NXS/T的结构。糖基化修饰是一种翻译后的修饰,包膜蛋白每经过一次糖基化的修饰可以使其分子量增加3kD,包膜蛋白的糖基化修饰与病毒颗粒的组装、稳定性、抗原性和感染性密切相关[13-14]。HBsAg99–169位氨基酸称为主要亲水区(major hydrophilic region,MHR),包含了HBV的主要构象表位。
本研究中该患者的4份血清获得96个克隆,仅1株为HBV S基因野生序列(WT),其余95株全部存在S基因突变,这种情况引起的长期表现即为OBI病例,以往在国内未见报道。从该患者4份血清样本中检出的HBV S基因突变多数位于MHR的a决定簇(aa124–147)内,这是一段相对保守的区域,是免疫识别的主要位点。sQ129N(M1)和s131–133 TSM→NST(M2)导致的新发糖基化位点,可以降低HBsAg与抗体的亲和力,导致病毒颗粒的抗原性下降;sQ129N突变、s131–133 TSM→NST突变株上清中HBV载量与野生株相比分别升高了53.4% 和60.7%,而核心颗粒定量无统计学差异,表明sQ129N突变、s131–133 TSM→NST突变可增加病毒的分泌能力,这也与临床HBV DNA检测值逐渐升高相符。
双荧光素酶报告基因检测显示缺失株的相对荧光素酶活性较野生株下降了97.2%,说明前S1大片段缺失(M5)严重影响了SPⅡ启动子活性,可能会严重影响2.1kb mRNA的转录,从而使HBsAg表达下降甚至不表达,这也与图1中HBsAg极低的表达量相符。
许多研究发现sG145R(M4)突变与OBI的发生相关性很大,但是关于其发生机制,一些研究认为它可以降低HBsAg的抗原性[15-17],还有一些研究认为它是通过影响病毒或HBsAg的分泌从而导致OBI发生[18-19],我们的研究结果更倾向于后者,sG145R突变对病毒的抗原性和复制力无明显影响,而上清中HBV的载量却下降了41.9%,说明sG145R可以降低病毒颗粒的分泌能力,使分泌到上清中的病毒颗粒减少。关于其他几种突变类型M6-M13(表3)与OBI发生的相关性有待进一步研究。
以往有研究发现,OBI患者肝脏疾病的进展要比普通乙肝更快[20-21],为了探讨其与肝病进展可能相关的因素,我们对该患者4份血清克隆测序进行了纵向分析,发现随着肝脏疾病的进展s131–133NST突变所占的比例越来越大,而前S1大片段缺失也伴随疾病进展的全过程。s131–133NST突变可以增加病毒的分泌能力,降低病毒的抗原性,这可能使大量的病毒能够逃逸免疫系统的清除,使机体处于一种长期隐匿的感染状态,这也与该患者长期低热、乏力和纳差的临床表现相符,从而加快了肝脏疾病的进展;前S1大段缺失可能也与疾病的进展有关,一些研究认为前S1大片段缺失可以使截短的大蛋白在内质网内积聚从而导致内质网压力增加,DNA氧化损伤,加重肝脏疾病的进展甚至肿瘤发生[22-23]。
总之,S基因突变与OBI的发生密切相关,一些突变可能促进了肝脏疾病的进展。本研究结果揭示了HBV S基因复杂突变在OBI发生和肝脏疾病进展中的作用,对研发完善相关检测试剂有重要意义。
[1] Fu XL, Wang L, Liu F. HBsAg quantitative value in different stages of hepatitis B virus infection and its correlations with serum HBV DNA and age[J]. J Shandong Univ (Health Sci), 2013, 51(5): 94-98. [符晓莉, 王磊, 刘峰. 乙肝病毒感染不同阶段血清HBsAg定量值及其与HBV DNA水平和年龄的相关性[J]. 山东大学学报(医学版), 2013, 51(5): 94-98.]
[2] Raimondo G, Allain JP, Brunetto MR, et al. Statements from the Taormina expert meeting on occult hepatitis B virus infection[J]. J Hepatol, 2008, 49(4): 652-657.
[3] Bes M, Vargas V, Piron M, et al. T cell responses and viral variability in blood donation candidates with occult hepatitis B infection[J]. J Hepatol, 2012, 56(4): 765-774.
[4] Wong DK, Huang FY, Lai CL, et al. Occult hepatitis B infection and HBV replicative activity in patients with cryptogenic cause of hepatocellular carcinoma[J]. Hepatology, 2011, 54(3): 829-836.
[5] Jiang L, Xu ZH, Liu Y, et al. Up-regulation effect of hepatitis B virus genome A1846T mutation on viral replication and core promoter activity[J]. Med J Chin PLA, 2013, 38(1): 10-14. [江玲, 许智慧, 刘妍, 等. HBV基因组A1846T变异对病毒复制力及核心启动子活性的上调作用研究[J]. 解放军医学杂志, 2013, 38(1): 10-14.]
[6] Huang CH, Yuan Q, Chen PJ, et al. Influence of mutations in hepatitis B virus surface protein on viral antigenicity and phenotype in occult HBV strains from blood donors[J]. J Hepatol, 2012, 57(4): 720-729.
[7] Hong K, Seoung-Ae L, Dong-Won K, et al. Naturally occurring mutation in large surface genes related to occult infection of hepatitis B virus genotype C[J]. Plos One, 2013, 8(1): e54486.
[8] Ireland JH, OHeland JB, Basuni AA, et al. Ractivity of 13 in vitro expressed hepatitis B surface antigen variants in 7 commercialdiagnostic assays[J]. Hepatology, 2000, 31(5): 1176-1182.
[9] Liu Y, Xu Z, Liu L, et al. Genotypic and phenotypic characteristics of multidrug-resistant hepatitis B virus infection in Chinese hepatitis B patients[J]. Med J Chin PLA, 2012, 37(6): 539-543. [刘妍, 许智慧, 刘立明, 等. 我国患者多重耐药乙肝病毒感染的基因型和表型特点[J]. 解放军医学杂志, 2012, 37(6): 539-543.]
[10] Wang X, LiuY, Si LL, et al. Analysis for phenotypic resistant characteristic of a novel mutation rtN236V in reversetranscriptase domain of hepatitis B virus isolated from an adefovir dipovoxil refractory-patient with chronic hepatitis B. Med J Chin PLA, 2013, 38(4):256-259. [王晓, 刘妍, 思兰兰, 等. 阿德福韦酯治疗失败的慢性乙型肝炎患者HBV反转录酶区新变异rtN236V的表型耐药特点分析[J]. 解放军医学杂志, 2013, 38(4):256-259.]
[11] Ji D, Liu Y, Si LL, et al. Variable influence of mutational patterns in reverse-transcriptase domain on replication capacity of hepatitis B virus isolates from antiviral-experienced patients[J]. Clinica Chimica Acta, 2011, 412(3-4): 305-313.
[12] Gao SY. Correlation analysis of serum markers of HBV infection and HBVDNA test results[J]. J Jilin Univ (Med Ed) 2011, 37(1): 101. [高淑艳. HBV感染者血清标志物与HBVDNA检测结果的关联性分析[J]. 吉林大学学报(医学版), 2011, 37(1): 101.]
[13] Renszel KM, Traister RS, Lynch WPk, et al. Unique N-linked glycosylation of CasBrE Env influences its stability, processing, and viral infectivity but not its neurotoxicity[J]. J Virol, 2013, 87(15): 8372-8387.
[14] Zai J, Mei L, Wang C, et al. N-glycosylation of the premembrane protein of Japanese encephalitis virus is critical for folding of the envelope protein and assembly of virus-like particles[J]. Acta Virol, 2013, 57(1): 27-33.
[15] Huang CH, Yuan Q, Chen PJ, et al. Influence of mutation in hepatitis B virus surface protein on viral antigenicity and phenotype in occult HBV strains from blood donors[J]. J Hepatol, 2012, 57(4): 720-729.
[16] Wu C, Deng L, Cao L, et al. Amino acid substitutions at position 122 and 145 of hepatitis B virus surface antigen (HBsAg) determine the antigenicity and immunogenicity of HBsAg and influence in vivo HBsAg clearance[J]. J Virol, 2012, 86(8): 4658-4669.
[17] Kajiwara E, Tanaka Y, Ohashi T, et al. Hepatitis B caused by a hepatitis B surface antigen escape mutant[J]. J Gastroenterol, 2008, 43(3): 243-247.
[18] Kalinina T, Iwanski A, Will H, et al. Deficiency in virion secretion and decreased stability of the hepatitis B virus immune escape mutant G145R[J]. Hepatology, 2003, 38(5): 1274-1281.
[19] Ito K, Qin Y, Guarnieri M, et al. Impairment of hepatitis B virus virion secretion by single-amino-acid substitutions in the small envelope protein and rescue by a novel glycosylation site[J]. J Virol, 2010, 84(24): 12850-12861.
[20] Ikeda K, Kobayashi M, Someya T, et al. Occult hepatitis B virus infection increases hepatocellular carcinogenesis by eight times in patients with non-B, non-C liver cirrhosis: A cohort study[J]. J Viral Hepat, 2009, 16(6): 437-443.
[21] Nishikawa H, Osaki Y. Clinical significance of occult hepatitis B infection in progression of liver disease and carcinogenesis[J]. J Cancer, 2013, 4(6): 473-480.
[22] Wang HC, Huang W, Lai MD, et al. Hepatitis B virus pre-S mutants, endoplasmic reticulum stress and hepatocarcinogenesis[J]. Cancer Sci, 2006, 97(8): 683-688.
[23] Su IJ, Wang HC, Wu HC, et al. Ground glass hepatocytes contain pre-S mutants and represent preneoplastic lesions in chronic hepatitis B virus infection[J]. J Gastroenterol Hepatol, 2008, 23(8 Pt1): 1169-1174.
Characteristics of S gene mutation in patients with occult HBV infection
CHEN Jian-hong1, LIU Yan2, XU Zhi-hui2, SI Lan-lan2, DAI Jiu-zeng2, LI Qi2, WANG Shuai4, LI Jin3, HAN Ju-qiang4*, XU Dong-ping1*1Viral Hepatitis Research Laboratory, 302 Hospital of PLA, Teaching Hospital of Peking University, Beijing 100039, China
2Viral Hepatitis Research Laboratory, Institute of Infectious Diseases/Liver Failure Research Center,3Department of Medical Administration, 302 Hospital of PLA, Beijing 100039, China
4Department of Liver Disease, General Hospital of Beijing Command, Beijing 100700, China
*
. XU Dong-ping, E-mail: xudongping302@sina.com; HAN Ju-qiang, E-mail: hanjq73@hotmail.com
This work was supported by the National Natural Science Foundation of China (81373136, 81271847)
ObjectiveTo analyze characteristics of HBV S gene mutation in one patient with occult hepatitis B virus infection, who was positive for serum HBV DNA for long term, but negative for HBsAg in order to reveal the correlation between S gene mutation and development of OBI as well as the progression of the liver disease.MethodsFour serum samples were collected at different time-points for the use of amplifying HBV S gene and performing cloning-sequencing. The representative S mutants were selected to construct recombinant vectors for phenotype analysis.ResultsSeveral S-gene mutational patterns were detected in the samples, including pre-S1 large fragment deletion, s126-127 "RPCMNCTI" insertion, sQ129N, s131-133 TSM→NST, and classical sG145R mutations. In sequential 4 samples, s131-133 TSM→NST mutation was detected in 0%, 26%, 59% and 74% of viral clones, respectively. The pre-S1 large fragment deletion was constantly found in the 4 serum samples, accounting for 26%, 17%, 15% and 21% of detected viral clones, respectively. Phenotypic analysis showed that sQ129N and s131-133 TSM → NST mutations reduced the affinity of the antibody to HBsAg and increased the secretion of virus particles. Compared with the wild-type strain, the replication capacity and surface antigen promoter Ⅱ (SPⅡ) activity of large fragment-deleted (nt 3046-3177 deletion) strain were decreased by 43.7% and 97.2%, respectively. In addition, sG145R-induced impairment to secretion capacity of viral particles was verified.ConclusionsClinical presentations of long-term OBI of this HBV-infected patient could be caused by multiple S-gene mutants.Some S-gene mutations influence viral phenotypic characteristics, which might closely be related to the progression of liver disease.
hepatitis B virus; mutation; HBsAg
R512.62
A
0577-7402(2015)03-0178-06
10.11855/j.issn.0577-7402.2015.03.02
2014-12-24;
2015-2-25)
(责任编辑:熊晓然)
国家自然科学基金(81373136、81271847)
陈建宏,医学硕士。主要从事肝病的基础与临床研究
100039 北京大学解放军302医院教学医院病毒性肝炎研究室(陈建宏、徐东平);100039 北京 解放军302医院全军传染病研究所、肝衰竭诊疗与研究中心病毒性肝炎研究室(刘妍、许智慧、思兰兰、戴久增、李奇),医务部(李进);100700 北京军区总医院肝病科(王帅、韩聚强)
徐东平,E-mail:xudongping302@sina.com;韩聚强,Email:hanjq73@hotmail.com
