一株磷脂酶D高产菌的筛选及发酵条件优化
2015-06-27张春枝
王 婧, 张春枝
一株磷脂酶D高产菌的筛选及发酵条件优化
王 婧, 张春枝
(大连工业大学生物工程学院,辽宁大连 116034)
磷脂酶D可以催化合成磷脂酰丝氨酸,为了得到高活力的磷脂酶D,采用蛋黄平板法从油脂厂区的土壤中筛选出产磷脂酶D的菌株X1。通过摇瓶培养,用TLC薄层层析法测定酶活力,达到2 023 U/L。对发酵培养基组分及发酵条件进行优化,结果表明,葡萄糖为碳源10 g/L,蛋白胨为氮源15 g/L,发酵温度为30℃,发酵液初始p H为7,摇床转速为180 r/min的发酵条件,酶活力达到最大,为7 330 U/L。
磷脂酶D产生菌;筛选;发酵优化;酶活力
0 引 言
磷脂酶D(phospholipase D,简称PLD)能催化水解卵磷脂释放出磷脂酸和胆碱,一些PLD亦能催化磷脂酰基转移反应,将具有羟基的底物与胆碱的极性头部进行交换反应,生成新的磷脂[1]。磷脂酰丝氨酸(phosphatidylserine,简称PS)是唯一能调控细胞膜关键蛋白功能的磷脂[2]。天然存在的PS量很低,且不容易提取,成本极高,因此廉价高效地合成PS成为当今科研研究的重要议题。目前国内较多采用酶转化法,以天然卵磷脂为基质,加入丝氨酸,在磷脂酶D的作用下,生成磷脂酰丝氨酸[3]。近年来,利用磷脂酶D的碱基交换反应特性进行磷脂改性以及制备单一磷脂和稀有磷脂取得重大进展[4]。
刘媛媛等[5]通过对发酵条件的优化,磷脂酶D活力达到3 230 U/L。郭浩等[6]通过对链霉菌进行诱变育种及发酵条件优化,磷脂酶D活力达到5 210 U/L。本实验通过特异培养基筛选出一株磷脂酶D的高效产生菌,之后确定培养基组分及条件优化,提高磷脂酶D的活力,为通过磷脂酶D催化合成磷脂酰丝氨酸的应用提供参考。
1 材料与方法
1.1材料
源于油脂厂区的土样,鸡蛋。
1.2培养基及试剂
1.2.1 培养基富集培养基(%):蛋黄5,NaCl 0.3,p H自然。平板分离培养基(%):NaCl 0.3,MgSO4·7H2O 0.05,CaCl20.1,蛋黄5,琼脂2,p H 6~7。
发酵培养基(%):蛋白胨1,NaCl 0.3, MgSO4·7H2O 0.05,CaCl20.1,蛋黄5。
1.2.2 试 剂
葡萄糖、蔗糖、淀粉、牛肉膏、蛋白胨、玉米浆、硫酸铵、大豆卵磷脂、乙醚、Triton X-100、tris盐、甲苯、氯仿、甲醇、冰醋酸等。
1.3方法
1.3.1 磷脂酶D产生菌的分离
取土样1 g,接入50 mL的富集培养基中,32℃、220 r/min条件下培养24 h。富集培养液经10倍梯度稀释后,选择合适浓度涂布于平板分离培养基上。32℃培养30 h,挑取具有透明圈的菌落分离、纯化,直至得到单一菌株的纯培养物[7]。
1.3.2 酶液的制备
将所得的单一菌株接入装有50 m L发酵培养基的三角瓶中,32℃、220 r/min条件下培养24 h。4 000 r/min离心10 min,上清液为酶液。1.3.3 酶活力的测定
采用薄板层析法(TLC法)测定酶活力。磷脂酶D的活力单位定义为:最适条件下(30℃、p H=7),单位时间(1 min)内,底物被水解1μmol所对应的酶量。
1.3.4 标准曲线的绘制
取浓度梯度分别为4.5,3.5,3.0,2.5,2.0, 1.5,0.5 mg/m L的卵磷脂的乙醚溶液做标样,取GF254硅胶板放入100℃烘箱烘干后点板,碘蒸汽染色后根据浓度和斑点面积绘制标准曲线。
1.3.5 酶活力的计算
根据标准曲线,结合反应时间,由公式(1)可计算出酶对底物卵磷脂的水解活力(U/L)。
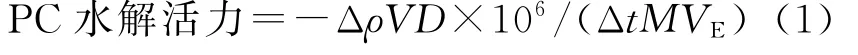
式中:Δρ为反应后与反应前底物量的变化, mg/m L;Δt为反应前后时间的变化,min;M为卵磷脂相对分子质量;V,VE为有机相反应总体积及反应中所用酶液体积,m L;D为酶液稀释倍数。
1.4发酵培养条件的优化
1.4.1 碳 源
改变“1.2.1”中发酵培养基中碳源的种类,分别以用葡萄糖、蔗糖、淀粉作为碳源,添加量为10 g/L,其他成分不变,摇床振荡培养3 d,离心取上清液,测定酶活力。
1.4.2 氮 源
以10 g/L的葡萄糖为碳源,用蛋白胨、牛肉膏、玉米浆、硫酸钠作为氮源,添加量为15 g/L,摇床振荡培养3 d,离心取上清液,测定酶活力。
1.4.3 发酵温度
以10 g/L的葡萄糖为碳源,以15 g/L的蛋白胨为氮源,发酵温度分别设定为20,25,30,35,40℃,摇床振荡培养3 d,离心取上清液,测定酶活力。
1.4.4 酵液p H
以10 g/L的葡萄糖为碳源,以15 g/L的蛋白胨为氮源,发酵液起始p H分别设定为4.0, 5.0,6.0,7.0,8.0,9.0,30℃恒温振荡培养3 d,离心取上清液,测定酶活力。
1.4.5 摇床转速
以10 g/L的葡萄糖为碳源,以15 g/L的蛋白胨为氮源,发酵液起始p H为8,摇床转速分别设定为140,160,180,200,220 r/min,30℃恒温振荡培养3 d,离心取上清液,测定酶活力。
2 结果与讨论
2.1磷脂酶D产生菌的分离筛选
鸡蛋中含有大量不溶于水的卵磷脂,因此,以5 g/L蛋黄为唯一碳源的分离平板是不透明的,如果该平板上生长的菌落周围出现透明圈,初步说明该菌有降解磷脂的能力,透明圈越大,说明降解能力越强。图1中,X1菌株呈乳白色,表面光滑,中央隆起,边缘整齐,透明圈清晰透明。
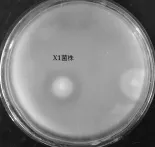
图1 蛋黄培养基上X1菌株Fig.1 X1 strains on the yolk medium
2.2标准曲线的绘制
图2中,3~9号斑点均为卵磷脂,质量浓度依次为4.5,3.5,3.0,2.5,2.0,1.5,1.0, 0.5 mg/m L。根据图2绘制标准曲线,得出公式
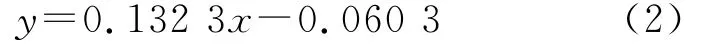
式中:x为PC斑点面积,y为PC质量浓度。

图2 PC浓度-斑点面积图Fig.2 The picture of PC concentration-spot area
2.3X1菌株产酶活力的测定
将筛选出的X1菌株接入发酵培养基中培养24 h,离心取上清液即为酶液。用TLC法测定酶活力,达到2 023 U/L。
2.4碳源及其质量浓度
碳源是微生物生长的必需营养元素,微生物对不同的碳源利用程度不同[8]。选择葡萄糖、蔗糖、淀粉取代原发酵培养基碳源,结果如图3所示。由图3可知,当以葡萄糖为碳源时,酶活力达到3 210 U/L。原因可能是单糖可直接进入代谢途径被降解,降解速度快于双糖和多糖。
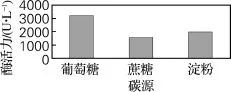
图3 碳源对酶活力的影响Fig.3 Effect of carbon sources on the enzyme activity
进一步考察适宜的葡萄糖质量浓度,结果由图4可知,当葡萄糖质量浓度为10 g/L时,酶活力为4 183 U/L。质量浓度继续增大,菌体进入稳定期,酶活力也维持在原来水平,不再增大。故选择葡萄糖质量浓度10 g/L为最佳。
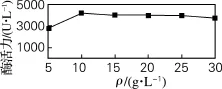
图4 葡萄糖质量浓度对酶活力的影响Fig.4 Effect of glucose concentration on the enzyme activity
2.5氮源及其质量浓度
选择蛋白胨、牛肉膏、玉米浆、硫酸铵作为氮源,结果由图5可知,当以蛋白胨为氮源时,酶活力最大,可达3 905 U/L。有机氮有利于菌体的生长和酶活力的提高,而无机氮对酶活力的提升作用有限[9]。其原因可能是,有机氮在提供氮源的同时,还可以提供一些微生物生长的营养物质,如蛋白质、维生素、微量元素等。
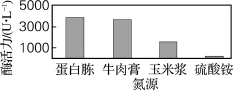
图5 氮源对酶活力的影响Fig.5 Effect of nitrogen sources on the enzyme activity
进一步考察最适的蛋白胨质量浓度,结果由图6可知,当蛋白胨质量浓度为15 g/L时,酶活力最高,为4 937 U/L。当蛋白胨质量浓度继续增大,酶活力维持在原来水平,不再增大。故选择蛋白胨质量浓度为15 g/L最佳。
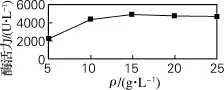
图6 蛋白胨质量浓度对酶活力的影响Fig.6 Effect of peptone concentration on the enzyme activity
2.6发酵温度
微生物群体生长、繁殖最快的温度为其最适生长温度,但并不等于其发酵的最适温度,所以研究温度对酶活力的影响是必要的[10]。由图7可知,在20~30℃温度范围内,酶活力随温度增加而不断增加,在30℃达到最大,为6 320 U/L。当温度继续升高,酶活力呈下降趋势。原因可能是过高的温度加快了酶的失活速度。
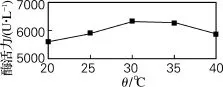
图7 温度对酶活力的影响Fig.7 Effect of temperature on the enzyme activity
2.7发酵液p H
培养基的p H对微生物的生命活动有较大影响,p H会使蛋白质、核酸等生物大分子所带的电荷发生变化,从而影响其生物活性。第二是引起细胞膜电荷变化,导致微生物细胞吸收营养物质能力改变[11]。由图8可知,当p H为7.0~8.0时,酶活力最大,为7 330 U/L。当p H小于5时,菌体很难生长。
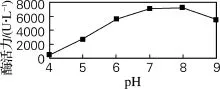
图8 p H对酶活力的影响Fig.8 Effect of p H on the enzyme activity
2.8摇床转速
在摇瓶装液量一定的条件下,摇床的转速可通过影响培养基中溶解氧的浓度来影响发酵结果[12]。由表1可知,在较低的转速下,发酵液的酶活力较低。摇床转速在180~220 r/min对发酵液产酶影响并不明显。基于节约能源方面的考虑,选择180 r/min为发酵的摇床转速。

表1 摇床转速对酶活力的影响Tab.1 Effect of shaking speed on enzyme activity
3 结 论
通过蛋黄平板法,从油脂厂区的土壤中筛选出产磷脂酶D的菌株X1,经过摇瓶培养,用TLC薄层层析法测定酶活力,达到2 023 U/L。对发酵培养基组分及发酵条件优化,磷脂酶D活力达到7 330 U/L。得出最适发酵培养基组分:碳源为葡萄糖,最适质量浓度10 g/L;氮源为蛋白胨,最适质量浓度15 g/L。
PAOLA等[13]对4株链霉菌所产的磷脂酶D进行了比较,发现具有相同的最适反应温度,在35℃时碱基转移活性最高。HAGLSHITA等[14]分离出的磷脂酶D最适p H为7.5,可在p H 7~13的范围内保持稳定。赵紫薇等[15]分离的磷脂酶D与本实验所得磷脂酶D的最适温度和p H相近,分别为28℃和6.5,但p H适应范围差异大。其分离所得磷脂酶D在p H=9时活性仍有上升趋势,而本实验的磷脂酶D在p H大于8时活性开始下降。原因可能是酶的来源不同,蛋白质结构之间的差异所造成的。
[1]陈石良,许正宏,孙微.磷脂酶D的研究进展[J].工业微生物,1999,29(4):47-50.
[2]杨伟东.磷脂酶D催化合成磷脂酰丝氨酸的工艺研究[J].现代食品科技,2010,26(9):994-996.
[3]张忆雪,袁其鹏.酶法制磷脂酰丝氨酸[D].北京:北京化工大学,2013:28-29.
[4]钟秀丽,崔德才,李玉中.磷脂酶D的细胞信号转导作用[J].植物生理学与分子生物学学报,2005,31 (5):451-460.
[5]刘媛媛,张小里,姚娜,等.磷脂酶D的紫外诱变选育及发酵条件的优化[J].化工进展,2012,31(9): 2036-2038.
[6]郭浩,张小里.磷脂酶D高产菌株的选育及发酵条件优化[D].西安:西北大学,2010:30-43.
[7]胡博新,顾鸽青,朱裕辉,等.链霉菌磷脂酶D的分离纯化及部分酶学性质[J].中国医药工业杂志,2008, 39(9):655-658.
[8]杨治彪,张小里.磷脂酶D制备及催化合成磷脂酰丝氨酸工艺研究[D].西安:西北大学,2008:31-55.
[9]姚娜,张小里.磷脂酶D催化大豆磷脂合成磷脂酰丝氨酸工艺[D].西安:西北大学,2011:45-50.
[10]杜连祥,路福平.微生物学实验技术[M].北京:中国轻工业出版社,2006:118-120.
[11]沈同,王镜岩.生物化学:下册[M].2版.北京:高等教育出版社,2001:53-59.
[12]张永刚,曹栋,史苏佳.磷脂酶D催化转酰基中磷脂的分析[J].广西农业生物科学,2008,27(2):158-160.
[13]PAOLA D A,PIERGIANNI V,SCARCELLI D, et al.A spectrophotometric assay for phospholipase D[J].Analytica Chimica Acta,1995,304(4):249-254.
[14]HAGISHITA T,NISHIKAWA M,HATANAKA T.A spectrophotometric assay for the activit of phospholipase D enzyme[J].Analytical Biochemistry,1999,276(2):161-165.
[15]赵紫薇,杨天奎,牟英.色褐链霉菌产磷脂酶D的发酵条件研究[J].油脂化学,2010,35(11):52-57.
Isolation and properties of a phospholipase D-producing strain
WANG Jing, ZHANG Chunzhi
(School of Biological Engineering,Dalian Polytechnic University,Dalian 116034,China)
Strains X1 producing phospholipase D was isolated from the soil collected from oil factory using the yolk medium plate.The activity of phospholipase D could reach to 2023 U/L in flask fermentation by TLC.Medium composition and culture condition were optimized for phospholipase D production,which was 10 g/L glucose,15 g/L peptone,temperature 30℃,p H 7.0 and shaking speed of 180 r/min.The maximum phospholipase D activity was increased to 7 330 U/L from 2 023 U/L.
phospholipase D-producing strain;screening;fermentation optimizing;enzyme activity
TS261
:A
1674-1404(2015)05-0326-04
2014-09-22.
王婧(1989-),女,硕士研究生;通信作者:张春枝(1963-),女,教授.
