PCV2与PPV共感染猪PBMCs对其白细胞介素转录时相影响
2015-06-27景亚星张睿智何潇湘兰培英曹贝贝靳晓慧徐卫松魏战勇
景亚星,张睿智,何潇湘,兰培英, 曹贝贝, 靳晓慧, 徐卫松, 魏战勇
(1.河南农业大学牧医工程学院,河南 郑州 450002;2.河南牧业经济学院,河南 郑州 450011;3.河南省动物性食品安全重点实验室,河南 郑州450002)
PCV2与PPV共感染猪PBMCs对其白细胞介素转录时相影响
景亚星1,张睿智2,何潇湘3,兰培英3, 曹贝贝1, 靳晓慧3, 徐卫松1, 魏战勇1
(1.河南农业大学牧医工程学院,河南 郑州 450002;2.河南牧业经济学院,河南 郑州 450011;3.河南省动物性食品安全重点实验室,河南 郑州450002)
为分析PCV2 与 PPV 体外共感染对猪外周血单个核细胞( PBMC) 对其白细胞介素mRNA转录水平的影响,探讨PCV2与PPV体外混合感染的致病机制。运用荧光定量PCR技术,测定和分析了PCV2和PPV感染PBMC后PCV2,PPV的病毒核酸含量及IL-1β,IL-6,IL-8,IL-12p35,IL-12p40,IL-13,IL-17,IL-18等的转录时相变化。结果表明,PCV2,PPV能够感染PBMC细胞,PCV2/PPV共感染中PCV2,PPV的含量分别在24 h显著最高(P<0.01);PCV2,PPV单独感染和PCV2与PPV共感染PBMC后引起IL-1β,IL-6,IL-8,IL-17转录水平上升,IL12p35,IL-12p40,IL-18转录水平明显受到抑制。由PCV2,PPV共感染而引起的免疫反应和免疫抑制比单独感染更明显。
猪细小病毒;猪圆环病毒;共感染;白细胞介素;外周血淋巴细胞
猪圆环病毒2型(Porcine circovirus type 2,PCV2),属圆环病毒科圆环病毒属,是最小、环状、无折叠、无囊膜、单股的DNA病毒,是猪圆环病毒相关疾病(Porcine circovirus disease, PCVAD)的必须病原[1]。研究表明,该病毒是引起断奶仔猪多系统衰竭综合征(Postweaning multisystemic wasting syndrome,PMWS)、猪皮炎与肾病综合征(Porcine dermatitis and dephropathy syndrome,PDNS)等疾病的重要病原体,同时也与母猪繁殖障碍综合征(SMEDC)、先天性震颤(CT)等有关[2-3]。其中,以PMWS是PCVAD的一种重要表现形式,该病可以导致断奶后和育成期仔猪,尤其是5~12周龄的猪的进行性消瘦、呼吸困难和中枢神经障碍等临床症状,以及全身淋巴结炎症等病理变化[4-6]。猪细小病毒(Porcineparvovirus, PPV),属细小病毒科,细小病毒属,是圆形或六角形的、无囊膜的单股DNA病毒。该病毒主要引起母猪繁殖障碍,导致母猪流产、早产、产死胎、木乃伊胎、弱仔及母猪不育和新生仔猪大量死亡,同时还可引起仔猪的皮炎和腹泻,尤其是在免疫程序不规范或存在免疫抑制病的猪群中。猪细小病毒在猪群中血清抗体阳性率达50%~80%,给畜牧业带来了巨大的经济损失。研究证明,PCV2或PPV单感染都不引起悉生猪发病,但是PCV2经常同上述所说的病原呈现双重或多重感染,引起猪的免疫抑制[7]。这2种病毒共同感染可引起猪群不同程度的消耗性疾病,如体重下降、衰竭、黄疸、贫血及实质器官出现典型的肉芽肿性炎症,还有肝炎、肠炎、肾炎等经典的PMWS症状,然后引起相关疾病,给猪病的防治带来新的挑战。临床发现PCV2和PPV时常伴有混合感染,PPV促进了PCV2在体内的复制和分布,使得PCV2的抗原广泛存在于病猪组织中的巨噬细胞、树突状细胞和多核巨细胞的胞浆中,这说明两者有协同作用[8-9]。但是,关于这2种病毒协同致病的机制还不是很清楚。PCV2与PPV共同的靶细胞猪外周血单核细胞是机体重要的免疫细胞,它能分泌一些细胞因子,例如白细胞介素、干扰素和细胞集落刺激因子等。通过对PCV2和PPV体外感染PBMC后白细胞介素的研究可以推测这2种病毒在猪体内感染及发展的特性,对于了解PCV2和PPV共感染的免疫致病机理及相关疾病的防控具有重要的意义。本试验欲通过体外培养PBMC,在RNA水平上测定上述感染细胞中的白细胞介素的变化规律,以阐明PCV2和PPV共感染的发病机制,为有效预防和控制该病提供理论依据。
1 材料与方法
1.1 材料
1.1.1 病毒 PCV2病毒HN-ZZ株,由河南省动物源性食品安全重点实验室分离并保存,病毒拷贝数为4×103.28拷贝·μL-1。PPV病毒7909标准毒株(PPV-7909)购自中国兽药监察所,经河南省动物源性食品安全重点实验室传代保存,病毒滴度为106.1TCID50·mL-1。
1.1.2 试验动物与细胞 试验选用40日龄去势公猪,体重为25~35 kg,该猪由河南省正阳诸美集团种猪场提供,经RT-PCR/PCR和间接ELISA检测PRRSV、PCV2、PPV、PRV、SIV、HCV及其特异性抗体均为阴性,抽取其前腔静脉抗凝血,参照Histopaque®-1077说明书提取外周血单个核细胞,并于10%胎牛血清的RPMI-1640培养基中进行培养。
1.1.3 主要试剂 Protein K(Promega公司);RPMI-1640培养基(GIBCOBR公司);Trypsin(Invitrogen);Histopaque®-1077(sigma);胎牛血清培养液(Hyclone公司);E.Z.N.A Total RNA Kit Ⅰ(OMEGA);SYBR®Premix EX Taq TM Ⅱ(TaKaRa),Primescript®RT reagent Kit With gDNA Erase (TaKaRa),其他常规试剂均为分析纯试剂。
1.1.4 主要仪器 CFX96 Real-Time PCR 仪(BioRad公司);台式高速低温离心机(德国Sigma公司);PTC-200型PCR仪(M J Research公司);紫外凝胶成像系统(美国SIM公司);小型台式离心机(德国Sigma公司)。
1.2 病毒感染
试验分4组,分别为PCV2,PPV,PCV2/PPV及空白细胞对照,取2 mL的PBMCs(经细胞计数,细胞105个·mL-1)置于6孔板中。采取同步接毒方法,接种剂量分别为200 ,200,200 μL(PCV2和PPV各100 μL)及200 μL RPMI-1640,每个处理设2个重复,直接接种于含PBMCs的六孔板中,轻轻摇匀,放入37 ℃、5%CO2恒温培养箱中培养。吸附60 min(在此期间每隔15 min轻轻晃动1次)。用PBS洗去未吸附的病毒,然后用含体积分数 2%胎牛血清的1640维持液(加入D-氨基葡萄糖使其终浓度为2 mmol·L-1)培养细胞。
1.3 细胞的收集
分别收集未感染的病毒的PBMCs(对照组,CK)及PCV2,PPV,PCV2/PPV感染后1 ,3 ,12 ,24 ,48 ,72 h的PBMCs细胞反复吹打后,用PBS洗涤2次,用2.5 g·L-1胰酶液消化细胞,1 000×g离心10 min,收集PBMCs,于-80 ℃备用。
1.4 DNA及RNA的提取和反转录
按实验室的蛋白酶K法提取2种病毒的DNA,参照E.Z.N.A Total RNA Kit Ⅰ说明书提取细胞总RNA,具体方法和步骤参照文献[10]进行,参照Primescript®RT reagent Kit With gDNA Erase说明书将提取的总RNA反转录合成cDNA。并将反转录合成后的cDNA及提取的DNA做为荧光定量PCR的模板。
1.5 引物的设计与合成
引物的设计使用Primer Premier 5.0 软件,根据GenBank上收录的国内外的全基因序列,进行全基因序列分析,选择各自保守区段设计引物。文中所需要的引物的基因名称、参考序列、退火温度及产物大小见表1。引物由上海生工生物工程技术服务有限公司合成,引物的使用浓度为15μmol·L-1。
1.6 相对定量PCR
以β-action为看家基因进行相对定量PCR,反应体系为20 μL,其中SYBR Premix Ex Taq 10 μL,上、下游引物各0.4 μL,cDNA 400 ng,加三蒸水补足20 μL。反应条件为:95 ℃ 30 s;95 ℃ 10 s,表1中所指引物的退火温度 15 s,72 ℃ 30 s,共进行40个循环;循环结束后升温至95 ℃持续15 s,再降至60 ℃ 持续15 s,然后开始从60 ℃递增至95 ℃ 保持20 min,采集荧光信号得出扩增产物的解链曲线,于95 ℃ 15 s结束反应。
1.7 数据分析
在荧光定量PCR中,Ct值反映模板中目标基因的含量,通过与看家基因β-action进行比较,结果采用2-△△Ct法[11]进行分析,能够准确反映出目标基因的含量。试验结果采用方差分析的Duncan 法进行统计学分析,P<0.05时表示差异显著。
2 结果与分析
2.1 PCV2,PPV在PBMCs中的增殖规律
PCV2和PPV感染PBMCs后,在1 ,3 ,12 ,24 ,48 ,72 h分别收集细胞,提取这2种病毒的DNA,进行相对定量PCR,与β-action进行比较分析,将病毒感染1 h时的病毒DNA含量定义为1倍,得出不同时间病毒DNA在细胞的相对含量(图1)。图1中A显示的是PCV2的相对含量,仅在12,48 h 时PCV2/PPV组高于PCV2单感染组且差异极显著(P<0.01),其他时间点均低于PCV2单感染组。图1中B显示PPV相对含量,在12 ,24 h时PCV2/PPV组PPV相对含量在高于单感染组,且12 h时差异极显著(P<0.01);其他时间点均低于PPV单感染组,其中在48,72 h时2组之间的差异极显著(P<0.01)。试验过程中,PCV2和 PPV单感染组的PBMCs中分别没有检测到PPV或PCV2, CK中没有检测到PCV2和PPV。
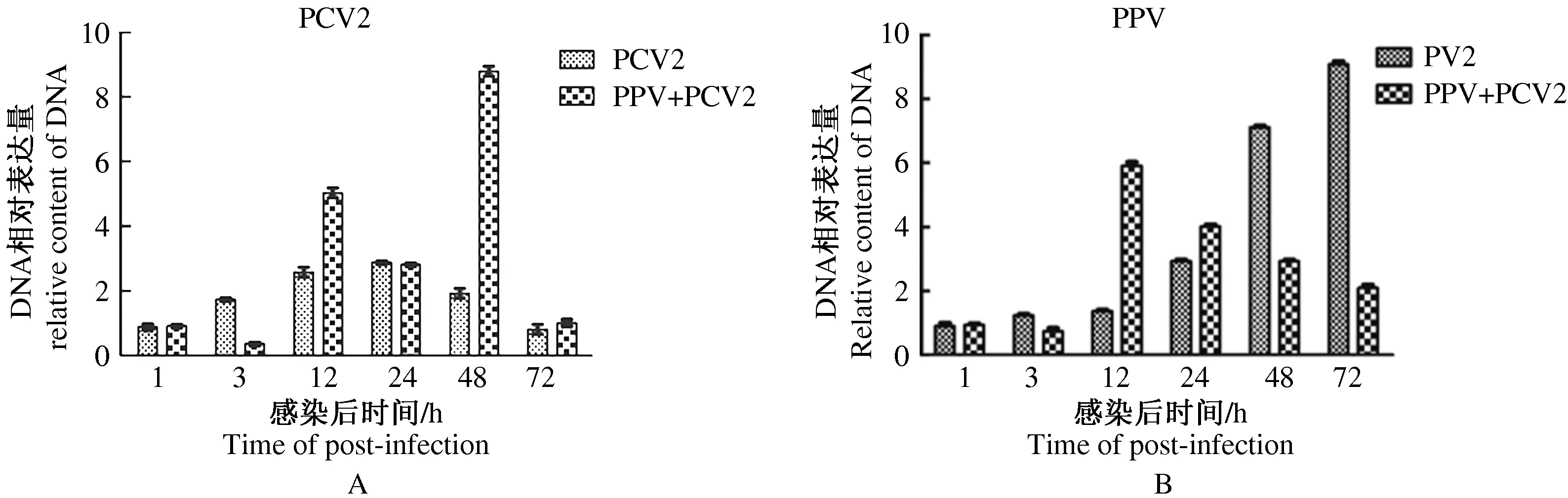
图1 感染后不同时间 PBMCs中 PCV2(A)和(B)PPV核酸的相对含量
2.2 PCV2,PPV体外感染PBMCs对白细胞介素的影响
分别在PCV2,PPV,PCV2/PPV感染PBMC后,于1,3,12,24,48,72 h分别收集细胞,提取RNA,反转录获得cDNA,进行相对定量PCR,与β-action进行比较分析,并将病毒感染1 h时mRNA含量定义为1倍,可得出不同时间白细胞介素mRNA转录的水平。
由图2可以看出,IL-1β mRNA在3个病毒感染组中的表达量均较高,且3,12,24,48 h IL-1β mRNA转录水平均高于对照组,当2种病毒共感染时在3 h和48 h显著高于2种病毒的单感染组。IL-6 mRNA2种病毒共感染的转录水平比单独感染的转录水平在1,3,24,48 h显著上调(P<0.05),在12 h时显著下调(P<0.05),在72 h变化不显著。结果说明,共感组比PPV,PCV2单感染组更能刺激细胞内IL-6的表达,更能抵抗病毒的进一步感染。而IL-8 mRNA在3个病毒感染组中的表达量均较高,共感染组在3 h和72 h 时的IL-8 mRNA转录水平高于PPV,PCV2单感染组。3个病毒感染组中IL-12p35 mRNA和IL-12p40 mRNA的变化量不高。IL-12p35 mRNA仅PPV在1,72 h与对照组相比mRNA上调显著,其他2组与对照组相比均在低于或变化不显著。而IL-12p40的共感染组的转录水平与单感染组相比,只有在24h的时候显著上调(P<0.05)。3个病毒感染组中的IL-13 mRNA在感染后3 h均高于对照组,且PCV2,PCV2/ PPV感染组分别在48 h和72h高于对照组,可知IL-13只有在病毒感染早期处于激活状态。PCV2/ PPV共感染组IL-17 mRNA转录水平在病毒感染后24,48 h显著上调(P<0.05)。IL-18 mRNA在3个病毒感染组中的表达量均较低,只有在PCV2/ PPV共感染后的1 h和3 h的时候显著上调(P<0.05),随着时间的推移3组中IL-18的mRNA转录水平都逐步下调,以PCV2/PPV共感染组下调明显(图2)。
以上试验结果表明,IL-12p35,IL-12p40,IL-18细胞因子在病毒感染后其转录水平均较低或受到抑制,并且PPV与PCV2共感染在感染后期比PPV或PCV2单感染组受到的抑制更加严重。IL-1β,IL-6,IL-8,IL-13,IL-17细胞因子在病毒感染后其转录水平均较高,并且PPV与PCV2共感染比PPV或PCV2单感染组高,说明病毒感染后启动了白细胞介素因子的表达,发挥生物学效应。
3 结论与讨论
PCV2和PPV共同感染可以引起猪体重下降、衰竭、黄疸、贫血 以及全身淋巴结炎症、肝炎、肠炎、肾炎或肺炎等 PMWS 的典型特征[12-14]。KRAKOWKA等[15]认为,在悉生猪体内复制PMWS需要PCV2和PPV等其他病原参与。本研究表明,病毒感染初期3组中未见病毒的大量增殖。PCV2/PPV组中PPV的相对含量在12 ,24 h时高于PPV单感染组,其余时间点均低于PPV单感染组。而PCV2/PPV组中PCV2相对含量仅在48 h时高于PCV2单感染组,其余时间点均低于PCV2单感染组。由此推测,在PPV与PCV2共感染后期促进PCV2的增殖,而PCV2/PPV共感染早期促进,后期抑制PPV的增殖。
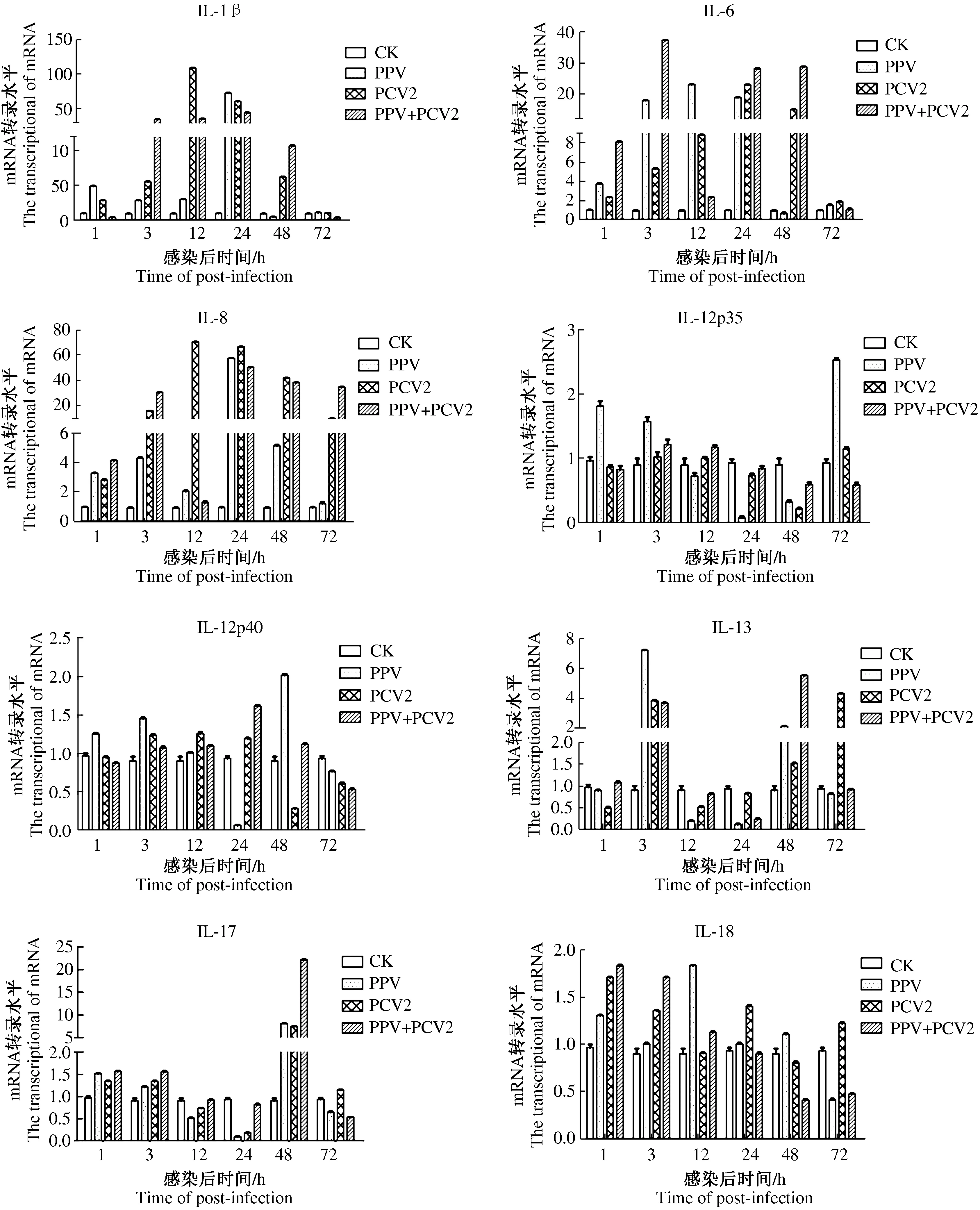
图2 细胞因子的转录时相
IL-1β生物学活性表现在促进T细胞的活化、增殖和分化,诱导CTL的产生,增强NK细胞的杀伤活性,刺激单核细胞/巨噬细胞产生炎性介质[16]。IL-6可以促进B细胞分化和诱导肝细胞合成急性期反应蛋白来启动抗病毒及抗肿瘤作用[17-18]。IL-6还能在体外有效地在体外刺激猪淋巴细胞的增殖,与ConA对猪外周血淋巴细胞的增殖能力相当[19]。IL-8是一种重要的趋化性细胞因子,趋化和激活中性粒细胞、嗜碱性粒细胞及T细胞进入感染部位。中性粒细胞是一种参与先天免疫重要的免疫效应细胞,在炎症反应中迅速到达感染或损伤部位,同时释放大量效应分子如NO、溶菌酶等,发挥吞噬功能,清除病原微生物[20-21]。IL-l7主要是由活化的记忆性CD4 T淋巴细胞分泌,能诱导产生多种细胞因子如IL-6,TNF-α等,参与炎症反应主要通过募集中性粒细胞、诱导粒细胞生成等来完成[22-24]。施开创等[25]在研究PRRSV和PCV2共感染组促炎细胞因子的转录水平变化时发现,共感染组总体上均比单感染下降,处于明显的抑制状态,在IL-1β,IL-6,IL-8尤为明显,说明病毒感染后,PRRSV和PCV2共感染的炎症反应比单感染受到更大程度的抑制,PRRSV和PCV2对机体的先天性免疫的抑制具有加重作用。郭东辉等[8]研究发现,PPV和PCV2病毒感染的中后期中,PPV优先在PBMC中增殖,引起细胞抗凋亡因子Bcl-2的分泌,延缓了细胞凋亡,为PCV2增殖创造了条件。我们研究发现,IL-1β,IL-6,IL-8,IL-17细胞因子在病毒感染后其转录水平均较高,并且PPV与PCV2共感染比PPV或PCV2单感染组高,说明病毒感染后,经过一段病毒与细胞的适应后,PCV2/PPV共感染比单感染刺激细胞释放更多的IL-1β,IL-6,IL-8,IL-17,来趋化淋巴细胞分化,进一步抵抗病毒入侵。IL-6在3,24,48 h时PCV2/PPV共感染组高于PPV,PCV2单感染组,刺激了PBMCs中淋巴细胞的增殖,是病毒进一步感染新的细胞,与PCV2/PPV共感染组中PCV2在病毒感染后期出现1个高峰。
IL-12 是细胞毒性T 细胞(CTL)和自然杀伤细胞(NK)活性刺激因子,诱导T 细胞和NK细胞产生IFN-γ、TNF-α,有利于宿主清除病毒。IL-12由p35和p40 2个独立的亚基组成的异源二聚体,p35决定IL-12的种属特异性,p40在IL-12与受体结合时起关键作用[26-27]。IL-18 主要生物学功能包括诱导免疫细胞产生IFN-γ和激活NK细胞;刺激T细胞增殖,增强淋巴细胞的细胞毒性作用。IL-12的生物学功能与IL-18 相同相似,在抗病毒感染上具有协同效应[28-29]。本试验研究发现,3组引起IL-12p35,IL-12p40 mRNA的变化量不大,仅PPV在1,72 h与对照组相比IL-12p35 mRNA上调显著,其他2组与对照组相比均在低于或变化不显著;IL-18 mRNA在3组中的表达量均较低,且随时间的推移逐步下调,以PCV2/PPV共感染组下调明显。结果说明:病毒感染后,IL-12p35 和IL-12p40处于低活力或抑制状态。IL12p35,IL-12p40,IL-18细胞因子在病毒感染后其转录水平均较低或受到抑制,尤其是PCV2/PPV共感染,这可能是PCV2、PPV感染引起机体免疫抑制的机制之一。
IL-13是重要的免疫调节因子,具有复杂的生物活性,对炎症性细胞因子具有普遍的抑制作用[30-31]。本研究发现,在感染后3 h,各组的IL-13转录水平均显著增加,提示在病毒感染早期,IL-13的表达抑制了其他因子的转录,致使IL-12p35,IL-12p40,IL-18整体表达量不高。在48 h PCV2/PPV共感染组高于PPV,PCV2单感染组,提示PCV2/PPV共感染后期引起的抑制作用,为病毒的持续感染提供给了条件。
本试验采用Real-time PCR技术对PPV,PCV2单感染与PCV2/PPV共感染猪PBMCs后1,3,12,24,48,72 h中PPV,PCV2的DNA含量及白细胞介素(IL-1β,IL-6,IL-8,IL-12p35,IL-12p40,IL-13,IL-17,IL-18)mRNA转录水平进行了检测。结果显示,IL-1β,IL-6,IL-13,IL-8 和IL-17细胞因子在病毒感染后其转录水平均较高,并且共感染比PPV,PCV2单感染组高,而IL12p35,IL-12p40和IL-18细胞因子在病毒感染后其转录水平均较低或受到抑制。由此表明,PCV2/PPV共感染组比PPV,PCV2单感染组更能刺激炎症的发生,同时共感染对细胞的免疫抑制具有加重作用。
[1] MENG X J. Porcine Circovirus Type 2(PCV2): Pathogenesis and Interaction with the Immune System[J]. Annu Rev Anim Biosci, 2013, 42(1):43-64.
[2] CHAE C. Postweaning muhisystemic wasting syndrome:a review of aetiology,diagnosis and pathology[ J].Vet,2004,168:41-49.
[3] 王丽娟. 猪圆环病毒病的诊断与防治措施[J]. 中国畜牧兽医文摘. 2014, 30(7): 91-92.
[4] NEUMANN E J, DOBINSON S S, WELCH E B, et al. Descriptive summary of an outbreak of porcine post weaning multisystemic wasting syndrome ( PMWS) in New Zealand [J] . N Z Vet J, 2007, 55(6) : 346-352.
[5] FAN H, XIAO S, TONG T, et al. Immunogenicity of porcine circovirus type 2 capsid protein targeting to different subcellular compartments [J]. Mol Immunol, 2008, 45(3): 653-660.
[6] FORT M, OLVERA A, SIBILA M, et al. Detection of neutralizing antibodies in postweaning multisystemic wasting syndrome( PMWS) affected and non PMW S affected pigs [J] . Vet Microbiol, 2007, 125(34): 244-255.
[7] KIM J, HA Y, CHAE C. Potentiation of porcine eircovirns 2 induced postweaning multisystemic wasting syndrome by porcine parvovirus is associated with excessive production of tumor necrosis factor-α[J].Vet Pathol,2006,43:718-792.
[8] 郭东辉,张莉娟,李金磊,等. PCV2与PPV共感染猪外周血单个核细胞对其细胞凋亡相关因子表达水平的影响[J]. 畜牧兽医学报, 2013,44(1):71-77.
[9] 王永帅, 唐 波, 张雪花, 等. PCV2与PPV体外混合感染猪肺泡巨噬细胞对细胞因子的影响[J]. 江苏农业学报, 2014, 30(4):772-778.
[10]李厚伟, 魏战勇, 尹海燕, 等. 猪细小病毒感染PK-15细胞抗病毒相关因子转录变化的分析[J]. 畜牧兽医学报, 2011, 42(1):48-55.
[11]LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-△△Ct method[J]. Methods, 2001,25: 402-408.
[12]HASSLUNG F, WALLGREN P. Experimental reproduction of postweaning multisystemic wasting syndrome (PMWS) in pigs in Sweden and Denmark with a Swedish isolate of porcine circovirus type 2[J]. Veterinary Microbiolog, 2005, 106 (1-2):49-60.
[13]LOHSE L, BTNER A, HANSEA A S, et al. Examination for a viral co-factor in postweaning multisystemic wasting syndrome (PMWS) [J]. Veterinary Microbiolog, 2008, 129(1): 97-107.
[14]SUSY C, HUGH Y C, JOSEPHA D, et al. The emergence of a new strain of porcine circovirus-2 in ontario and quebec swine and its association with severe porcine circovirus associated disease[J]. Canadian Journal of Veterinary Research, 2008, 72(3):259-268.
[15]KRAKOWKA S, ELLIS J A, MEEHAN B, et al. Viral wasting syndrome of swine: experimental reproduction of postweaning multisystemic wasting syndrome in gnotobiotic swine by coinfection with porcine circovirus 2 and porcine parvovirus[J]. Veterinary Pathology, 2000, 37(3):254-263.
[16]BORASCHI D, BOSSU P, MACCHIA G, et al. Structure-function relationship in the IL-1 family[J]. Front Biosci, 1996, 32(1):270-308.
[17]周延冲. 多肽生长因子基础与临床[M]. 北京:中国科学技术出版社, 1992:333-354.
[18]ZLOTNIK A, YOSHIE O. Chemokines:a new classification system and their role in immunity[J]. Immunity, 2000, 12(2):121-127.
[19]范俊娟, 陈 建, 余兴龙, 等. 猪白细胞介素-6基因在大肠杆菌中的表达及其产物的促淋巴细胞增殖活性[J]. 中国兽医科学, 2008, 38(6):531-534.
[20]纪桂贤, 王邦茂. 细胞因子与炎症性肠病关系研究新进展[J]. 天津医科大学报, 2004, 10(S1):55-58.
[21]张鑫宇, 秦爱建, 金文杰, 等. 马立克氏病病毒类白细胞介素8(vlL-8)基因的克隆和表达[J]. 中国兽医学报, 2003, 23(6):521-524.
[22]ONISHI R M, GAFFEN S L. Interleukin-17 and its target genes:mechanisms of interleukin-17 function in disease[J]. Immunology, 2010, 129(3):311-321.
[23]LAAN M, CUI Z H, HOSHINO H, et a1. Neutrophil recruitment by human IL-17 via C-X-C chemokine release in the airways[J]. J Immunol, 1999, 162(4):2347-2352.
[24]FORLOW S B, SCHURR J R, KOLLS J K, et a1. Increased granulopoiesis through interleukin-17 and granulocyte colony-stimulating factor in leukocyte adhesion molecule-deficient mice[J]. Blood, 2001, 98(12):3309-3314.
[25]施开创,杨汉春,郭 鑫,等.猪繁殖与呼吸综合征病毒和猪圆环病毒2型共感染对外周血单个核细胞促炎细胞因子mRNA表达的影响[J].畜牧兽医学报,2009,40(3):363-370.
[26]PODLASKI F J, NANDURI V B, HULMES J D, et a1. Molecular characterization of interleukin 12[J]. Arch Biochem biophys, 1992, 294(1):230-237.
[27]DENNIS L F,MICHAEL P M. Molecular cloning and mRNA expression of porcine interleukin-12[J]. Veterinary Immunology and Immunopathology, 1997, 57(2):121-123.
[28]郑 敏, 金宁一, 张洪勇, 等. 猪白细胞介素18成熟蛋白基因的克隆及在大肠杆菌中的表达[J]. 中国兽医学报, 2003, 23(5):430-432.
[29]BOZKAYA H , BOZDAYI M , TURKYILMAZ R , et al. Circulating IL-2 , 1L-10 and TNF-alpha in chronic hepatitis B : their relations to HBeAg status and the activity of liver disease [J ]. Hepatogastroenterology , 2000 , 47 (36) : 1675-1679.
[30]MALEFT R W, FIGDOR C G, HUIJBENS R, et al. Effects of IL-13 on phenotype,cytokine production, and cytotoxic function of human monocytes[J]. J Immunol, 1993, 151 (6):6370-6378.
[31]SCHMID-GRENDELMEIER P, ALTZNAUER F, FISCHER B, et a1. Eosinophils express functional IL-13 in eosinophilic inflammatory diseases[J]. J Immunol, 2002, 169(12):1021-1027.
(责任编辑:蒋国良)
Study on influence of PCV2 and PPV co-infection of porcine PBMCs on transcriptional profiels of IL cytokines
JING Yaxing1, ZHANG Ruizhi2, HE Xiaoxiang3, LAN Peiying3, CAO Beibei1,JIN Xiaohui3, XU Weisong1, WEI Zhanyong1
(1.College of Animal Science and Veterinary Medicine, Henan Agricultural University, Zhengzhou 450002, China; 2.Henan University of Animal Husbandry and Economy, Zhengzhou 450011, China;3.Key Laboratory for Animal-derived Food Safety of Henan Province, Zhengzhou 450002, China)
In order to investigate the influence of inflammatory cytokines in porcine peripheral blood mononuclear cells (PBMC) on the mRNA expression level following the co-infection with pathogenesis of porcine circovirus type 2(PCV2) and porcine parvovirus(PPV),the viral titre and the transcript level of IL-1β, IL-6, IL-8, IL-12p35, IL-12p40, IL-13, IL-17 and IL-18 were measured and andyzed by real-time PCR. The results showed that PCV2,PPV could infect the PBMC in vitro, the mRNA levels of interleukin cytokines, IL-1β, IL-6, IL-13, IL-8 and IL-17 cytokines were significantly increased respectively in co-infected group compared to those of single -infected group on 24 h (P<0.01) ; the depression of IL12p35, IL-12p40 and IL-18 was extremely obvious. The transcript level of IL-1β, IL-6, IL-8, IL-17 increased in the PCV2, PPV and PCV2/PPV co-infection groups, while the transcript level of IL12p35, IL-12p40, IL-18 were suppressed. These results indicated that the inflammatory response and immune-suppression induced by PPV and PCV2 co-infection was more obvious than that of single-infection in the stage of infection.
PPV; PCV2; co-infected; IL; PBMC
2015-06-11
国家自然科学基金项目(U1404326);河南省高校科技创新人才科技创新人才支持计划(15HASTIT028)
景亚星(1989-),女,河南平顶山人, 硕士研究生, 主要从事动物分子免疫学研究。
魏战勇(1975-), 男, 河南安阳人, 副教授。
1000-2340(2015)05-0646-07
S855.3
A
