甲醇或乙醇水蒸气重整制氢高效新型催化剂的研发
2015-06-24梁雪莲刘志铭谢建榕陈秉辉林国栋张鸿斌
梁雪莲,刘志铭,谢建榕,陈秉辉,林国栋,张鸿斌
(厦门大学 化学化工学院,固体表面物理化学国家重点实验室,醇醚酯化工清洁生产国家工程实验室,福建厦门361005)

·综 述·
甲醇或乙醇水蒸气重整制氢高效新型催化剂的研发
梁雪莲,刘志铭,谢建榕,陈秉辉,林国栋,张鸿斌*
(厦门大学 化学化工学院,固体表面物理化学国家重点实验室,醇醚酯化工清洁生产国家工程实验室,福建厦门361005)
新型替代清洁能源的开发是大势所趋.氢能作为理想的清洁能源之一,已引起人们广泛重视.但氢能广泛地应用,尤其是用作电动车燃料电池的燃料,必须解决其储存和输运的技术问题.采用液体作为氢的载体,通过其重整即时产生燃料H2在商业上具有重要实用价值.在诸多可重整制H2的液体燃料中,甲醇、乙醇以其反应温度和压力低,H/C 比高,无NOx、SOx排放,并可利用现行动力燃料输配系统等优点而占据优势.本文介绍甲醇、乙醇制氢技术的研发动态,重点报道本实验室在甲醇、乙醇经水蒸气重整制氢用高效高稳定性催化剂的研发进展.
氢能;甲醇水蒸气;重整制氢;乙醇水蒸气
氢是一种理想的清洁燃料,有着化石燃料无法比拟的一些优点,诸如:放热效率高;在燃烧过程中产生的废物只有水,用作燃料电池(fuel cell)的燃料时基本上可实现零排放;通用性强,可用于大多数终端燃烧设备;也是一种可再生的循环燃料,能输运、储存.长期以来化石燃料的广泛使用,既对全球环境造成严重污染,也难免因过度开采而日渐枯竭.新型替代清洁能源的开发是大势所趋.氢能作为理想的新型替代能源之一,已引起人们广泛重视[1-2].
现有制氢方法有多种,诸如:电解水制氢、太阳能制氢、化石燃料制氢、甲醇制氢、生物质制氢、热化学方法制氢、利用核能制氢等[3-4],但作为大规模廉价制氢的方法仍在研发之中.从全球制氢的发展趋势看,氢的生产呈现多种方法/途径并存的格局,其中天然气水蒸气转化和生物质气化占主导地位.预计到21世纪后期,生物质制氢可期大幅增长、并成为最主要的制氢途径.利用可再生资源(尤其是生物质和太阳能)制氢是H2生产的发展方向.
由于H2的密度小、易燃,导致氢能的存储输送比化石燃料困难得多,氢能的应用须建立在储氢技术之上.世界各国对氢储运技术的研究十分重视,并已取得一定的进展[5-6].储氢方法可分为物理方法和化学方法.物理方法储氢指的是通过改变温度和压力使氢液化、气化或吸附、脱附,从而达到储存氢的目的.化学方法储氢指的是利用氢和储氢物质在一定条件下反应,将氢储存起来,改变条件后,又可以释放出氢,从而达到储氢的目的,诸如:金属氢化物储氢,有机液态氢化物储氢和无机物储氢.
多年来人们一直在努力寻找既有较高的能源利用效率又不污染环境的能源利用方式,而燃料电池就是比较理想的发电技术.燃料电池是一种将存在于燃料与氧化剂中的化学能直接转化为电能的发电装置,其发电过程不通过热机转换,转换效率高,没有污染物排放,几乎没有噪声;而以氢为燃料的燃料电池是最有发展前途的发电装置之一.近年来,电动车领域成为燃料电池应用的主要方向,并取得许多可喜的进展[7-8].
氢作为一种燃料,欲期广泛地应用,尤其是作为电动车燃料电池的燃料,尚存在一些亟待解决的问题[9-10],包括:1) 现有的制氢工艺能量消耗大,效率低,其技术有待提高;2) 氢密度小,易气化、着火、爆炸,这给氢的储存、运输及使用带来一些不便,储氢技术亟待改进;3) 氢燃料“逃逸率”高,即使用真空密封燃料箱,也以每24小时2%的速率“逃逸”,而汽油每月“逃逸率”一般只1%;4) 添加氢燃料既费时又有危险.鉴于氢燃料电池电动车在运行中存在上述若干不足,采用液体作为氢的载体,通过其重整即时产生氢燃料电池所需要的燃料H2在商业上具有重要实用价值.在诸多可重整制氢的液体燃料中,甲醇、乙醇以其反应温度和压力低、H/C 比高、无NOx、SOx等排放物,并可利用现行动力燃料输配系统等优点而占据优势[10-12].
本文介绍甲醇和乙醇制氢技术的研发动态,重点报道本实验室在甲醇、乙醇经水蒸气重整制氢用作高效新型催化剂的研发进展.
1 甲醇制氢研究概况
现有甲醇制氢主要有如下3条途径:1) 甲醇分解制氢,2) 甲醇部分氧化制氢,3) 甲醇水蒸气重整(MSR)制氢.
甲醇分解反应是利用合成气制甲醇的逆反应,反应式为:CH3OH → CO + 2H2,适合于合成甲醇用的催化剂均可用于其分解.在燃料电池电动车上可以利用燃料电池未反应完的废气燃烧提供热量进行甲醇的分解.该法的不足之处是分解气中含有大量的CO,而CO使燃料电池的Pt电极严重中毒,需将CO转化,且其体积分数须控制在0.01%以下[13],所以需要较大的转化器.此方法制氢不宜于直接用于燃料电池电动车上.
用氧气或空气部分氧化甲醇,在特定条件下可以得到CO2和H2,反应式为:CH3OH + 0.5O2→ CO2+ 2H2.甲醇部分氧化法制氢的优点是反应属放热反应,反应速度快,但反应气中氢的体积分数不高;由于通入空气氧化时,其中含N2降低了混合气中H2的体积分数(使其低于50%),不利于燃料电池的正常工作(因为燃料电池要求氢体积分数为50%~100% )[14].
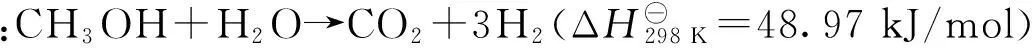
2 MSR制氢催化剂的研发
2.1 研发概况
近20年来,MSR制氢用催化剂的研发一直受到氢能学界的重视[15].Tsai等[16]最早报道用一种准晶态AlCuFe合金微粒作为MSR催化剂,在573 K的反应条件下,H2的产率达到 235 mL/(g·min);高的活性可归因于该合金催化剂的脆性便于粉碎以获得较大的表面积;加入Fe的目的在于抑制Cu颗粒的烧结.Liu等[17]报道一种由共沉淀法制备的Ce1-xCuxO2-x复氧化物经还原制得Cu/CeO2作为MSR催化剂,在一种3.9%Cu/CeO2(3.9%为Cu为负载量,即质量分数,下同)上513 K的反应条件下,MSR的转化率(X)可达53.9%,明显高于相同Cu载量的Cu/ZnO,Cu/Zn(Al)O 和Cu/Al2O33种催化剂在相同反应条件下的转化率(分别为37.9%,32.3% 和11.2%).该Cu/CeO2催化剂的高活性可归因于Cu金属颗粒的高分散度以及Cu+物种被CeO2载体稳定化;但在493和513 K的反应条件下也观测到该催化剂缓慢失活.Zhang等[18]报道共沉淀型Cu/ZrO2/Al2O3催化剂,其对MSR显示出比Cu/Al2O3较高的活性和稳定性.在一种ZrO2质量分数为15%的Cu/ZrO2/Al2O3催化剂上,在523 K的反应条件下,甲醇转化率可达95.0%(摩尔分数),产物H2的选择性达99.9%(摩尔分数);反应200 h后甲醇转化率尚维持在90.0%(摩尔分数).X射线衍射(XRD)检测结果显示,在Cu/Al2O3中掺入ZrO2不仅显著地提高Cu组分的分散度,还有助于防止Cu微晶的聚集烧结.从总体上看,Cu基催化剂的MSR活性和选择性甚佳,但其耐热性能差,当反应温度高于573 K时就容易烧结失活[15],实用前景似乎不被看好.
贵金属基催化剂用于MSR是另一研发领域[19-26].Iwasa等[19]最先报道一系列Pd基催化剂(包括:Pd/SiO2,Pd/A12O3,Pd/La2O3,Pd/Nb2O5,Pd/Nd2O3,Pd/ZrO2,Pd/ZnO和非负载的Pd)用于MSR反应,结果显示:载体对MSR的反应活性有强烈影响,以ZnO负载的Pd基催化剂(Pd/ZnO)的产物选择性最佳.Iwasa等[20-21]随后陆续报道,在较高温度下进行Pd/ZnO的还原活化能显著提高其对MSR反应的催化性能,原先金属Pd的催化功能因高温还原生成PdZn合金而大为改进,认为在含有PdZn合金的催化剂上,反应中间物甲醛同水有效地起作用,转化为CO2和H2,而含有金属Pd的催化剂与此不同,其反应中间物甲醛却选择性地分解生成CO和H2;负载在Ga2O3、In2O3上的Pd,以及负载在ZnO、Ga2O3或In2O3上的Pt,对MSR也都显示出与Pd/ZnO体系相似的催化活性和选择性;程序升温还原(TPR)和XRD测量的结果证实,当用H2还原时上述体系都分别生成PdZn,PdGa,PdIn,PtZn,PtGa和PtIn等合金,进一步证实合金化修改了上述体系的催化功能.

表1 在CNTs和Sc2O3双促进的Pd-ZnO催化剂及其参比体系上MSR制氢的反应活性[27]
Karim等[23]的对比研究发现,妨碍CO2选择性提高的,主要是粒径低于2 nm的金属Pd颗粒,因而认为高温H2-还原处理不仅转化单金属Pd为PdZn合金,同时还消去粒径低于2 nm的那些金属(可能包括合金) 颗粒,这两个因素都贡献于CO2选择性的提高.Chin等[24]也报道过Pd/ZnO对MSR制氢显示出优良的催化性能,其催化剂制备和预处理研究显示,Pd/ZnO催化剂对MSR特殊的催化性能可归因于催化剂的制备和预处理效应.
尽管十多年来在MSR用贵金属基催化剂的研究开发方面取得了一系列进展,但从工业实用角度考虑,现有一些催化剂的活性,尤其是操作稳定性,仍待改进.
2.2 高效高稳定性催化剂研发
新近本实验室Yang等[27]研发出一种多壁碳纳米管(CNTs)和Sc2O3双促进的共沉淀型Pd-ZnO催化剂,其对MSR选择生成CO2+H2显示出优异的催化活性和操作稳定性.在组成经优化的CNTs单促进的Pd0.15Zn1-10%CNTs(10%表示质量分数,下同)催化剂上,在0.5 MPa,548 K,n(CH3OH)∶n(H2O)∶n(N2)=30∶30∶40和空速(GHSV)=180 L/(h·g)的反应条件下,反应150 h时H2的STY大体上维持在0.96 mol/(h·g)的高水平;这个值是非促进原基质Pd0.15Zn1催化剂的相应值(0.56 mol/(h·g))的1.7倍.掺入少量Sc2O3于上述CNTs单促进催化剂中能进一步提高其催化活性和操作稳定性.在组成经优化的双促进的Pd0.15Zn1Sc0.067-10%CNTs催化剂上,在上述反应条件下,反应150 h时STY(H2)能稳定地保持在1.29 mol/(h·g)的更高水平;这个值是上述非促进的原基质Pd0.15Zn1催化剂的相应值的2.3倍(见图1和表1).
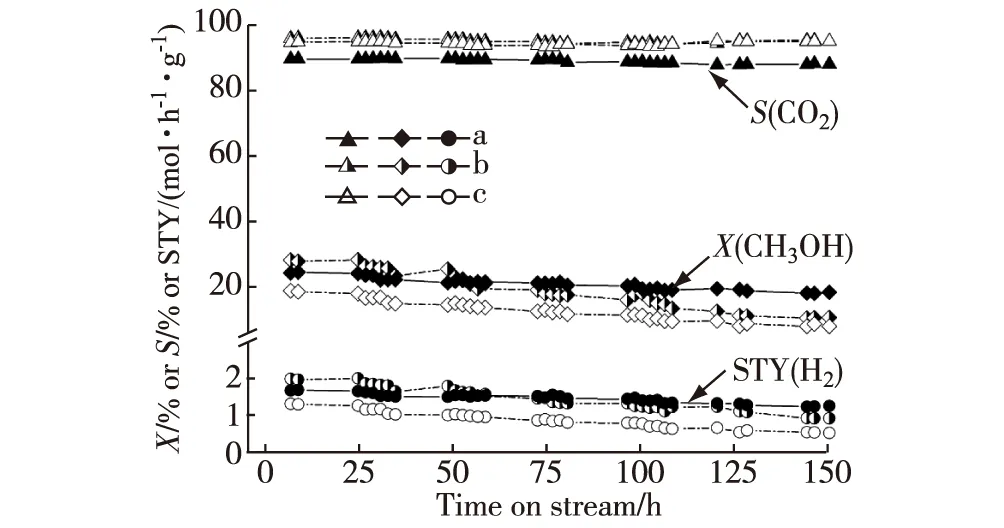
a.Pd0.15Zn1Sc0.067-10%CNTs;b.Pd0.15Zn1-10%CNTs;c.Pd0.15Zn1;反应条件:0.5 MPa,548 K,n(CH3OH)∶n(H2O)∶n(N2)=30∶30∶40,GHSV=180 L/(h·g).
上述MSR反应的表观活化能(Ea) 的测试结果显示,在Pd0.15Zn1Sc0.067-10%CNTs,Pd0.15Zn1-10%CNTs 和 Pd0.15Zn13种催化剂上观测到的Ea值分别为86.2,86.4和87.8 kJ/mol.这些Ea值彼此相当接近,表明适当添加少量CNTs或CNTs+Sc2O3于Pd0.15Zn1基质催化剂中并不引起MSR反应的表观活化能发生明显变化,暗示少量CNTs或CNTs+Sc2O3的掺入并不导致MSR反应主要途径的速率决定步骤有所改变.

(a) Pd0.15Zn1Sc0.067-10%CNTs;(b) Pd0.15Zn1-10%CNTs;(c) Pd0.15Zn1.
从反应后催化剂的透射电镜(TEM)照片(图2)可以估算,3种催化剂(Pd0.15Zn1Sc0.067-10%CNTs,Pd0.15Zn1-10%CNTs和Pd0.15Zn1)在MSR反应后试样的PdZn合金微晶粒径分别为4~7 nm,10~16 nm 和 12~16 nm.相应的X射线能谱(EDX)测量揭示,MSR反应后3种催化剂试样的元素组成分别为:n(Pd)∶n(Zn)∶n(O)=6.4∶38.7∶54.9,n(Pd)∶n(Zn)∶n(O)∶n(C)=4.0∶28.9∶39.2∶27.9和n(Pd)∶n(Zn)∶n(O)∶n(C)∶n(Sc)=3.7∶24.6∶44.4∶26.7∶0.6.这表明:添加少量Sc2O3于Pd0.15Zn1-10%CNTs催化剂中导致工作态催化剂所含元素O的摩尔分数明显上升,暗示还原为Pd0的Pd量占总Pd量的摩尔分数明显下降.
XRD观测结果(图3)显示,MSR反应后准工作态催化剂Pd和Zn组分可观测到的主要晶相是ZnO和PdZn合金,单纯金属Pd相的含量在XRD观测极限以下.利用Scherrer公式,可估算出3种催化剂(Pd0.15Zn1Sc0.067-10%CNTs,Pd0.15Zn1-10%CNTs和Pd0.15Zn1)的PdZn合金微晶粒径分别为4.5,12.5和14.1 nm.这个结果与上述TEM照片(图2)估算的结果十分相近,并表明随着少量Sc3+的加入,PdZn合金的分散度有明显提高.
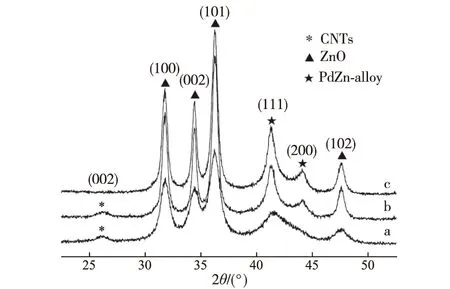
a.Pd0.15Zn1Sc0.067-10%CNTs;b.Pd0.15Zn1-10%CNTs;c.Pd0.15Zn1.
如图4所示,X射线光电子能谱分析(XPS)揭示,3种MSR反应后准工作态催化剂的Pd(3d)-XPS谱都包含2或3种表面Pd物种:Pd0(PdZn合金),Pd2+(PdO)和Pd4+(PdO2).反应后的Pd0.15Zn1-10%CNTs催化剂的Pd0-物种占其总表面Pd的摩尔分数达到79.9%(见图4-b和表2),高于非促进的基质Pd0.15Zn1催化剂的对应值(71.8%)(见图4-c和表2),暗示适当量CNTs的加入改善了催化剂的可还原性,使表面Pd0-物种占总表面Pd的摩尔分数有所提高.这个结果连同上述XRD分析和催化剂活性评价的结果再次证实:以PdZn合金形式存在的表面Pd0-物种与相应催化剂对MSR制氢的优异选择性存在密切相关性;高浓度的PdZn合金形式的表面Pd0-物种有助于MSR反应中H2和CO2的选择生成.
与添加CNTs的情形不同,少量Sc3+的加入明显地提高工作态催化剂表面Pd2+及Pd4+的摩尔分数;在反应后准工作态Pd0.15Zn1Sc0.067-10%CNTs催化剂表面,Pd2+和 Pd4+表面物种的摩尔分数上升至42.7%和14.4%,相应Pd0降为42.9%(见图4-a和表2).Sc3+的显著调变作用很可能缘于Sc2O3在ZnO晶格中的高溶解度,因为Sc3+的离子半径(0.074 5 nm)与Zn2+(0.074 nm)十分相近.少量Sc2O3在ZnO晶格中的溶解导致阳离子形式的Schottky缺陷的生成,除非通过溶解入等价量的Pd+得以补偿.然而,Pd+并不稳定,且由于其大得多的离子半径使其无法溶解于ZnO晶格中(已知r(Pd2+)=0.085 nm,可期r(Pd+)更大).于是,由Sc2O3在ZnO晶格中的溶解而产生的阳离子形式Schottky缺陷将转移/扩散到ZnO表面层,形成表面正离子空位;后者可通过装填(PdZn)0-Pdn+原子簇的Pdn+(n=1或2)以达到对“掺杂有Sc3+的ZnO次表面层”的价态和电荷补偿,(PdZn)0-Pdn+原子簇由此可得到稳定化.这将有助于抑制(PdZn)0纳米颗粒的迁移和烧结,显著延长催化剂的寿命.
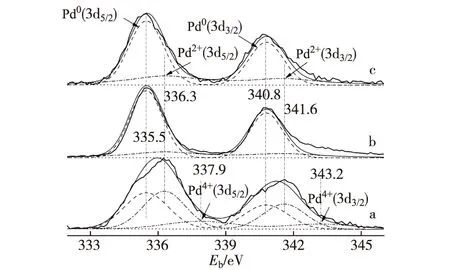
a.Pd0.15Zn1Sc0.067-10%CNTs;b.Pd0.15Zn1-10%CNTs;c.Pd0.15Zn1.

表2 反应后催化剂表面不同价态Pd物种的XPS结合能及相对含量
H2在预还原态催化剂上吸附的程序升温脱附(H2-TPD)测量结果(图5)显示,在473~823 K温度范围,3种催化剂的H2-TPD曲线覆盖区的相对面积强度比可估算为:S′(a)∶S′(b)∶S′(c)= 100∶56∶47,意味着3种催化剂工作态表面H2-吸附位浓度高低顺序为:Pd0.15Zn1Sc0.067-10%CNTs > Pd0.15Zn1-10%CNTs > Pd0.15Zn1.基于CNTs高的电子传递性能及促进氢溢流的特性,在CNTs促进PdZn/ZnO催化的MSR反应过程中,从甲醇(及其中间产物HCHO和HCOOH)脱氢产生的 H(a) 物种,可以从PdZn/ZnO吸附位原位迁移至CNTs表面H-吸附位,随后组合成H2(a),接着脱附为H2(g).这与Cu10Cr1/CNTs催化甲醇深度脱氢生成H2和CO的情景[28-29]相似,有助于提高MSR反应过程中一系列表面脱氢反应的速率.上述3种催化剂工作态表面H2-吸附位浓度增加顺序与所观测这些催化剂上MSR的反应活性高低顺序相一致.
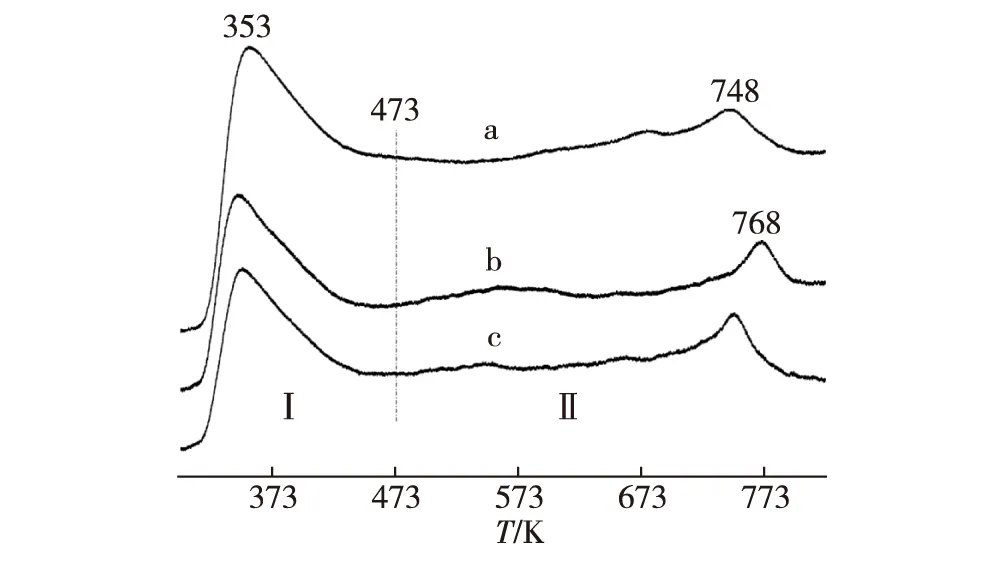
a.Pd0.15Zn1Sc0.067-10%CNTs;b.Pd0.15Zn1-10%CNTs;c.Pd0.15Zn1.
3 乙醇制氢研究概况
在理论上,乙醇和甲醇都可通过直接裂解、水蒸气重整、部分氧化、或氧化重整等方法转化产生H2,但若从可再生能源资源利用考虑,未来利用生物质经发酵法生产“生物乙醇”必将成为主流.生物质在成长过程中能吸收大量CO2,尽管乙醇生产、制氢须放出相当量的CO2,但整个过程形成一个碳循环,不净产CO2排放;由此可期,乙醇制氢将是一条很具发展前景的制氢途径.
现在乙醇制氢途径主要有如下3条:1) 乙醇水蒸气重整(ESR)制氢,2) 乙醇部分氧化制氢,3) 乙醇氧化重整制氢.
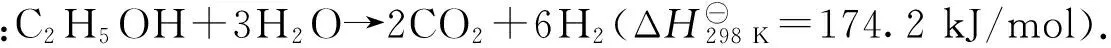
乙醇部分氧化制氢是利用燃料乙醇在氧气不足的情况下发生氧化还原反应[34-35],反应式为:C2H5OH + 1.5O2→ 2CO2+ 3H2.该反应属于放热反应,不需外部供热;其缺点是反应时需要纯氧,成本较高,若用空气进行反应,则产物中H2含量被稀释,从而导致燃料电池效率下降,并增加净化难度.
乙醇氧化重整制氢是将上述的“蒸气重整”(吸热)和“部分氧化”(放热)两个反应组合到一起(反应式为:C2H5OH + 2H2O+0.5O2→2CO2+ 5H2),并在一定条件下实现热量自平衡[36-37];其优点是效率高、热量得到充分利用,是一种最具发展潜力和工业应用价值的乙醇制氢途径.
4 ESR制氢催化剂的研发
4.1 研发概况
在ESR制氢反应中,催化剂起着关键作用.高活性的催化剂应促使H2的生成达到最大化,同时能抑制结焦以及CH4的生成.尽管贵金属的价格昂贵,但它具有负载型过渡金属催化剂所不能代替的优良催化性能,因此负载型贵金属催化剂的研究和开发仍是人们关注的热点.现阶段,贵金属主要采用Rh,Ru,Pd,Pt等,使用的氧化物载体一般有Al2O3,MgO,ZrO2,CeO2,La2O3,TiO2等[35-44].
Liguras 等[38]比较了金属负载量(即质量分数)在0~5%时的Al2O3(或MgO,TiO2)负载的 Rh,Ru,Pd和Pt催化剂在873~1 123 K温度下的催化性能,以Rh催化剂上乙醇转化率和H2的产率为最高.Ru催化剂在低负载量时几无活性,但高负载量时则可与Rh相比;5%Ru/Al2O3能完全转化乙醇为合成气,生成H2的选择性约95%.
载体的优化选择十分重要.酸性的载体(诸如γ-Al2O3)易诱导乙醇脱水生成乙烯,这往往是结焦的根源;用K中和酸性载体或采用碱性载体(诸如γ-La2O3和MgO),脱水能被抑制.5%Ru/Al2O3在反应操作100 h之后,乙醇转化率已下降15%;5%Rh/Al2O3在反应操作100 h之后,其活性也大为下降[39].Frusteri等[40]评价了MgO负载Rh,Pd,Ni和Co催化剂上ESR制氢的反应性能,结果显示,Rh/MgO催化剂上乙醇转化率和操作稳定性均最佳;由于MgO具碱性,Rh/MgO上结焦的速率很低,催化剂的失活主要是金属颗粒烧结所致.Aupretre等[41]在Mg-Al基尖晶石氧化物载体上沉积Rh,与Rh/Al2O3相比,其碱性明显提高,酸性明显下降,其操作稳定性大为改善.
一直以来,人们都在寻求开发出低贵金属含量的高效催化剂,双金属催化剂是其重要研发方向.第二种金属的加入可通过表面修饰或形成合金的方式调变催化剂的行为,以产生良好的促进效应.Kugai等[35]研究了Rh-Ni/CeO2双金属体系,发现组成为1%Rh-5%Ni/CeO2的催化剂对ESR具有非常好的催化性能;但Ni的含量过高或过低都不利于H2的生成,在相近的反应条件下1%Rh/CeO2对ESR的催化活性比10%Ni/CeO2高近1倍.他们认为,Rh断裂C—C键的能力比Ni强,同时还能有效地活化C—H键,在ESR反应中起主要作用;而Ni的功能主要是通过水煤气变换反应(WGS)将CO转化为CO2和H2.与上述Rh的情形不同,Pd和Zn在ZnO载体上共沉积能导致PdZn合金的生成,后者有助于脱氢反应和H2的生成[43].
表3示出若干ESR贵金属催化剂[38-40,42,44].就ESR生产H2而言,Rh比其他贵金属(诸如Pt,Pd和Au)更有效;在较高温度和较大金属负载量条件下,Ru的催化性能可与Rh相比.CeO2,MgO和La2O3适宜于作为ESR用Rh基催化剂的载体;而用Al2O3作为载体难免导致催化剂失活.从长期操作的稳定性考虑,MgO作为载体显示最佳的性能;对于Rh,La2O3也可以是合适的载体.
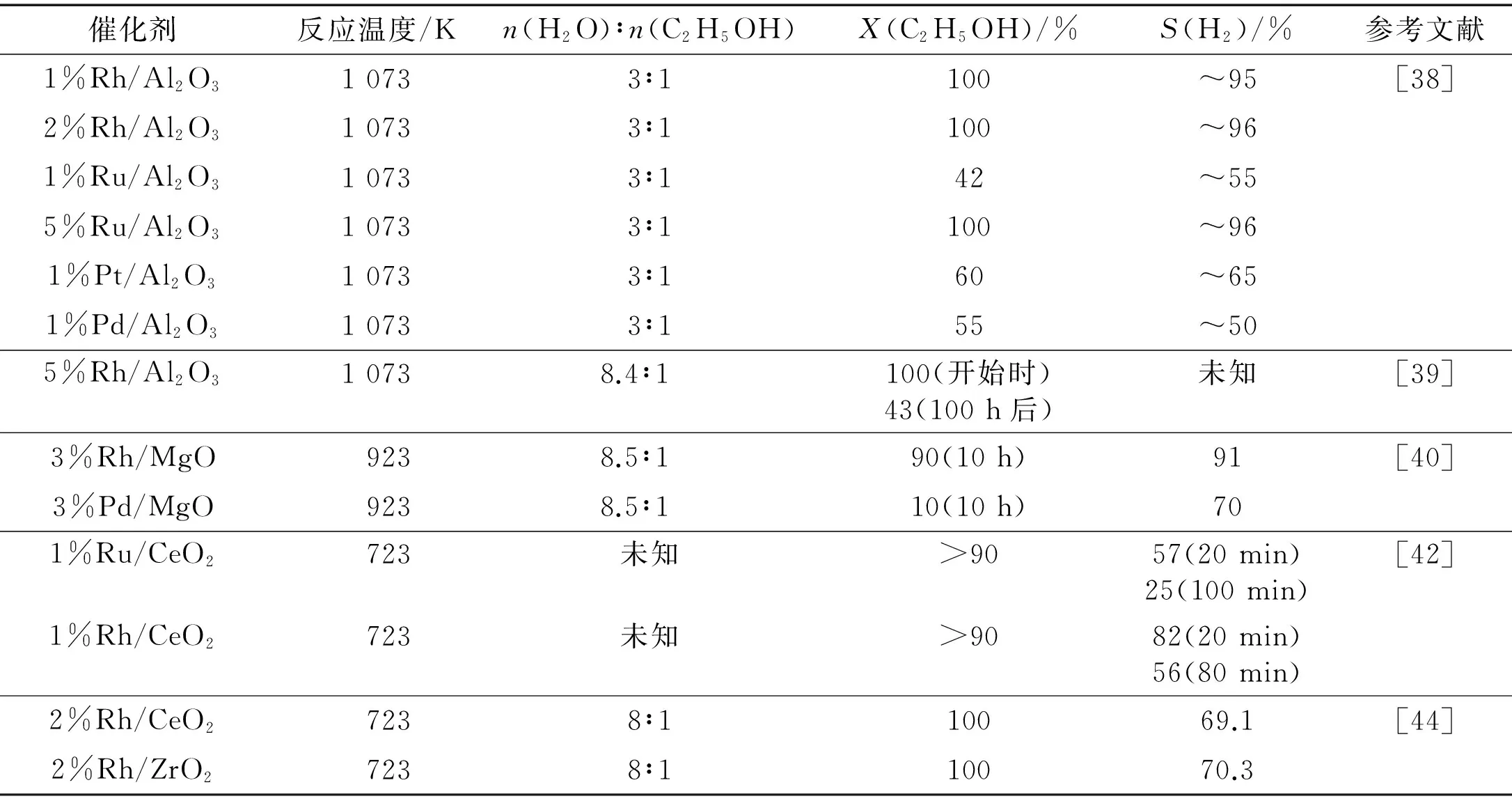
表3 贵金属催化剂上ESR制H2的反应活性
由于金属Rh的稀缺、昂贵,难有工业应用前景.非贵金属ESR用作催化剂是着力研发的另一领域.迄今显示出有兴趣结果的催化剂主要是Ni基和Co基催化剂.Sun等[45]以草酸镍作为前驱物,由浸渍-分解-还原法制备Ni/Y2O3,Ni/La2O3和Ni/Al2O33种催化剂,比较它们对ESR制氢的催化活性.在常压,593 K的反应条件下,在Ni/Y2O3和Ni/La2O3上乙醇的转化率分别可达93.1%和99.5%,H2的选择性分别为53.2%和48.5%.Ni/La2O3催化剂的高活性和高稳定性是由于生成碳酸氧化镧(La2O2CO3)物种,后者能与反应过程中沉积的表面碳反应,以防止催化剂失活.作为比较,Ni/Al2O3的H2选择性在573 K达到最大值47.7%.上述报告的H2选择性比较低很可能是由于所用反应原料气的水/乙醇摩尔比较低(3∶1).Comas等[46]证实,增加水/乙醇摩尔比能显著提高H2的选择性.Yang等[47]评价Ni基催化剂上载体对ESR的影响,结果表明,在923 K和10%Ni负载量的条件下,参加试验的4种催化剂上乙醇的转化率几乎都达到100%;H2选择性的高低顺序为:S(Ni/ZnO)≈S(Ni/La2O3)>S(Ni/MgO)>S(Ni/Al2O3).Frusteri等[48]评价在Ni/MgO催化剂上添加碱(Li或Na,K)对其催化性能的影响,结果显示,添加Li和K能抑制Ni的烧结,从而提高催化剂的稳定性.他们[49]还发现,Ni/CeO2上积炭、结焦比Ni/MgO的快;这很可能与吸附在CeO2载体上的反应中间物种同载体之间发生强相互作用有关.
双金属或合金或复合氧化物负载的催化剂的研发兴趣也有所增加.Barroso等[50]用柠檬酸盐溶胶-凝胶法制备ESR制氢用的NiZnAl催化剂,发现产物分布对合金组成十分敏感.在Ni质量分数为18%~25%的催化剂上,在常压、873 K、n(H2O)∶n(C2H5OH)=3.6~3.8的反应条件下,反应操作230 min,乙醇100%转化,H2选择性高达85%.Marino等[51]研究了Cu-Ni-K/γ-Al2O3对ESR制氢的催化活性,结果显示:Cu和Ni分别促进脱氢和C—C键断裂;K中和γ-Al2O3的酸性位有助于降低结焦的可能性.Bellido等[52]制备ZrO2,ZrO2-Y2O3和ZrO2-CaO负载的Ni催化剂,其用于催化ESR显示,掺合Y2O3或CaO到ZrO2中能提高气体产物中CO2和H2的含量,这种效应被归因于载体中存在氧空位;当ZrO2用Y2O3修饰时H2选择性上升,但用CaO修饰时反而下降,表明除氧空位之外,还有其他相互作用因素影响Ni物种的催化行为.Coleman等[53]评价一系列Mg-Al复合氧化物负载Ni(10%)催化剂对ESR制氢的催化性能,发现:复合氧化物负载Ni催化剂(10%Ni/(MgO-Al2O3))比单组分氧化物负载的对应物(10%Ni/MgO或10%Ni/Al2O3)具有较高的活性和生成H2和COx的选择性;催化剂的性能与复合氧化物载体的Al和Mg含量存在相依性.他们认为,上述催化剂性能的改进与两个单组分氧化物(MgO 和Al2O3)结合生成复合氧化物MgAl2O4相关;具有中等强度酸-碱性的MgAl2O4,通过降低副产物反应(生成乙烯和乙炔)的活性,从而提高催化剂催化ESR的活性、生成H2的选择性以及操作稳定性.Akiyama等[54]制备ZrO2及其他载体负载、并经碳化的碱(或La,Ce)-掺杂的Ni催化剂,其催化ESR的结果显示,经823 K碳化的Ni/ZrO2和Ni/V2O5展示了比CeO2,Al2O3,SiO2-Al2O3,和 MgO 负载的Ni催化剂更高的活性;与CeO2,Al2O3,SiO2-Al2O3,和 MgO 负载的Ni催化剂相比,掺杂Cs的Ni/ZrO2催化剂能更强烈地促进H2的生成.
已知负载的Co能断裂C—C键[55],Co因而也是较广泛研究的另一种非贵金属催化剂.Haga等[56]较早报道:Co催化剂上乙醇催化转化很大程度上受载体所控制.几种载体负载的Co催化剂上ESR制H2的选择性顺序为:S(Co/Al2O3)>S(Co/ZrO2)>S(Co/MgO)>S(Co/SiO2)>S(Co/C).在Co/SiO2,Co/MgO和Co/ZrO2上可伴随着CO加氢甲烷化,在Co/C上可伴随着乙醇分解产生甲烷;而在Co/Al2O3上,CO甲烷化和乙醇分解两个副反应都受到抑制,因此生成H2的选择性最高.Cavallaro等[57]的工作显示,由于MgO的碱性特征,在923 K下,Co/MgO比Co/Al2O3更能抑制焦炭的生成. Llorca等[58]用Co2(CO)8作为前驱物,制备ESR用的一种高度活泼Co/ZnO催化剂,在623 K下,其乙醇转化率达100%,生成不含CO的H2的选择性约为73%.75 h的试验显示其作为ESR活泼催化剂的操作稳定性和可实用性.他们的后续工作[59]显示,添加Na能减少结焦,进一步提高Co/ZnO催化剂的活性和操作稳定性.Batista等[60]用浸渍法制备8.6%Co/Al2O3,7.8%Co/SiO2,和18%Co/MgO 3种催化剂,其催化ESR都显示出高的活性(乙醇转化率>90%) 和生成H2的选择性(~70%).然而,在673 K反应9 h之后,3种催化剂都不同程度地结焦,其焦炭量顺序为:Co/Al2O3(24.6%)>Co/MgO(17.0%)>Co/SiO2(14.2%).Al2O3上结焦最严重,这可归因于Al2O3的酸性特性,有利于乙醇脱水生成乙烯.他们的后续研究[61]显示,增加Co负载量能降低反应尾气中的CO含量.Song等[62]研究γ-Al2O3,TiO2,ZrO2负载的Co催化剂,其催化ESR显示,乙醇的转化率同金属分散度,也即金属Co活性位,密切相关;产物分布取决于主反应与副反应(包括:ESR,甲烷化,WGS,脱水和脱氢)的竞争.在所用的几种载体中,ZrO2能提供最高的金属分散度和最高的H2产率:在823 K下,在10%Co/ZrO2上H2的产率达92%(即1 mol乙醇可以产出5.5 mol H2).Chiou等[63]用浸渍法制备Cox/ZnO和PtyCo10/ZnO催化剂,评价其对ESR的催化性能.组成经优化的10%Co/ZnO显示出最高的表面积和最高的催化活性.(0.5%Pt-10%Co)/ZnO显示出最佳的混合和协同效应,组合Pt和Co单金属催化剂的优点,即在≤ 300 ℃的温度下,Pt善于催化乙醇脱氢和乙醛分解,而Co善于催化乙醛重整.添加适量Pt于10%Co/ZnO中能提高ESR制氢的效率;在598 K下,在组成经优化的(0.5%Pt-10%Co)/ZnO催化剂上,产生最佳的结果,反应产物的选择性为:n(H2)∶n(CO2)∶n(CH4)∶n(CO)≈73.2∶23.8∶2.4∶0.6.
4.2 高效高稳定性催化剂研发
新近本实验室Hou等[64]研发出一种共沉淀型Yb2O3掺杂Ni-ZrO2催化剂.该催化剂对ESR选择生成CO2和H2显示出异常高的活性和热稳定性.在组成经优化的Ni1.25Zr1Yb0.8催化剂上,在0.5 MPa,723 K,n(C2H5OH)∶n(H2O)∶n(N2)=12.5∶37.5∶50和GHSV=90 L/(h·g)的反应条件下,反应120 h时,乙醇转化率保持在18.2%水平,相应的H2的STY为0.396 mol/(h·g).这个H2的STY值是非促进的原基质Ni1.25Zr1催化剂的相应值(0.247 mol/(h·g))的1.6倍(见图6和表4).在上述反应条件下,历时240 h的整个反应过程中,Ni1.25Zr1Yb0.8催化剂上的乙醇转化率、CO2选择性和H2的STY均能大体保持稳定.相比之下,不含Yb2O3的原基质Ni1.25Zr1催化剂上的乙醇转化率、CO2选择性和H2的STY均缓慢下降,反应240 h时已分别降至7%,65.1%和0.204 mol/(h·g)(见图6).

a.Ni1.25Zr1Yb0.8;b.Ni1.25Zr1;反应条件:0.5 MPa,723 K,n(C2H5OH)∶n(H2O)∶n(N2)=12.5∶37.5∶50,GHSV=90 L/(h·g).
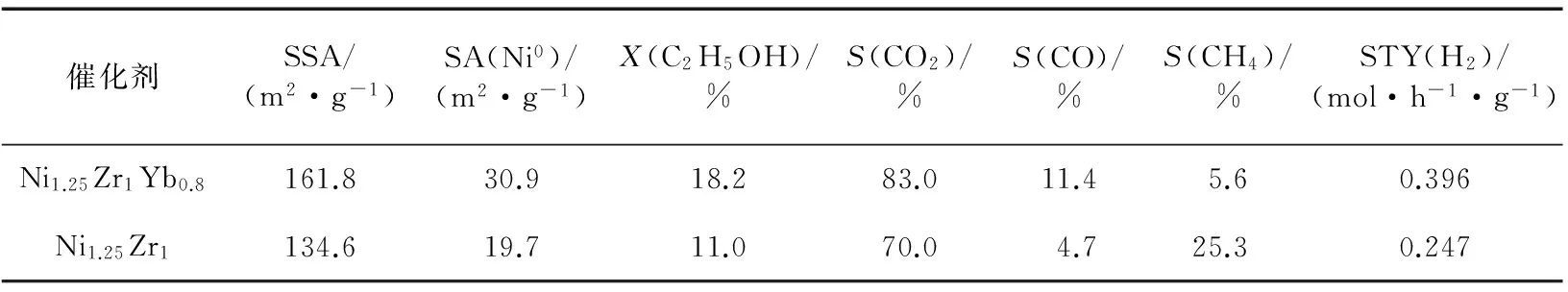
表4 在Yb2O3促进的Ni-ZrO2催化剂及其参比体系上ESR制氢的反应活性[64]
催化剂的耐热性能优劣是其是否具备实用性的一项重要指标.所研发Ni1.25Zr1Yb0.8催化剂用于ESR制氢的耐热性能测试在0.5 MPa,723~973 K,n(C2H5OH)∶n(H2O)∶n(N2)=12.5∶37.5∶50,GHSV=90 L/(h·g)的反应条件下进行,并与非促进的原基质Ni1.25Zr1催化剂作比较.在历时180 h的耐热试验中,被测催化剂连续在723,823,873,923和973 K每个温度点各工作24 h后将操作温度降回至723 K进行活性测试,示于图7的结果表明,Ni1.25Zr1Yb0.8催化剂上进行ESR反应的乙醇转化率一直保持在19%以上,没观察到失活的迹象.而不添加Yb2O3的原基质Ni1.25Zr1催化剂差别悬殊,在823 K经24 h热处理操作之后,其乙醇转化率已降至4.4%;这种转化率的突然下降意味着催化剂已烧结失活.

(a) Ni1.25Zr1Yb0.8;(b) Ni1.25Zr1.
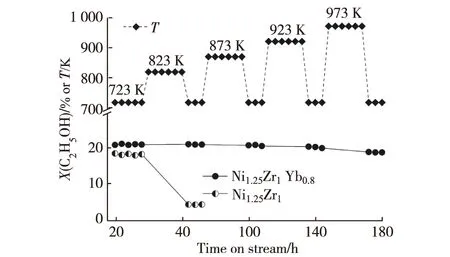
图7 不同反应温度下ESR制氢催化剂的热稳定性[64]
上述催化剂上ESR反应表观活化能的测试在0.5 MPa,673~773 K,n(C2H5OH)∶n(H2O)∶n(N2)=12.5∶37.5∶50,GHSV=105 L/(h·g)的反应条件下进行,结果显示,Ni1.25Zr1Yb0.8和Ni1.25Zr12种催化剂上所观测Ea值分别为74.5 和71.5 kJ/mol,彼此相当接近,表明适当添加Yb2O3于Ni1.25Zr1基质催化剂中并不引起ESR反应的表观活化能发生明显变化,暗示Yb2O3的参与并不导致ESR反应主要途径的速率决定步骤有所改变.
图8所示扫描电镜(SEM)照片可见,反应240 h后准工作态催化剂Ni1.25Zr1Yb0.8和Ni1.25Zr1的外貌有明显差异.在添加Yb2O3的催化剂上,Nix0-NiOy纳米颗粒保持着相同的形状和颗粒大小,且均匀分散在(Zr-Yb)Oz复合载体上.由于在SEM图中很难将Nix0-NiOy纳米颗粒和(Zr-Yb)Oz复合载体区别开来,遂将Nix0-NiOy/(Zr-Yb)Oz作为一个复合整体对待.经估算,Ni1.25Zr1Yb0.8催化剂上的Nix0-NiOy/(Zr-Yb)Oz颗粒粒径约在15~30 nm;而Ni1.25Zr1催化剂上的Nix0-NiOy/ZrO2颗粒粒径却在60~100 nm,并在催化剂表面生展出可观量的CNTs或碳纳米纤维(CNFs).上述结果与2种催化剂工作态表面金属Ni的表面积以及2种催化剂上ESR反应活性的高低顺序相一致.
ESR反应240 h后催化剂的XRD测量结果(图9)显示,在添加Yb2O3的催化剂上观测到的微晶相是Nix0和c-(Zr-Yb)Oy,其平均粒径分别为4.5和4.8 nm;而不含Yb2O3的原基质催化剂上观测到的微晶相是Nix0,t-ZrO2和m-ZrO2,其平均粒径分别为15.6,12.6和14.6 nm.这表明不含Yb2O3的原基质催化剂,其Nix0和t-ZrO2微晶的粒径随着反应的进行明显增大,并且有部分t-ZrO2转变为更为稳定的m-ZrO2.基于上述结果可作如下论断,由于Yb3+的离子半径(0.087 nm)与Zr4+的(0.079 nm)较为接近,可以较大量地溶于ZrO2晶格中,从而形成具有高度热稳定性的“立方氧化锆结构”的Yb-Zr复合氧化物(c-(Zr-Yb)Oy)[65-68],这是Ni1.25Zr1Yb0.8催化剂展示出更高活性和热稳定性的主要原因.
a.Ni1.25Zr1Yb0.8;b.Ni1.25Zr1.
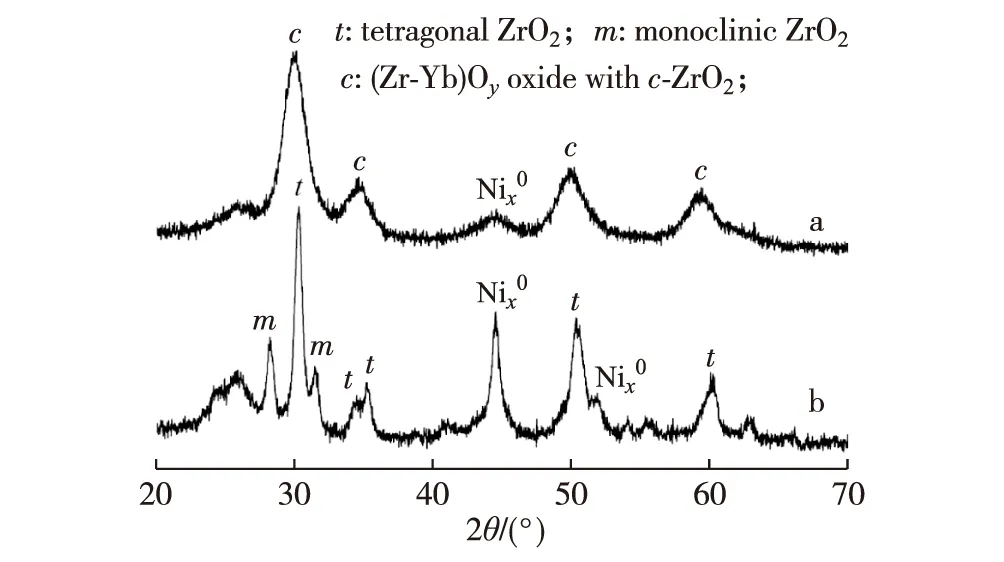
图9 反应后催化剂Ni1.25Zr1Yb0.8(a)和Ni1.25Zr1(b)的XRD谱[64]
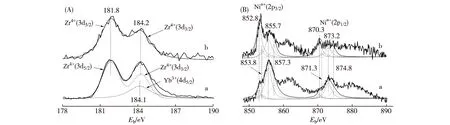
反应后(即准工作态)催化剂的XPS谱(图10)揭示,添加Yb3+与不添加Yb3+的2种催化剂,它们的Zr(3d)-XPS谱的位置和形状几乎无变化,但Ni(2p)-XPS谱的形状有明显差别.在Ni1.25Zr1Yb0.8催化剂表面,其Ni物种的主要存在形态是Ni(OH)2,其次是Ni2O3,Ni0和NiO含量很少.而在Ni1.25Zr1催化剂表面,主要的Ni物种是Ni0,其次是Ni(OH)2,而Ni2O3和NiO含量甚低.那些不同价态或微环境的Ni物种的XPS结合能及摩尔分数示于表5.可以推断,在准工作态的Ni1.25Zr1Yb0.8催化剂表面,Ni组分主要是以Nix0-Nin+(n= 2或3)的形式存在,这很可能是由于催化剂表面高度分散的Ni纳米颗粒与c-(Zr-Yb)Oy载体之间存在较强的相互作用所致;通过其Nin+与表面O2-的结合,使Nix0-Nin+纳米簇锚定在c-(Zr-Yb)Oy载体表面,避免活性组分Nix0纳米颗粒的移动和聚集,保持表面金属Ni的高分散度,有效抑制表面积碳,从而明显地提高催化剂的热稳定性和操作稳定性.
H2-TPD研究可为催化剂表面氢吸附位的浓度和性质提供有用信息.图11示出2种催化剂的H2-TPD测试结果.可以推断,每一条H2-TPD曲线的低温段(303~593 K)系源于弱吸附氢物种(包括分子态吸附氢H2(a)和原子态弱吸附氢H(a))的脱附),而其高温段(593~923 K)可归因于原子态强吸附氢H(a)的脱附.可以想象,在ESR反应温度(本工作≥593 K)下,与低温段(即区-I)相关的吸附氢的表面浓度必然很低,在工作态催化剂表面大部分吸附氢是对应于高温段(即区-II)的那些吸附氢.这暗示:正是那些较强的氢吸附位与ESR反应活性密切相关.在Ni-ZrO2基催化剂催化的ESR反应过程中,从反应物C2H5OH(以及中间产物CH3CHO和CH3COCH3)脱氢产生的氢吸附物种H(a)可以原位转移到工作态催化剂表面的那些较强的H-吸附位,结合成H2(a),而后脱附成H2(g).这将有助于提高ESR反应过程中一系列表面脱氢反应的速率.被测试的2种催化剂在区-II的H2-TPD曲线覆盖区的相对面积强度比可估算为S′(a)∶S′(b)=100∶60,意味着2种催化剂活性表面氢吸附位浓度的高低顺序为:Ni1.25Zr1Yb0.8> Ni1.25Zr1,与所观测2种催化剂上ESR反应活性的高低顺序相一致.
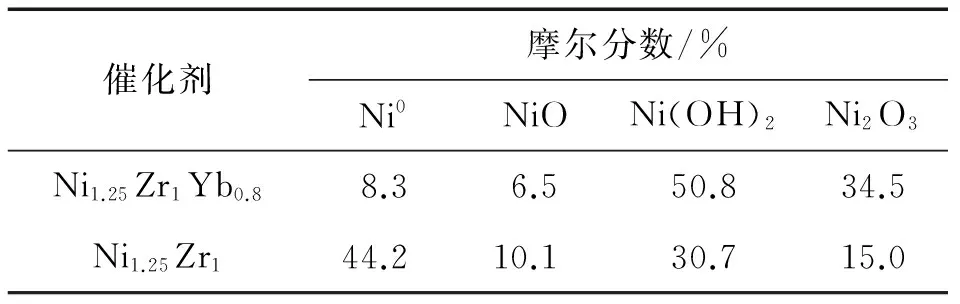
表5 反应后催化剂表面不同价态或微环境的Ni物种的XPS结合能及相对含量[64]

a.Ni1.25Zr1Yb0.8;b.Ni1.25Zr1.
5 结 语
在过去十多年,有关MSR和ESR制氢的研究已取得重要进展.虽然不同研究组之间仍存在一些引人注意的微妙差异,但有关MSR和ESR的反应机理以及催化剂的组成/结构,其认识已趋于一致,同时涌现出若干系列催化剂.
若从工业实用角度考虑,催化剂的操作稳定性(以及耐热性和寿命)是一个挑战性问题.催化剂失活主要缘于如下2个因素:1) 催化活性金属颗粒的团聚烧结;2) 碳沉积、结焦;这些是迟早须研究解决的问题.现已知道,载体的组成/结构/性能对催化剂的操作稳定性和耐热性能有重大影响:载体的酸碱性影响着主反应与副反应(包括:ESR,甲烷化,WGS,脱水和脱氢)的竞争,由此影响产物的选择性;载体自身是否不易烧结(即具有高分散性及其耐热性)、并具有稳定化高度分散载于其表面的金属活性组分的性能,这些属性与结焦和金属活性微晶的烧结密切相关.上述本研究组研发的2种高活性、高稳定性的催化剂,想必可为工业实用型MSR和ESR催化剂的开发提供一些有益思路.
[1] 陈丹之.氢能[M].西安:西安交通大学出版社,1990.
[2] 叶大均.能源概论[M].北京:清华大学出版社,1990.
[3] Dicks A L.Hydrogen generation from natural gas for the fuel cell systems of tomorrow [J].J Power Sources,1996,61:113-124.
[4] Mitsugi C,Harumi A,Kenzo F.We-net:Japanese hydrogen program [J].Int J Hydrogen Energy,1998,23:159-165.
[5] Das L M.On-board hydrogen storage systems for automotive application [J].Int J Hydrogen Energy,1996,21:789-800.
[6] 陈进富,赵永丰,朱亚杰.储氢技术及其发展现状 [J].化工进展,1997(1):10-15.
[7] Donitz W.Fuel cells for mobile applications,status,requirements and future application potential [J].Int J Hydrogen Energy,1998,23:611-615.
[8] Thomas C E,Kuhn I F,James B D,et al.Affordable hydrogen supply pathways for fuel cell vehicles [J].Int J Hydrogen Energy,1998,23:507-516.
[9] Cannon J S.Hydrogen vehicle programs in the USA [J].Int J Hydrogen Energy,1994,19:905-909.
[10] Amphlett J C,Creber K A M,Davis J M,et al.Hydrogen-production by steam reforming of methanol for polymer electrolyte fuel-cells [J].Int J Hydrogen Energy,1994,19:131-137.
[11] Hohlein B,Boe M,Bogild Hansen J,et al.Hydrogen from methanol for fuel cells in mobile systems:development of a compact reformer [J].J Power Sources,1996,61:143-147.
[12] Cheng W H.Development of methanol decomposition catalysts for production of H2and CO [J].Acc Chem Res,1999,32:685-691.
[13] Gottesfeld S,Pafford J.A new approach to the problem of carbon-monoxide poisoning in fuel-cells operating at low-temperatures [J].J Electrochem Soc,1988,135:2651-2652.
[14] Amphlett J C,Mann R F,Peppley B A.On board hydrogen purification for steam reformation PEM fuel cell vehicle power plants [J].Int J Hydrogen Energy,1996,21:673-678.
[15] Trimm D L,Önsan Z I.On-board fuel conversion for hydrogen-fuel-cell-driven vehicles [J].Catal Rev Sci Eng,2001,43:31-84.
[16] Tsai A P,Yoshimura M.Highly active quasi-crystalline Al-Cu-Fe catalyst for steam reforming of methanol [J].Appl Catal A:Gen,2001,214:237-241.
[17] Liu Y,Hayakawa T,Suzuki K,et al.Highly active copper/ceria catalysts for steam reforming of methanol [J].Appl Catal A:Gen,2002,223:137-145.
[18] Zhang X R,Shi P,Zhao J,et al.Production of hydrogen for fuel cells by steam reforming of methanol on Cu/ZrO2/Al2O3catalysts [J].Fuel Process Technol,2003,83:183-192.
[19] Iwasa N,Kudo S,Takahashi H,et al.Highly selective supported Pd catalysts for steam reforming of methanol [J].Catal Lett,1993,19:211-216.
[20] Iwasa N,Masuda S,Ogawa N,et al.Steam reforming of methanol over Pd/ZnO:effect of the formation of PdZn alloys upon the reaction[J].Appl Catal A:Gen,1995,125:145-157.
[21] Iwasa N,Mayanagi T,Ogawa N,et al.New catalytic functions of Pd-Zn,Pd-Ga,Pd-In,Pt-Zn,Pt-Ga and Pt-In alloys in the conversions of methanol [J].Catal Lett,1998,54:119-123.
[22] Iwasa N,Mayanagi T,Nomura W,et al.Effect of Zn addition to supported Pd catalysts in the steam reforming of methanol [J].Appl Catal A:Gen,2003,248:153-160.
[23] Karim A,Conant T,Datye A.The role of PdZn alloy formation and particle size on the selectivity for steam reforming of methanol [J].J Catal,2006,243:420-427.
[24] Chin Y H,Wang Y,Dagle R A,et al.Methanol steam reforming over Pd/ZnO:catalyst preparation and pretreatment studies [J].Fuel Process Technol,2003,83:193-201.
[25] Lorenz H,Penner S,Jochum W,et al.Pd/Ga2O3methanol steam reforming catalysts:Part II.Catalytic selectivity [J].Appl Catal A:Gen,2009,358:203-210.
[26] Halevi B,Peterson E J,Roy A,et al.Catalytic reactivity of face centered cubic PdZn α for the steam reforming of methanol [J].J Catal,2012,291:44-54.
[27] Yang L,Lin G D,Zhang H B.Highly efficient Pd-ZnO catalyst doubly promoted by CNTs and Sc2O3for methanol steam reforming [J].Appl Catal A:Gen,2013,455:137-144.
[28] 陈书贵.周金梅,张鸿斌,等.碳纳米管负载/促进Cu-Cr催化剂上甲醇分解制氢[J].厦门大学学报:自然科学版,2003,42(2):133-138.
[29] Zhang H B,Dong X,Yuan Y Z,et al.MWCNTs as novel material for carrier or promoter of catalyst[C]//13thICC.Paris,France:[s.n.],2004:267.
[30] Mattos L V,Noronha F B.Partial oxidation of ethanol on supported Pt catalysts[J].J Power Sources,2005,145:10-15.
[31] Bi L,Hsu S N,Yeh C T,et al.Low-temperature mild partial oxidation of ethanol over supported platinum catalysts [J].Catal Today,2007,129:330-335.
[32] Fierro V,Akidim O,Mirodatos C.On-board hydrogen production in a hybrid electric vehicle by bio-ethanol oxidative steam reforming over Ni and noble metal based catalysts [J].Green Chem,2003,5:20-24.
[33] Pereira E B,Homs N,Marti S,et al.Oxidative steam-reforming of ethanol over Co/SiO2,Co-Rh/SiO2and Co-Ru/SiO2catalysts:catalytic behavior and deactivation/ regeneration processes [J].J Catal,2008,257:206-214.
[34] Auprêtre F,Descorme C,Duprez D.Bio-ethanol catalytic steam reforming over supported metal catalysts [J].Catal Commun,2002,3:263-267.
[35] Kugai J,Subramani V,Song C,et al.Effects of nanocrystalline CeO2supports on the properties and performance of Ni-Rh bimetallic catalyst for oxidative steam reforming of ethanol [J].J Catal,2006,238:430-440.
[36] Cai W,Wang F,Zhan E,et al.Hydrogen production from ethanol over Ir/CeO2catalysts:a comparative study of steam reforming,partial oxidation and oxidative steam reforming [J].J Catal,2008,257:96-107.
[37] de Lima S M,Silva A M,Graham U M,et al.Ethanol decomposition and steam reforming of ethanol over CeZrO2and Pt/CeZrO2catalyst:reaction mechanism and deactivation [J].Appl Catal A:Gen,2009,352:95-113.
[38] Liguras D K,Kondarides D I,Verykios X E.Production of hydrogen for fuel cells by steam reforming of ethanol over supported noble metal catalysts [J].Appl Catal B:Env,2003,43:345-354.
[39] Cavallaro S,Chiodo V,Freni S,et al.Performance of Rh/Al2O3catalyst in the steam reforming of ethanol:H2production for MCFC [J].Appl Catal A:Gen,2003,249:119-128.
[40] Frusteri F,Freni S,Spadaro L,et al.H2production for MC fuel cell by steam reforming of ethanol over MgO supported Pd,Rh,Ni and Co catalysts [J].Catal Commun,2004,5:611-615.
[41] Aupretre F,Descorme C,Duprez D,et al.Ethanol steam reforming over MgxNi1-xAl2O3spinel oxide-supported Rh catalysts [J].J Catal,2005,233:464-477.
[42] Erdohelyi A,Rasko J,Kecskes T,et al.Hydrogen formation in ethanol reforming on supported noble metal catalysts [J].Catal Today,2006,116:367-376.
[43] Casanovas A,Llorca J,Homs N,et al.Ethanol reforming processes over ZnO-supported palladium catalysts:effect of alloy formation [J].J Mol Catal A:Chem,2006,250:44-49.
[44] Diagne C,Idriss H,Pearson K,et al.Efficient hydrogen production by ethanol reforming over Rh catalysts effect of addition of Zr on CeO2for the oxidation of CO to CO2[J].C R Chim,2004,7:617-622.
[45] Sun J,Qiu X P,Wu F,et al.H2from steam reforming of ethanol at low temperature over Ni/Y2O3,Ni/La2O3and Ni/Al2O3catalysts for fuel-cell application [J].Int J Hydrogen Energy,2005,30:437-445.
[46] Comas J,Marino F,Laborde M,et al.Bio-ethanol steam reforming on Ni/Al2O3catalyst [J].Chem Eng J,2004,98:61-68.
[47] Yang Y,Ma J X,Wu F.Production of hydrogen by steam reforming of ethanol over a Ni/ZnO catalyst [J].Int J Hydrogen Energy,2006,31:877-882.
[48] Frusteri F,Freni S,Chiodo V,et al.Steam reforming of bio-ethanol on alkali-doped Ni/MgO catalysts:hydrogen production for MC fuel cell [J].Appl Catal A:Gen,2004,270:1-7.
[49] Frusteri F,Freni S,Chiodo V,et al.Steam and auto-thermal reforming of bio-ethanol over MgO and CeO2Ni supported catalysts [J].Int J Hydrogen Energy,2006,31:2193-2199.
[50] Barroso M N,Gomez M F,Arrua L A,et al.Hydrogen production by ethanol reforming over NiZnAl catalysts [J].Appl Catal A:Gen,2006,304:116-123.
[51] Marino F,Baronetti G,Jobbagy M,et al.Cu-Ni-K/γ-Al2O3supported catalysts for ethanol steam reforming formation of hydrotalcite-type compounds as a result of metal-support interaction [J].Appl Catal A:Gen,2003,238:41-54.
[52] Bellido J D A,Assaf E M.Nickel catalysts supported on ZrO2,Y2O3-stabilized ZrO2and CaO-stabilized ZrO2for the steam reforming of ethanol:effect of the support and nickel load [J].J Power Sources,2008,177:24-32.
[53] Coleman L J I,Epling W,Hudgins R R,et al.Ni/Mg-Al mixed oxide catalyst for the steam reforming of ethanol [J].Appl Catal A:Gen,2009,363:52-63.
[54] Akiyama M,Oki Y,Nagai M.Steam reforming of ethanol over carburized alkali-doped nickel on zirconia and various supports for hydrogen production [J].Catal Today,2012,181:4-13.
[55] Llorca J,Homs N,Piscina P R.In situ DRIFT-mass spectrometry study of the ethanol steam-reforming reaction over carbonyl-derived Co/ZnO atalysts [J].J Catal,2004,227:556-560.
[56] Haga F,Nakajima T,Miya H,et al.Catalytic properties of supported cobalt catalysts for steam reforming of ethanol [J].Catal Lett,1997,48:223-227.
[57] Cavallaro S,Mondello N,Freni S.Hydrogen produced from ethanol for internal reforming molten carbonate fuel cell [J].J Power Sources,2001,102:198-204.
[58] Llorca J,Piscina P R,Dalmon J A,et al.CO-free hydrogen from steam reforming of bio-ethanol over ZnO-supported cobalt catalysts:effect of the metallic precursor [J].Appl Catal B:Env,2003,43:355-369.
[59] Llorca J,Homs N,Sales J,et al.Effect of sodium addition on the performance of Co-ZnO-based catalysts for hydrogen production from bio-ethanol [J].J Catal,2004,222:470-480.
[60] Batista M S,Santos R K S,Assaf E M,et al.Characterization of the activity and stability of supported cobalt catalysts for the steam reforming of ethanol[J].J Power Sources,2003,124:99-103.
[61] Batista M S,Santos R K S,Assaf E M,et al.High efficiency steam reforming of ethanol by cobalt-based catalysts [J].J Power Sources,2004,134:27-32.
[62] Song H,Zhang L,Watson R B,et al.Investigation of bio-ethanol steam reforming over cobalt-based catalysts [J].Catal Today,2007,129:346-354.
[63] Chiou J Y Z,Wang W Y,Yang S Y,et al.Ethanol steam reforming to produce hydrogen over Co/ZnO and PtCo/ZnO catalysts [J].Catal Lett,2013,143:501-507.
[64] Hou J,Liu Z M,Lin G D,et al.Novel Ni-ZrO2catalyst doped with Yb2O3for ESR [J].Int J Hydrogen Energy,2014,39:1315-1324.
[65] Martin U,Boysen H,Frey F.Neutron powder investigation of tetragonal and cubic stabilized zirconia,TZP and CSZ,at temperatures up to 1 400 K[J].Acta Cryst,1993,B49:403-413.
[66] Hyppänen I,Hölsä J,Kankare J,et al.Defect structure and up-conversion luminescence properties of ZrO2:Yb3+,Er3+nanomaterials [J].J Fluoresc,2008,18:1029-1034.
[67] Angeles-Chavez C,Salas P,Díaz-Torres L A,et al.Structural and chemical characterization of Yb2O3-ZrO2system by HAADF-STEM and HRTEM [J].Microsc Microanal,2009,15:46-53.
[68] Solis D,de la Rosa E,Meza O,et al.Role of Yb3+and Er3+concentration on the tunability of green-yellow-red upconversion emission of codoped ZrO2:Yb3+-Er3+nanocrystals [J].J Appl Phys,2010,108:023103.
Development of Novel Catalysts for Steam-reforming of Methanol or Ethanol to Generate Hydrogen
LIANG Xue-lian,LIU Zhi-ming,XIE Jian-rong,CHEN Bing-hui,LIN Guo-dong,ZHANG Hong-bin*
(State Key Laboratory of Physical Chemistry of Solid Surfaces,National Engineering Laboratory for Green Chemical Productions of Alcohols-Ethers-Esters,College of Chemistry and Chemical Engineering,Xiamen University,Xiamen 361005,China)
There is an ongoing trend to move toward exploitation of clean alternative energy sources.As one of the ideal energy sources,hydrogen has drawn great attention and been intensively studied.In order for hydrogen to be more widely used,especially serving as power-fuel for hydrogen-fuel-cell-driven vehicles,it is critical to solve issues associated with the storage and transportation of hydrogen.Liquid hydrogen-carriers,which can generate hydrogen in situ through conversion/reforming,are commercially important for practical applications.Among the many liquid-fuels that can generate hydrogen through reforming,methanol and ethanol have displayed some advantages in relatively lower reaction temperature and pressure,higher H/C ratio,no emission of NOxand SOxas by-products,and making use of the existing power-fuel transportation-distribution systems.In this article,we review recent developments in the hydrogen generation from methanol or ethanol,highlighting the progress in our lab on the development of catalysts for hydrogen generation from methanol or ethanol through steam reforming.
hydrogen energy;methanol steam-reforming;generate hydrogen;ethanol steam-reforming
2015-03-24 录用日期:2015-06-10
国家重点基础研究发展计划(973计划)(2011CBA00508);优秀国家重点实验室基金项目(20923004);教育部创新团队项目(IRT1036)
梁雪莲,刘志铭,谢建榕,等.甲醇或乙醇水蒸气重整制氢高效新型催化剂的研发[J].厦门大学学报:自然科学版,2015,54(5):693-706.
:Liang Xuelian,Liu Zhiming,Xie Jianrong,et al.Development of novel catalysts for steam-reforming of methanol or ethanol to generate hydrogen[J].Journal of Xiamen University:Natural Science,2015,54(5):693-706.(in Chinese)
10.6043/j.issn.0438-0479.2015.05.013
新能源材料专题
O 643.36
A
0438-0479(2015)05-0693-14
* 通信作者:hbzhang@xmu.edu.cn
