片状碳酸锰薄膜材料的制备
2015-06-23姚如富
方 璐,姚如富,薛 燕
合肥师范学院化学与化学工程学院,安徽合肥,230601
片状碳酸锰薄膜材料的制备
方 璐,姚如富,薛 燕
合肥师范学院化学与化学工程学院,安徽合肥,230601
以MnCl2和CO(NH2)2为反应前驱物在溴苯/水溶液界面上、超重力为1000/g的条件下采用水热方法合成片状MnCO3薄膜,研究了前驱物浓度、温度、超重力大小和反应时间对MnCO3薄膜形成的影响。采用SEM、XRD、FT-IR对样品的形貌和物相进行表征。结果发现较低的温度和高重力场条件有利于薄膜状MnCO3薄膜的形成。形成MnCO3薄膜的最优条件是在1000/g超重力场、溴苯/水溶液体系、120℃条件下水热反应30 min,在该条件下制备得到的MnCO3薄膜光滑致密,并且具有金属光泽。
水热法;超重力;碳酸锰;薄膜材料
近年来,金属碳酸盐材料被广泛运用在工业生产中,如绘画颜料、塑料、橡胶以及纸张生产等[1]。同时,一些重要的纳米结构的锰的氧化物可以在一定温度下煅烧碳酸锰得到。例如,通过碳酸锰的热转化形成的纳米结构的四氧化三锰就是一种良好的半导体材料,应用于催化[2-3]、可充电电池[4-5]、磁性材料和电极材料[6]领域。因此,碳酸锰的合成研究对于其应用以及含锰氧化物的制备具有重要意义。
一般来说,工业上生产无定型碳酸锰是由氯化锰与碳酸钠在150℃条件制备的。近来人们在水溶液中通过水热法[7-8]、溶剂热法[9]、沉淀法[10]等合成具有不同形态的微纳米结构的碳酸锰晶体。有研究报道用超声波法制备了可控结构的碳酸锰[11],也有研究报道在离子液体中合成了中空微米球状的碳酸锰材料[12]。但是,采用水热法制备得到多晶薄膜状碳酸锰尚未见报道。超重力场[13]在原子尺度的形成上有直接的作用力,已被广泛应用于制备陶瓷[14]和具有不同等级原子尺度范围的新材料上。水热法是一种极佳的化学合成技术。通过水热法制备得到的多种粉末都具有好的结晶度,宏观上是观察不到凝聚的。李汶军[15]团队研究了超重力场对于纳米结构材料形成的影响,并在超重力场、水/氯苯体系中采用水热方法下合成了高密度的硫化镉微球。本文研究在超重力场、水/溴苯体系中采用水热法合成高致密的多晶碳酸锰薄膜。
1 实验部分
1.1 试剂
氯化锰(MnCl2)、尿素(CO(NH2)2)、邻1,2-二氯苯、苯醚、PVA、无水乙醇、均为市售分析纯试剂。
1.2 仪器
超重力反应炉(如图1所示),JSM-840型扫描电子显微镜(日本JEOL公司),D8 Advance型 X射线衍射仪(德国Bruker公司) 和 Alpha-Centauri560型红外光谱仪(德国Bruker公司)。
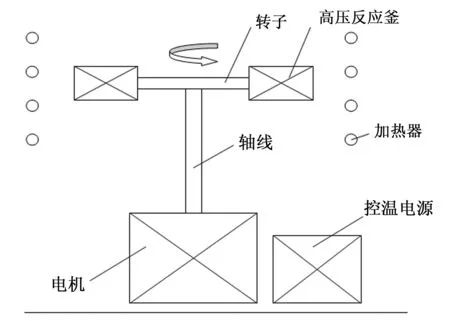
图1 超重力反应设备示意图
1.3 实验方法
首先,称取一定质量的MnCl2和CO(NH2)2(按表1的浓度比)加入到去离子水中配成6 mL的溶液,再加入2 mL有机溶液(总体积不超过反应釜容积的80%);然后将混合溶液加入到以聚四氟乙烯为内衬的高压反应釜中,密封高压反应釜放入超重力反应炉中,设定相对重力大小、反应温度和时间,待反应完全后自然冷却至室温,打开反应釜;接着分别用去离子水及无水乙醇洗涤沉淀3~5次,以除去未反应完全的离子及有机溶剂;最后,将洗涤后得到的沉淀置于烘箱中60℃条件下烘干即为最终产物。
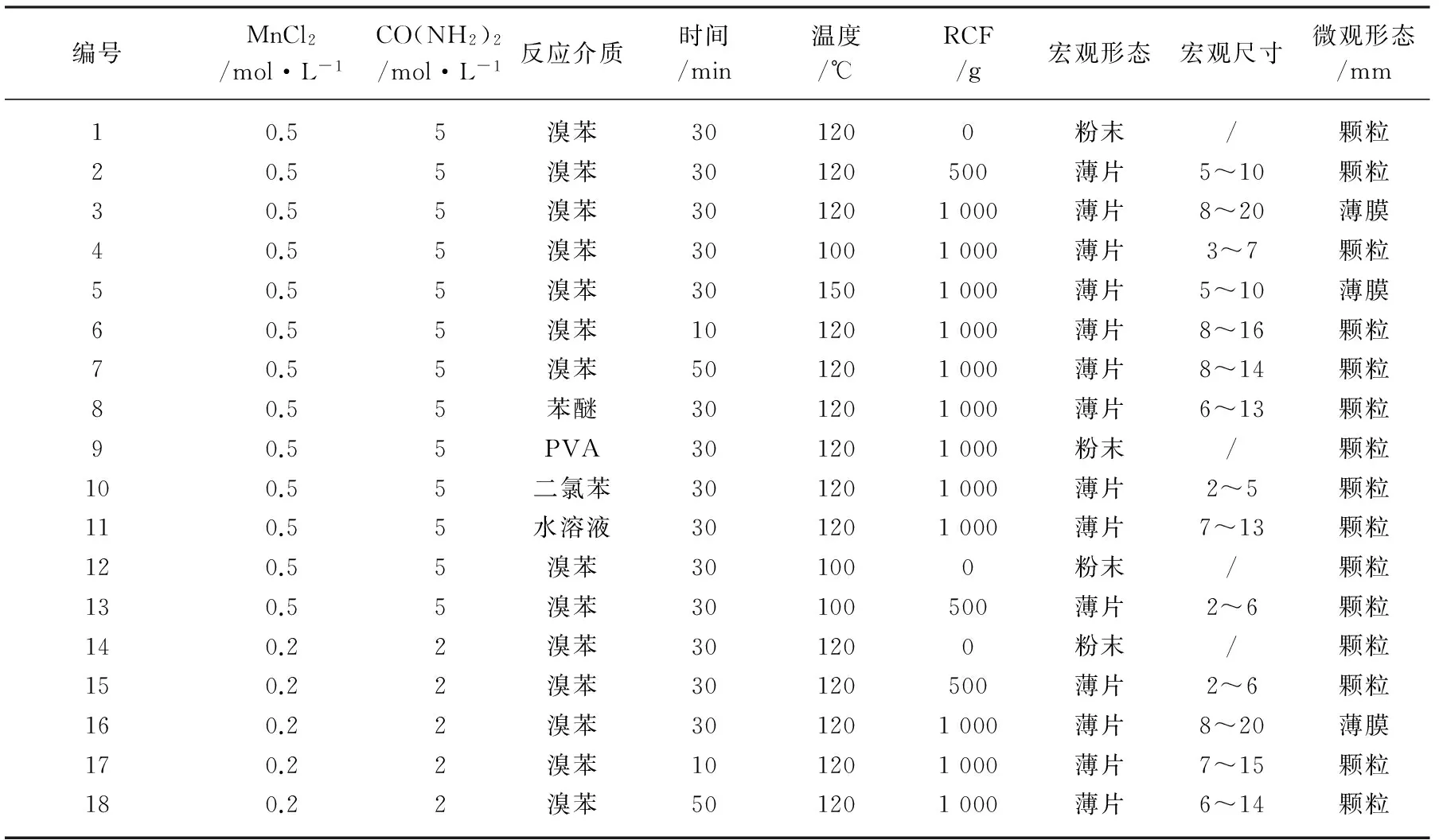
表1 MnCO3制备的实验条件和性质
2 结果与讨论
2.1 超重力对合成MnCO3的影响
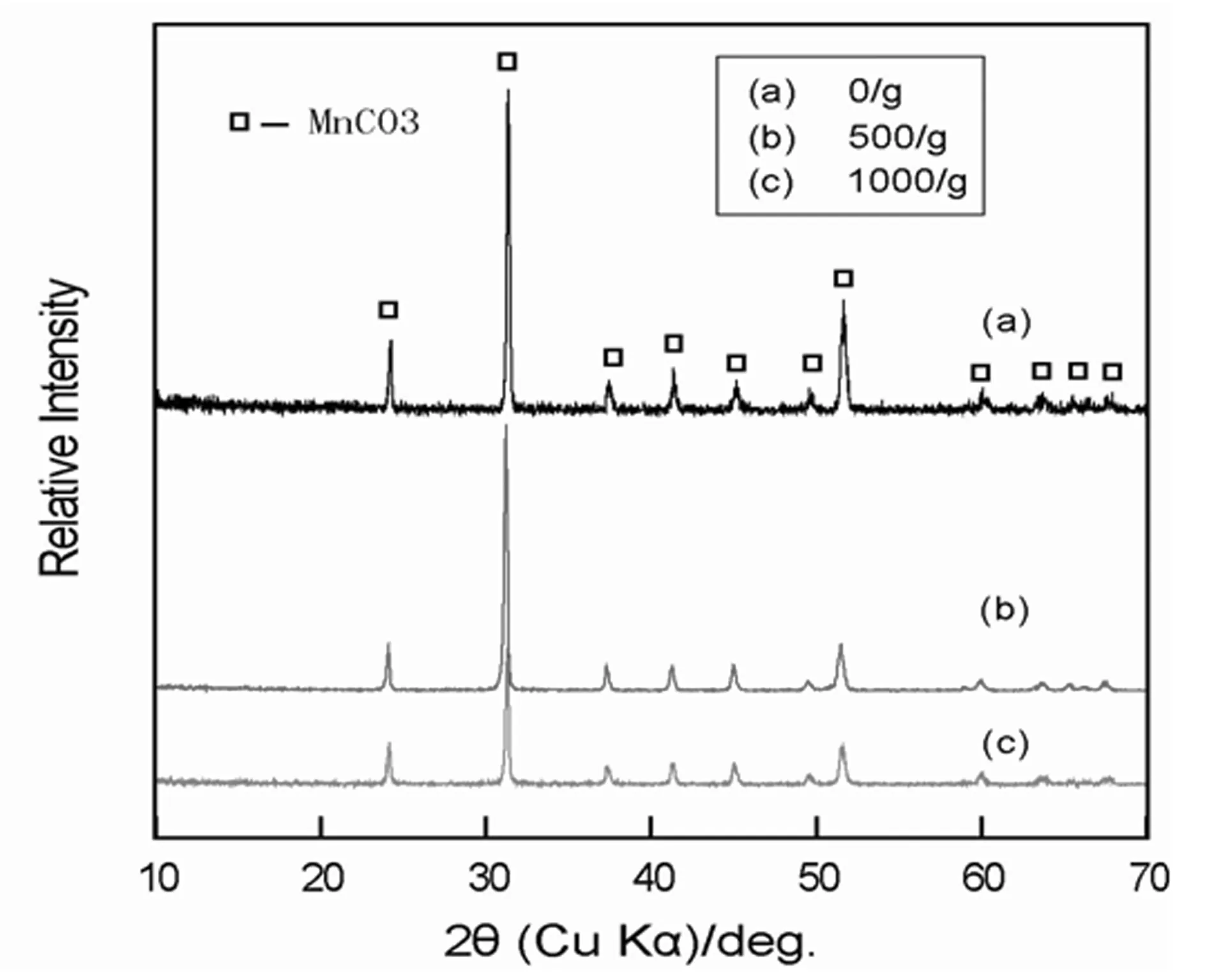
图2 不同超重力场条件下水热反应生成样品XRD图谱
图2是0.5 mol·L-1MnCl2和5 mol·L-1CO(NH2)2在不同超重力场,溴苯/水溶液体系下120℃水热反应30 min所得样品的XRD图谱。从图2中所得峰可知是样品MnCO3物质,没有其他杂峰,与标准谱图(卡片:44-1472)中的位置完全一致,a=4.790·,c=15.694·。从图2(a)(b)(c)中分析得出,随着超重力的增大,峰强变弱,峰宽变宽。
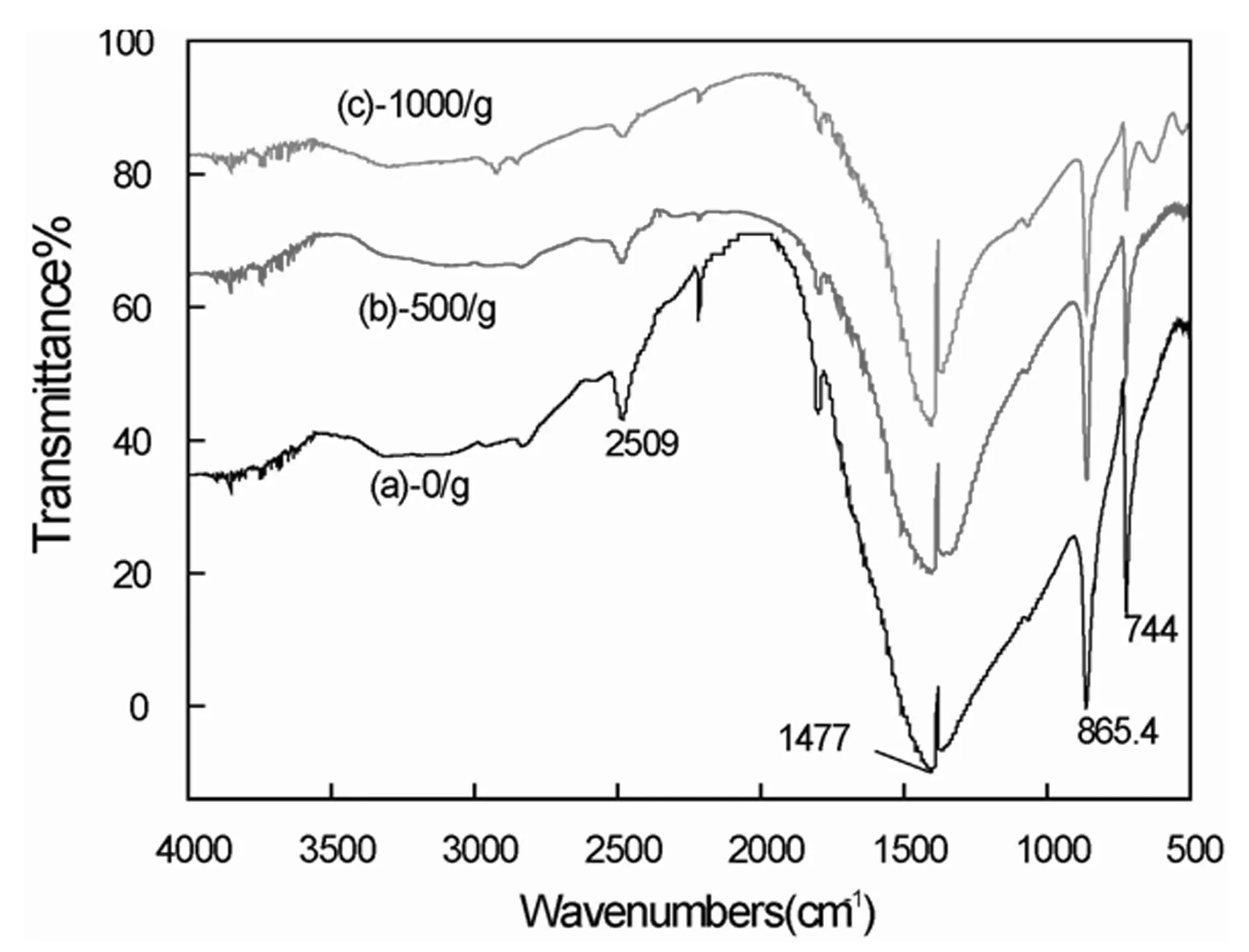
图3 不同超重力场条件下水热反应生成的MnCO3的FT-IR图谱
图4是不同超重力场下制备得到样品的SEM图。当相对超重力大小为0/g时(图4(a)所示),MnCO3的形貌为斜六面体的颗粒,边长在5 μm左右。有的颗粒表面光滑,有的颗粒表面有孔洞。当增至500/g(图4(b)所示),MnCO3的形貌还是为斜六面体的颗粒,边长在5~10 μm范围内。而当超重力大小增至1000/g(图4(c)所示),样品形貌是大片的块状,边长在30 μm左右,由小颗粒紧密堆积而成。这说明在超重力的作用下,颗粒在介质表面上紧密堆积自组装成了大片的块状。由此得出,超重力是合成片状MnCO3薄膜的条件之一。

图4 不同超重力场条件下水热反应生成MnCO3的SEM图
2.2 温度和反应时间对合成MnCO3的影响

图5 不同的反应温度和反应时间条件下水热反应生成MnCO3的SEM图
反应温度和反应时间一样会影响MnCO3的形貌。图5是0.5 mol·L-1MnCl2和5 mol·L-1CO-(NH2)2在超重力为1 000/g的溴苯/水溶液体系,在不同的反应温度和反应时间条件下水热反应生成MnCO3的SEM图。从图5(a)和(b)中看出,反应温度为100℃时,MnCO3形貌为颗粒,这些颗粒结晶度不好,边长尺寸在2 μm左右。当温度升高至150℃时,结晶程度提高了,斜六面体的表面光滑,边长尺寸在5 μm左右。与图4(c)相比即反应温度为120 ℃时,MnCO3的形貌为片状。说明温度过高或过低都不能形成片状的薄膜。从图5(c)和(d)中看出,当反应时间为10或50 min时,MnCO3形貌均是颗粒,而且结晶度不高,颗粒尺寸在5μm左右。从不同反应温度和时间条件下制备得到MnCO3形貌来看,薄膜状的MnCO3是个亚稳态的结构。发现反应温度120℃和反应时间30 min是合成片状MnCO3薄膜的条件之一。
2.3 介质对合成MnCO3的影响
图6是0.5 mol·L-1MnCl2和5 mol·L-1CO-(NH2)2在超重力为1000/g的不同介质体系下,120℃反应30 min水热反应生成MnCO3的SEM图。当介质体系为苯醚/水、PVA/水、二氯苯/水和水溶液时,MnCO3的形貌均为颗粒状,这说明溴苯/水的介质体系是合成MnCO3薄膜的有利条件之一。
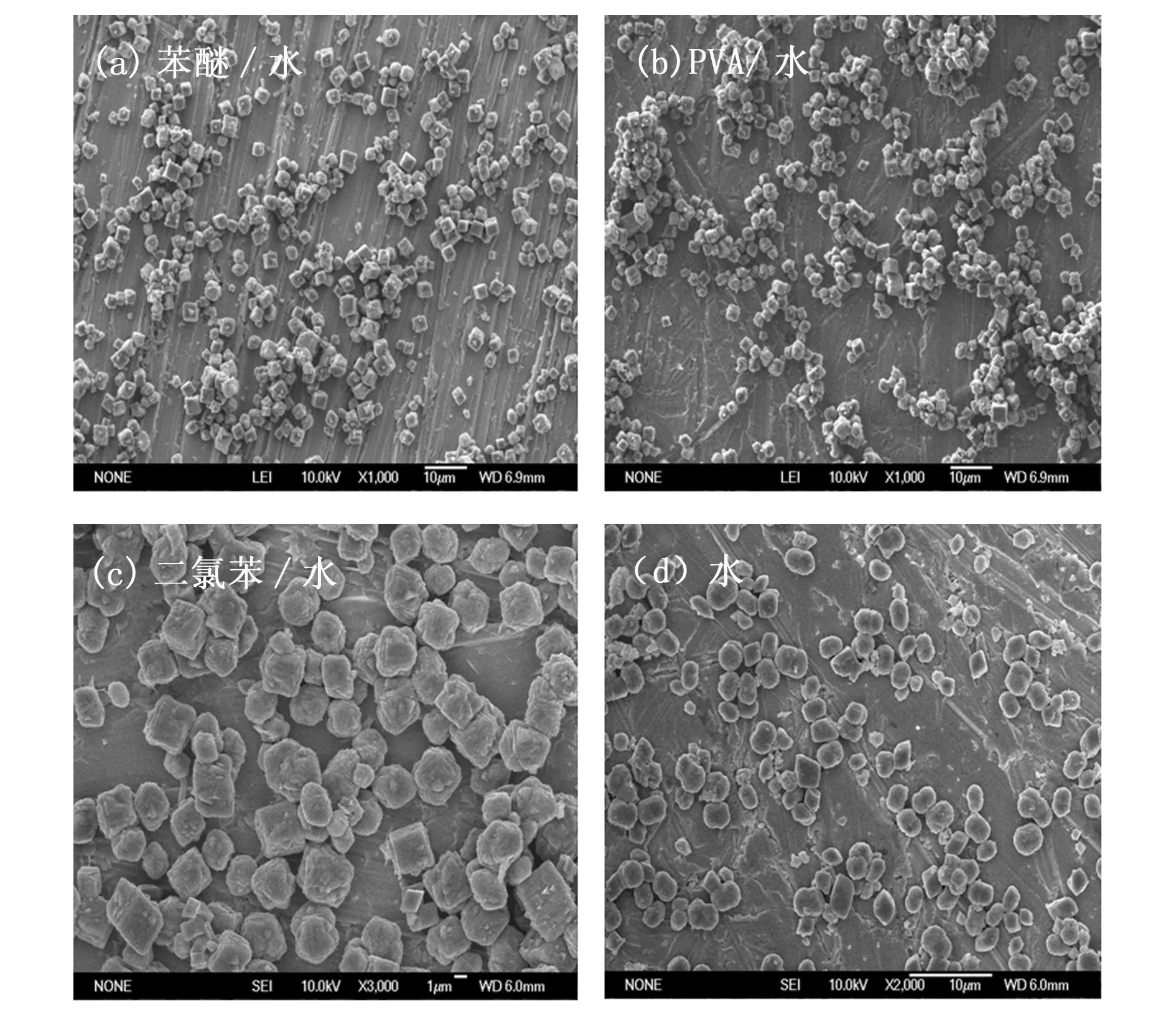
图6 不同介质体系下水热反应生成MnCO3的SEM图
2.4 浓度对合成MnCO3的影响
如图7所示,在不同超重力场下由0.2 mol·L-1MnCl2和2 mol·L-1CO(NH2)2在120℃条件下水热反应30 min生成样品的XRD图谱。从图7中所得峰可知样品是MnCO3物质,没有其他杂峰,与标准谱图(卡片:44-1472)中的位置完全一致,a=4.790·,c=15.694·。从图7(a)(b)(c)中分析得出,当超重力大小依次从0/g增长到500/g到1000/g时,可以发现图7中的峰强逐渐变弱,峰宽变宽。
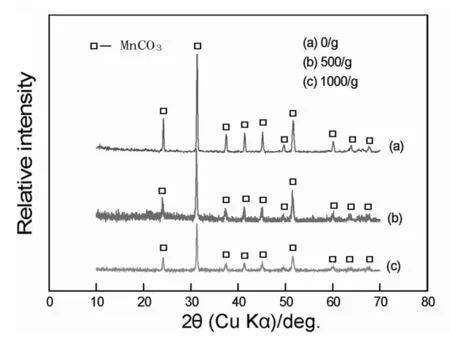
图7 不同超重力场条件下水热生成样品的XRD图谱
图8(a)(b)和(c)是0.2 mol·L-1MnCl2和2 mol·L[-1]CO(NH2)2在不同超重力场,溴苯/水溶液体系下120℃水热反应反应30 min所得MnCO3样品的SEM图,比较(a)(b)(c)三图,发现随着相对超重力的增大,样品由分散的斜六面体颗粒逐步堆积形成块状薄膜,且一面光滑,另一面堆积致密。薄膜尺寸大小为60 μm。图8(d)是图8(c)所示样品的光学图片,该MnCO3薄膜是棕色的,并且具有光泽,尺寸约为1 cm左右。从以上分析得出,相对超重力为1 000/g时有利于形成MnCO3薄膜,并且薄膜致密光滑。

图8 不同超重力场条件下水热反应合成MnCO3样品的SEM图片和光学图片
图9是0.2 mol·L-1MnCl2和2 mol·L-1CO(NH2)2在120℃、相对超重力为1000/g的溴苯/水溶液体系中水热反应不同时间生成MnCO3的SEM图。图9(a)是反应10 min得到样品的SEM图,发现MnCO3形貌为斜六面体颗粒,边长尺寸在5 μm左右;图9(b)是反应50 min得到样品的SEM图,同样MnCO3形貌有斜六面体,也有类似球形,这些形貌是一层层地堆积而成的。与图8(c)在30 min条件下形成的薄膜片状相比,说明在10 min和50 min的反应时间条件下,不能合成薄膜状的MnCO3,也说明了该薄膜片状是个中间态、亚稳态。

图9 不同反应时间条件下水热合成MnCO3样品的SEM图
3 结 论
不同超重力大小、反应时间、反应温度和反应介质体系的条件对制备的MnCO3形貌产生影响,发现制备MnCO3薄膜的最优条件是0.2 mol·L-1MnCl2和2 mol·L-1CO(NH2)2在1000/g超重力场、溴苯/水溶液体系、120℃条件下水热反应反应30 min。该条件下制备得到的MnCO3薄膜不仅光滑,而且致密,具有金属光泽。
[1]Lei S J,Tang K B,Fang Z,et al.Preparation of alpha-Mn2O3and MnO from thermal decomposition of MnCO3and control of morphology[J]. Materials Letters,2006,60:53-56
[2]Jothiramalingam R,Viswanathan B,Varadarajan T K.Preparation,characterization and catalytic properties of cerium incorporated porous manganese oxide OMS-2 catalysts[J].Catalysis Communications,2005,6:41-45
[3]Baldi M,Finocchio E,Milella F,et al.Catalytic combustion of C3hydrocarbons and oxygenates over Mn3O4[J].Applied Catalysis B,1998,16:43-51
[4]Giraldo O,Brock S L,Willis W S,et al.Manganese oxide thin films with fast ion-exchange properties[J].Journal of the American Chemistry Society,2000,122:9330-9331
[5]Tarascon J M,Armard M.Issues and challenges facing rechargeable lithium batteries[J].Nature,2001,414:359-367
[6]Armstrong A R,Bruce P G.Synthesis of layered LiMnO2as an electrode for rechargeable lithium batteries[J].Nature,1996,381:499-500
[7]Wang X,Li Y D.Hydrothermal reduction route to Mn(OH)2and MnCO3nanocrystals[J].Materials Chemistry and Physcis,2003,82:419-422
[8]Lei S J,Liang Z H,Zhou L,et al.Synthesis and morphological control of MnCO3and Mn(OH)2by a complex homogeneous precipitation method[J].Materials Chemistry and Physcis,2009,113:445-450
[9]Yang L X,Liang Y,Chen H,et al.Controlled synthesis of Mn3O4and MnCO3in a solvothermal system[J].Materials Research Bulletin,2009,44: 1753-1759
[10]Zhu H G,Stein E W,Lu Z H,et al.Synthesis of size-controlled monodisperse manganese carbonate microparticles as templates for uniform polyelectrolyte microcapsule formation[J]. Chemistry of Materials,2005,17: 2323-2328
[11]Yang L X,Zhu Y J,Tong H,et al.Submicrocubes and highly oriented assemblies of MnCO3synthesized by ultrasound agitation method and their thermal transformation tonanoporous Mn2O3[J].Ultrasonics Sonochemisty,2007,14:259-265
[12]Duan X C,Lian J B,Ma J M,et al.Shape-controlled synthesis of metal carbonate nanostructure via ionic liquid-assisted hydrothermal route: the case of manganeseCarbonate[J].Crystal Growth&Design,2010,10 (10):4449-4455
[13]Ono M,Mashimo T.Sedimentation process for atoms in a Bi-Sb system alloy under a strong gravitational field: a new type of diffusion of substitutional solutes[J].Philosophical Magazine,2002,82:591-600
[14]Cushing B L,Kolesnichenko V L,O'Connor C J.Recent advances in the liquid-phase syntheses of inorganic nanoparticles[J].Chemical Review,2004,104:3893-3946
[15]Chen J,Li W J.Hydrothermal synthesis of high densified CdS polycrystalline microspheres under high gravity[J].Chemical Engineering Journal,2011,168:903-908
(责任编辑:汪材印)
The Synthesis of Flake-like MnCO3Flim Materials
FANG Lu,YAO Rufu,XUE Yan
Department of Chemistry and Chemical Engineering,Hefei Normal University,Hefei Anhui,230601,China
A flake-like MnCO3film has been successfully synthesised by the hydrothermal method,with high gravity field 1000/g in the aqueous solution-bromobenzene system,which used MnCl2and CO(NH2)2as precursor .The effect of the precursor concentration,temperature,the relative centrifugal field and reaction time on the formation of flake-like MnCO3film were investigated.The resultant samples were characterized by scanning electron microscopy (SEM),powder X-ray diffraction (XRD) and IR spectra.The results reveal that lower temperature and higher gravity field are favourable for the formation of flake-like MnCO3film.The optimum condition is in the aqueous solution/ bromobenzene system under 1000/g relative centrifugal field at the temperature of 120℃.The flake-like MnCO3prepared under the conditions is of smooth outside surface and metallic luster.
Hydrothermal method;high gravity;MnCO3;film-like material
10.3969/j.issn.1673-2006.2015.07.027
2015-03-12
安徽省教育厅自然科学研究重点项目“复合纳米阵列结构的合成及其电化学储能性质研究”(KJ2014A201);安徽省教育厅教学研究一般项目“化学师范生教学能力培养的学科教学类模块化课程建设研究”(2014jyxm279);合肥师范学院校级质量工程项目“优化科研管理促进研究生专业成长机制探索研究”(JX201412)。
方璐 (1987-),女,安徽黄山人,硕士研究生,助教,主要研究领域:无机纳米材料。
O611
A
1673-2006(2015)07-0098-05
