臭氧与干旱胁迫对华南地区3种绿化树种荧光生理的影响
2015-06-23李秋静卢广超田茂涛林婧庭
李秋静,卢广超,薛 立,田茂涛,林 敏,林婧庭
(华南农业大学林学院,广东广州510642)
臭氧与干旱胁迫对华南地区3种绿化树种荧光生理的影响
李秋静,卢广超,薛 立,田茂涛,林 敏,林婧庭
(华南农业大学林学院,广东广州510642)
【目的】了解尖叶杜英Elaeocarpusapiculatus、米老排Mytilaria laosensis和藜蒴Castanopsis fissa的抗臭氧和干旱生理机制,为华南地区筛选抗逆树种提供参考.【方法】以3种幼苗为研究对象,进行人工臭氧熏气和干旱处理后,测定其叶绿素荧光参数时间动态.【结果和结论】随着胁迫处理时间的延长最小初始荧光(F0)先升后降,PSⅡ最大光化学效率(Fv/Fm)保持稳定;臭氧胁迫的PSⅡ实际光量子效率Y(Ⅱ)先降后升,其余处理的保持稳定;尖叶杜英的非光化学淬灭(NPQ)保持稳定,其余幼苗的先升后降.主成分分析表明,幼苗抗臭氧胁迫和干旱胁迫的能力为:黎朔>尖叶杜英>米老排,幼苗抗臭氧和干旱交叉胁迫的能力为:尖叶杜英>黎朔>米老排.总体来看,臭氧胁迫和干旱胁迫下,3种幼苗能够启动光保护作用的调节机制,具有一定的抗臭氧或干旱的能力.
绿化树;幼苗;叶绿素荧光参数;臭氧胁迫;干旱胁迫
臭氧(O3)具有强氧化作用[1],当其在地球表面附近时,可通过影响气孔开放,损伤光保护系统,特别是抑制光合系统Ⅱ(PSⅡ)反应中心的活性,下调光化学效率,影响叶绿素荧光参数[2].O3也能改变植物类囊体膜的成分,从而导致叶绿素荧光产量发生变化[3].干旱胁迫抑制植物光合作用,导致光合器官的损伤[4],叶绿素含量减少,叶绿素荧光参数发生变化[5-8].植物长期进化过程中,光合机构形成抵御逆境的生理机制,其中PSⅡ扮演着重要角色[9-10].应用叶绿素荧光动力学可以深入分析环境胁迫对植物PSⅡ等的叶绿素荧光参数的影响,筛选出抗逆能力强的种类.
臭氧和干旱对植物的交互作用不同于二者对植物的单一影响,取决于干旱胁迫的强度、臭氧浓度以及试验时间和环境.二者的交互作用导致了活性氧的过量生产和气孔功能的改变[11].目前有关学者对O3和干旱胁迫下植物荧光生理进行过一些研究.魏晓东等[9]发现,干旱胁迫使银杏叶片PSⅡ最大光化学效率(Fv/Fm)在后期大幅度下降,最终降低光化学活性.曹际玲等[12]发现,O3主要是通过减少最大荧光(Fm)从而导致Fv/Fm下降,即O3胁迫条件下小麦光合作用受到抑制[13].欧立军等[14]通过研究辣椒的PSⅡ最大光化学效率(Fv/Fm)和非光化学猝灭(NPQ)等叶绿素荧光参数,筛选出抗性强的栽培品种.尖叶杜英Elaeocarpus apiculatus、米老排Mytilaria laosensis和藜蒴Castanopsis fissa是我国华南地区重要的园林绿化树种.尽管前人对这些树种的光合生理有零星的研究[15-17],但鲜见臭氧胁迫或干旱胁迫对其荧光生理影响的报道.本文研究臭氧和干旱对尖叶杜英、米老排和藜蒴的叶绿素荧光的影响,探究3种树种对臭氧胁迫和干旱胁迫的适应性,旨在为选择抗臭氧和干旱的绿化植物提供参考.
1 材料与方法
1.1 试验材料
试验于2012年11月15日在华南农业大学林学院进行.试验所用的尖叶杜英、米老排、黎朔幼苗(每种苗木150株)均为1年生营养袋实生苗,营养袋直径12 cm、高10 cm,基质为黄心土.幼苗生长基本情况见表1.
熏气设备采用开顶式熏气室(OTC),横截面为六角形,直径3.0 m、高2.4 m,玻璃室壁;由CFY5制氧机及COM-AD-01臭氧发生器提供O3; GT901-03便携式臭测仪(量程为0~1μL/L,分辨率0.001μL/L)监测臭氧浓度.

表1 幼苗生长基本情况1)Tab.1 General situations of the experim ental seed ling types
1.2 试验方法
每个熏气室内设2个臭氧处理,分别为E40(仅通风不通臭氧,熏气室的臭氧体积分数和大气中自然的臭氧体积分数相同,均约为0.04μL/L)和E150 (臭氧体积分数约为0.15μL/L).每个熏气室设2个水分梯度,即每天正常浇水和2 d浇1次水(D).臭氧和干旱胁迫共组合成4种处理分别为E40(对照)、E150(臭氧胁迫)、E40+D(干旱胁迫)、E150+ D(臭氧与干旱交叉胁迫).通风与布气系统可以满足气室内气体每分钟交换1次以上,使得气室内温度、湿度与CO2浓度等环境因素与外界基本保持一致.将幼苗移入气室适应1周,定期浇水,待土壤水分稳定(2 d浇1次水的幼苗土壤自然含水量约为正常浇水的70%)后开始通气.每天通气时间为09:00—17:00.在0、15和30 d时,分别测定各处理的荧光参数.
1.3 测定指标
叶片叶绿素荧光参数采用脉冲调制荧光仪(OS-1P调制荧光仪,OPTI-SCIENCES,美国)测定.每树种测量3株,每株选择生长一致的3片功能叶片在暗适应20 min后,在非化学淬灭(NPQ)模式下设定每次测量1 min,测量3次,取平均值.测定时间为09:00—11:00.测定内容包括光下最小初始荧光(F0)、最大荧光(Fm)、任意时间实际荧光(F')、光适应下最大荧光(Fm').计算变动荧光值(Fv,Fv= Fm-F0)、PSⅡ最大光化学效率(Fv/Fm)、非光化学淬灭(NPQ,NPQ=Fm/Fm'-1)、PSⅡ实际光量子效率[Y(Ⅱ),Y(Ⅱ)=(Fm'-F')/Fm'].
1.4 数据处理
运用Microsoft Excel 2003软件对数据进行统计分析和作图,运用SAS 9.0软件进行Duncan's多重比较和主成分分析.主成分分析利用极差法对各指标数值进行标准化,标准化公式为:
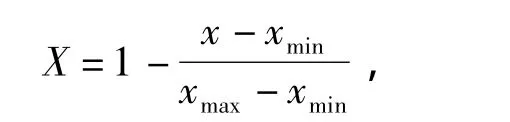
式中,X为标准化后所得数据,x、xmin和xmax分别为某项指标的原始数据、原始数据的最小值和最大值.对标准化后的数据进行主成分分析,计算E40、E150、E40+D、E150+D这4个处理中各种幼苗抗臭氧和干旱指标的得分,按得分多少评定各植物的抗性大小.
2 结果与分析
2.1 臭氧和干旱胁迫下幼苗的最小初始荧光变化
随着臭氧和干旱胁迫时间的延长,3种幼苗的最小初始荧光(F0)变化如图1.E40处理的尖叶杜英幼苗F0随时间持续小幅上升后保持稳定;E150处理的幼苗基本保持稳定,E40+D和E150+D处理的幼苗先升后降,三者30 d时比0 d分别比对照显著下降3%、23%和26%(P<0.05).米老排幼苗各处理的F0随着时间延长先上升后下降,E150、E40+D和E150+D处理的30 d时比0 d分别显著上升16%、33%和25%(P<0.05).藜蒴幼苗4个处理的F0变动趋势与米老排相似,E150、E40+D和E150+ D处理的30 d时分别比0 d显著上升8%、33%和22%(P<0.05).
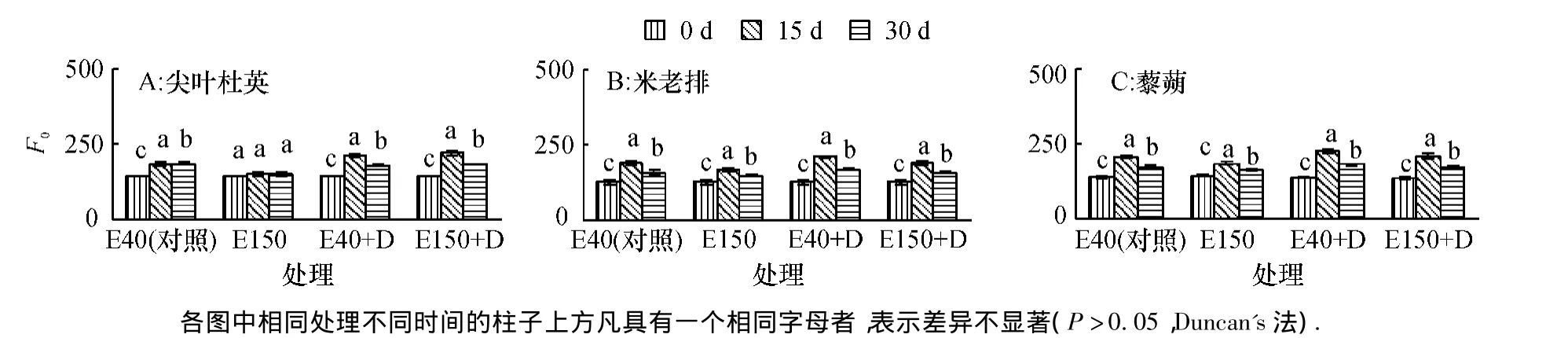
图1 臭氧和干旱胁迫下最小初始荧光(F0)的变化Fig.1 The changes ofminimal initial fluorescence(F0)under O3and drought stress
2.2 臭氧和干旱胁迫下幼苗的最大光化学效率变化
由图2可见,随着时间延长,E40、E150和E40+ D处理的尖叶杜英幼苗的Fv/Fm先升后降;E150+D处理保持稳定.米老排幼苗E40、E40+D和E150+ D处理的Fv/Fm小幅变化,E150处理的下降后小幅上升.藜蒴幼苗4个处理的Fv/Fm随时间持续延长保持稳定,与对照差异不显著.
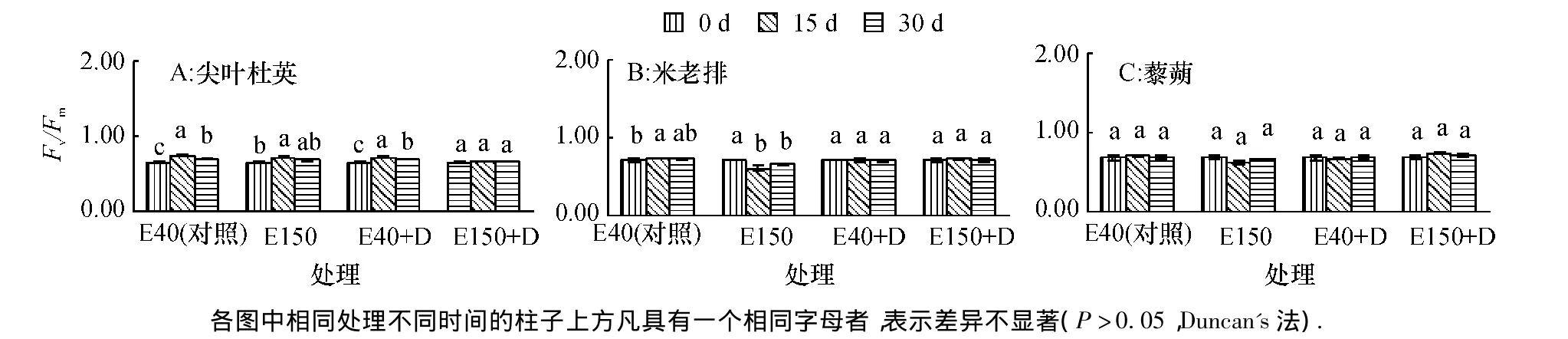
图2 臭氧和干旱胁迫下PSⅡ最大光化学效率(Fv/Fm)的变化Fig.2 The changes of PSⅡmaximum photochemical efficiency(Fv/Fm)under O3and drought stress
2.3 臭氧和干旱胁迫下幼苗的PSⅡ实际光量子效率变化
图3显示,尖叶杜英和米老排幼苗E40、E40+D和E150+D处理的PSⅡ实际光量子效率[Y(Ⅱ)]随时间的持续而小幅变化,E150处理的Y(Ⅱ)显著下降后显著上升(P<0.05).藜蒴幼苗E40和E150处理的Y(Ⅱ)随时间持续而显著下降后显著上升(P<0.05),E40+D和E150+D处理的保持稳定.

图3 臭氧和干旱胁迫下PSⅡ实际光量子效率[Y(Ⅱ)]的变化Fig.3 The changes of PSⅡactive quantum efficiency[Y(Ⅱ)]under O3and drought stress
2.4 臭氧和干旱胁迫下幼苗的非光化学淬灭变化
随时间持续,尖叶杜英幼苗各处理的NPQ小幅变化,米老排幼苗各处理的NPQ显著下降后显著上升,E150、E40+D和E150+D处理的30 d时比0 d分别显著下降16%、14%和5%(P<0.05) (图4).E40和 E150+D处理的藜蒴幼苗的NPQ随时间持续而保持稳定,E150和E40+D处理的显著下降后显著上升(P<0.05),E150和E40+D处理30 d时比0 d分别显著下降14%和12%(P<0.05).
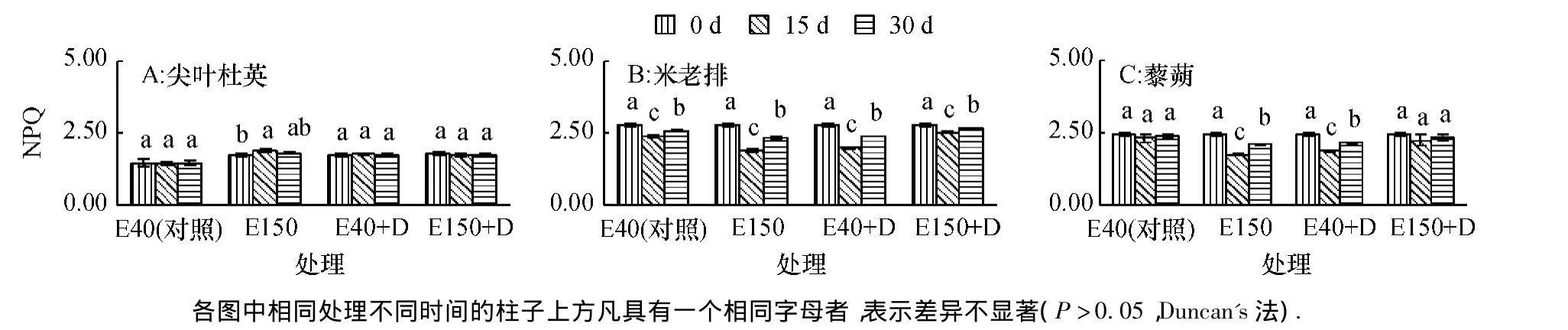
图4 臭氧和干旱胁迫下非光化学淬灭(NPQ)的变化Fig.4 The changes of non-photochemical quenching(NPQ)under O3and drought stress
2.5 幼苗抗臭氧胁迫和干旱胁迫能力的综合评价
臭氧胁迫、干旱胁迫及臭氧与干旱双重胁迫的程度与植物体内的F0、Fm/Fv、Y(Ⅱ)和NPQ等参数受抑制程度显著相关,可作为植物抗逆的指标,但不同抗逆指标表现往往不一致[18].利用主成分分析法可以全面而准确地分析植物各种生理指标的综合抗性.对标准化后的数据进行主成分分析,以累积贡献率达85%以上为参考值,确定主成分个数.由于主成分之间相互独立且有着不同的贡献率,因此,每个主成分得分就是其加权值,其中权重就是主成分对应的贡献率.E40、E150、E40+D处理的幼苗得分为黎朔>尖叶杜英>米老排,表明黎朔抗臭氧或干旱单一胁迫的能力最强,尖叶杜英次之,米老排最弱; E150+D处理的幼苗得分为尖叶杜英>黎朔>米老排,表明尖叶杜英抗臭氧或干旱交叉胁迫的能力最强,黎朔次之,米老排最弱(表2).

表2 3种幼苗抗臭氧和抗旱性综合评价值及排序Tab.2 Comprehensive assessment values and orders of ozone and drought stress resistance of three seedling types
3 讨论与结论
F0是PSⅡ反应中心全部开放时的最小初始荧光水平,其大小主要与PSⅡ天线色素与PSⅡ反应的结构状态及叶绿素浓度有关[19-20].F0降低表明天线色素的热耗散增加,F0上升表明PSⅡ反应中心破坏或可逆失活[19].除了尖叶杜英幼苗的E150处理外,F0随着胁迫处理时间的延长先升后降,可能是幼苗在臭氧胁迫或干旱胁迫15 d时,叶片的PSⅡ反应中心发生可逆失活,胁迫30 d时,启动了光保护作用的调节机制免遭强光的破坏[19-21].
Fv/Fm是暗适应下PSⅡ的最大光化学效率,能反映植物对光能的利用效率.在环境胁迫中Fv/Fm常随胁迫程度加重而降低,所以是反映植物在胁迫条件下光合作用受抑制程度的理想指标[22-23].本研究中,各处理的3种幼苗的Fv/Fm值通常与对照差异不显著,说明其在臭氧或干旱胁迫时幼苗叶片的PSⅡ活性中心没有受损[4,22,24],光对光合机构的伤害轻微,植物发生的光抑制不明显.
Y(Ⅱ)反映植物的实际光合效率,Y(Ⅱ)的下降,表明植物发生光合受阻,氧释放能力降低是受到环境因子的胁迫.E40+D和E150+D处理的3种幼苗的Y(Ⅱ)保持稳定,说明其受干旱胁迫及臭氧和干旱交叉胁迫的影响不明显.E150处理的3种幼苗的Y(Ⅱ)先降后升,表明臭氧胁迫15 d时其实际光合效率的下降,影响了植物对碳的固定和同化[25],臭氧胁迫30 d时实际光合效率的回升,说明在臭氧逆境下的幼苗实际光合效率的下降是可逆的[26-27].
NPQ反映的是PSⅡ吸收的光能中不能用于光合电子传递而以热的形式耗散掉的光能部分[28].热耗散可以防御光抑制带来的破坏,是植物保护PSⅡ免受伤害的重要机制[29].尖叶杜英在各种处理下NPQ保持稳定,说明其抗逆性强,热耗散功能稳定.胁迫15 d时,米老排和藜蒴幼苗的NPQ下降,热耗散较小,能保证吸收的光能最大程度地进入电子传递系统进而进行碳固定[30].胁迫30 d时NPQ显著上升,有利于通过热耗散防御光抑制带来的破坏[31].
3种幼苗的叶绿素荧光参数的变化表明:随着臭氧和干旱胁迫时间的延长,启动了光保护作用的调节机制,使光合系统免遭强光的破坏,出现热耗散增加,PSⅡ反应中心内部吸收的能量流向光化学的部分增加,促进光合电子传递,使PSⅡ的最大光化学效率保持稳定.
[1] CAO JL,ZHU JG,ZENGQ,etal.Research advance in the effect of elevated O3on characteristics of photosynthesis[J].JBiol,2012,29(1):66-70.
[2] 罗克菊,朱建国,刘钢,等.臭氧胁迫对水稻的光合损伤与施氮的缓解作用[J].生态环境学报,2012,21(3): 294-306.
[3] 列淦文,叶龙华,薛立.臭氧胁迫对植物主要生理功能的影响[J].生态学报,2014,34(2):481-488.
[4] 李春霞,曹慧.干旱对苹果属植物叶绿素荧光参数的影响[J].安徽农业科学,2008,36(31):13536-13538.
[5] EKMEKCIY,BOHMSA,THOMSON JA,et al.Photochemical and antioxidant responses in the leaves of Xerophyta viscosa Baker and Digitaria sanguinalis L.,under water deficit[J].Z Naturforsch,2005,60(5/6):435-443.
[6] MOHSENZADEH S,MALBOOBIM A,RAZAVI K,et al.Physiological and molecular responses of Aeluropus lagopoides(Poaceae)to water deficit[J].Environ Exp Bot,2006,56(3):314-322.
[7] NAYYAR H,GUPTA D.Differential sensitivity of C3and C4plants to water deficit stress:Association with oxidative stress and antioxidants[J].Environ Exp Bot,2006,58(1/ 3):106-113.
[8] YANG Y,LIUQ,HANC,etal.Influence ofwater stress and low irradiance on morphological and physiological characteristics of Picea asperata seedlings[J].Photosynthetica,2007,45(4):613-619.
[9] 魏晓东,陈国祥,施大伟,等.干旱胁迫对银杏叶片光合系统Ⅱ荧光特性的影响[J].生态学报,2012,32(23): 7492-7500.
[10]BAKER N R.A possible role for photosystem II in environmental perturbations of photosynthesis[J].Physiol Plant,1991,81(4):563-570.
[11]列淦文,薛立.臭氧与其他环境因子对植物的交互作用[J].生态学杂志,2014,33(6):1678-1687.
[12]曹际玲,朱建国,曾青,等.对流层臭氧浓度升高对植物光合特性影响的研究进展[J].生物学杂志,2012,29 (1):66-70.
[13]FENG Z Z,KOBAYASHIK,AINSWORTH E.Impact of elevated ozone concentration on growth,physiology,and yield ofwheat(Triticum aestivum L.)[J].Global Change Biol,2008,14,2696-2708.
[14]欧立军,陈波,邹学校,等.干旱对辣椒光合作用及相关生理特性的影响[J].生态学报,2012,32(8):2612-2619.
[15]潘文,张卫强,甘先华,等.SO2胁迫对园林植物幼苗光合生理特性的影响[J].中国水土保持科学,2013,11 (1):82-87.
[16]廖凌娟,黎清,陈怡竹,等.海岸带迎风坡环境干扰对造林植物叶片解剖、气孔和水分利用效率的影响[J].植物科学学报,2011,29(5):613-624.
[17]张卫强,曾令海,王明怀.东江中上游主要造林树种光合特性[J].生态环境学报,2011,20(1):51-57.
[18]左胜鹏,叶良涛,马永清.不同生态型化感冬小麦抽穗期的荧光动力学特性[J].中国生态农业学报,2011,19 (2):331-337.
[19]种培芳,李毅,苏世平,等.荒漠植物红砂叶绿素荧光参数日变化及其与环境因子的关系[J].中国沙漠,2010,30(3):539-545.
[20]卢从明,张其德,匡廷云.水分胁迫对小麦光系统Ⅱ的影响[J].植物学报,1994,36(2):93-98.
[21]徐德聪,吕芳德,刘小阳,等.不同品种美国山核桃叶绿素荧光参数日变化的研究[J].激光生物学报,2007,16 (3):259-265.
[22]尹海龙,田长彦.氮调控对盐环境下甜菜功能叶光系统Ⅱ荧光特性的影响[J].植物生态学报,2013,37(2): 122-131.
[23]郝兴宇,韩雪,李萍,等.大气CO2浓度升高对绿豆叶片光合作用及叶绿素荧光参数的影响[J].应用生态学报,2011,22(10):2776-2780.
[24]孙景宽,张文辉,陆兆华,等.干旱胁迫下沙枣和孩儿拳头叶绿素荧光特性研究[J].植物研究,2009,29(2): 216-223.
[25]刘爱荣,陈双臣,王淼博,等.高温胁迫对番茄幼苗光合作用和叶绿素荧光参数的影响[J].西北农业学报,2010,19(5):145-148.
[26]马博英,金松恒,徐礼根,等.低温对三种暖季型草坪草叶绿素荧光特性的影响[J].中国草地学报,2006,28 (1):58-62.
[27]梁芳,郑成淑,孙宪芝,等.低温弱光胁迫及恢复对切花菊光合作用和叶绿素荧光参数的影响[J].应用生态学报,2010,21(1):29-35.
[28]段仁燕,吴甘霖,黄振波.草莓叶绿素荧光参数日变化的研究[J].生物学杂志,2009,26(5):69-70.
[29]邓培雁,刘威,邱元凯,等.宝山堇菜和紫花地丁叶绿素荧光参数的日变化[J].华南师范大学学报:自然科学版,2009,1(2):96-100.
[30]宗梅,谈凯,吴甘霖.两种石楠叶绿素荧光参数日变化的比较研究[J].生物学杂志,2010,27(1):27-30.
[31]卢广超,张柔,叶龙华,等.4种彩叶植物叶绿素荧光参数日变化研究[J].湖南林业科技,2013,40(1):25-28.
【责任编辑 李晓卉】
Effects of ozone and drought on fluorescence physiology of seed lings of three afforestation tree species in South China
LIQiujing,LU Guangchao,XUE Li,TIAN Maotao,LIN Min,LIN Jingting
(College of Forestry,South China Agricultural University,Guangzhou 510642,China)
【Objective】This study was conducted to demonstrate the fluorescent physiology of ozone resistance and drought physiologymechanism in the seedlings of three native tree species and provide reference for screening stress-resistant tree species in South China.【Method】Seedlings of Elaeocarpusapiculatus,Mytilaria laosensis and Castanopsis fissa were treated with ozone fumigation and drought condition,and their chlorophyll fluorescence parameters were determined.【Result and conclusion】The results showed thatwith increasing treatment time,minimal initial fluorescence(F0)of the three seedling types increased and then decreased,and their PSⅡmaximum photochemical efficiency(Fv/Fm)remained stable;active quantum efficiency of PSⅡ[Y(Ⅱ)]treated with ozone stress decreased,followed by an increase and other treatments remained stable;non-photochemical quenching(NPQ)of E.apiculatus seedlings remained stable and other seedling types increased and then decreased.Principal component analyses showed that resistance of the three seedling types to ozone stress and drought stresswas C.fissa>E.apiculatus>M.laosensis,whereas their resistance to intercross stress of ozone and droughtwas E.apiculatus>C.fissa>M.laosensis.In general,the three seedling types have a certain ability to resist ozone or droughtby starting an adjustmentmechanism of photoprotection under ozone stress or drought stress.
afforestation tree;seedling;chlorophyll fluorescence parameter;ozone stress;drought stress
Q945.11
A
1001-411X(2015)01-0091-05
李秋静,卢广超,薛 立,等.臭氧与干旱胁迫对华南地区3种绿化树种荧光生理的影响[J].华南农业大学学报,2015,36(1):91-95.
2013-10-01 优先出版时间:2014-12-02
优先出版网址:http://www.cnki.net/kcms/doi/10.7671/j.issn.1001-411X.2015.01.017.html
李秋静(1990—),女,硕士研究生,E-mail:623638417@qq.com;通信作者:薛 立(1958—),男,教授,博士,E-mail:forxue@scau.edu.cn
广东省林业局资助项目(F09054)
