冷循环射频消融人离体肾癌的实验研究
2015-06-23陈光富王希友刘爱军孙圣坤朱捷陈文政张旭
陈光富 王希友 刘爱军 孙圣坤 朱捷 陈文政 张旭
1中国人民解放军总医院泌尿外科 100853 北京
2中国人民解放军海军总医院泌尿外科
3中国人民解放军总医院病理科
论 著
冷循环射频消融人离体肾癌的实验研究
陈光富1王希友2△刘爱军3孙圣坤1朱捷1陈文政1张旭1
1中国人民解放军总医院泌尿外科 100853 北京
2中国人民解放军海军总医院泌尿外科
3中国人民解放军总医院病理科
目的:探讨射频消融对人离体肾癌消融坏死范围、形态及周围组织的影响,为临床应用提供理论依据。方法:12例行后腹腔镜下肾根治切除术的肾癌患者(肿瘤最大径≤3.2 cm)的肾脏,根据消融的组织及时间设置为四组:5 min正常肾组(A组,12例次)、5 min肾癌组(B组,6例次)、12 min正常肾组(C组,12例次)及12 min肾癌组(D组,6例次)。标本送入病理科后,给予不同时间射频消融,肉眼下观察射频消融时的状态、正常肾组织和肿瘤组织消融坏死范围及集合系统完整性。随后制作病理切片,观察消融组织的病理改变。结果:①射频消融时的组织外表面温度升高,组织皱缩、内陷,并有热气泡顺针道溢出;②正常肾组织射频消融灶的形态为围绕射频针的椭球形,长轴平行射频针,小于3.2 cm肾肿瘤组织消融灶形态为肿瘤原始形状,包膜形成肿瘤和正常肾组织的明显分界;③与C组相比,A组射频消融直径显著减小(P<0.01),B组的消融范围不一致,小于2 cm的肿瘤消融直径为肿瘤最大径,大于2 cm的肿瘤消融直径为2 cm,D组消融直径为肿瘤最大径;④集合系统损伤2例,见于针尖靠近集合系统小于5 mm的肾脏。结论:5 min射频消融对于小于3.2 cm的肿瘤不能保证彻底消融,而12 min射频消融能够完全有效的达到杀灭肿瘤的目的;包膜完整时,形成“高压锅”效应,小于3.2 cm的肿瘤可以任何角度进针;包膜不完整时,手术时尽可能保证射频针与肿瘤的长轴吻合,如为肾脏腹侧、中心部位的肿瘤,腹腔镜辅助射频消融可能更合适;当肿瘤靠近集合系统时,尤其压迫肾盂或肾盏的肿瘤,集合系统可能会受到损伤,可行集合系统冷水灌注保护;消融组织表面温度升高,对于肿瘤毗邻肠道、脾脏等器官时,腹腔镜手术辅助可能更加安全。
射频消融;消融时间;肾癌
外科手术是局限性肾癌的首选治疗方法,然而有较多合并症的患者不适合手术治疗,如心脑血管病、全身麻醉禁忌、肾功能不全、孤立肾等的肾癌患者。因此,肾脏射频消融(radio frequency ablation, RFA)技术应运而生,对于患有早期肾癌的不适合手术的老年患者,RFA是一项新的安全有效的技术方法[1]。因其具有并发症发生率低、恢复期更短、无肾脏缺血损伤等优点,目前临床应用也越来越广泛。但是缺乏体外人肾RFA参数的研究。2012年11月~2013年3月,我们收集后腹腔镜下肾根治性切除术切除的人肾标本行体外RFA,探讨人肾RFA适合参数。
1 资料与方法
1.1 临床资料
12例肾癌患者,男7例 ,女5例,年龄49~73岁,中位年龄61.6岁。12例均经术后病理检查明确诊断,均为透明细胞癌。术前均未进行化疗、肾动脉栓塞等治疗。
1.2 实验材料及仪器
Cool-tipTMRF冷循环超能射频肿瘤治疗系统(美国valleylab公司)、负极板、水、人体外肾及肾脏肿瘤、病理科临床常用的石蜡切片及H-E染色设备及试剂。
1.3 实验方法
收集后腹腔镜下肾根治性切除术切除人肾标本,不固定,即刻送病理科。记录肾脏及肿瘤大小后,将射频电极穿刺入正常肾组织或肿瘤组织(图1),调整肾脏及肿瘤的位置。设5 min正常肾组为A组(12例次),5 min肾癌组为B组(6例次),12 min正常肾组为C组(12例次),12 min肾癌组为D组(6例次)。采用美国Cool-tipTMRF冷循环超能射频肿瘤治疗系统,将单束电极穿刺入正常组织及肿瘤内,根据肿瘤大小插入相应深度,使发射段的中点位于肿瘤中心(图2)。开启冷循环泵及射频发生器,持续将冰水泵入电极的内置管中,设置射频发生器输出功率在150 W左右,使针尖温度保持在16~20℃。射频过程中,观察消融时肾肿瘤的状态,可见肾肿瘤逐渐皱缩、塌陷。单次射频治疗持续5或12 min,关闭冷循环并调节输出功率至190 W左右使针尖温度升至90~100℃,持续10 s使针道碳化止血。结束后,沿针道或垂直针道切开消融组织,肉眼观察变化,测量消融最大直径并记录。病理组织学常规H-E染色,观察镜下变化。

图1 人体外肾射频消融图
1.4 结果判读效果评估
所有标本均行病理学检查。沿电极进针的长轴行冠状位和横断位剖开消融区,观察剖面形态并测量反应区的最大径,记录3次测量的平均值。根据肉眼观察结果,分别取消融灶的中央区,外周区和正常部分连续切取组织,95%乙醇固定后常规H-E染色进行组织细胞学检查,对消融灶病理改变进行比较。病理学检查由同一医师进行。
1.5 统计学处理

2 结果
2.1 肉眼观察
射频消融时的组织外表面温度明显升高,射频针周围组织皱缩、内陷(红色箭头),并有热气泡顺针道排出,其他组织膨胀(图3)。

图2 射频消融前

图3 射频消融后
正常肾组织消融灶呈棕褐色,外围绕有0.2~0.4 cm的淡红色环。A组正常肾脏最大消融直径1.5~2.0(1.792±0.183)cm,C组正常肾脏最大消融直径3.2~3.5(3.383±0.140)cm,与C组相比,A组射频消融范围显著减小(t=23.892,P<0.01)。
肿瘤组织因其内部坏死液变的不同,呈现黄褐色(图4)或黑色(图5)。B组中小于2 cm的肿瘤消融直径为肿瘤最大径,大于2 cm的肿瘤消融直径为2 cm,肿瘤消融后针道周围与肿瘤边缘呈不均一改变,提示有肿瘤组织残留(图4);D组对小于3.2 cm的肿瘤12 min消融后均成均一坏死改变,由于包膜的限制,消融范围为包膜内肿瘤最大径,尖端消融径1.0~1.2 cm。

肿瘤大小为3.1 cm×2.8 cm×2.9 cm,针道周围组织变为棕褐色(蓝色箭头),显示消融彻底,而肿瘤边缘为黄色(红色箭头),表明消融不彻底。
图4 5 min组肿瘤组织
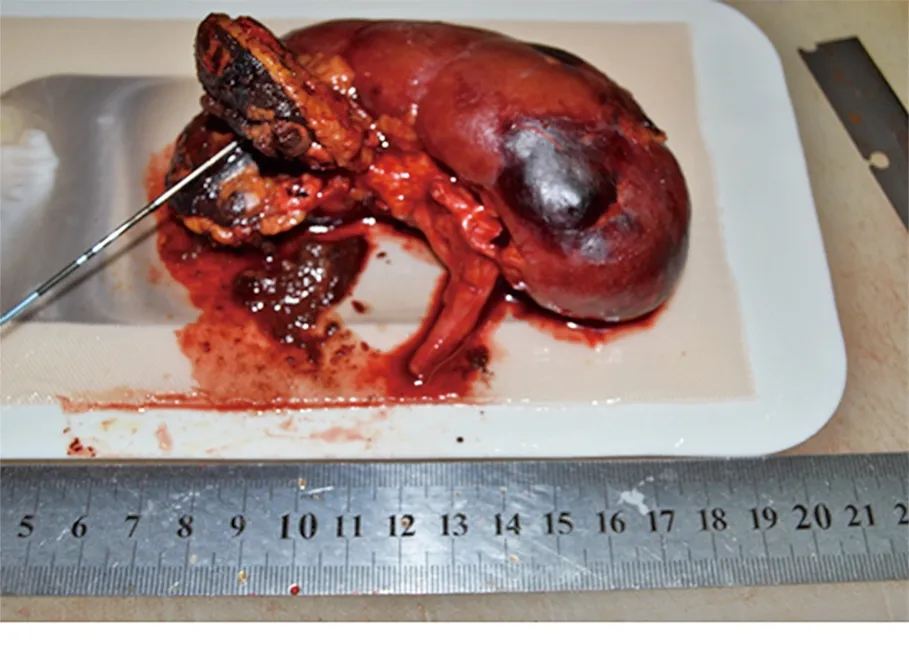
肿瘤大小为3.2 cm×3.0 cm×2.7 cm,整个包膜内肿瘤组织变为黑色,显示消融彻底,而肿瘤边缘未见肿瘤残留。
图5 12 min肿瘤组织
正常肾组织消融灶的形态为围绕射频针的椭球形,长轴平行射频针(图6)。而12 min射频消融最大径<3.2 cm的肿瘤组织射频消融灶的形态为肿瘤的形态(图5,7)。
本资料中集合系统损伤2例,见于针尖距离集合系统小于5 mm的肾脏(图8)。
2.2 病理检查
常规组织H-E染色,消融前癌细胞呈实性巢索状、腺泡状排列,癌细胞体积较大,呈立方形,细胞质为透明状(图9)。消融后癌细胞轮廓不清,细胞质消融、红染、胞核体积缩小、溶解(图10)。
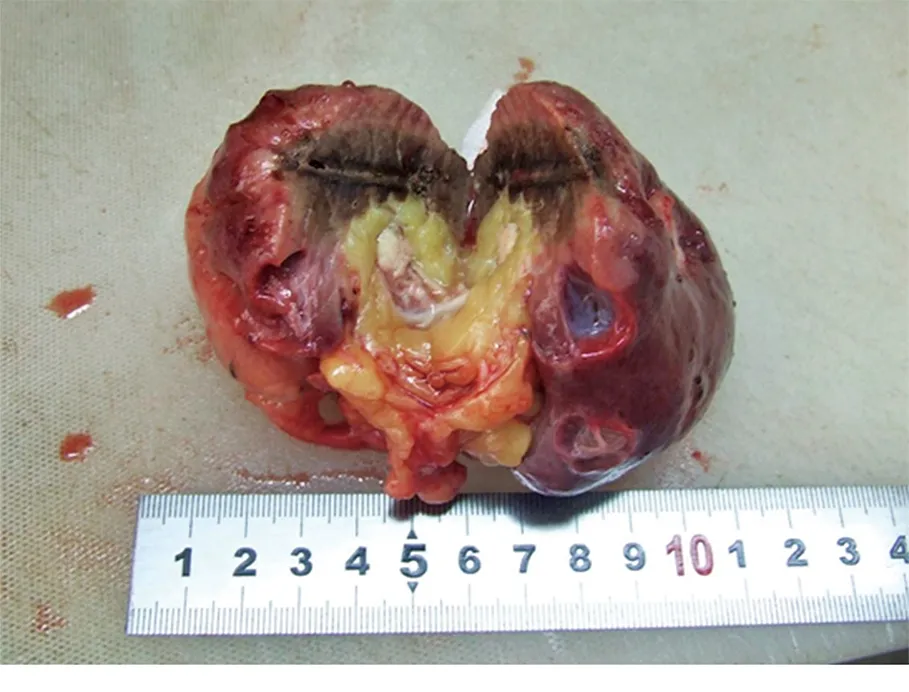
图6 正常组织消融形态
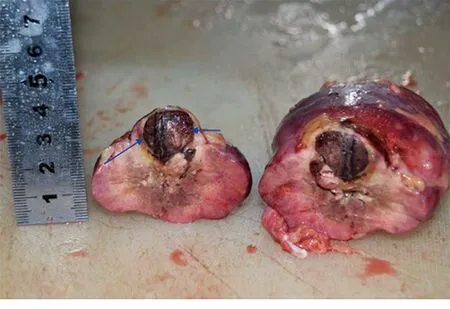
肿瘤大小为2.3 cm×2.0 cm×2.1 cm,整个包膜(蓝色箭头)内肿瘤组织变为黑色,显示消融彻底,而肿瘤边缘未见肿瘤残留。
图7 12 min肿瘤组织
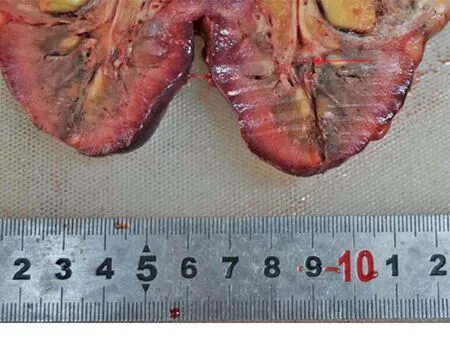
正常肾组织12 min消融,针尖距集合系统小于5 mm,可见集合系统损伤。
图8 集合系统损伤
3 讨论
RFA是一种高温介导的组织坏死,高频率的射频电流使组织细胞分子震荡摩擦产生热量,局部温度可以达到60~100℃,导致蛋白变性、肿瘤组织产生凝固性坏死,最终形成液化灶或者纤维组织。高温还可以使肿瘤周围的微血管和动脉闭塞,防止肿瘤转移[2]同时杀灭的肿瘤细胞作为瘤苗产生抗肿瘤免疫作用[3]。
目前多数RFA研究都是采用动物实验的方式,对于人肾缺乏研究,为取得人肾RFA参数,我们采用后腹腔镜下肾根治性切除术的肾脏进行实验,以期获得人肾RFA参数,为临床应用进一步提供依据。

图9 肿瘤射频消融前(H-E染色, ×400)
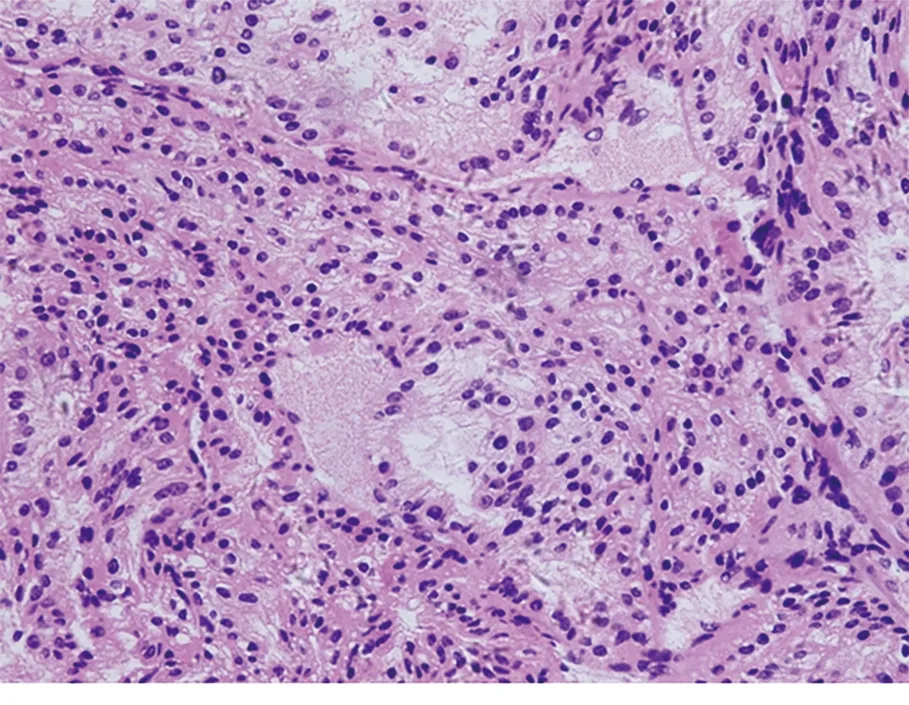
图10 肿瘤射频消融后(H-E染色, ×400)
实验中所用的Cool-tipTM冷循环系统具有如下特点:①射频电极内部形成冷却循环,使工作状态时电极表面温度只有15~25℃,这个温度不可能使电极周围组织结碳,从而使输出能量成倍增加(200 W),大大提高毁损效果(最大可达到7.2 cm);②直针设计易于定位,便于操作;③低温脉冲技术的采用,短时间内能量积累倍增,使治疗时间大大缩短,单次治疗仅需12 min;④手术过程电脑全自动完成,随机软件根据肿瘤组织阻抗值自动调节最佳输出能量,达到最佳治疗效果。
3.1 消融时间与消融范围的关系
Kim等[4]学者报道49例RFA肾肿瘤的患者,他们发现小于3 cm的肿瘤可以通过单针1次消融完全,大于3 cm的肿瘤多消融不完全,需要多次消融。
在本实验中,我们对正常肾组织和肿瘤组织的消融时间与消融范围的关系进行了研究。结果为正常肾组织消融灶呈棕褐色,外围绕有0.2~0.4 cm的淡红色环。A组正常肾脏最大消融横径1.5~2.0 cm,对大于2 cm的肿瘤消融后针道周围与肿瘤边缘呈不均一改变,提示有肿瘤组织残留。这表明对于大于2 cm的肿瘤,5 min消融可能无法达到完全消融的目的。不建议采用5 min时间为射频消融肾肿瘤的标准治疗时间。
实验中我们也对肿瘤组织的消融时间与消融范围的关系进行了研究。结果为C组正常肾脏组织最大消融直径3.2~3.5 cm,D组肿瘤组织因其内部坏死液变的不同,呈现棕褐色或黑色。小于3.2 cm的肿瘤12 min消融后均成均一坏死改变,包膜形成肿瘤和正常肾组织的明显分界。由于包膜的限制,消融范围为包膜内肿瘤最大径。尖端消融范围1.0~1.2 cm。这说明对于小于3.2 cm的肾肿瘤单针12 min射频消融是完全有效的。因此,建议采用12 min时间作为小于3.2 cm的肾肿瘤射频消融的标准治疗时间。
3.2 消融组织表面温度明显升高,应避免对临近组织的损害
实验中,我们观察到RFA人肾脏时组织外表面温度升高,组织皱缩、内陷,并有热气泡顺针道溢出。热损伤既可以消融肿瘤,也能够造成周围毗邻组织损伤的并发症。有学者报道并发症包括:肾周血肿、神经痛、短暂血尿、肾盂输尿管连接部梗阻、尿漏、肠道损伤、大量出血、气胸和肝脏损伤[5]。其并发症主要取决于肿瘤的位置,腹侧外生型肿瘤可能损伤邻近的肠道,曾有1例肾结肠瘘的报道[6]。肿瘤临近腰大肌,热损伤肌肉表面的神经导致肌肉疼痛及感觉功能紊乱[5]。肿瘤临近肋膈角,热损伤导致气胸、血胸和气肿[7~10]。
因此,肿瘤如临近肠道、腰部肌肉神经、肝脏及胸膜等组织器官,为防止周围组织的热损伤,若腹腔镜下游离肾脏,远离上述部位后,RFA是一安全方法。我们曾行后腹腔镜下冷循环RFA治疗肾细胞癌15例手术,术中游离肾脏,移动肾脏位置,远离肠道、血管、腰大肌等组织器官,随访均未发现上述并发症发生[11]。
3.3 正常肾组织射频消融灶的形态
实验中我们对正常肾脏组织的消融形态进行了研究,结果为正常肾组织射频消融灶的形态为围绕射频针的椭球形,针道即长轴。从这个结果角度看,手术时射频针应与肿瘤的长轴吻合,以达到射频消融的椭球形态与肾肿瘤的形态最大化的契合。
实验中我们也对肿瘤组织的消融形态进行了研究,结果为小于3.2 cm肾肿瘤组织12 min消融灶形态为肿瘤原始形状,包膜形成肿瘤和正常肾组织的明显分界。表明包膜可以阻隔热的传导,将热量限制于包膜内的肿瘤组织,形成了“高压锅”的现象。而正常肾组织缺乏包膜结构,形成了射频消融热量传导原理为基础的椭球形的特点。因此,似乎小于3.2 cm的肿瘤无需采用射频针与肿瘤长轴吻合的原则。然而,众所周知,有一部分患者的肾肿瘤包膜是不完整的。如果我们忽视这个特点,这一部分患者可能会发生肿瘤消融不完全致肿瘤残留的结果 ,这样就达不到彻底杀灭肿瘤的目的。而且,为了完全消融残留肿瘤采用二次消融,则会增加肾脏的损伤,未达到最大限度保护肾功能的目的。因此,临床上仍应规划好穿刺进针的角度,保证射频针与肾肿瘤长轴吻合。从这个原则来看,对于肾脏腹侧、中心性生长肿瘤,经皮穿刺射频消融可能不合适,而腹腔镜下游离肾脏,通过调整肾脏位置辅助射频消融可能更合适。
3.4 集合系统损伤
来自射频电极的热能可以破坏任何近端肾集合系统,近端输尿管是最常受伤的肾脏集合系统部分。有学者认为,5 mm以上的脂肪可以防止肠道热损伤[5],我们的观察结果也提示,大于5 mm的脂肪间隔的肾脏消融均未出现集合系统损伤,射频消融术后肾脏集合系统损伤的2例的针尖距离集合系统<5 mm。RFA导致输尿管狭窄和肾盂积水(必需放置支架)、尿性囊肿及皮肤瘘已有报道[6,8,9,12]。因此,临床上射频消融时应注意保护集合系统,尤其是内生型肿瘤压迫肾盂或肾盏的患者。目前,通过提前放置输尿管导管逆行冷水灌注保护集合系统的方法简单可靠。
综上所述,我们认为5 min射频消融对于大于2.0 cm的肿瘤不能保证彻底消融,而12 min射频消融能够完全有效的达到杀灭小于3.2 cm肿瘤的目的;包膜完整时,形成“高压锅”效应,小于3.2cm的肿瘤可以任何角度进针;包膜不完整时,手术时尽可能保证射频针与肿瘤的长轴吻合,如为肾脏腹侧、中心部位的肿瘤,腹腔镜辅助射频消融可能更合适;当肿瘤靠近集合系统时,尤其压迫肾盂或肾盏的肿瘤,集合系统可能会受到损伤,可行集合系统冷水灌注保护;消融组织表面温度升高,对于毗邻肠道、脾脏等器官时,腹腔镜手术辅助可能更加安全。
[1]Zagoria RJ, Pettus JA, Rogers M, et al. Long-term outcomes after percutaneous radiofrequency ablation for renal cell carcinoma. Urology, 2011, 77(6):1393-1397.
[2]Gill IS, Hsu TH, Fox RL, et al. Laparoscopic and percutaneous radiofrequency ablation of the kidney: acute and chronic porcine study. Urology, 2000,56(2):197-201.
[3]黄皎琳.高温-固化瘤苗研究新进展.中国肿瘤临床,1997,24(1):27-31.
[4]Kim JH, Kim TH, Kim SD, et al. Radio frequency ablation of renal tumors:our experience. Korean J Urol, 2011,52 (8):531-537.
[5]Rhim H, Dodd GD 3rd, Chintapalli KN,et al. Radiofrequency thermal ablation of abdominal tumors: lessons learned from complications. Radiographics, 2004,24(1):41-52.
[6]Hui GC, Tuncali K, Tatli S, et al. Comparison of percutaneous and surgical approaches to renal tumor ablation: meta analysis of effectiveness and complication rates. J Vasc Interv Radiol, 2008,19(9):1311-1320.
[7]Zagoria RJ. Imaging-guided radiofrequency ablation of renalmasses. Radiographics, 2004,24(Suppl 1):S59-S71.
[8]Breen DJ, Rutherford EE, Stedman B, et al. Management of renal tumors by image-guided radiofrequency ablation:experience in 105 tumors. Cardiovasc Intervent Radiol, 2007,30(5):936-942.
[9]Dib RE, Touma NJ, Kapoor A. Review of the efficacy and safety of radiofrequency ablation for the treatment of small renal masses. Can Urol Assoc J, 2009,3(2):143-149.
[10]Clark TW, Malkowicz B, Stavropoulos SW, et al. Radiofrequency ablation of small renal cell carcinomas using multitined expandable electrodes: preliminary experience. J Vasc Interv Radiol, 2006,17(3):513-519.
[11]陈光富,郑涛,马鑫,等.后腹腔镜冷循环射频消融治疗肾细胞癌.临床泌尿外科杂志,2012,27(10):728-730.
[12]Gervais DA, McGovern FJ, Arellano RS, et al. Radiofrequency ablation of renal cell carcinoma:part 1, Indications, results, and role in patient management over a 6-year period and ablation of 100 tumors. AJR Am J Roentgenol, 2005,185(1):64-71.
Cool-tip radiofrequency ablation for renal cell carcinoma in vitro
ChenGuangfu1WangXiyou2LiuAijun3SunShengkun1ZhuJie1ChenWenzheng1ZhangXu1
(1Department of Urology, Chinese People's Liberation Army General Hospital, Beijing 100853, China;2Department of Urology, The Navy General Hospital of the Chinese People's Liberation Army;3Department of Pathology, The General Hospital of the Chinese People's Liberation Army)
Chen Guangfu, cgf-301@qq.com
Objective: To investigate the influence of radiofrequency ablation on the ablation necrosis range, form and surrounding tissue of human vitro kidney carcinoma, in order to provide theoretical basis for clinical application. Methods: 12 cases of kidney of renal cell carcinoma patients by laparoscopic retroperitoneal radical nephrectomy(the maximum diameter of tumor ≤3.2 cm), which were randomly divided into 5 min normal kidney group (group A, 12 cases / times), 5 min renal carcinoma group (group B, 6 cases / times), 12 min normal kidney group (group C, 12 cases) and 12 min renal carcinoma group (group D, 6 cases / times). After the specimens being sent to Pathology Department, we gave them radiofrequency ablations for different time, observed the state during radiofre quency ablation, ablation necrosis range of normal kidney tissue and tumor tissue and the integrity of collection system by macroscopic observation. Then made the pathological slices and observed the pathological changes of the ablation issue. Results: ①The outer surface temperature of the tissue rises during radiofrequency ablation, tissue shrinks, sinks, and there are hot bubbles overflowing along the needle track; ②The patterns of normal kidney tissue radiofrequency ablation lesion is the ellipsoidal around RF needle, long axis parallels to RF needle, the kidney tumor tissue ablation lesion less than 3.2 cm is the original shape of tumor morphology, the capsule formation obvious boundary of tumor and normal kidney tissue; ③Compared with group C, radiofrequency ablation range of group A decreased significantly (P<0.01). The ablation range of group B is not consistent, less than 2 cm in diameter of tumor ablation maximum tumor diameter, tumor ablation diameter greater than 2 cm, the ablation diameter of group D is the maximal tumor diameter; ④There are 2 cases of collection system injury, which are observed in the kidney of needle tip close to collection system of less than 5 mm. Conclusions: 5 minutes of radiofrequency ablation cannot ensure completely ablate the tumors wich are less than 3.2 cm, 12 minutes of ablation is suitable for the tumor with the maximum diameter of less than 3.2 cm; when complete capsule, forming the "pressure cooker" effect, less than 3.2 cm of the tumors can be any angle needle; when incomplete capsule, ensure the RF needle and tumor axis overlap as far as possible, such as renal ventral or central tumor, laparoscopic radiofrequency ablation may be more appropriate; when the tumor is close to collection system, it may be damaged, the collection system cold perfusion can be used to protect it; if the tumor is adjacent to the organs such as bowel, spleen, laparoscopic surgery may be safer.
radiofrequency ablation; laparoscopy; renal cell carcinoma
陈光富,cgf-301@qq.com
2015-01-20
2012年度国家自然科学基金面上项目(81171971)
R737.11
A
2095-5146(2015)02-065-06
△并列第一作者
