罗格列酮对自发性高血压大鼠海马区MCP-1、COX-2、NF-κB表达的影响及其机制
2015-06-23李雅丽张巧俊袁海峰高登峰牛小麟
李雅丽,张巧俊,袁海峰,高登峰,牛小麟,罗 昆
(西安交通大学医学部第二附属医院:1.脑病科;2.心血管内科,陕西西安 710004;3.西安市儿童医院,陕西西安 710003)
罗格列酮对自发性高血压大鼠海马区MCP-1、COX-2、NF-κB表达的影响及其机制
李雅丽1,张巧俊1,袁海峰1,高登峰2,牛小麟2,罗 昆3
(西安交通大学医学部第二附属医院:1.脑病科;2.心血管内科,陕西西安 710004;3.西安市儿童医院,陕西西安 710003)
目的 观察64周龄自发性高血压大鼠(SHR)海马区炎症相关因子COX-2(环氧合酶-2)、MCP-1(单核细胞趋化蛋白-1)、NE-κB(核转录因子-κB)、PPAR-γ(过氧化物酶体增殖激活受体-γ)的表达水平,海马CA1区神经元改变及罗格列酮对上述指标的影响,探讨高血压脑损伤过程中的炎症反应机制及PPAR-γ激动剂在高血压脑损伤中的作用及相关机制。方法 雄性56周SHR及威斯塔京都大鼠(WKY)各10只,随机分为2组,对照组(生理盐水2 mL/d灌胃)和Ros组[罗格列酮5 mg/(kg·d)溶于2 m L生理盐水中灌胃],每组各5只,各组给药8周,至64周龄时处死取脑。采用尼氏染色法观察各组海马CA1区神经元损伤情况,Real-time PCR法检测海马COX-2、MCP-1 m RNA表达水平,Western blot法检测NE-κB、PPAR-γ蛋白表达水平。结果 64周龄SHR大鼠海马区PPAR-γ蛋白表达降低,NE-κB活化(P<0.05),MCP-1及COX-2表达升高(P<0.05),海马CA1区神经元减少(P<0.05),罗格列酮通过升高PPAR-γ表达,降低NE-κB、MCP-1及COX-2表达,逆转了SHR大鼠海马CA1区神经元损伤。结论 SHR海马CA1区神经元丢失明显,NE-κB、MCP-1、COX-2等炎症因子表达升高可能参与了高血压神经元损伤的病理过程,罗格列酮可通过活化PPAR-γ通路发挥抗炎及神经保护作用。
自发性高血压大鼠;MCP-1;COX-2;NE-κB;PPAR-γ
高血压引起的长期慢性缺血缺氧可诱导神经元凋亡,累及海马、皮质等与学习、记忆密切相关的脑区,是脑认知功能下降的主要危险因素。近年来,研究显示炎症在高血压靶器官损伤过程中发挥重要作用。我们前期研究证实,随增龄自发性高血压大鼠(spontaneously hypertensive rats,SHRs)脑内海马区存在炎症活化及神经元凋亡情况,但其机制尚不明确。罗格列酮是一种高选择性过氧化物酶体增殖激活受体-γ(peroxisome proliferator-activated receptorγ,PPAR-γ)激动剂,在缺血性脑损伤动物模型中,通过抗炎、抗氧化应激作用发挥神经保护作用。罗格列酮是否可通过活化PPAR-γ通路对SHR脑组织发挥神经保护作用?炎症通路在其中有何作用?通过探讨罗格列酮的神经保护作用及机制,将为PPARγ激动剂治疗高血压认知功能障碍提供理论依据。
1 材料与方法
1.1 实验动物及分组健康雄性56周SHR大鼠和威斯塔京都大鼠(WKY)各10只,均购自上海SLAC实验动物中心,随机分为对照组(生理盐水2 m L/d灌胃)和Ros组[罗格列酮5 mg/(kg·d)溶于2 mL生理盐水中灌胃],每组5只,共给药8周,标准环境下饲养,室温20~25℃,24 h昼夜循环光照,自由摄食饮水,到达相应周龄时,尾动脉测压后处死取脑。
1.2 试剂B-巯基乙醇、TEMED购于Sigma公司;Sample protectors、RNAiso、PrimeScript RT Master Mix、SYBR Premix Ex TaqTMⅡ均购自Ta KaRa公司。NE-κB兔抗大鼠、β-actin小鼠抗大鼠多克隆抗体均购自Bioworlde公司;辣根过氧化物酶标记的山羊抗兔IgG二抗、山羊抗小鼠二抗及ECL试剂盒(Amersham公司)。
1.3 方法
1.3.1 大鼠尾动脉测压 大鼠在正式实验前,进行为期1周的尾动脉测压预适应,然后将Tail-cuff压力换能器与多导生理记录仪相连,调整标压,将Tailcuff压力换能器缠绕于待测大鼠尾根部,充气后测量各组大鼠尾动脉收缩压。
1.3.2 标本收集及测定 各组大鼠达相应周龄尾动脉测压后,腹腔注射100 g/L水合氯醛(500 mg/kg),麻醉后处死,冰上剥离鼠脑。用预冷的生理盐水洗净表面血液并吸干残留水分后,一部分贮存在标本保护液(sample protector,Ta KaRa),液氮中保存以便进行Real-time PCR及Western blot检测。另一部分迅速贮存在预冷的新鲜40 g/L多聚甲醛中,4℃过夜,石蜡包埋,用于甲苯胺蓝染色检测。
1.3.3 甲苯胺蓝染色 切片经二甲苯Ⅰ、Ⅱ和梯度酒精脱蜡入水,甲苯胺蓝染色10 min,700 m L/L乙醇分色,梯度酒精脱水,二甲苯透明后,中性树胶封片,显微镜下观察并拍照。观察每只大鼠海马CA1区神经元数量,每个大鼠3张切片,选取层面为前囟后3.72~3.96 mm,40倍目镜下随机取5个视野,图像分析仪(Q550CW,德国莱卡公司)计数单位面积神经元数量。
1.3.4 Real-time EQ-PCR分析 Trizol法提取各组大鼠海马区总RNA,PrimeScript RT Master Mix盒子(Ta KaRa)反转录成cDNA。用SYBR Premix Ex TaqTMⅡKit(Ta KaRa)进行Real-time EQ-PCR实验。MCP-1(上游序列:5'-CTATGCAGGTCTCTGTCACGCTTC-3',下游序列:5'-CAGCCGACTCATTGGGATCA-3')、COX-2(上游序列:5'-CGGAGGAGAAGTGGGGTTT-3',下游序列:5'-GTTGATGGTGGCTGTCTTGG-3')和β-actin(上游序列:5'-GGAGATTACTGCCCTGGCTCCTA-3',下游序列:5'-GACTCATCGTACTCCTGCTTGCTG-3'),序列均由Ta KaRa公司设计并合成。在iQ Multicolor Real-Time PCR detection system(Bio-Rad,Hercules,CA)仪器进行Real-time EQ-PCR实验。每个基因的m RNA水平都用其β-actin m RNA水平来调整。Ct值由Bio-Rad iQ5 2.0标准Edition optical系统软件获得,并用2-△△Ct法分析。每组3个样,进行3次独立实验。
1.3.5 Western blot 从Sample protector里取出海马组织后提取蛋白质,BCA测试盒测定各组蛋白质浓度,并调整一致,蛋白变性后制取120 g/L琼脂糖凝胶,各组等量上样进行电泳,电泳完毕后,将蛋白转移到NC膜上。100 g/L脱脂奶粉封闭,加入兔抗大鼠NE-κB(1∶1 000,Bioworld)或兔抗大鼠PPAR-γ(1∶1 000,Bioworld)及小鼠抗大鼠β-actin(1∶1 000,Bioworld)多克隆抗体,4℃过夜。TBST洗涤3次后,加入辣根过氧化物酶标记的二抗(羊抗兔或羊抗小鼠IgG)孵育,ECL化学发光法发光,X光片记录结果。蛋白条带进行相对密度扫描并分析。
1.4 统计学处理实验数据以均数±标准差(±s)表示,SPSS16.0统计软件进行分析,用析因分析的方差分析检测种族与给药与否两因素对各指标的交互效应及主效应,然后对主效 应显著的变量采用单因素方差分析(One-way ANOVA)进行LSD组间检验,方差分析前均先进行检验方差齐性及正态性分布,P<0.05表示差异有统计学意义。
2 结 果
2.1 各组大鼠血压监测情况的比较结果显示,SHR组SBP较WKY对照组明显升高(P<0.01)。SHR Ros组较SHR组无明显差异(P>0.05)。WKY对照组和Ros组差异无统计学意义(P>0.05,表1)。统计结果显示,种族与给药与否对于SBP结果无交互作用,种族对SBP水平有显著影响,给药与否对SBP水平无显著影响。
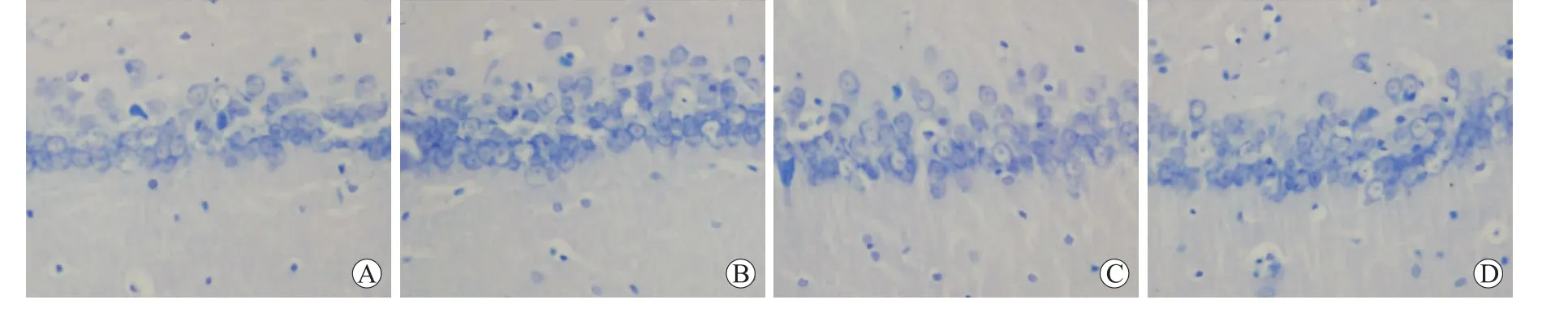
图1 各组海马CA1区尼氏小体的组织形态学变化Eig.1 Nissl's staining of CA1 subfield of the hippocampus in different groups(×400)
表1 各组大鼠血压监测情况的比较Tab.1 Comparison of blood pressure in different groups(±s,mm Hg)
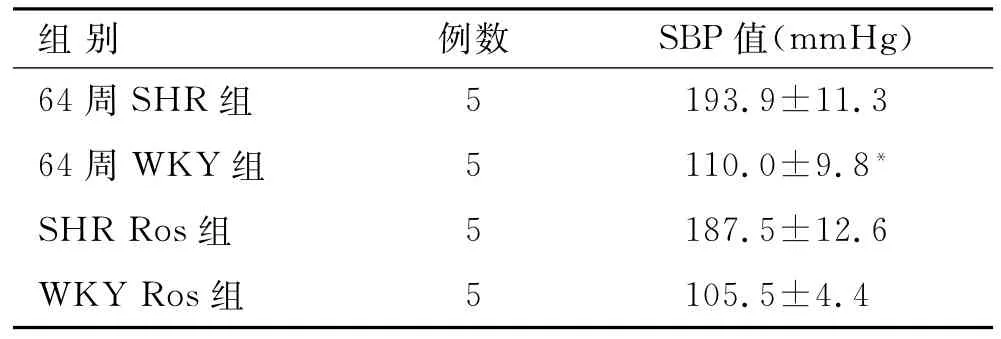
表1 各组大鼠血压监测情况的比较Tab.1 Comparison of blood pressure in different groups(±s,mm Hg)
与64周SHR组比较,*P<0.01。
组别例数SBP值(mm Hg)64周SHR组193.9±11.3 64周WKY组5 110.0±9.8*SHR Ros组5 187.5±12.6 WKY Ros组5 5 105.5±4.4
2.2 各组海马CA1区尼氏小体的组织形态学变化高倍镜下观察,WKY组大鼠海马CA1区神经元胞核着色不明显,核内有1~3个深蓝色核仁,胞质内可见蓝色的颗粒状物质,即为尼氏小体。由图中可以观察到,WKY组海马CA1区神经元胞质内尼氏小体数量多、染色深,SHR组尼氏小体数量减少、染色变淡,提示其神经元存在损伤,SHR Ros组神经元数量和形态处于SHR组及WKY组之间(图1)。
比较各组大鼠海马CA1区单位面积的神经元数目,可以观察到,SHR组单位面积神经元数目较WKY对照组明显减少(P<0.01),SHR Ros组较SHR组神经元数目增多,差异有统计学意义(P<0.05)。而WKY对照组与Ros组两组之间神经元数目无明显变化(图2)。
2.3 各组海马区COX-2、MCP-1 mRNA表达水平的比较各组大鼠海马组织中MCP-1、COX-2 m RNA表达水平如图3所示:SHR组COX-2、MCP-1 m RNA水平显著高于WKY组(P<0.01),罗格列酮治疗后SHR组的COX-2、MCP-1 mRNA水平明显降低(分别为P<0.05,P<0.01),其中COX-2 m RNA表达较WKY对照组仍有差异(P<0.01)。WKY对照组和Ros组两组之间COX-2、MCP-1 m RNA表达无差异(P>0.05)。
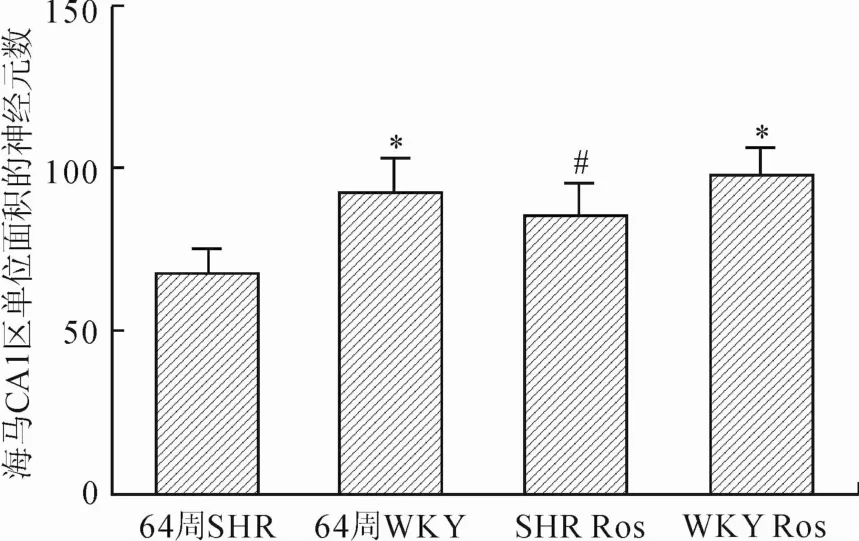
图2 各组大鼠海马CA1区单位面积的神经元数目的比较Eig.2 Comparison of the number of neurons in CA1 subfield of the hippocampus in different groups

图3 各组大鼠海马组织中COX-2、MCP-1 mRNA表达水平的比较Eig.3 Comparison of COX-2 and MCP-1 m RNA expressions in the hippocampus of different groups
2.4 各组海马区NF-κB、PPAR-γ蛋白表达水平的比较如图4所示,与WKY组相比,SHR组的NE-κB蛋白表达水平明显升高(P<0.01),PPAR-γ蛋白表达水平明显降低(P<0.01),罗格列酮明显升高了SHR组脑内代偿不足的PPAR-γ蛋白表达水平(P<0.01),降低SHR组升高的NE-κB蛋白表达水平(P<0.01)。WKY对照组和药物组之间NE-κB、PPAR-γ蛋白表达水平无明显差异(P>0.05)。
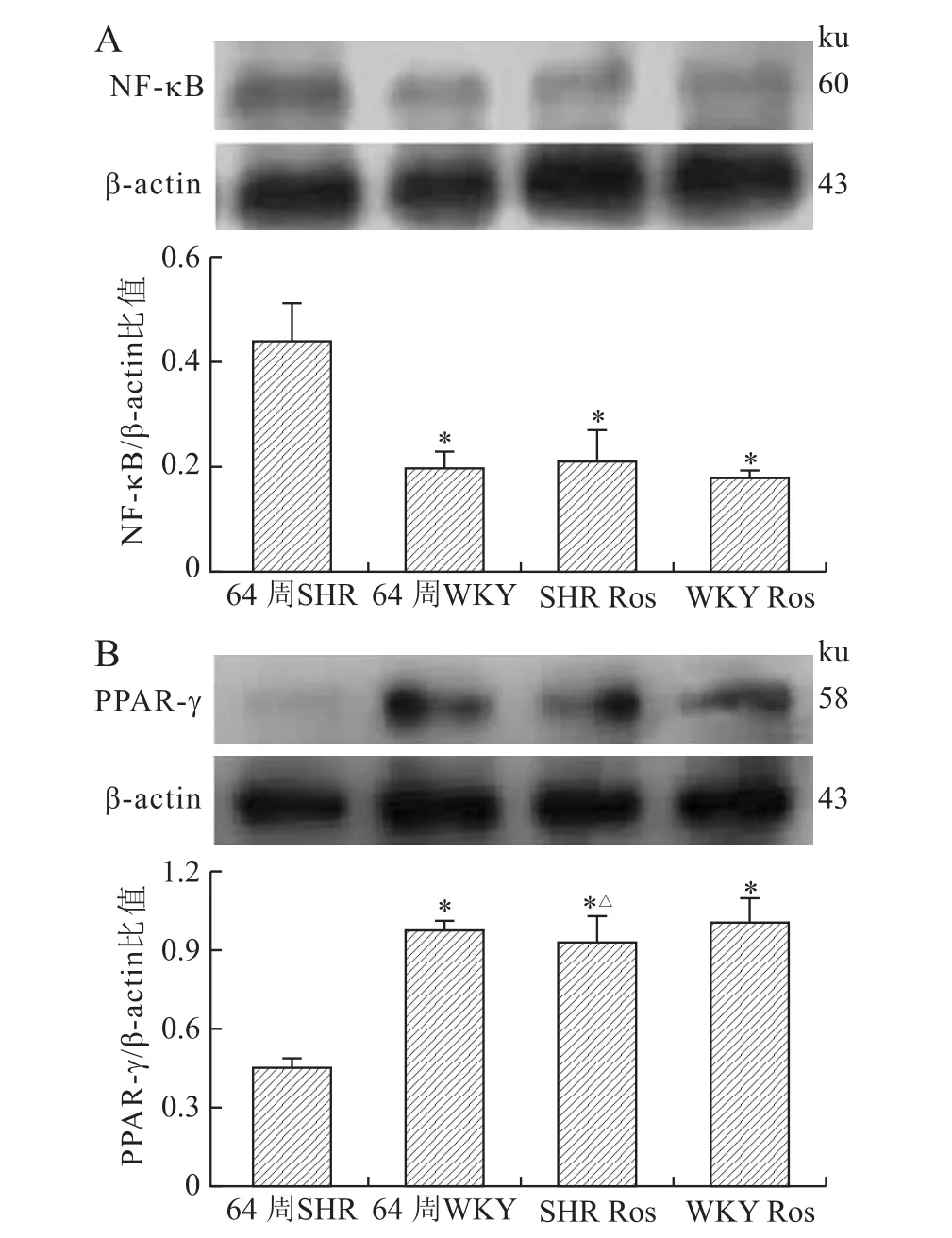
图4 各组大鼠海马组织中NF-κB、PPAR-γ蛋白表达水平的比较Eig.4 The protein expressions of NE-κB(A)and PPAR-γ(B)in the hippocampus of different groups
3 讨 论
卒中前高血压脑损伤的病理机制为长期慢性缺血、缺氧所致的神经元凋亡,主要累及海马、皮质等与学习、记忆密切相关的脑区,临床表现为认知功能障碍。高血压诱导过量的活性氧产物(reactive oxygen species,ROS)生成,活化NE-κB并诱导炎症反应,这可能是高血压进展过程中的早期事件[1]。COX-2和MCP-1为NE-κB的下游炎症反应指标。前期研究中我们发现,随增龄,SHR海马区NE-κB激活,COX-2、MCP-1表达升高,神经元凋亡增多[2],但其机制仍不明确。本研究证实,高血压脑内存在PPARγ表达显著下调,罗格列酮可通过上调PPAR-γ改善SHR脑内炎症反应,保护神经元细胞。
SHR是用于评估高血压脑损伤及治疗最常用的高血压动物模型。高血压脑损伤主要累及额枕叶皮质、海马等脑区,导致神经元丢失范围扩大。尼氏小体是存在于神经元中的一种嗜碱性物质,主要功能是合成蛋白质,对病理反应非常敏感,在炎症、变性、中毒等情况下,可发生溶解、消失,表现为数量减少、染色变淡,故被作为评价神经元功能的重要指标。本研究观察到WKY大鼠海马CA1区神经元胞浆内尼氏小体数量多、染色深,SHR组尼氏小体数量减少、染色变淡,SHR ROS组神经元数目及形态介于两者之间。提示高血压海马CA1区神经元损伤明显,罗格列酮治疗可改善神经元损伤,发挥神经保护作用。
COX-2是合成前列腺素过程中的限速酶,正常情况下低水平表达于皮质、海马、杏仁核、下丘脑和脊髓等部位的神经元,多种病理信号能诱导COX-2基因过度表达,通过炎症反应参与组织损伤。本研究观察到SHR脑内COX-2表达显著升高,提示其在高血压脑损伤中发挥重要作用。这与以往有关COX-2与SHR脑缺血损伤关系的研究结果一致。COX-2表达上调参与了SHR脑缺血损伤过程[3]。脑缺血后腹腔注射COX-2抑制剂可减少脑梗死的体积和神经功能缺失[4]。MCP-1是由多种细胞分泌的趋化因子,可趋化、激活炎症细胞,使其合成、释放大量炎症介质,引发组织受损。近年来发现,MCP-1表达与高血压密切相关[5],其升高可能参与了高血压靶器官损伤。研究发现,SHR的心、肾、胸主动脉等靶器官组织及外周血中MCP-1表达均较WKY大鼠显著升高,且药物抑制MCP-1表达可对靶器官发挥明显保护作用[6]。本研究观察到SHR组COX-2、MCP-1表达显著升高,提示高血压脑内炎症反应增强,这可能是SHR大鼠海马CA1区神经元减少的分子生物学基础。罗格列酮可降低海马区MCP-1、COX-2表达,提示罗格列酮可能通过抗炎作用发挥神经保护作用。
NE-κB是一种与炎症反应相关的信号调控因子[7]。多种炎症介质如COX-2、MCP-1、IL-6、TNE-α的基因启动子上均有NE-κB的结合位点,当NE-κB与之结合后,基因被激活开始转录表达[8]。RODRIGUEZ-ITURBE等发现SHR体内NE-κB蛋白水平升高,多种组织内有明显炎症细胞浸润,腹膜注射NE-κB抑制剂可降低NE-κB蛋白水平,减轻组织炎症[9]。与我们之前的发现一致,SHR脑内NE-κB与COX-2、MCP-1表达水平同步上调,提示NE-κB可能对COX-2、MCP-1表达有调控作用,表达上调的NE-κB可能与COX-2和MCP-1的基因启动子结合,使COX-2和MCP-1基因激活后,转录水平上调。本研究中SHR ROS组NE-κB表达水平较SHR组明显降低,同时伴COX-2、MCP-1表达下调,这一结果也支持NE-κB可能对COX-2、MCP-1具有调控作用这一观点。
已有研究显示,PPAR-γ能通过竞争抑制炎症信号通路发挥抗炎作用,NE-κB是其中一条重要的炎症信号通路。PPAR-γ可直接与NE-κB基因结合,形成转录抑制复合物,下调NE-κB表达水平,抑制其下游炎症介质的生成[10]。动物实验表明PPAR-γ激动剂可通过激活PPAR-γ,下调炎症因子,改善缺血性脑损伤动物模型的神经功能[11]。细胞实验证实,PPAR-γ激动剂可下调体外CNS来源细胞炎症相关因子的表达水平[12]。本研究发现罗格列酮可升高PPAR-γ表达水平,降低NE-κB及炎症因子COX-2、MCP-1的表达,可能是其作为PPARγ激动剂上调脑内代偿不足的PPARγ表达,通过下调NE-κB表达水平,降低COX-2、MCP-1表达,发挥其对脑组织的保护作用。另外,本研究还观察到罗格列酮对WKY大鼠海马组织中COX-2、MCP-1及NE-κB的表达无影响,提示其对血压正常脑组织中炎症相关因子的基础表达无下调作用。
总之,在高血压脑损伤中炎症介质COX-2、MCP-1发挥着重要作用,NE-κB可能对COX-2和MCP-1的表达起调控作用,有可能成为治疗高血压脑损伤新的干预靶点。罗格列酮可能通过上调PPAR-γ表达,下调NE-κB及COX-2、MCP-1的表达,抑制高血压脑组织中的炎症反应,发挥脑保护作用,故PPARγ激动剂可能在高血压脑损伤的治疗中具有潜在的临床应用价值。
[1]KOENERS MP,BRAAM B,JOLESJA.Perinatal inhibition of NF-kappaB has long-term antihypertensive effects in spontaneously hypertensive rats[J].J Hypertens,2011,29:1160-1166.
[2]李雅丽,张巧俊,袁海峰,等.自发性高血压大鼠海马区MCP-1、COX-2、NF-k B表达及神经元损伤的增龄性变化[J].西安交通大学学报:医学版,2014,35(4):437-441.
[3]PEREZ-GIRON JV,MARTIN A,HERNANZ R,et al.Pioglitazone reduces angiotensin II-induced COX-2 expression through inhibition of ROS production and ET-1 transcription in vascular cells from spontaneously hypertensive rats[J].Am J Physiol Heart Circ Physiol,2014,306(11):H1582-1593.
[4]CANDELARIO-JALIL E,GONZALEZ-FALCON A,GARCIA-CABRERA M,et al.Wide therapeutic time window for nimesulide neuroprotection in a model of transient focal cerebral ischemia in the rat[J].Brain Res,2004,1007(1-2):98-108.
[5]何军,陈仪,肖恒怡,等.醋柳黄酮对自发性高血压大鼠主动脉内MCP-1表达的影响[J].四川大学学报:医学版,2009,40(3):481-485.
[6]徐梦丹,戴秋艳,孙宝贵.氯沙坦和替米沙坦保护靶器官与抑制单核细胞趋化蛋白-1及受体-2表达有关[J].中华高血压杂志,2007,15(9):735-740.
[7]VERSTREPEN L,BEYAERT R.Receptor proximal kinases in NF-κB signaling as potential therapeutic targets in cancer and inflammation[J].Biochem Pharmacol,2014,92(4):519-529.
[8]HAYDEN MS,GHOSH S.Regulation of NF-κB by TNF family cytokines[J].Semin Immunol,2014,26(3):253-266.
[9]RODRIGUEZ-ITURBE B,FERREBUZ A,VANEGAS V,et al.Early and sustained inhibition of nuclear factor-kappaB prevents hypertension in spontaneously hypertensive rats[J].J Pharmacol Exp Ther,2005,315:51-57.
[10]USUDA D,KANDA T.Peroxisome proliferator-activated receptors for hypertension[J].World J Cardiol,2014,26,6(8):744-754.
[11]GIAQINIS C,TSOUROUFLIS G,THEOCHARIS S.Peroxisome proliferator-activated receptor-gamma(PPAR-gamma)ligands:novel pharmacological agents in the treatment of ischemia reperfusion injury[J].Curr Mol Med,2008,8(6):562-579.
[12]BERNARDO A,LEVI G,MINGHETTI L.Role of the peroxisome proliferator-activated receptor-gamma(PPAR-gamma)and its natural ligand 15-deoxy-Delta12,14-prostaglandin J2 in the regulation of microglial functions[J].Eur J Neurosci,2000,12:2215-2223.
(编辑 韩维栋)
Effects of rosiglitazone on MCP-1,COX-2 and NF-κB expressions in spontaneously hypertensive rats
LI Ya-li1,ZHANG Qiao-jun1,YUAN Hai-feng1,GAO Deng-feng2,NIU Xiao-lin2,LUO Kun3
(1.Department of Brain Diseases;2.Department of Cardiovascular Medicine,
the Second Affiliated Hospital of Xi'an Jiaotong University Health Science
Center,Xi'an 710004;3.Xi'an Children's Hospital,Xi'an 710003,China)
Objective To investigate the expressions of inflammatory factors including NF-κB,COX-2 and MCP-1 as well as the changes of neurons in the hippocampus of spontaneously hypertensive rats(SHRs)so as to explore the protective effect of peroxisome proliferator-activated receptorγ(PPARγ)agonists on hypertensioninduced brain injury and the related mechanisms.Methods Male SHR and WKY rats aged 56 weeks were divided evenly into two groups at random:control group(2 m L/d saline by lavage)and Ros group[5 mg/(kg·d)rosiglitazone dissolved in 2 m L saline by lavage].The animals were killed at week 64 before SBP test and their brains were taken out for detection.Then Nissl's staining was performed in CA1 area;COX-2 and MCP-1 m RNA expressions were detected by Real time PCR,while NF-κB and PPARγprotein expressions were detected by Western blot.Results We found in the SHRs a decreased expression of PPARγ;upregulated expressions of NF-κB,MCP-1 and COX-2(P<0.05);and decreased number of neurons in CA1 subfield of the hippocampus(P<0.05). Rosiglitazone reversed these pathological changes and exerted neuroprotective effects through PPARγpathway. Conclusion In SHRs there is obvious loss of neurons in CA1 subfield of the hippocampus.The expressions of inflammatory factors like NF-κB,MCP-1 and COX-2 are upregulated,which may be involved in the pathologicprocess of hypertension-induced neuronal injury.Rosiglitazone can have anti-inflammatory and neuroprotective effects by activating PPAR-γpathway.
spontaneously hypertensive rat;MCP-1;COX-2;NF-κB;peroxisome proliferator-activated receptorγ(PPAR-γ)
R544.1
A
10.7652/jdyxb201505008
2015-01-07
2015-04-18
张巧俊.E-mail:Zhangqj@mail.xjtu.edu.cn
优先出版:http://www.cnki.net/kcms/detail/61.1399.R.20150720.1533.006.html(2015-07-20)
