过敏性哮喘对小鼠动脉粥样硬化斑块发生发展及稳定性的影响
2015-06-23王丽君郜珊珊袁祖贻
王丽君,马 利,郜珊珊,周 娟,袁祖贻
(1.西安交通大学医学部第一附属医院心内科,陕西西安 710061;2.延安大学附属医院神经内科,陕西延安 716000)
过敏性哮喘对小鼠动脉粥样硬化斑块发生发展及稳定性的影响
王丽君1,马 利2,郜珊珊1,周 娟1,袁祖贻1
(1.西安交通大学医学部第一附属医院心内科,陕西西安 710061;2.延安大学附属医院神经内科,陕西延安 716000)
目的 观察过敏性哮喘对apoE-/-小鼠动脉粥样硬化(AS)病变发生及发展不同时期的影响。方法 取6周龄的apoE-/-小鼠,以卵清蛋白(OVA)致敏后给予雾化吸入,激发哮喘发作以建立过敏性哮喘模型,激发2周后检测小鼠肺部病理改变判断造模是否成功。造模成功后分别于激发2周、4周、8周及16周时处死小鼠,取主动脉根部进行冰冻切片,油红O染色并计算AS斑块相对面积,CD68荧光染色检测斑块内巨噬细胞含量,天狼星红染色检测斑块内胶原含量。结果 与对照组相比,过敏性哮喘apoE-/-小鼠主动脉根部在激发2周时就有明显的斑块形成和巨噬细胞浸润,并且随着激发时间的延长,斑块面积和斑块内巨噬细胞含量始终高于对照组,同时斑块内胶原含量下降。结论 过敏性哮喘促进apoE-/-小鼠AS斑块的形成和发展,并导致其稳定性降低。
过敏性哮喘;apoE-/-小鼠;动脉粥样硬化;斑块面积;斑块稳定性
动脉粥样硬化(atherosclerosis,AS)是一种以Th1反应为主导的慢性炎症[1-2],而过敏性哮喘(allergic asthma)则是以Th2反应为主导的慢性炎症[3],二者代表CD4+T细胞炎症反应的不同方向,但目前对二者之间的具体关系尚未有定论。临床流行病学资料显示,过敏性哮喘是冠心病和中风的显著危险因素[4-6],对女性尤其明显[5];而另外一些研究则显示,过敏性哮喘是成人中风的独立危险因素,但与冠心病无关[7];还有研究显示过敏性哮喘对肥胖引起的AS有保护作用[8]。这些结果提示合并过敏性哮喘对AS病变发生发展的影响仍未完全明了。本研究拟在过敏性哮喘AS动物模型(过敏性哮喘apoE-/-小鼠)基础上,进一步观察在病变发生及发展不同时期其主动脉AS病变面积和稳定性的改变,以期明确过敏性哮喘对AS的作用,为进一步研究奠定理论基础。
1 材料与方法
1.1 材料C57BL/6J背景的apoE-/-小鼠,本实验室已有维持品系,饲养于西安交通大学医学部实验动物中心,出生后4周离乳,给予SPE级普通饲料喂养。造模用的卵清蛋白(ovalbumin,OVA)及氢氧化铝均购自Sigma公司,油红O染料购自Amresco公司,天狼星红染料和EITC标记的α-actin单克隆抗体购自Sigma公司。大鼠抗小鼠CD68抗体购自Ab Dserotec公司。Leico恒冷切片机、Olympus BX51正置荧光显微镜来自西安交通大学心内科实验室。
1.2 动物模型的制备和评价取6周龄apoE-/-小鼠,在SE-WOONG等[9]的方法基础上进行改良,分别于第0、7、14天给予腹腔注射OVA+氢氧化铝佐剂进行致敏(每只0.2 m L,含OVA 500μg/m L),并于第14天开始以10 g/L OVA溶液进行雾化吸入激发哮喘发作,每周3次,每次30 min,对照组给予PBS雾化吸入。
所有小鼠分为哮喘组和对照组2个大组,每个大组根据激发持续时间不同分为激发2周(急性)、4周(亚急性)、8周(慢性)和16周(持续慢性),共8个组,每组6只。于激发2周后,取对照组和哮喘组各2只处死,并取小鼠左肺进行HE染色检测肺部病理炎症浸润情况,以判断造模是否成功。
1.3 标本采集分别于激发2、4、8、16周处死小鼠(末次激发后24 h处死),眼球采血后快速开胸并充分暴露心脏,生理盐水心脏灌流冲净血管及组织中的残留血液,分离并取下主动脉根部,40 g/L多聚甲醛固定1 h,250 g/L蔗糖脱水至组织沉底。滤纸吸干多余水分,OCT复合物包埋储存于—80℃冰箱直至切片。
1.4 主动脉根部斑块面积的分析OCT包埋的主动脉根部做冰冻切片,从主动脉根部开始连续横切,以见到3个主动脉瓣为标志,连续收集7μm厚的系列冰冻切片共400μm长,每张玻片8个切片。—20℃冰箱保存切片。
油红O染色检测主动脉根部的脂质,以斑块面积占管腔横截面积的百分比表示病变面积的相对大小。使用奥林巴斯正置荧光显微镜采集图像,并用IPP6.0软件进行图像分析。
1
.5 主动脉根部斑块成分的检测取主动脉根部冰冻切片,用抗CD68抗体(1∶200)进行免疫荧光染色检测斑块内的巨噬细胞含量,天狼星红染色检测斑块内的胶原含量,以阳性面积占斑块面积的百分比表示斑块内的巨噬细胞和胶原含量。使用奥林巴斯正置荧光显微镜采集图像,并用IPP6.0软件进行图像分析。
1.6 统计学分析所有数据以均数±标准差(±s)表示,用SPSS 16.0统计软件进行数据分析,两组数据间的差异用独立样本t检验进行分析,P<0.05为差异有统计学意义。
2 结 果
2.1 动物模型评价哮喘组小鼠在激发过程中出现明显呼吸加深加快、烦躁不安或者匍匐少动,弓背直立,并有抓耳骚鼻和二便失禁等哮喘急性发作表现。肺组织切片HE染色显示小支气管及伴行小血管旁大量炎性细胞浸润,小支气管内黏膜皱壁消失,平滑肌染色可见气道下平滑肌有损伤及断裂,天狼星红染色可见气道下有胶原沉积。支气管灌洗液嗜酸性粒细胞数目增加(图1)。上述结果证明模型制备成功。
2.2 过敏性哮喘对apoE-/-小鼠主动脉根部AS斑块面积的影响油红O染色检测apoE-/-小鼠主动脉根部AS斑块面积,结果发现哮喘组apoE-/-小鼠主动脉根部切片2周组(急性)即有明显斑块出现,而此时对照组并无显著斑块形成。随激发时间的延长斑块面积逐渐增加。与对照组相比,从急性期到慢性期各个时期的哮喘组小鼠斑块面积均明显增加(P<0.05,图2)。
2.3 过敏性哮喘对apoE-/-小鼠主动脉根部AS斑块内成分的影响用免疫荧光染色检测apoE-/-小鼠主动脉根部AS斑块内巨噬细胞标志物CD68表示巨噬细胞含量。与对照组相比,从激发2周开始,哮喘组小鼠的斑块内巨噬细胞含量就有显著增加(P<0.05),并且随着激发时间的延长,哮喘组小鼠斑块内的巨噬细胞含量始终高于对照组(P<0.05,图3)。此外天狼星红染色提示哮喘组小鼠斑块内胶原含量在激发8周和16周的时候较对照组显著降低(P<0.05,图4)。

图1 过敏性哮喘apoE-/-小鼠模型肺部的病理改变Eig.1 Pathological changes in the lung of apoE-/-mice(×100)

图2 过敏性哮喘与对照apoE-/-小鼠主动脉根部AS病变内油红O染色Eig.2 Oil red staining of aortic root AS lesion in asthma and control apo E-/-mice(×100)
3 讨 论
AS和过敏性哮喘都是慢性炎症性疾病,多种炎症细胞和炎性因子参与其中,包括巨噬细胞、T细胞、平滑肌细胞和肥大细胞等[10]。CD4+T细胞在其中发挥着重要作用,Th1/Th2阴阳平衡的失衡被认为是AS和过敏性哮喘发病的重要机制:Th1/Th2失衡,Th1过度增殖是AS的发病机制[11];而Th2细胞增多则被认为是过敏性哮喘的重要发病机制[3]。临床流行病学资料中一些研究认为过敏性哮喘是冠心病和中风的显著危险因素[4-6];而另外一些研究则显示过敏性哮喘与冠心病无关[7]。还有研究则显示过敏性哮喘对肥胖引起的AS有保护作用[8]。本研究采用OVA诱导的过敏性哮喘AS动物模型(过敏性哮喘apoE-/-小鼠)并观察了其主动脉AS病变面积和稳定性在病变发生发展不同时期的改变。

图3 过敏性哮喘与对照apoE-/-小鼠主动脉根部AS病变内巨噬细胞染色Eig.3 Macrophage staining of aortic root AS lesion in asthma and control apo E-/-mice(×200)
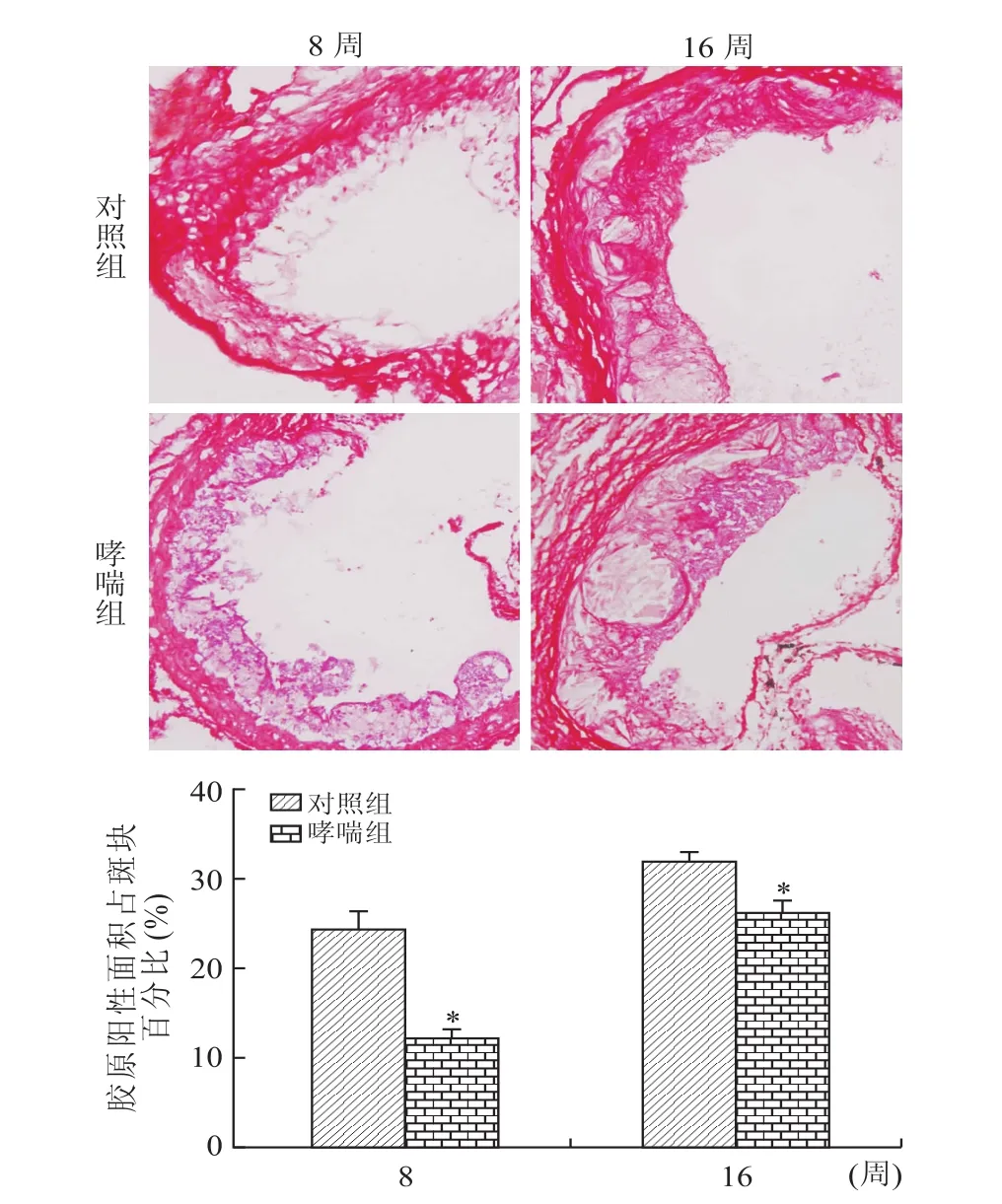
图4 过敏性哮喘与对照apoE-/-小鼠主动脉根部AS病变内胶原染色Eig.4 Collagen staining of aortic root AS lesion in asthma and control apoE-/-mice(×200)
本研究对小鼠主动脉根部斑块进行油红O染色,发现在哮喘激发2周时,哮喘组apoE-/-小鼠主动脉根部就有明显的斑块出现,而此时对照组尚未有显著斑块生成,提示过敏性哮喘对AS发生的早期发生即有促进作用。而随着激发时间的延长,哮喘组小鼠主动脉根部斑块面积始终大于对照组,提示过敏性哮喘不仅对AS发生的早期发生有促进作用,而且对其进展期依然有明显的作用。
巨噬细胞是一种重要的炎症细胞,AS斑块的起始、发生和发展均离不开巨噬细胞的参与,其所分泌的各种炎性因子影响着AS斑块的转归。因此,主动脉根部AS斑块中巨噬细胞的含量多少被认为是判断斑块稳定性的一个重要指标,巨噬细胞含量多则说明炎症浸润较多,斑块趋向于不稳定,相反则趋向于稳定[12-15]。而斑块内的胶原含量则是另一个影响斑块稳定性的重要指标,胶原含量少则斑块趋向于不稳定,相反则趋向于稳定[12-13]。本研究用免疫荧光染色法观察了不同时期小鼠主动脉根部斑块中CD68含量,在OVA激发哮喘2周后,哮喘组apoE-/-小鼠主动脉根部就有明显的巨噬细胞浸润,而对照组则几乎未观察到,提示过敏性哮喘对AS早期的炎症浸润有显著促进作用;随着激发时间的延长,哮喘组小鼠主动脉根部斑块中巨噬细胞含量始终高于对照组,并且斑块内的胶原含量也较对照组显著减少。这提示过敏性哮喘不仅对AS斑块面积增长有促进作用,还影响了进展期斑块的稳定性,使其变得更加不稳定。
此外,本研究还发现小鼠激发16周的主动脉根部斑块中的巨噬细胞含量较前有所减少,分析其由于AS的病变发生发展早期是以炎性浸润为主,晚期则是以纤维修复为主,而在OVA激发16周时,小鼠已经是24周龄,此时斑块已进展为纤维斑块,因此巨噬细胞的浸润较早期相对减少。
总之,本研究发现OVA诱导的过敏性哮喘可以显著增加apoE-/-小鼠主动脉根部斑块的面积,并且导致其斑块巨噬细胞含量增加、胶原减少、稳定性下降,且此作用贯穿斑块发生发展各个时期,为过敏性哮喘作为AS的危险因素增添了新的实验证据,并为进一步研究其具体机制奠定了理论基础。
[1]HANSSON GK,LIBBY P.The immune response in atherosclerosis:a double-edged sword[J].Nat Rev Immunol,2006,6(7):508-519.
[2]LI N.CD4+T cells in atherosclerosis:regulation by platelets[J].Thromb Haemost,2013,109(6):980-990.
[3]LIOYD CM,HESSEL EM.Functions of T cells in asthma:more than just T(H)2 cells[J].Nat Rev Immunol,2010,10(12):838-848.
[4]KNOFLACH M,KIECHL S,MAYR A,et al.Allergic rhinitis,asthma,and atherosclerosis in the Bruneck and ARMY studies[J].Arch Intern Med,2005,165(21):2521-2526.
[5]ONUFRAK SJ,ABRAMSON JL,AUSTIN HD,et al.Relation of adult-onset asthma to coronary heart disease and stroke[J].Am J Cardiol,2008,101(9):1247-1252.
[6]IRIBARREN C,TOLSTYKH IV,EISNER MD.Are patients with asthma at increased risk of coronary heart disease?[J]. Int J Epidemiol,2004,33(4):743-748.
[7]SCHANEN JG,IRIBARREN C,SHAHAR E,et al.Asthma and incident cardiovascular disease:the Atherosclerosis Risk in Communities Study[J].Thorax,2005,60(8):633-638.
[8]JAAKKOLA U,KAKKO T,JUONALA M,et al.Neuropeptide Y polymorphism increases the risk for asthma in overweight subjects;protection from atherosclerosis in asthmatic subjects—the cardiovascular risk in young Finns study[J].Neuropeptides,2012,46(6):321-328.
[9]OH SW,PAE CI,LEE DK,et al.Tryptase inhibition blocks airway inflammation in a mouse asthma model[J].J Immunol,2002,168(4):1992-2000.
[10]HANSSON GK,LIBBY P.The immune response in atherosclerosis:a double-edged sword[J].Nat Rev Immunol,2006,6(7):508-519.
[11]OLSON NC,SALLAM R,DOYLE MF,et al.T helper cell polarization in healthy people:implications for cardiovascular disease[J].J Cardiovasc Transl Res,2013,6(5):772-786.
[12]SHAI SY,SUKHANOV S,HIGASHI Y,et al.Smooth muscle cell-specific insulin-like growth factor-1 overexpression in Apoe -/-mice does not alter atherosclerotic plaque burden but increases features of plaque stability[J].Arterioscler Thromb Vasc Biol,2010,30(10):1916-1924.
[13]SHE ZG,ZHENG W,WEI YS,et al.Human paraoxonase gene cluster transgenic overexpression represses atherogenesis and promotes atherosclerotic plaque stability in ApoE-null mice[J].Circ Res,2009,104(10):1160-1168.
[14]SAKAKURA K,NAKANO M,OTSUKA F,et al.Pathophysiology of atherosclerosis plaque progression[J].Heart Lung Circ,2013,22(6):399-411.
[15]郭夏青,卢宏.血清组织蛋白酶K、胱抑素C水平与缺血性脑血管病患者颈动脉粥样硬化斑块稳定性的关系[J].郑州大学学报:医学版,2013,48(2):269-271.
(编辑 国 荣)
Effect of allergic asthma on the development of atherosclerosis in mice
WANG Li-jun1,MA Li2,GAO Shan-shan1,ZHOU Juan1,YUAN Zu-yi1
(1.Department of Cardiology,the Eirst Affiliated Hospital of Xi'an Jiaotong University Health Science Center,Xi'an 710061;2.Department of Neurology,the Affiliated Hospital of Yan'an University,Yan'an 716000,China)
Objective To investigate the effect of allergic asthma on the pathogenesis and development of atherosclerosis(AS)in apoE-/-mice.Methods Six-week apoE-/-mice were used in the experiment.Allergic asthma model was established by ovalbumin(OVA)sensitization and challenge.After asthma was induced,the model was assessed by lung histopathology and eosinophils counts of BALF.Mice were challenged for 2,4,8 or 16 weeks.Frozen sections of aortic root were examined for AS lesion:the area of lesion by oil red staining,the collagen content by Sirius red staining and the macrophage infiltration by CD68 immunofluorescence staining,respectively.Results The results showed that the allergic asthma mice models were successfully established.The area of aortic root plaque was significantly increased in asthmatic apoE-/-mice compared with that in the control group.Meanwhile,macrophage infiltration was increased but the collagen content was decreased in plaque of asthmatic apoE-/-mice compared with control group.Conclusion Allergic asthma accelerates the formation and development of AS and decreases the stability of plaques in the apo E-/-mice.
allergic asthma;apoE-/-mouse,atherosclerosis;area of lesion;stability of plaque
R541.4
A
10.7652/jdyxb201505005
2014-12-14
2015-03-18
国家自然科学基金杰出青年基金资助项目(No.81025002);国家重点基础研究发展计划(“973计划”,No.2012CB517804)Supported by the National Natural Science Eoundation for Distinguished Young Scholars(No.81025002)and the National Key Basic Research Program of China(“973 Project”,No.2012CB517804)
袁祖贻.E-mail:zuyiyuan@mail.xjtu.edu.cn
优先出版:http://www.cnki.net/kcms/detail/61.1399.R.20150720.1654.012.html(2015-07-20)
