Anti-hEGFR轻、重链共表达及高表达细胞株快速筛选
2015-06-22李德山刘春香姜媛媛刘铭瑶张瑛杰袁清艳郭笑辰任桂萍吴强李婷婷东北农业大学生命科学学院哈尔滨50030哈药集团技术中心哈尔滨5005
李德山,刘春香,姜媛媛,刘铭瑶,张瑛杰,袁清艳,郭笑辰,任桂萍,吴强,李婷婷(.东北农业大学生命科学学院,哈尔滨50030;.哈药集团技术中心,哈尔滨5005)
Anti-hEGFR轻、重链共表达及高表达细胞株快速筛选
李德山1,刘春香1,姜媛媛2,刘铭瑶1,张瑛杰1,袁清艳1,郭笑辰1,任桂萍1,吴强1,李婷婷1
(1.东北农业大学生命科学学院,哈尔滨150030;2.哈药集团技术中心,哈尔滨150025)
为实现hEGFR全长抗体(anti-hEGFR)轻、重链共表达以及建立快速、高效筛选方法并获得共表达细胞株。采用分子克隆技术获得重链和轻链基因,将之连入peedual真核表达载体;经GS-Neo加压及流式细胞术筛选获得稳定表达细胞株;通过proteinA亲和层析技术纯化出目标抗体;应用cck-8法、AnnexinV/PI法以及qPCR技术检测anti-hEGFR对A431细胞增殖、凋亡影响。SDS-PAGE分析结果显示,纯化后抗体纯度为95.0%、分子质量约为150 ku。cck-8试验中不同浓度anti-hEGFR对A431细胞增殖均有极显著抑制作用,且与商品化Cetuximab效果相近;anti-hEGFR与Cetuximab均可诱导A431细胞产生凋亡,作用效果相近,均达极显著。全长抗体轻、重链的共表达,省去分别表达的重组过程,保证抗体天然结构;GS-Neo双加压结合流式筛选,实现阳性细胞株快速、高效分离;建立省时、高效抗体共表达平台,为抗体类药物真核构建及筛选提供新思路。
anti-hEGFR;共表达载体;GS-Neo筛选;流式细胞术;抗肿瘤
表皮生长因子受体(Epidermal growth factor receptor,EGFR)是表皮生长因子(erbB)家族成员,具有酪氨酸激酶活性膜表面受体[1],EGFR稳定表达于许多上皮组织、间质和神经源性组织。不同器官发生的实体瘤也高表达EGFR,如头颈部癌、卵巢癌、宫颈癌、膀胱癌和食管癌等[2],Janani等研究发现,EGFR通过与相应配体结合实现RAS/RAF/MEK/ ERK和PI3K/AKT信号通路转导,两个通路间通过复杂网络运行[3]。
目前,用于EGFR靶向性治疗肿瘤的药物主要有小分子化合物酪氨酸激酶拮抗剂和EGFR单克隆抗体(anti-hEGFR)两类,药物通过调节细胞周期、促进细胞凋亡、抑制细胞转移杀伤肿瘤细胞。一系列癌症类型临床揭示,接受小分子化合物酪氨酸激酶拮抗剂治疗的患者中约有50%发生获得性EGFR耐药突变[4-5]。抗体针对相应抗原具有高特异性和高亲和力特性,毒副作用较低,在疾病诊断和治疗中有专一性。目前已上市抗肿瘤抗体药物共20种,其中美国FDA批准17个[6]。
原核生物不含蛋白加工修饰细胞器,因此,大肠杆菌表达系统仅用于生产体积小、结构简单、不需要糖基化的抗体片段如Fab、Fab'、scFv等[7];低等真核生物表达系统,如酵母及丝状真菌,可用于全长抗体生产,但其糖基化类型与人类存在差异,此类型糖蛋白抗体半衰期较短、生理活性有限甚至对人体有毒性[8]。最接近于人体蛋白修饰的系统为哺乳动物表达系统,该系统可以对蛋白进行适当折叠、装配和翻译修饰,在临床应用中占主导地位[9-10]。
抗体轻、重链同时表达并有效整合是载体构建关键部分,高效筛选方法是蛋白药物研发核心。本研究在载体中引入谷氨酰胺合成酶(Glutamine synthetase,GS)基因,并在轻链下游插入增强型绿色荧光蛋白(Enhanced green fluorescent protein,EGFP)基因,在重链下游插入Neo基因,该方法不仅可保证轻、重链同时整合于表达细胞基因组,可通过两种药物加压筛选并结合流式细胞仪分选,快速获得高产细胞株。
1 材料与方法
1.1 材料
1.1.1 菌株、细胞株和载体
大肠杆菌E.coli DH5α,细胞株CHO-K1SV,真核表达载体Kozak-Pkappa、Pee6.4,Ires Neo均由东北农业大学生命中心基因部保存;anti-EGFR抗体LC、HC由英潍捷基公司合成;皮肤鳞癌细胞株A431购自ATCC;IRES-EGFP购自美国Clontech,Pee12.4购自Lonza;pMD18-T simple载体,购自大连宝生物。
1.1.2 试剂
Taq DNA聚合酶,T4DNA连接酶,限制性内切酶购自TaKaRa公司;DNA胶回收试剂盒,质粒DNA小提试剂盒,去内毒素质粒提取试剂盒购自OMEGA公司;SDS-PAGE相关试剂购自Amersham Pharmacia Biotech公司;蛋白分子质量标准购自Fermentas公司;高糖DMEM培养基、胎牛血清(FBS)、G418购自GIBCO公司;MSX、L-谷氨酰胺购自Sigma Corporation;胰蛋白酶购自北京原平皓生物技术有限公司;GS supplement,HT supplement购自Invitrogen;IMDM培养基购自M&C corporation;cck-8试剂盒购自日本同仁化学研究所(Dojindo);细胞凋亡检测试剂盒购自宝赛生物公司;Quantitative Real-time PCR检测试剂盒购自TaKaRa公司。
1.1.3 引物
引物均由Invitrogen公司合成,序列见表1、2。
1.2 方法
1.2.1 真核表达载体构建
真核表达载体peedual-anti-hEGFR由Pee12.4、Pee6.4、Kozak-Pkappa载体及anti-hEGFR重链和轻链、PIRES-Neo、PIRES-EGFP基因序列经多步PCR、酶切、连接、转化得到。
1.2.2 细胞的电转及阳性细胞筛选
取对数生长期CHO-K1SV细胞以1∶3浓度传代,于37℃、5%CO2培养箱中培养直至汇合度为70%~80%,0.25%胰蛋白酶消化,1 000 r·min-1转速离心3 min后用PBS洗细胞一次,将细胞用无血清IMDM培养基稀释计数,使浓度达1×107个·mL-1。将20μg质粒DNA加入400μL细胞悬液中,250 V、1 000Ω、1 000μF参数下电转。转染后细胞转入含有10%FBS的完全培养基中复苏培养。电转30 h后更换含GS、G418培养基加压筛选,只有转入该载体的细胞可以存活,待细胞长至约90%后,用胰蛋白酶消化,PBS洗一次,再用PBS重悬细胞进行流式细胞仪(购自BD公司)分选。
1.2.3 Anti-hEGFR表达及纯化
将未转染空细胞及分选后阳性细胞分别接种六孔板,待细胞汇合度达90%时,用PBS洗一次,换成无血清培养基,培养约72 h后取培养上清,1 000 r·min-1转速离心3 min,取上清与标准品Cetuximab同时做SDS-PAGE分析。

表1 基因扩增引物Table 1 Primers for gene amplification

表2 qPCR引物Table 2 Primers for qPCR
收集约400 mL细胞培养上清,使用AKTA Purifier 100蛋白层析系统抗体纯化。纯化后蛋白用SDS-PAGE分析,并用紫外分光光度计(ND-1000型Spectrophotometer)测定浓度。
1.2.4 cck-8试验检测anti-hEGFR对A431细胞增殖影响
收集处于对数生长期A431细胞,用新鲜完全培养基将其稀释至5×104个·mL-1后,按每孔100μL体积接种于96孔板(边孔以培养基填充),37℃、5%CO2培养箱中培养直至汇合度为60%~70%。将anti-hEGFR及Cetuximab分别用无血清DMEM稀释到3 000 ng·mL-1后,经倍比稀释直至最小浓度为93.75 ng·mL-1,将各浓度药品依次加入接好的细胞中,此时设置调零孔、对照孔、试验孔及标准品试验孔。72 h后取出培养板,向每孔中加入cck-8溶液10μL,将板放入培养箱中,培育1 h±10 min。使用酶标仪450 nm波长下测定吸光度值,计算细胞抑制率:细胞抑制率(%)=(对照组OD均值-试验组OD均值)/对照组OD均值×100%
1.2.5 流式细胞仪检测Anti-hEGFR蛋白对A431细胞凋亡影响
取对数生长期的A431细胞以1~5×105个·mL-1浓度接种于六孔板,分三组,分别为Control、anti-hEGFR和Cetuximab组,24 h后将anti-hEGFR和Cetuximab分别以3 000 ng·mL-1浓度稀释,加入试验组细胞中,48 h后收集细胞进行凋亡检测,检测方法参见宝赛生物凋亡试剂盒说明书。
1.2.6 qPCR技术检测bax/bcl2 mRNA水平变化
取对数生长期的A431细胞以1~5×105个·mL-1浓度接种于六孔板,并分为三组,分别为Control、anti-hEGFR和Cetuximab组,24 h后将anti-hEGFR和Cetuximab以3 000 ng·mL-1浓度稀释,加入试验组细胞中。48 h后收集细胞,提取细胞总RNA,反转录成cDNA,以β-actin表达量作为内参,实时荧光定量PCR技术检测凋亡相关因子bax/bcl2相对表达情况。
1.2.7 统计学分析
采用SPSS 13.0统计软件统计学分析。计量资料以均数±标准差(xˉ±s)表示。多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,P<0.05为差异显著,具有统计学意义。
2 结果与分析
2.1 anti-hEGFR真核共表达载体构建
该载体由pee6.4、pee12.4、Kozak-Pkappa真核表达载体及Ires EGFP、Ires Neo、anti-hEGFR的重链和轻链经过多步酶切、PCR、连接、转化而获得。构建成功载体如图1所示。
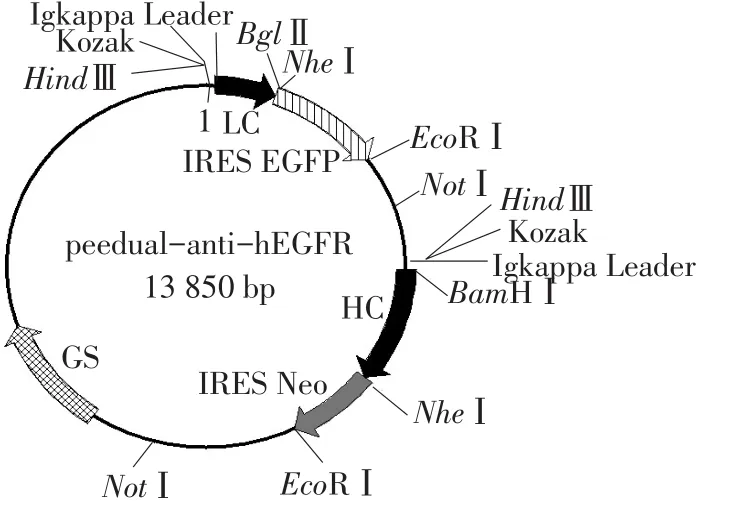
图1 peedual-anti-hEGFR真核共表达载体构建Fig.1 Profiles of peedual-anti-hEGFR eukaryotic co-expression vector
2.2 阳性细胞株筛选
利用电穿孔转染技术将peedual-anti-hEGFR真核共表达载体转入CHO-K1SV细胞中,经GS、G418加压筛选结合流式细胞术分选出稳定、高效的表达anti-hEGFR细胞株(见图2)。
2.3 Anti-hEGFR蛋白表达及纯化
将空细胞及筛选出的阳性细胞分别用无血清培养基培养并收取上清,经非还原性SDS-PAGE分析可见(见图3A),空细胞不表达抗体,筛选到的细胞株可以表达抗体,大小与商品化的标准品Cetuximab相符。利用AKTA Purifier 100蛋白层析系统,通过proteinA亲和层析技术纯化出的全长抗体纯度约为95.0%(见图3B)。
2.4 cck-8法检测anti-hEGFR对A431细胞抑制作用
cck-8检测结果(见图4)所示,与阴性对照组相比,不同浓度anti-hEGFR对A431细胞均有抑制作用,具有统计学意义(P<0.01),anti-hEGFR组与标准品相比,各浓度均差异不显著。结果表明通过共表达方法获得的anti-hEGFR对EGFR过表达型肿瘤细胞A431具有明显抑制作用。
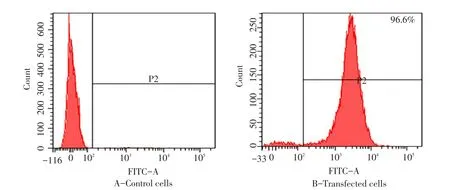
图2 阳性细胞株分选Fig.2 Positive cells were identified and sorted by flow cytometry at 488 nm
2.5 Anti-hEGFR蛋白对A431细胞凋亡情况检测
利用AnnexinV/PI双染法检测细胞凋亡情况,细胞总凋亡率为早期凋亡(Q2)与晚期凋亡(Q4)比率之和,结果(见图5)可见,空白对照组凋亡率为12.0%,而anti-hEGFR组与Cetuximab组凋亡率分别为23.4%和23.6%,anti-hEGFR组与空白对照组相比促凋亡效果显著(P<0.01)。
2.6 anti-hEGFR对细胞凋亡相关因子mRNA表达水平影响
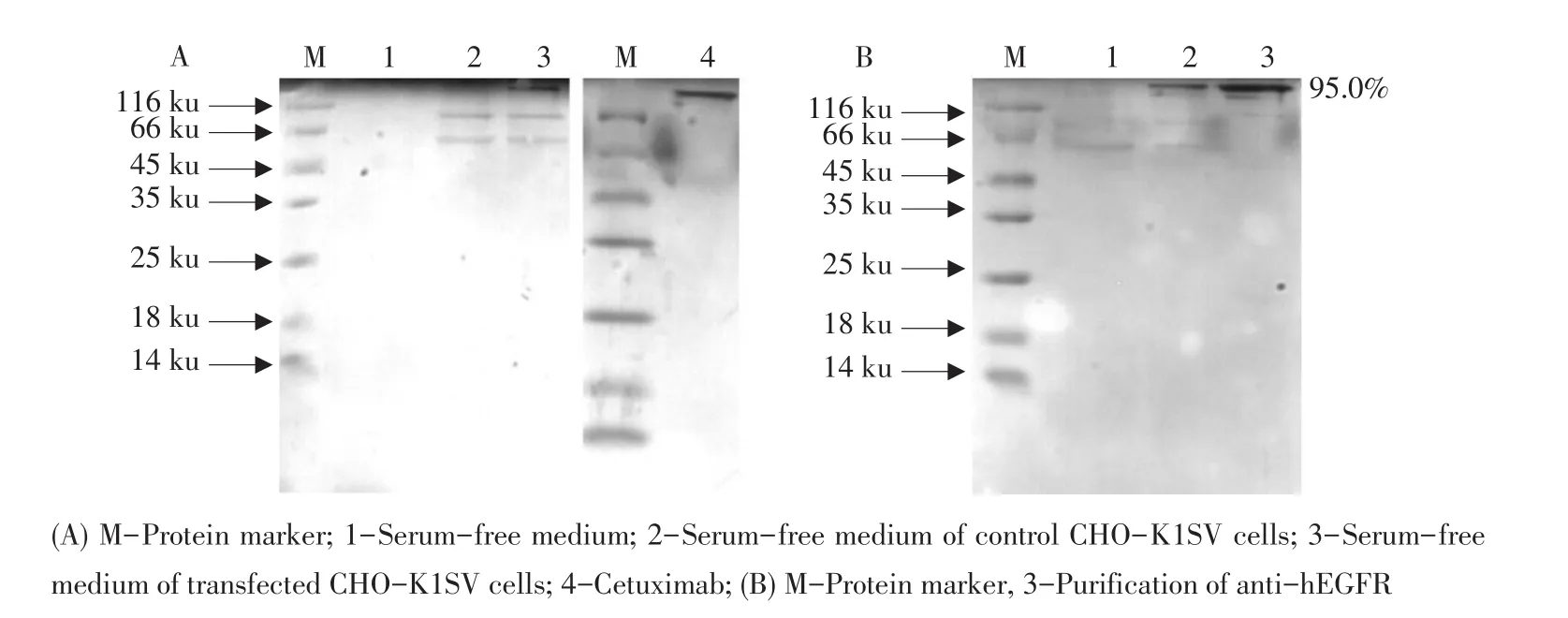
图3 anti-hEGFR的表达及纯化的SDS-PAGE分析Fig.3 SDS-PAGE analysis the expression and purification of anti-hEGFR

图4 cck-8法检测anti-hEGFR对A431细胞增殖的抑制作用Fig.4 A431 cellinhibition caused by anti-hEGFR was determined with cck-8
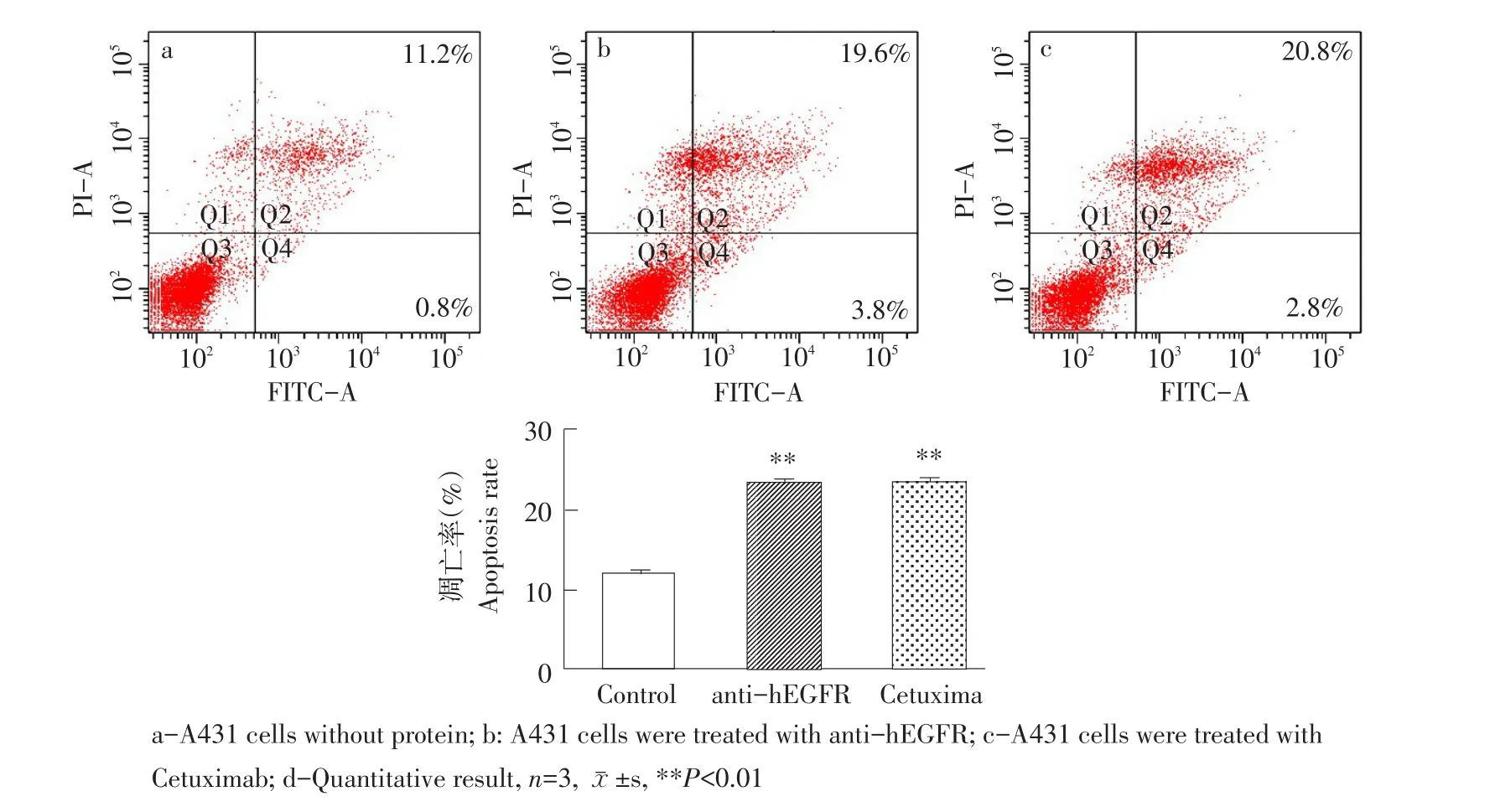
图5 anti-hEGFR对A431细胞凋亡的作用Fig.5 Effectof anti-hEGFR on apoptosis of A431 cells
Bcl2、Bax的qPCR检测结果见图6,与空白对照组相比,anti-hEGFR组中Bcl2基因在mRNA水平上显著降低(P<0.05),Bax基因mRNA水平显著提高(P<0.01),而anti-hEGFR组与Cetuximab组相比无显著差异。Bax的上调表达可诱导细胞产生凋亡,同时Bcl2基因下调表达可抑制细胞增殖。结果表明,anti-hEGFR可以通过调节Bcl2、Bax表达促进由EGFR通路诱导的细胞凋亡。
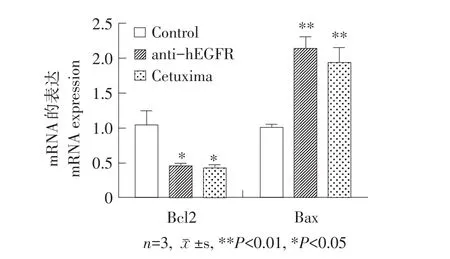
图6 anti-hEGFR对A431细胞中Bcl2和Bax基因mRNA水平的影响Fig.6 Effect of anti-hEGFR on Bcl2 and Bax mRNA expression in A431 cells
3 讨论与结论
目前,FDA批准的抗体药物多产自中国仓鼠卵巢细胞(Chinese hamster ovary cells,CHO),CHOK1SV细胞是可以悬浮生长的谷氨酰胺合成酶(GS)缺陷型细胞,因此可以在表达载体上游加入GS基因作为筛选标记,利用GS抑制物甲硫胺酸亚砜(L-Methionine sulfoxide,MSX)加压筛选[11];G418是一种氨基糖苷类抗生素,通过抑制转座子Tn601和n5的基因,干扰核糖体功能而阻断蛋白质合成,是稳定转染中最常用的抗性筛选剂[12]。由于GS及Neo筛选标记不能直观监测及分选阳性细胞,因此,本试验在轻链的下游引入EGFP基因,EGFP是GFP突变体,具有更高的荧光强度,在488 nm波长光激发下可产生绿色荧光,进而通过流式细胞仪检测和分选[13-15];本试验在EGFP及Neo基因上游引入内部核糖体进入位点(internal ribosome entry sites,IRES),IRES来自脑心肌炎病毒(Encephalomyocarditis virus,EMCV),能在真核细胞内模拟mRNA的5'帽子结构,招募核糖体进入并使其上游及下游的两个转录子同时翻译,被广泛用于各类蛋白真核表达[16]。在阳性细胞筛选过程中,多数只在载体构建时引入单一筛选标记,且只用一种筛选方法,使筛选时间长达数月甚至造成高表达细胞株丢失,最终无法达到预期效果。
本试验对原有真核表达载体进行改造,通过亚克隆方法获得EGFR单克隆抗体轻、重链基因,并将之连入同一真核表达载体,从而保证抗体基因同时表达。EGFR单克隆抗体轻、重链的共表达避免分别表达后的重组过程,省去摸索最佳重组条件的时间,保持抗体天然活性,在抗肿瘤方面与商品化的Cetuximab有相近作用。多筛选标记的加入使筛选工作可在一个月内完成,节约共表达细胞株的筛选时间,加快研发进程。该研究可为抗体的真核表达及细胞分选提供可靠方法,为抗体大量制备奠定基础。
[1]Schroeder R L,Stevens C L,Sridhar J,et al.Small molecule tyrosine kinase inhibitors of ErbB2/HER2/Neu in the treatment of aggressive[J].Breast Cancer,2014,19(9):15196-15212.
[2]Mendelsohn J,Baselga J.Status of epidermal growth factor receptor antagonists in the biology and treatment of cancer[J]. Journalof ClinicalOncology,2003,21(14):2787-2799.
[3]Ravi J,Sneh A,Shilo K,et al.FAAH inhibition enhances anandamide mediated anti-tumorigenic effects in non-small cell lung cancer by downregulating the EGF/EGFR pathway[J]. Oncotarget,2014,5(9):2475-2486.
[4]杜亚利,李琼,等.皮细胞生长因子受体拮抗剂在肿瘤靶向治疗中的应用[J].兰州大学学报:医学版,2009,35(3):99-102.
[5]Pao W,Miller V A,Politi K A,et al.Acquired resistance of lung adenocarcinomas to gefitinib or erlotinib is associated witha second mutation in the EGFR kinase domain[J].Plos Medicine, 2005,2(3):225-235.
[6]陈雪静,常亮,高健.抗肿瘤抗体药物的研究进展[J].中国生物制品学杂志,2015,28(1)∶84-90.
[7]刘东海,张更荣,张乐鸣,等.人神经生长因子β亚基cDNA的克隆及在大肠杆菌中的表达[J].中国病理生理杂志,2002,5:39-42.
[8]Gerngross T U.Advances in the production of human therapeutic proteins in yeasts and filamentous fungi[J].Nature Biotechnology, 2004,22(11):1409-1414.
[9]Wurm F M.Production of recombinant protein therapeutics in cultivatedma mamalian cells[J].Nat Biotechnol,2004,22(11): 1393-1398.
[10]Conradt H S,Nitmz M,Dittmar K E,et al.Expression of humaninterleukin-2 in recombinant baby hamster kidney,Ltk-,and Chinese ovary cells.tructure of O-linked carbohydrate chains and their location within the polypeptide[J].J Biol Chem,1989,264 (29):17368-17373.
[11]de la Cruz Edmonds MC,Tellers M,Chan C,et al.Development of transfection and high-producer screening protocols for the CHOK1SV cell system[J].Molecular Biotechnology,2006,34(2): 179-190.
[12]蒋玲琳,刘丽,朱含章,等.稳定表达GlyRα1的HEK293细胞系的建立[J].南京医科大学学报:自然科学版,2007,27(7):64-650.
[13]邓超,黄大昉,宋福平.绿色荧光蛋白及其应用[J].中国生物工程杂志,2011,31(1):96-102.
[14]宋军,王振坤,孔庆然,等.利用体细胞核移植技术生产表达绿色荧光蛋白转基因猪胚胎的研究[J].东北农业大学学报,2008,39 (3):64-69.
[15]李璐,刘向宇,李德山.应用流式细胞仪分选中性粒细胞的研究[J].东北农业大学学报,2009,40(4):52-55.
[16]Bochkov Y A,Palmenberg A C.Translational efficiency of EMCV IRES in bicistronic vectors is dependentupon IRES sequence and gene location[J].Bio Techniques,2006,41(3):283-288.
Co-expression of anti-hEGFR light and heavy chain and rapid screening of cell lines
LI Deshan1,LIU Chunxiang1,JIANG Yuanyuan2,LIU Mingyao1, ZHANG Yingjie1,YUAN Qingyan1,GUO Xiaochen1,REN Guiping1,WU Qiang1,LI Tingting1
(1.School of Life Sciences,Northeast Agricultural University,Harbin 150030,China;2.Harbin PharmaceuticalGroup Technology Center,Harbin 150025,China)
The aim of this study was to co-express hEGFR fulllength antibody(anti-hEGFR)light and heavy chains,also to establish a rapid screening method and obtain co-expressing cell lines.fulllength heavy chain and light chain were connected to peedual eukaryotic expression vector,which cloned by molecular cloning techniques.stably expressing cell lines were screened by GS-Neo pressure combining flow cytometry;the target antibody was purified by proteinA affinity chromatography;To validate the influence for cell proliferation and apoptosis of anti-hEGFR,cck-8 assay, AnnexinV/PImethod and qPCR were applicated to A431 cell.SDS-PAGE showed that molecular weight ofanti-hEGFR was about150 ku and relative purity was 95.0%.In cck-8 assay,the proliferation ofA431 cells were significantly inhibited,and anti-hEGFR had similar effects with Cetuximab.anti-hEGFR hadthe same effect with Cetuximab in terms of pro-apoptotic of A431 cells.Co-expression could eliminate the refolding process and ensure the activity;The method of GS-Neo pressure combining flow cytometry could achieve a fast and efficient separation of positive celllines;In this study,the province and efficient co-expression platform was established,which could offer new ideas for the production of antibody drugs.
anti-hEGFR;co-expression vector;GS-Neo screening;flow cytometry;anti-tumor
Q816
A
1005-9369(2015)10-0056-07
时间2015-10-28 16:14:39[URL]http://www.cnki.net/kcms/detail/23.1391.S.20151028.1614.040.html
李德山,刘春香,姜媛媛,等.Anti-hEGFR轻、重链共表达及高表达细胞株快速筛选[J].东北农业大学学报,2015,46(10):56-62.
Li Deshan,Liu Chunxiang,Jiang Yuanyuan,et al.Co-expression of anti-hEGFR light and heavy chain and rapid screening ofcelllines[J].Journalof NortheastAgriculturalUniversity,2015,46(10):56-62.(in Chinese with English abstract)
2015-02-11
国家自然基金东北农业大学生物学理科基地科研训练及科研能力提高项目(J1210069/J0116);黑龙江省应用技术研究与开发计划项目(GC13C104)
李德山(1950-),男,教授,博士,博士生导师,研究方向为生物技术制药。E-mail:deshanli@163.com
