硫普罗宁修饰纳米金对铜的比色检测研究
2015-06-22曹小红李芳清马儒超刘云海张志宾
曹小红, 李芳清, 马儒超, 刘云海, 张志宾
( 1.东华理工大学核资源与环境省部共建国家重点实验室培育基地,江西 南昌 330013;2.东华理工大学化学生物与材料科学学院,江西 南昌 330013)
硫普罗宁修饰纳米金对铜的比色检测研究
曹小红1,2, 李芳清2, 马儒超2, 刘云海1,2, 张志宾1,2
( 1.东华理工大学核资源与环境省部共建国家重点实验室培育基地,江西 南昌 330013;2.东华理工大学化学生物与材料科学学院,江西 南昌 330013)
以纳米金粒子为载体,将硫普罗宁修饰至其表面形成硫普罗宁修饰的纳米金溶液(MPG-AuNPs),实现对铜离子的比色检测。系统研究了pH和时间等因素对比色检测的影响,考察了该比色传感器检测铜的灵敏度与线性范围,探究了环境中常见离子对体系的干扰。结果表明,在pH5.0时,响应时间为30 min时,纳米粒子MPG-AuNPs对Cu2+的检出限0.97 μmol·L-1,K+, Na+, Sr2+, Cs+, Hg2+, Co2+, Ni2+等离子的存在对Cu2+的比色检测无影响。
比色检测;硫普罗宁;纳米金;铜离子
曹小红,李芳清,马儒超,等.2015.硫普罗宁修饰纳米金对铜的比色检测研究[J].东华理工大学学报:自然科学版,38(4):433-437.
Cao Xiao-hong,Li Fang-qing,Ma Ru-chao,et al.2015.Colorimetric detectionof Cu2+using N-(2-Mercaptopropionyl)glycine (MPG)-functionalized gold nanoparticles[J].Journal of East China Institute of Technology (Natural Science), 38(4):433-437.
Cu2+在工业生产以及生物组织中占据重要角色。在适宜浓度下,它对于机体新陈代谢有良好的推动作用。然而,高浓度铜离子的存在会对人体有巨大毒害作用。过量Cu2+的存在会置换体内其他金属离子,影响机体酶催化反应(Que et al., 2008);幼儿过度摄入铜离子会导致各种疾病,影响健康生长(Barranguet et al., 2003);高浓度的铜会破坏机体再生系统(Becker et al., 2007)。因此,过量的铜离子对人类健康的影响不容忽视。目前测定环境中痕量Cu2+的方法主要有电感耦合等离子体质谱法(Wu et al., 1997)、电化学法(Herzog et al., 2003)、原子吸收光谱法(Chan et al., 2000)和分光光度法(李小燕等,2012)等。这些方法虽然具有灵敏度极高、检出限低等优点,但由于使用成本较高、仪器设备昂贵和操作过程繁琐,所以不适用于现场实时测定。比色法通过肉眼观察溶液的颜色变化,从而简便、快速地确定待测组分的大致含量,具有仪器便宜、分析成本低、能在线分析待测组分的变化,并且随时监测毒性物质污染情况以便及时防治的特点,在分析测试中显示出较强优势。基于纳米粒子的比色检测方法是近年来出现的一种实时、现场检测的手段,其基本原理纳米粒子作为信息传递者,通过待测物引发纳米粒子的聚集或分散,导致颜色发生变化,最终实现对不同物质的分析检测。近十多年来被广泛用于重金属离子(Zhang et al., 2012)、化学样品(Kubo et al., 2005)及生物样品(Li et al., 2009; Lin et al., 2011)等的高灵敏、高选择性检测。
Liu等(2007)通过DNA酶修饰的纳米金溶液,在Cu2+的作用下发生聚集产生颜色变化,实现了对Cu2+的比色检测。Wang等(2010)同样利用DNA上的特异性基团实现对Cu2+的比色检测。这些检测方法灵敏度极高,选择性好。但诱导DNA成链需要较长时间且DNA修饰纳米金粒子难度大、成本高。纳米金粒子具有极高的消光系数(108~1010M-1cm-1及更高)、在可见光区表现出强的LSPR吸收, 胶体溶液呈现特有的红色(520 nm),随着纳米金粒子粒径的增大或减小其吸收峰的位置发生红移或蓝移,颜色也随之发生改变,许多有机分子(如多糖)和基团(如巯基和胍)可通过化学作用直接与纳米金粒子交联成键,它们与金属纳米粒子有着非常强的表面结合能力。有学者利用Au-S作用力将L-半胱氨酸(L-Cys)修饰到Au纳米粒子表面,当加入Hg2+后,由于Hg2+与纳米金表面的—COOH之间强烈的金属-配体作用,导致纳米金粒子聚集(Chai et al.,2010)。本文以N-(2-巯基丙酰基)甘氨酸(MPG,亦称硫普罗宁)为修饰剂,制备MPG-AuNPs,通过氨基与羧基的共同作用实现对水溶液中铜的比色检测。
1 实验部分
1.1 仪器与试剂
氯金酸( HAuCl4·4H2O),柠檬酸钠,硫普罗宁均购自国药集团化学试剂有限公司,其他试剂均为分析纯,实验用水为超纯水。实验所用玻璃仪器均要用王水润洗备用。
TU-1810紫外-可见分光光度计(北京普析通用仪器有限公司), PHS-3C精密酸度计(上海虹益仪器仪表有限公司),DF-101S集热式恒温加热磁力搅拌器(巩义市英峪予华仪器厂)。
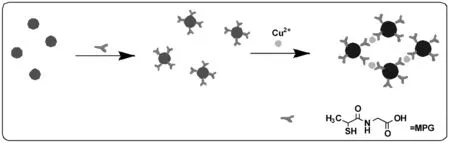
图1 MPG-AuNPs比色检测Cu2+机理图Fig.1 Schematic representation of the analytical process for detecting Cu2+
1.2 实验方法
1.2.1 硫普罗宁修饰纳米金粒子(MPG-AuNPs)的制备
“那么,你准备怎样处置他?”男子看了一眼石屋,试探着问。范坚强伸出手去,将易拉罐捏得“嘎嘣”响,他舔着嘴唇上的酒液说:“我自有计划。”
16 nm纳米金依据相关文献方法制得(Storhoff et al., 1998)。在250 mL圆底烧瓶中加入100 mL 1 mmol·L-1HAuCl4·4H2O溶液,加热回流,随后加入10 mL 38.8 mmol·L-1柠檬酸钠溶液,剧烈搅拌20 min,该过程中溶液由淡黄色转变为酒红色。继续搅拌直至溶液冷却,产物于4 ℃下保存备用。
将300 μL 1.0×10-4mol·L-1硫普罗宁加入至15 mL 纳米金溶液中,缓慢震荡2 h后取出,移至离心管中离心以除去剩余硫普罗宁,随后分散在水中即得MPG-AuNPs。
1.2.2 MPG-AuNPs对Cu2+的比色检测
移取3 mL制备好的MPG-AuNPs溶液,加入不用浓度的Cu2+离子,调节溶液pH 5.0,均匀混合30 min,观察颜色变化。利用紫外-可见分光光度计对溶液进行光谱扫描,以吸光度比值(A650/A524)的变化情况为考察对象,确定显色最佳条件及检测限。
将同浓度的常见金属离子与Cu2+分别加入到MPG-AuNPs溶液中,并利用紫外-可见分光光度计进行光谱扫描,以最大吸光度长比值(A650/A524)的变化情况为考察对象,研究MPG-AuNPs的抗干扰能力。
2 结果与讨论
2.1 实验方法的可行性研究
图1解释了MPG-AuNPs比色检测Cu2+的传感机理。巯基是一种可稳定结合在纳米金粒子表面的基团,因此通过Au-S共价偶联作用硫普罗宁可修饰至纳米金粒子的表面(Liu et al., 2007)。另一方面,硫普罗宁另一端的羧基与氨基基团与Cu2+具有金属螯合能力,可作为Cu2+的比色配体基团。
用MPG-AuNPs纳米溶液检测浓度为60 μmol·L-1的Cu2+溶液,结果如图2所示。未加入Cu2+的纳米金溶液呈现紫色,表明纳米金仍处于良好的分散状态。UV-vis谱上,其特征离子吸收峰的位置在524 nm附近(曲线a),峰窄且尖。当向以上溶液中加入Cu2+后,溶液颜色转变为蓝色,其表面等离子体共振吸收发生红移,由原来的524 nm的尖锐吸收峰变为650 nm的宽峰(曲线b),这是由于Cu2+与羧基通过金属-配体协同作用形成配位键,缩短了纳米金粒子之间距离,纳米金粒子之间发生了聚集。加入Cu2+导致的MPG-AuNPs聚集也可由Zeta值的变化看出,加入Cu2+后的Zeta电位值明显降低,表明纳米金粒子表面电荷发生变化,MPG-AuNPs的稳定性降低,最终导致其大量聚集并产生颜色变化。

图2 MPG-Au NPs 检测Cu2+的紫外-可见吸收光谱图(插图为实际照片)Fig.2 UV-vis spectra of MPG-AuNPs for Cu2+ detection
2.2 pH对MPG-AuNPs比色检测Cu2+的影响
为了优化MPG-AuNPs测定Cu2+的最佳条件,利用单变量法考察了影响灵敏度、选择性和稳定性的因素。首先,以比色响应值(A650/A524)为考察对象,研究pH对测定Cu2+的影响。未加入Cu2+时,MPG-AuNPs不随pH的变化而变化,表明酸度对纳米金的聚集影响较小。而加入Cu2+后,A650/A524值迅速增加,在pH 5.0左右,达到最大值(图3)。因此,选取pH 5.0作为比色检测Cu2+的最佳溶液pH。

图3 pH 对MPG-AuNPs比色检测的Cu2+的影响Fig. 3 pH-dependent changes for Cu2+ detection
2.3 MPG-AuNPs比色检测Cu2+的响应时间研究
实验考察了不同Cu2+浓度时比色响应值(A650/A524)与时间的关系,来确定体系的稳定时间。由图4可以看出,加入Cu2+后,Cu2+浓度越高MPG-AuNPs的比色响应值(A650/A524)增加越大。并且随着Cu2+浓度增大,响应速度加快,10 min内发生颜色变化,基本在30 min左右达到显色稳定。因此选用30 min作为体系对Cu2+的检测时间。
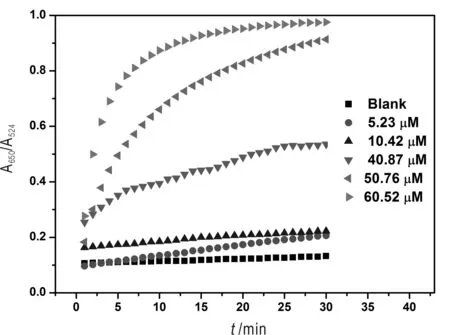
图4 时间对MPG-AuNPs比色检测的Cu2+的影响Fig.4 Time-dependent changes for Cu2+ detection
2.4 MPG-AuNPs对Cu2+浓度的线性检测
为了验证最佳条件下MPG-AuNPs检测Cu2+的灵敏度,选取不同浓度的Cu2+加入到MPG-AuNPs溶液中,显色30 min后分别进行紫外-可见吸收光谱分析和目视比色分析(图5)。Cu2+浓度在5.23~30.85 μmol·L-1范围内,Cu2+浓度与吸光度比值(A650/A524)有良好的线性关系,线性方程为(Y=0.124 63X-0.002 5)(R2=0.993 5)。理论计算证明该体系对Cu2+的检出限为0.97 μmol·L-1(S/N=3)。

图5 MPG-AuNPs对Cu2+比色检测的灵敏度Fig.5 Limit of MPG-AuNPs for Cu2+ detection
2.5 MPG-AuNPs纳米溶液检测Cu2+的选择性
研究MPG-AuNPs检测Cu2+的抗干扰能力,通过加入环境中常见重金属离子K+, Na+, Sr2+, Cs+, Hg2+, Co2+, Ni2+(浓度分别为100 μmol· L-1)。图6A为MPG-AuNPs检测不同离子的紫外-可见图谱。只有加入Cu2+的光谱曲线有明显红移,颜色变为蓝色。更重要的是,MPG-AuNPs的抗干扰能力可通过肉眼识别直接得到验证。MPG-AuNPs检测不同金属离子的吸光度比值(A650/A524)如图6B所示,加入60 μmol·L-1的Cu2+后,其吸光度比值与空白值形成鲜明对比。当加入100 μmol·L-1其他金属离子,与空白值相比,变化微小,接近相似。加入Cu2+的MPG-AuNPs吸光度比值约为其他金属离子的5倍以上。以上结果说明MPG-AuNPs中的羧酸基团对Cu2+有一定的选择性(显色机理如图1所示)。

图6 不同金属离子对Cu2+检测的干扰Fig.6 Interferences by other metal ions for Cu2+ detection
3 结论
本文以纳米金粒子为载体,将硫普罗宁在其表面形成硫普罗宁修饰的纳米金溶液(MPG-AuNPs)。在最佳pH 5.0时,MPG-AuNPS的对Cu2+的响应时间为30 min。体系对Cu2+的检出限分别为0.97 μmol·L-1(S/N=3),且对Cu2+离子有良好的选择性响应。该方法检不需要复杂昂贵的分析仪器和试剂,对水体中Cu2+的分析测定具有良好的应用前景。
李小燕, 阴强, 花榕, 等. 2012. 羧基化碳纳米管在分光光度法测定铜离子中的应用研究[J]. 东华理工大学学报:自然科学版, 35(4): 398-401.
Barranguet C, Ende FPVD, Rutgers M, et al. 2003. Copper-Induced Modifications of theTrophic Relations in Riverine Algal-Bacterial Biofilms[J]. Environ. Toxicol. Chem., 22(6):1340-1349.
Becker J S, Matusch A, Depboylu C, et al. 2007. Quantitative Imaging of Selenium, Copper, and Zinc in Thin Sections of Biological Tissues (Slugs-Genus Arion) Measured by Laser Ablation Inductively Coupled of Plasma Mass Spectrometry [J]. Anal. Chem., 79(16): 6074-6080.
Chai F, Wang C G, Wang T T, et al. 2010. L-Cysteine Functionalized Gold Nanoparticles for the Colorimetric Detection of Hg2+Induced by Ultraviolet Light [J]. Nanotechnology, 21(2):025501 (6pp)
Chan M S, Huang S D. 2000. Direct Determination of Cadmium and Copper in Seawater Using a Transversely Heated Graphite Furnace Atomic Absorption Spectrometer with Zeeman-Effect Background Corrector [J]. Talanta, 51(2): 373-380.
Herzog G, Arrigan D W M. 2003. Comparison of 2-Mercaptoethane Sulfonate and Mercaptoacetic Acid Disorganized Monolayer-Coated Electrodes for the Detection of Copper Via Underpotential Deposition-Stripping Voltammetry [J]. Electroanalysis, 15(15-16): 1302-1306.
Kubo Y,Uchida S, Kemmochi Y, et al. 2005. Isothiouronium-Modified Gold Nanoparticles Capable of Colorimetric Sensing of Oxoanions in Aqueous Meoh Solution [J]. Tetrahedron Lett., 46(25): 4369-4372.
Li L, Li B. 2009. Sensitive and Selective Detection of Cysteine Using Gold Nanoparticles as Colorimetric Probes [J]. Analyst, 134(7): 1361-1365.
Lin Y, Chen C, Wang C, et al. 2011. Silver Nanoprobe for Sensitive and Selective Colorimetric Detection of Dopamine Via Robust Ag-Catechol Interaction [J]. Chem. Commun., 47(4): 1181-1183.
Liu J, Lu Y. 2007. Colorimetric Cu2+Detection with a Ligation Dnazyme and Nanopairticles [J]. Chem. Commun., (46): 4872-4874.
Que E L, Domaille D W,Chang C J. 2008. Metals in Neurobiology: Probing Their Chemistry and Biology with Molecular Imaging [J]. Chem. Rev., 108(5): 1517-1549.
Storhoff J J, Elghanian R, Mucic R C, et al. 1998. One-Pot Colorimetric Differentiation of Polynucleotides with Single Base Imperfections Using Gold Nanoparticle Probes [J]. J. Am. Chem. Soc., 120(9): 1959-1964.
Wang Y, Yang F,Yang X R.2010. Label-Free Colorimetric Biosensing of Copper(II) Ions with Unimolecular Self-Cleaving Deoxyribozymes and Unmodified Gold Nanoparticle Probes [J]. Nanotechnology, 21(20): 205502(6pp).
Wu J F, Boyle E A.1997. Low Blank Preconcentration Technique for the Determination of Lead, Copper, and Cadmium in Small-Volume Seawater Samples by Isotope Dilution Icpms [J]. Anal. Chem., 69(13): 2464-2470.
Zhang M,Liu Y Q, Ye B C. 2012. Colorimetric Assay for Parallel Detection of Cd2+, Ni2+and Co2+Using Peptide-Modified Gold Nanoparticles [J]. Analyst, 137(3): 601-607.
Colorimetric Detectionof Cu2+Using N-(2-Mercaptopropionyl)glycine (MPG)-functionalized Gold Nanoparticles
CAO Xiao-hong1,2, LI Fang-qing2, MA Ru-chao2, LIU Yun-hai1,2, ZHANG Zhi-bin1,2
(1. State Key Laboratory Breeding Base of Nuclear Resources and Environment, East China Institute of Technology, Nanchang,JX 330013, China; 2 School of Chemical, Biological and Materials Sciences, East China Institute of Technology, Nanchang,JX 330013, China)
A simple and selective colorimetric sensor based on N-(2-Mercaptopropionyl)glycine (MPG)-functionalized gold nanoparticles (MPG-AuNPs) has been developed for the detection of Cu2+. MPG-AuNPs rapidly aggregated in the presence of Cu2+, thereby causing a visual color change from red to blue, which is easily detectable by eye or a UV-vis spectrophotometer. The absorbance ratio (A650/A524) was linear with the Cu2+concentration. Under optimum condition (pH 5.0), the detection limit of Cu2+was 0.97 μmol·L-1(S/N=3). The proposed sensing system possesses a selective response for Cu2+over other heavy metal ions.
colorimetric sensor; N-(2-Mercaptopropionyl)glycine; gold nanoparticles; copper ion
2014-11-07
国家自然科学基金项目(21301028);江西省教育厅科技项目(GJJ14472);江西省科技厅科技支撑计划项目(20151BBG70010)
曹小红(1974—),女,博士,副教授,主要从事分析化学的研究工作。 E-mail: xhcao@ecit.cn
10.3969/j.issn.1674-3504.2015.04.015
O652
A
1674-3504(2015)04-0433-05
