CYP2E1基因RsaI/PstI多态性与膀胱癌遗传易感性的Meta分析
2015-06-21李家兵林世庆
李家兵,张 盼,林世庆,孙 懿
(四川省绵阳市第三人民医院泌尿外科,四川 绵阳 621000)
CYP2E1基因RsaI/PstI多态性与膀胱癌遗传易感性的Meta分析
李家兵,张 盼,林世庆,孙 懿
(四川省绵阳市第三人民医院泌尿外科,四川 绵阳 621000)
目的 探讨CYP2E1基因RsaI/PstI多态性与膀胱癌遗传易感性的关系。方法 检索PubMed、Medline、Web of Science、中国学术期刊全文数据库(CNKI)、万方数据库和VIP数据库,检索时间截止时间为2014年2月,获取有关CYP2E1基因RsaI/PstI多态性与膀胱癌遗传易感性的病例-对照研究。以病例组与对照组人群基因型分布的OR值及其95%CI 为效应指标,运用Stata 11.0软件在同质、异质、显性和隐性遗传模式下进行meta分析。结果 共纳入8个研究(试验组1733例和对照组1814例)。Meta分析结果显示CYP2E1基因RsaI/PstI多态性与膀胱癌遗传易感性在异质和显性遗传模式下均存在明显的统计学意义(异质模式:OR=0.831,95%CI:0.701~0.986,P= 0.033;显性模式:OR=0.816,95%CI:0.694~0.959,P= 0.014);按种族进行亚组分析,结果显示该遗传易感性在亚洲人群中较显著。结论 CYP2E1基因RsaI/PstI多态性可能与亚洲人群膀胱癌遗传易感性有关,需开展更多高质量、大样本的随机对照试验加以验证。
CYP2E1;单核苷酸多态性;遗传易感性;膀胱癌;Meta分析
膀胱癌是全球常见的泌尿系统恶性肿瘤,是我国死亡率最高的10种肿瘤之一;在我国泌尿系统肿瘤中,膀胱癌的发病率和死亡率占据首位[1,2]。目前,膀胱癌的具体发病机制还不甚清楚,但它是环境因素和遗传因素共同作用的结果已得到大家的一致认可。有研究表明吸烟、饮酒和职业暴露是膀胱癌最常见的环境因素[3,4],同时也发现,尽管很多人接触相同的危险因素,但最终发展为膀胱癌的仅占少数,提示个体易感性存在差异。随着细胞分子生物学的发展,人们意识到遗传变异导致基因生物学功能改变可能是个体易感性存在差异的关键所在。近年来已有许多学者从Ⅰ相代谢酶CYP2E1基因RsaI/PstI多态性与膀胱癌易感性的方面进行了研究,但研究结论并不完全一致[5,6]。本研究运用Meta分析方法进行了综合客观的分析评价,以探讨该基因多态性与膀胱癌易感性的关系。
1 资料与方法
1.1 文献检索 以细胞色素 P450 2E1、单核苷酸多态性、膀胱癌等为主题词,检索中国学术期刊全文数据库(CNKI)、万方数据库和VIP数据库;以Cytochrome P450 2E1 or CYP2E1、polymorphisms or SNPs or mutation or variant or variation、bladder cancer等为主题词,检索PubMed、Medline和Web of Science英文数据库,收集国内外公开发表CYP2E1基因RsaI/PstI多态性与膀胱癌遗传易感性的相关文献。检索截止时间为2014年2月。文献纳入标准:①文献语种限于中文和英文;②关于人群研究CYP2E1基因RsaI/PstI多态性与膀胱癌遗传易感性;③病例-对照研究,包括回顾性/巢式实验-对照研究;④直接或间接报告等位基因频率和基因型分布的数据,可计算OR值和95%CI;⑤不限文献的研究样本量;⑥如果同一作者或单位发表一篇以上相关或类似的文献,纳入样本量最大的文献,排除重复的其它文献;⑦ 未公开发表的文献不纳入。
1.2 数据的提取 两位作者独立评阅检索文献并按照上述文献纳入标准提取相关文献信息,包括文献的第一作者、发表时间、种族和国家、实验组和对照组基因型/等位基因数据、HWE、基因分型技术、实验组和对照组参数匹配情况。由第3位作者核实,争议之处共同讨论并达成一致。
1.3 统计学方法 采用Stata 11.0 软件进行统计学分析。采用卡方检验分析纳入文献中对照组的HWE,P< 0.05为对照组人群偏离HWE。采用Q 检验在不同遗传模式下对纳入研究进行异质性分析(异质模式:C1C2 vs C1C1;同质模式:C2C2 vs C1C1、显性模式:C2C2/C1C2 vs C1C1;隐性模式:C2C2 vs C1C1/C1C2),如纳入研究间同质(PQ>0.1和I2<50%),则采用固定效应模型进行合并分析;反之,则采用随机效应模型进行合并分析[7,8]。若纳入文献报告基因型数据为0,则该基因型加1后计算各研究合并的OR值及其95%CI[9],评估CYP2E1基因RsaI/PstI多态性与膀胱癌遗传易感性之间的相关性。若研究间存在异质性,运用亚组分析(HWE、种族)、Meta回归、及结合Galbraith 图寻找异质性来源。Meta回归参数包括样本量大小(≥500为大样本,反之为小样本)、HWE、基因分型技术、种族、匹配参数及对照组来源。Meta分析可靠性用敏感性分析评价,发表偏倚用Egger’s和Begg’s分析[10]。P< 0.05为差异有统计学意义。
2 结果
2.1 纳入研究的基本特征 初次检索相关文献26篇(英文数据库17篇,中文数据库9篇),剔重后剩下22篇,通过阅读标题和摘要排除4篇不相关文献,剩下18 篇文献通过阅读全文排除10篇文献,最终符合纳入标准的文献8篇。纳入文献有2篇中文文献[11,12],6篇英文文献[5,6,13~16];6篇亚洲人群[6,11~14,16],2篇高加索人群[5,15];6篇小样本量研究[6,11~14,16],2篇大样本量研究[5,15],其中样本量最少100例,最大1294例;除1篇文献采用GoldenGate assay基因分型技术外[5],其余7篇均采用PCR-RFLP基因分型技术;6篇文献描述年龄和性别均匹配[5,11~13,15,16],1篇文献性别匹配但年龄不匹配[14],1篇文献年龄匹配但未描述性别匹配情况[6],其中量2篇文献研究人群均为男性[14,16];其中5篇不符合HWE[5,6,11,12,16]。纳入文献的主要研究特征和基因型分布情况见表1。
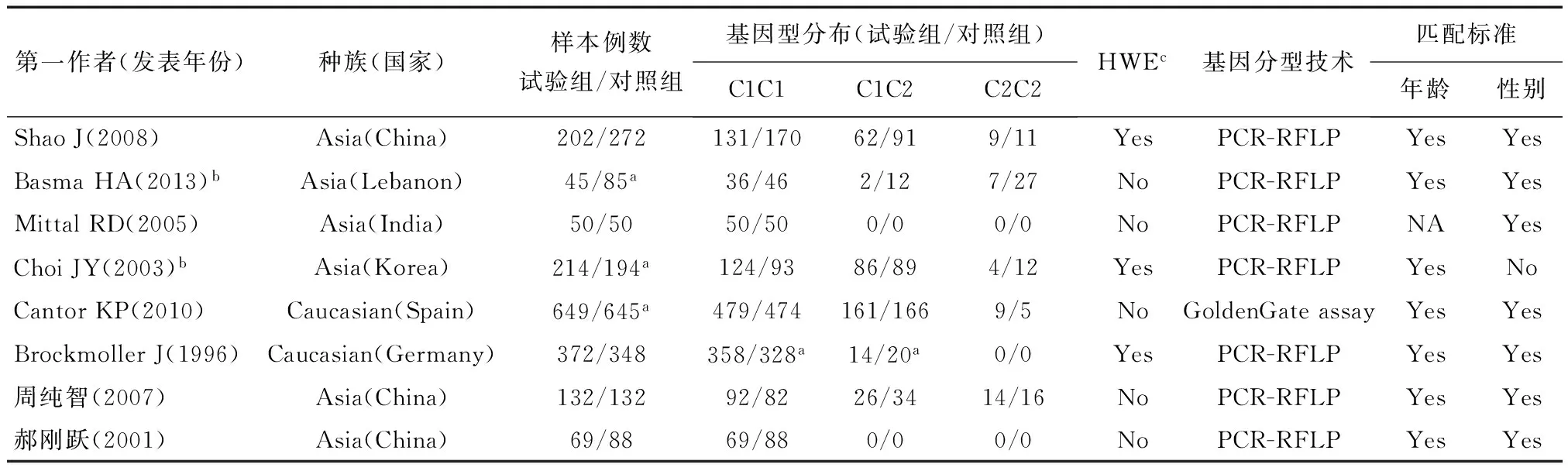
表1 纳入研究的基本特征
a:根据文中给出比例计算基因型数据;b:试验组和对照组性别均为男性;c:哈迪-温伯格平衡定律
2.2 Meta分析主要结果 表2显示CYP2E1基因RsaI/PstI多态性与膀胱癌遗传易感性关联在不同遗传模式的主要Meta分析结果。Meta分析结果表明CYP2E1基因RsaI/PstI多态性与膀胱癌遗传易感性在异质和显性遗传模式下均存在明显的统计学意义(异质模式:OR=0.831,95%CI:0.701~0.986,POR=0.033;显性模式:OR=0.816,95%CI:0.694~0.959,POR=0.014)(图1);按种族亚组分析结果显示RsaI/PstI多态性在亚洲人群中明显统计学差异(异质模式:OR=0.748,95%CI:0.584~0.957,POR=0.021;同质模式:OR=0.577,95%CI:0.373~0.892,POR=0.013;显性模式:OR=0.716,95%CI:0.571~0.898,POR=0.004;隐性模式:OR=0.641,95%CI:0.417~0.985,POR=0.043)。异质性检验结果显示该meta分析在四种遗传模式均不存在显著异质性(异质模式:I2=0.0%,PQ=0.563;同质模式:I2=25.5%,PQ=0.226;显性模式:I2=29.6%,PQ=0.192;隐性模式:I2=12.2%,PQ=0.335)(表2),表明本研究所纳入的文献是可靠的。
2.3 发表偏倚及敏感性分析 Begg(P> 0.458)和Egger(P> 0.254)分析说明该Meta分析不存在发表偏倚(图2);敏感性分析结果表明当前Meta分析结果是稳定可靠的。
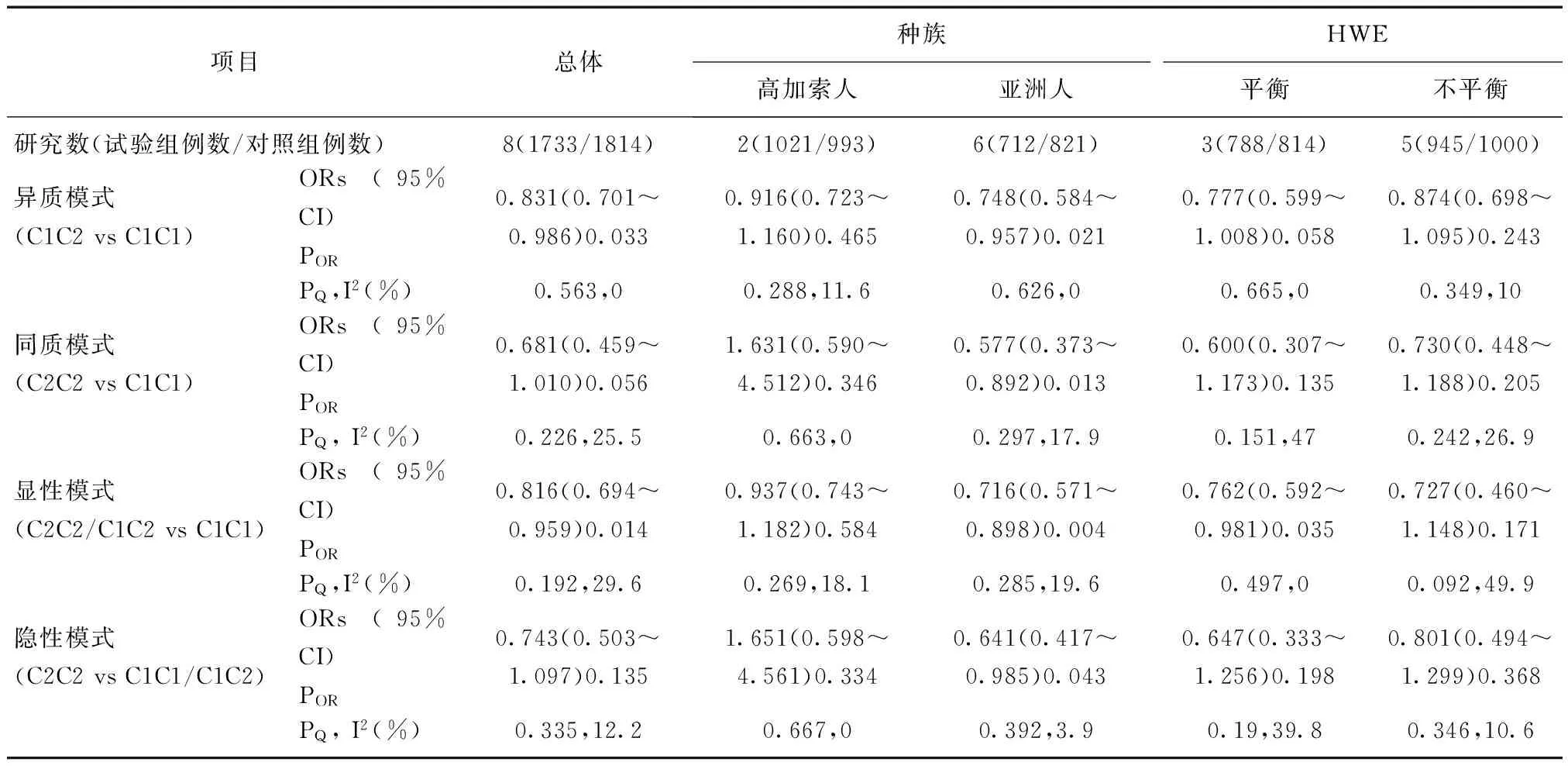
表2 不同遗传模式CYP2E1基因RsaI/PstI多态性与膀胱癌遗传易感性Meta分析结果
ORs为比值比;PQQ为检验P值;I2为异质性比例
3 讨论
细胞色素p450(CYP)是一类含亚铁血红素的超家族酶系,参与内、外源性毒物的氧化、还原、水解代谢。CYP450为多基因家族,其CYP2E1主要代谢前致癌物和前毒物,被认为是机体对环境和工业毒物或致癌物的敏感程度起决定因素的代谢酶[17]。CYP2E1基因多态性在癌变始动阶段对环境致癌物的敏感程度起着关键作用[18]。近年来,CYP2E1基因RsaI/PstI多态性与膀胱癌易感性关联最具争议[5,6,11~16]。本研究采用系统评价和Meta分析方法分析CYP2E1基因RsaI/PstI多态性与膀胱癌易感性是否存在相关性。
本研究结果显示CYP2E1基因RsaI/PstI多态性携带C2的基因型个体明显降低膀胱癌发病风险,表明C2突变子是其保护因素。膀胱癌是遗传和环境因素共同作用的结果,一般情况下致癌物本身并不直接致癌,在体内经过一系列代谢酶激活后产生终致癌物。该致癌物与核酸和蛋白质等大分子物质结合,引起细胞膜结构破坏、DNA损伤、基因突变和(或)细胞转化,最终可能导致机体癌症的发生[19]。CYP2E1基因表达水平一般较低,但可被前致癌物或前毒物高度诱导;然而RsaI/PstI多态性可能改变该酶的诱导性,变异基因型可能导致该诱导性减弱或丧失[20]。CYP2E1基因5’-端非编码区(5’-UTR)的RsaI/PstI多态性C2等位基因直接或间接影响其表达和转录,降低CYP2E1酶活力[21,22];研究发现C2等位基因在体内的活性显著低于C1等位基因,这从生物学角度解释了CYP2E1基因RsaI/PstI多态性与膀胱癌易感性间的关系。因此,C2等位基因降低CYP2E1基因活性,抑制前致癌物转化成终致癌物的代谢过程,降低膀胱癌发病风险。然而,该多态性的分布存在明显种族差异[23];研究发现C2 等位基因频率亚洲人群明显高于高加索人群[24]。本研究按照种族进行亚组分析显示C2突变子在亚洲人群中可能是膀胱癌的保护因素,但在高加索人群中未发现此现象,这也证实了以往的研究结论[23,24]。本研究异质性检验未发现各研究间存在明显的异质性,表明本研究所纳入的文献是可靠的;同时敏感性分析证实本研究结果是稳定可靠的。
本研究结果存在某些偏倚风险:①较多文献中不符合HWE(5篇),同时,某些研究存在人口学特征差异,可能使meta分析结果存在某些偏倚。②研究未纳入其他语种以及未公开发表的文献,可能会造成某些偏倚。③纳入研究中受试者绝大多数都是亚洲人群,同时,纳入样本数相对较小可能导致统计学差异;其Meta分析结果对亚洲人群具有参考价值,不能在整个人群中运用,如高加索人群和非洲人群。④缺乏CYP2E1基因其他多态性及其他基因的多态性数据和环境因素相关数据,未能分析基因-基因或者基因-环境的相互作用关系。但本研究没有发表偏倚和显著异质性,敏感性分析显示Meta分析结果是稳定可靠的,说明本研究结论具有可靠性。因此,要通过多中心、随机、大样本的在不同种族进行前瞻性试验或全基因测序(GWAS)进一步验证本研究的结论。

图1 CYP2E1基因RsaI/PstI多态性与膀胱癌遗传易感性的Meta分析森林图 a:异质模式;b:显性模式

图2 CYP2E1基因RsaI/PstI多态性与膀胱癌遗传易感性的Meta分析Begg’s分析图 a:异质模式;b:同质模式;c:显性模式;d:隐性模式
综上所述,当前Meta分析显示CYP2E1基因RsaI/PstI多态性可能与亚洲膀胱癌遗传易感性有相关性。
[1] 韩苏军,张思维,陈万青,等.中国膀胱癌发病现状及流行趋势分析[J].癌症进展,2013,11(1):89-95.
[2] Ploeg M,Aben KK,Kiemeney LA.The present and future burden of urinary bladder cancer in the world[J].World J Urol,2009,27(3):289-293.
[3] 宋瑞祥,许传亮,张振声,等.饮酒与膀胱癌发病危险的Meta分析[J].实用医院临床杂志,2014,11(4):16-22.
[4] Kiriluk KJ,Prasad SM,Patel AR,et al.Bladder cancer risk from occupational and environmental exposures[J].Urol Oncol,2012,30(2):199-211.
[5] Cantor KP,Villanueva CM,Silverman DT,et al.Polymorphisms in GSTT1,GSTZ1,and CYP2E1,disinfection by-products,and risk of bladder cancer in Spain[J].Environ Health Perspect,2010,118(11):1545-1550.
[6] Mittal RD,Srivastava DS.Genetic polymorphism of drug metabolizing enzymes(CYP2E1,GSTP1)and susceptibility to bladder cancer in North India[J].Asian Pac J Cancer Prev,2005,6(1):6-9.
[7] Wang Y,Kong CZ,Zhang Z,et al.Relationships between CYP1 A1 genetic polymorphisms and bladder cancer risk:a meta-analysis[J].DNA Cell Biol,2014,33(3):171-181.
[8] Higgins JP,Thompson SG.Quantifying heterogeneity in a meta-analysis[J].Stat Med,2002,21(11):1539-1558.
[9] Camargo MC,Mera R,Correa P,et al.Interleukin-1beta and interleukin-1 receptor antagonist gene polymorphisms and gastric cancer:a meta-analysis[J].Cancer Epidemiol Biomarkers Prev,2006,15(9):1674-1687.
[10]Egger M,Davey SG,Schneider M,et al.Bias in meta-analysis detected by a simple,graphical test[J].BMJ,1997,315(7109):629-634.
[11]周纯智.CYP2E1及GSTM1基因多态性与膀胱癌易感性的研究[D].长春:吉林大学,2007.
[12]郝刚跃.膀胱肿瘤代谢酶基因多态性和细胞周期蛋白的研究[D].济南:山东大学,2001.
[13]Shao J,Gu M,Zhang Z,et al.Genetic variants of the cytochrome P450 and glutathione S-transferase associated with risk of bladder cancer in a south-eastern Chinese population[J].Int J Urol,2008,15(3):216-221.
[14]Choi JY,Lee KM,Cho SH,et al.CYP2E1 and NQO1 genotypes,smoking and bladder cancer[J].Pharmacogenetics,2003,13(6):349-355.
[15]Brockmoller J,Cascorbi I,Kerb R,et al.Combined analysis of inherited polymorphisms in arylamine N-acetyltransferase 2,glutathione S-transferases M1 and T1,microsomal epoxide hydrolase,and cytochrome P450 enzymes as modulators of bladder cancer risk[J].Cancer Res,1996,56(17):3915-3925.
[16]Basma HA,Kobeissi LH,Jabbour ME,et al.CYP2E1 and NQO1 genotypes and bladder cancer risk in a Lebanese population[J].Int J Mol Epidemiol Genet,2013,4(4):207-217.
[17]Gonzalez FJ.Role of cytochromes P450 in chemical toxicity and oxidative stress:studies with CYP2E1[J].Mutat Res,2005,569(1-2):101-110.
[18]石云.生物转化酶类基因多态性与肿瘤易感性[J].国外医学(分子生物学分册),2001,(05):267-270.
[19]Yue J,Peng R,Chen J,et al.Effects of rifampin on CYP2E1-dependent hepatotoxicity of isoniazid in rats[J].Pharmacol Res,2009,59(2):112-119.
[20]林东昕,唐永明,彭琼,等.细胞色素P450 2E1和谷胱甘肽转硫酶P1基因与食管癌易患性[J].中华肿瘤杂志,1998,20(2):14-17.
[21]Marchand LL,Wilkinson GR,Wilkens LR.Genetic and dietary predictors of CYP2E1 activity:a phenotyping study in Hawaii Japanese using chlorzoxazone[J].Cancer Epidemiol Biomarkers Prev,1999,8(6):495-500.
[22]Kim RB,Yamazaki H,Chiba K,et al.In vivo and in vitro characterization of CYP2E1 activity in Japanese and Caucasians[J].J Pharmacol Exp Ther,1996,279(1):4-11.
[23]王建,刘焯霖,卢锡林,等.广州地区汉族人群细胞色素P4501 A1和细胞色素P4502E1基因多态性[J].中华医学遗传学杂志,2000,17(4):38-40.
[24]Stephens EA,Taylor JA,Kaplan N,et al.Ethnic variation in the CYP2E1 gene:polymorphism analysis of 695 African-Americans,European-Americans and Taiwanese[J].Pharmacogenetics,1994,4(4):185-192.
Association between CYP2E1 RsaI/PstI polymorphism and bladder cancer genetic susceptibility:A meta-analysis
LI Jia-bing,ZHANG Pan,LIN Shi-qing,SUN Yi
(Department of Urology,The Third Hospital of Mianyang,Mianyang 621000,China)
Objective To investigate the association between CYP2E1 RsaI/PstI polymorphism and bladder cancer genetic susceptibility.Methods Literatures were retrieved in electronic databases including PubMed,Medline,Web of Science,CNKI,WanFang and VIP up to Feb,2014 to collect the case-control studies on CYP2E1 RsaI/PstI polymorphism and bladder cancer genetic susceptibility.For population genotype distributions of both case and control groups,their odds ratios(ORs)and 95% confidence intervals(CIs)were taken as the effect indexes.Either the fixed or random effect model was applied to conduct Meta-analysis by Stata 11.0 software including heterozygote,homozygote,dominant and recessive genetic models.Results A total of 8 case-control studies were identified involving 1733 cases and 1814 controls.Our meta-analysis showed that CYP2E1 RsaI/PstI polymorphism was significantly associated with bladder cancer under homozygote and dominant genetic model(homozygote:OR= 0.831,95%CI= 0.701~0.986,P= 0.033;dominant:OR= 0.816,95%CI= 0.694~0.959,P= 0.014).Subgroup analysis by ethnicity was significantly associated with Asian population.Conclusion The meta-analysis suggest that CYP2E1 RsaI/PstI polymorphism might be associated with bladder cancer susceptibility in Asians.Further studies are needed to validate the results.
CYP2E1;Single nucleotide polymorphism;Genetic susceptibility;Bladder cancer;Meta-analysis
四川省绵阳市科技局科研基金资助项目(编号:11M011);四川省绵阳市卫生局科研基金资助项目(编号:201103)
R737.14
A
1672-6170(2015)05-0241-05
2014-12-04;
2015-03-05)
