SO2通入Ba(NO3)2溶液中反应原理的实验研究
2015-06-18庾丹叶芬芬马宏佳
庾丹+叶芬芬+马宏佳
摘要:SO2气体通入Ba(NO3)2溶液中会产生沉淀,其原因是氧气和硝酸根的氧化作用,人们一般认为反应中硝酸根氧化亚硫酸根的能力更强,是产生沉淀的主导因素。本文通过对比实验,利用pH传感器,得到不同反应条件下溶液的pH变化曲线,分析曲线得知在该反应中氧气和硝酸根都能够氧化亚硫酸根,但是氧气氧化能力更强。
关键词:pH传感器;SO2;Ba(NO3)2溶液;BaCl2溶液
文章编号:1005–6629(2015)4–0069–03 中图分类号:G633.8 文献标识码:B
1 问题的提出
SO2是典型的无机化合物之一,在习题或者高考题中也常出现“向Ba(NO3)2溶液中通入SO2气体,预测实验现象”等类似的题目。基本的共识是:SO2气体通入Ba(NO3)2溶液中会产生BaSO4沉淀,因为溶液中氧气和硝酸根都可以将亚硫酸根氧化为硫酸根,考虑到硝酸的强氧化性,有人认为硝酸根的氧化作用是主要的。我们的问题是:上述情况下,氧气和硝酸根是否都起了氧化剂作用?如果是,氧气和硝酸根何者氧化亚硫酸根的能力更强?
2 实验设计
为了探究SO2气体通入Ba(NO3)2溶液的反应中氧气与硝酸根的氧化作用,我们设计了对比实验。用数字化实验系统分别测定SO2气体在有氧和无氧情况下通入BaCl2溶液、Ba(NO3)2溶液时体系的pH变化曲线,再通过对上述曲线的对比分析得出结论。
2.1 实验用品
实验药品:食用油、蒸馏水、0.1 mol/L的Ba(NO3)2溶液、0.1 mol/L的BaCl2溶液、Na2SO3固体、稀H2SO4溶液(浓硫酸与水体积比1:5)、饱和NaOH溶液
实验仪器:pH传感器(Vernier公司产品)、带活塞的注射器、玻璃导气管、玻璃尖嘴管、橡皮导管、酒精灯、铁架台、50mL小烧杯若干、锥形瓶若干
2.2 实验装置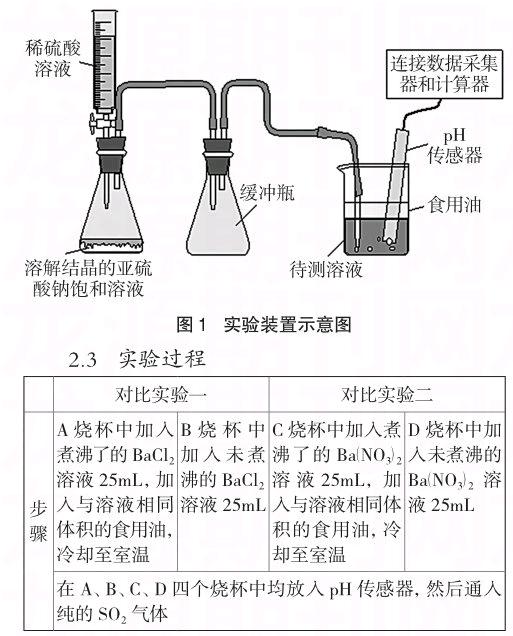
2.4 注意事项
以上实验装置是经过多次试验不断改进得到的,针对以上实验,有以下三点需要特别注意:
2.4.1 隔绝氧气
为了使实验更加简单,我们采取气封与液封相结合的方式。决定实验成败的关键因素之一就是是否完全隔绝氧气[1]。在实验中,但凡有少量的氧气混入都会影响pH曲线的变化,所以在实验前要进行多次查漏操作,确保装置密封效果好之后再进行后续工作。
2.4.2 通入SO2的速率
在以往的文献中给出的制备SO2的方法是将浓硫酸与固体亚硫酸钠反应[2],我们发现用这种方法不易控制SO2气体的产生速率,而且比较浪费实验药品,污染也比较严重,故尝试了多种方法解决这个问题:
首先减小浓硫酸浓度,将浓硫酸与水以体积比1:5进行稀释;然后将制取二氧化硫气体的亚硫酸钠固体进行加热溶解、冷却结晶,使之均匀地平铺于锥形瓶底部,避免亚硫酸钠在制气过程中发生板结而影响气体产生的速率;最后加一缓冲瓶以达到双重保险的效果,这样就能使通入溶液中的SO2气体的速率比较稳定,大约每秒一个气泡。二氧化硫气泡的产生速率直接影响着曲线的平滑程度。
2.4.3 pH传感器
pH传感器是比较灵敏的数字化仪器,本实验将pH传感器放入液封的待测溶液时由于穿过油层,仪器表面会沾有食用油而使读数波动较大,需待读数稳定以后方可开始实验测定。
3 实验现象与pH图分析
3.1 实验现象
A烧杯溶液依然澄清,无明显现象;B烧杯中出现轻微浑浊;C、D两个烧杯中均出现浑浊现象。
初步结论:
(1)在氯化钡溶液中,有氧气才可氧化亚硫酸根,产生硫酸钡沉淀。
(2)在硝酸钡溶液中,有无氧气参加都能产生硫酸钡沉淀,但氧气和硝酸根何者起了主要的氧化作用还需要进一步分析。
3.2 pH图分析

比较图2与图3可知,无氧参加的反应中,pH曲线呈缓慢下降趋势,说明没有发生氧化反应,仅有SO2溶解于氯化钡溶液中的pH变化。当有氧气参与反应时,pH曲线出现骤降,表明溶液中发生反应生成了H+,故有硫酸钡沉淀生成。氧气是致使氯化钡产生沉淀的因素。
比较图4与图5可见,SO2通入硝酸钡中,pH曲线都出现了骤降,说明氧气和硝酸根都可以氧化亚硫酸,导致硫酸钡沉淀的生成。在有氧参加的反应中pH的变化比无氧参加的大,说明氧气的影响是不可忽视的。
进一步比较图3与图5发现,两幅图的大致形状很像,也就是说,在有氧气存在的BaCl2和Ba(NO3)2溶液中通入SO2时,溶液pH下降的趋势和程度都非常接近,换句话说,是氧气的氧化起了主要作用。
为了更好地观察,将图3和图5合并在一起。如图6所示。
两条曲线基本上能够重合,SO2气体通入硝酸钡溶液中pH变化比通入氯化钡中的略大一点点,这一点点区别的原因正是硝酸根的影响,如果硝酸根不起作用,理论上两条曲线将重合。
另外,需要说明的是,在图2至图5中,相同溶液有氧和无氧情况下溶液的起始pH不同(图2无氧氯化钡溶液起始pH=5.03;图3有氧氯化钡溶液起始pH=4.77;图4无氧硝酸钡溶液起始pH= 5.06;图5有氧硝酸钡溶液起始pH=5.29),一方面是由于pH传感器本身的误差所致,另一方面在加热溶液去除氧气的同时,也会影响溶液本身的pH。
4 理论分析

但热力学数据只能告诉我们上述条件下氧气和硝酸根何者的氧化性更强,并不能说明哪个氧化反应速率更快,动力学问题的解决往往要依据实验数据。本实验所测得的pH随时间变化的数据说明了在SO2与硝酸钡溶液的反应中,是氧气起了主要的氧化作用,硝酸根起了次要的氧化作用。这一结论与上述条件下氧气氧化性强于硝酸根正好是一致的。
5 研究结论
综上所述,将SO2气体通入硝酸钡溶液中起主要氧化作用的是氧气,起次要氧化作用的是硝酸根。溶液中氧气氧化亚硫酸生成硫酸的作用不可小视。
参考文献:
[1][2]邹正良,于永民. SO2气体通入BaCI2溶液实验的探究[J].化学教学,2012,(4):52.
[3]北京师范大学,华中师范大学,南京师范大学无机化学教研室编.无机化学(第四版)[M].北京:高等教育出版社,2008:421~424.
