多重实时荧光定量PCR鉴别欧洲型、美洲型和高致病性PRRSV 检测方法的建立
2015-06-18温青娜周玲玲杨菊凤林祥群
温青娜,周玲玲,申 红,杨菊凤,林祥群
(1.河南科技学院,河南新乡 453000;2.广东中大南海海洋生物技术工程中心有限公司,广东广州 510330;3.石河子大学,新疆石河子 832003;4.山东畜牧兽医职业学院,山东潍坊 261061;5.石河子职业技术师范学院,新疆石河子 832003)
猪繁殖与呼吸综合征(Porcine reproductive and respiratory syndrome,PRRS)是由猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)引起猪的一种接触性病毒性传染病,典型症状为怀孕母猪流产、早产、产死胎和木乃伊胎增多,仔猪主要为呼吸困难、高死产率等特征。自我国首次分离到PRRSV以来,该病先后在国内的多个省市暴发和流行,给我国养猪业造成巨大的经济损失,成为危害当今养猪业的主要疫病之一[1]。PRRSV有欧洲型、美洲型毒株。起初,欧洲型只发生在欧洲,而美洲型则只限制在亚洲和北美。但是近年来,PRRSV打破了原有地理因素的限制,在欧洲、北美和亚洲地区,欧洲型及美洲型PRRSV已经被同时监测到[2]。近年来国内也有欧洲型PRRSV发病的报道[3]。此外,也有人们从组织病料中分离出疑似欧洲型PRRSV疫苗株的报道[4]。国内猪场中欧洲型PRRSV的阳性检出加剧了我国猪繁殖与呼吸综合征的鉴别与防控难度。美洲型和欧洲型PRRSV的基因序列同源性不是很高,但二者在基因组结构组成、功能和生物学特征等方面均具有一致性[4]。目前,国内猪繁殖与呼吸综合征毒株主要是以美洲型为主,经典毒株与高致病性变异毒株并存,同时欧洲型也有感染,且呈上升趋势[5]。目前国内尚未有鉴别检测不同型别PRRSV的报道。本研究根据多重实时荧光定量PCR的原理,建立一种快速鉴别美洲型、欧洲型和高致病性猪繁殖与呼吸综合征病毒的检测方法,针对猪群中的不同型别的PRRSV进行检测,具有良好的临床应用价值。
1 材料与方法
1.1 材料
1.1.1 毒株及疫苗 猪轮状病毒标准株(RN)来源于中国兽医微生物菌株保藏管理中心;猪乙型脑炎活疫苗(SA-14-14-2株)购自中牧实业股份有限公司;高致病性猪繁殖与呼吸综合征活疫苗(JXA1-R株)购自广东大华动物保健品股份有限公司;猪繁殖与呼吸综合征疫苗(CH-1R株)购自上海诺科生物药品有限公司;猪瘟(CSFV)活疫苗购自广东永顺生物制药有限公司;猪口蹄疫O型灭活疫苗(O2K/93株+OS/99株)购自新疆天康;猪传染性胃肠炎和流行性腹泻二联灭活疫苗(TEGV+PEDV)购自上海海利生物药品有限公司;猪腹泻三联疫苗(TGEV+PEDV+RN)购自河南省宝依特生物技术有限公司。
1.1.2 主要试剂 Premix ExTaqTM(Probe qPCR)、ExTaq®、Prime ScriptTM1st Strand cDNA Synthesis Kit、pMD18-T Vector购自宝生物工程(大连)有限公司;PfuTaqDNA Polymeras购自Sigma公司;Trizol@Reagent购自In Vitrogen公司。
1.2 方法
1.2.1 引物与探针的设计 用Bioedit软件对GenBank数据库中已发布的60株欧洲型和60株美洲型PRRSV N基因序列,97株美洲型和30株欧洲型PRRSV的M基因序列,30株高致病性PRRSV和30株普通PRRSV的NSP2基因序列,进行同源性分析,根据各基因保守区,用 Primer express 3.0设计相应的引物和探针(表1),由英俊公司合成。
1.2.2 SOE PCR引物的设计 以上述欧洲型PRRSV的扩增片段为目的基因,应用Primer primer5.0进行SOE PCR引物设计,OU1和OU2两条引物之间有16个~23个碱基序列反向互补,引物由英俊公司合成。

表1 本研究所用引物信息Table 1 The information of primers used in the study
1.2.3 欧洲型PRRSV 重组质粒的构建 利用SOE PCR技术人工合成欧洲型PRRSV的目的基因片段。SOE PCR扩增体系(50μL):1×Pfu buffer,dNTPs 0.2mmol/L,PfuTaqDNA Polymeras 1.25U,OU1和 OU2各0.4μmol/L。反应条件为:95℃3min;95℃ 30s,55℃ 30s,72℃ 30s,30个循环;72℃10min。反应结束后在产物中加入Taq5U,dNTPs 0.2mmol/L,72℃30min。回收SOE PCR产物并克隆至pMD18-T载体中,对重组质粒进行测序分析,确定为欧洲型PRRSV目的基因,用紫外分光光度计测其OD 260nm,换算成摩尔浓度后,稀释至1×106copies/μL,置-20℃保存备用。
1.2.4 美洲型和高致病性PRRSV重组质粒的构建 按照TRizol@Reagent(In-Vitrogen公司)的操作说明书对高致病性猪繁殖与呼吸综合征活疫苗(JXA1-R株)的 RNA进行提取,接着用Prime-ScriptTM1st Strand cDNA Synthesis Kit合成cDNA。取2μL cDNA进行PCR扩增,反应体系(50 μL):1×PCR buffer、ExTaq1.25U,dNTPs Mixture 0.2mmol/L,上、下游引物各20μmol/L,其余以双蒸水加至50μL。反应程序:94℃30s;94℃30 s,58℃30s,72℃30s,30个循环;72℃10min。回收PCR产物并克隆至pMD18-T载体中,对重组质粒进行测序分析,确定为美州型和高致病性PRRSV目的基因,测OD 260nm换算浓度后,均稀释至1×106copies/μL,置-20℃保存备用。
1.2.5 多重荧光PCR反应体系与反应条件的优化以稀释后的质粒为模板,用Premix ExTaqTM(Probe qPCR)体系在不同退火温度(54℃~62℃)下进行复合实时荧光定量PCR反应,同时应用矩阵优势法对荧光PCR体系中探针用量(2μmol/L~8μmol/L)和引物用量(5μmol/L~15μmol/L)进行优化,得到复合实时荧光定量PCR的最佳反应条件和反应参数。
1.2.6 特异性试验 以特异性样本JXA1-R株、CH-1R株、猪瘟活疫苗(兔源)、猪轮状病毒标准株、猪口蹄疫O型灭活疫苗(O2K/93株+OS/99株)、猪乙型脑炎活疫苗(SA-14-14-2株)、猪腹泻三联疫苗TGEV+PEDV+RN等的cDNA为模板进行检测,以验证该方法的特异性。
1.2.7 灵敏性试验和标准曲线的建立 将浓度为1×106copies/μL 的美洲型、欧洲型和高致病性PRRSV的重组质粒10倍系列稀释6个梯度,每个梯度做3次重复,进行多重荧光PCR反应,来确定该方法的敏感度。同时建立相应的标准曲线,并计算各自的相关系数。
1.2.8 重复性试验 分3次配制3批检测试剂,以上述重组质粒为模板(1×105copies/μL~1×102copies/μL),每个梯度进行3次重复性试验,在同一台荧光定量PCR仪上检测三批试剂的批内及批间重复性。
1.2.9 临床样品检测 收集经过实验室验证的20份美洲型PRRSV阳性样本(15份高致病性PRRSV阳性、5份普通PRRSV阳性),其他临床组织样品30份,累计50份,采用该多重荧光RT-PCR检测方法进行临床样品检测,以验证该方法的准确性。
2 结果
2.1 SOE PCR
SOE PCR的完整过程如图4,将OU1和OU2引物进行PCR扩增后,用琼脂糖凝胶电泳检测,结果扩增条带与设计时的目的片段大小一致(图1)。
2.2 多重荧光PCR反应体系的优化

图1 欧洲型PRRSV基因SOE-PCR产物电泳图Fig.1 Electrophoresis of SOE-PCR products of European genotype PRRSV gene
以不同型别的PRRSV目的质粒为模板对多重荧光PCR体系进行优化,获得最佳的反应条件。引物和探针的最佳浓度分别为:欧洲型PRRSV上、下游引物为10μmol/L,美洲型PRRSV上、下游引物为10μmol/L,高致病性PRRSV上、下游引物为8 μmol/L,OP1(FAM)探针3μmol/L,AP1(VIC)5 μmol/L,HP1(CY5)3μmol/L,总体系50μL。扩增条件确定为:95℃30s;95℃5s,58℃40s,40个循环,退火时收集荧光信号。最终的优化结果可知,每个通道都有明显的扩增曲线,且各通道之间的荧光信号差别最小(图2)。
2.3 灵敏度试验及标准曲线的建立
以浓度1×105copies/μL~1copies/μL 6个线性梯度的不同型别PRRSV重组质粒为模板,检测试剂盒灵敏度,其中1copies/μL没有被检测出来,其他浓度均为阳性,说明该多重荧光PCR检测下线为1×101copies/μL。其中1×105copies/μL~10copies/μL模板的扩增曲线呈等距性和平行性,由此梯度系列生成的标准曲线其相关系数r值均在0.98以上,说明较高的相关性;斜率在-2.66~-3.36,本方法具有较好的扩增效率(图3~图5)。

图2 PCR优化结果Fig.2 The results of PCR optimization

图3 实时荧光定量PCR体系中欧洲型PRRSV检测的敏感性试验Fig.3 Sensitivity test of multiplex real-time PCR for European genotype PRRSV detection
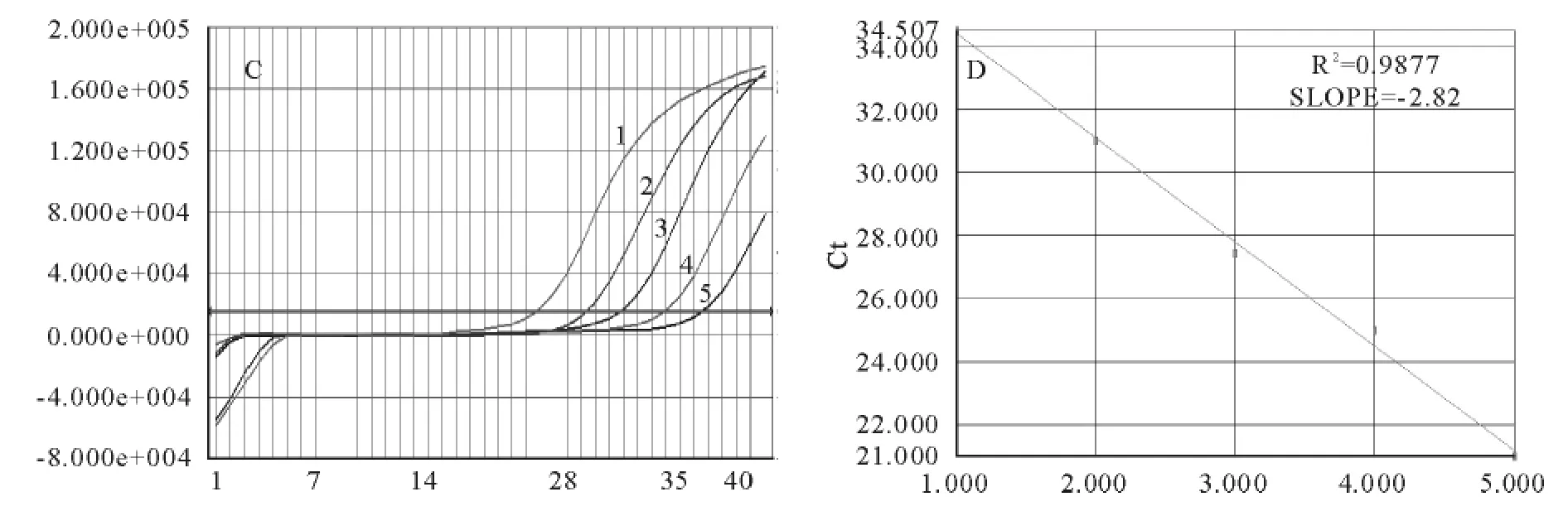
图4 实时荧光定量PCR体系中美洲型PRRSV检测的敏感性试验Fig.4 Sensitivity test of multiplex real-time PCR for American genotype PRRSV detection

图5 实时荧光定量PCR体系中高致病性PRRSV检测的敏感性试验Fig.5 Sensitivity test of multiplex real-time PCR for highly pathogenic PRRSV detection
2.4 特异性试验
对猪轮状病毒(RN)、猪乙型脑炎活疫苗(SA-14-14-2株)、JXA1-R 株、CH-1R 株、猪瘟活疫苗(CSFV)、猪口蹄疫 O型灭活疫苗(O2K/93株+OS/99株)、猪传染性胃肠炎和流行性腹泻二联灭活疫苗(TEGV PEDV)、猪腹泻三联疫苗(TGEV+PEDV+RN)等进行检测,结果JXA1-R株、CH-1R株为FAM检测通道阳性,JXA1-R株为cy5检测通道阳性,其他样本检测结果为FAM、VIC、cy5通道阴性,证实该方法有较好的特异性(图6~图8)。

图6 实时荧光定量PCR体系中美洲型PRRSV的特异性试验Fig.6 Sensitivity test of multiplex real-time PCR for American genotype PRRSV detection
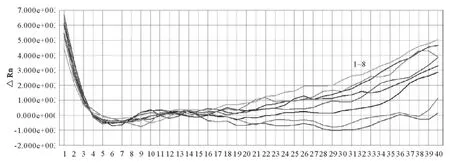
图7 实时荧光定量PCR体系中欧洲型PRRSV的特异性试验Fig.7 Specificity test of multiplex real-time PCR for European genotype PRRSV detection
2.5 重复性试验
将重组质粒(1×106copies/μL)浓度10倍梯度稀释成1×105copies/μL~1×102copies/μL,每个浓度样品做3次重复性试验,通过测定Ct值来验证方法的重复性,结果显示,第1批试剂的批内变异系数在0.13%~1.55%,第2批试剂的批内变异系数在0.27%~1.84%,第3批试剂的批内变异系数在0.25%~1.43%(表2~表4);3批试剂的批间变异系数在0.50%~1.76%(表5)。
2.6 临床样品检测结果
用所建立的方法对50份临床动物组织样品进行检测,20份美洲型PRRSV阳性样品的检验结果均为阳性,其中15例为高致病性PRRSV阳性,其他30例样品均为阴性。

图8 实时荧光定量PCR体系中高致病性PRRSV的特异性试验Fig.8 Specificity test of multiplex real-time PCR for highly pathogenic PRRSV detection

表2 实时荧光定量PCR方法FAM检测通道的批内重复性Table 2 Intra-assay variability of FAM detction channel of multiplex real-time PCR

表3 实时荧光定量PCR方法VIC检测通道的批内重复性Table 3 Intra-assay variability of VIC detction channel of multiplex real-time PCR

表4 实时荧光定量PCR方法CY5检测通道的批内重复性Table 4 Intra-assay variability of CY5detction channel of multiplex real-time PCR

表5 实时荧光定量PCR检测方法的批间重复性Table 5 Inter-assay variability of multiplex real-time PCR
3 讨论
猪繁殖与呼吸综合征病毒易发生变异,高致病性猪繁殖与呼吸综合征的发生就是PRRSV变异后毒力增强的有力证据。2006年-2007年在我国20多个省市区暴发了高致病性猪繁殖与呼吸综合征,使我国的养猪业遭受了的巨大的冲击,同时造成了严重的经济损失,为此农业部将其列为动物一类传染病,属动物重大疫病[6-9]。田克恭在多个技术研讨会上透露其实验室团队对全国猪病流行性调查的结论,2011年,通过对97个原种猪场共4 982头猪只的流行病调查发现,其中8个场共13头猪只检出欧洲型猪蓝耳病病毒株,猪场检出率达8.2%,个体检出率达0.3%[5]。到目前为止,国内猪繁殖与呼吸综合征毒株一直是以美洲型为主(经典毒株与高致病性毒株同在),欧洲型毒株偶有发生[6]。此外,国内某些猪场使用欧洲型PRRSV弱毒疫苗,加大了PRRSV的分析的难度,且弱毒疫苗的安全性还存在争议,在选择性压力的作用下,弱毒疫苗毒株会发生返祖现象,变为强毒株,从而造成PRRS的暴发[10]。国内缺乏对PRRSV全面系统性诊断的研究,因此,加强对美洲型、欧洲型、高致病性PRRSV的研究为形势所需。目前在我国,经典株、高致病株及欧洲型PRSSV均有检出,有必要建立一种快速鉴别猪繁殖与呼吸综合征的诊断方法。
重叠延伸PCR技术(SOE PCR)从问世就受到学者们的广泛关注,使得体外人工合成长链DNA成为可能[11]。本研究由于未能收集到欧洲型PRRSV的样本,所以应用重叠延伸PCR技术合成欧洲型PRRSV的目的基因片段,随机挑选一个测序正确的重组质粒,用本文的多重荧光PCR方法对此重组质粒进行检测,结果发现,仅有vic检测通道有明显的扩增曲线,且标准曲线的斜率为-3.36说明所设计的欧洲型PRRSV引物、探针具有比较理想的扩增效率,进一步证明所设计的欧洲型引物及探针合理可靠,可以扩增出正确的欧洲型PRRSV目的基因片段。
Real-time RT-PCR技术具有操作方便、灵敏度高、特异性好、重复性好、重复性高等优点,已被广泛用于病原体快速检测[12-14]。目前,国内外将实时荧光定量PCR技术用于检测美洲型PRRSV的报道比较常见[15-18],而关于欧洲型PRRSV的报道较少[19-20]。本研究构建的三重三色荧光PCR检测方法,能在一次反应中对欧洲型、美洲型和高致病性PRRSV 3种病原体进行鉴别检测,此方法的检测线性范围为1×102copies/μL~1×105copies/μL,具有良好的重复稳定性,批内和批间变异系数分别在0.25%~1.92%和0.50%~1.76%间,检测最低限可达10copies/μL。疫苗株和野毒株之间的基因序列的同源性比较高,由于本次试验未能收集到相关的病毒株,因此采用各自的疫苗株代替致病毒株进行特异性验证。此外,本研究还对临床确诊的阳性和阴性样本进行验证并获得了精准的数据。虽然此次研究缺乏对欧洲型PRRSV临床样本的验证,但我们成功构建了含欧洲型目的基因的质粒,并用其验证了欧洲型引物及探针的正确性。说明该方法可用于检测猪繁殖与呼吸综合征疾病,并对其病毒进行鉴别诊断。总之,本研究建立的PRRSV三重三色实时荧光定量PCR检测方法将有助于提高临床上不同类型PRRSV病毒感染的监控技术和检测能力,具有较高的应用价值。
[1]曾少灵,孙 洁,秦智锋,等.美洲型猪蓝耳病病毒高致病性变异株RT-LAMP检测方法的建立[J].动物医学进展,2010,31(12):22-27.
[2]Amonsin A,Kedkovid R,Puranaveja S,et al.Comparative analysis of complete nucleotide sequence of porcine reproductive and respiratory syndrome virus(PRRSV)isolates in Thailand(US and EU genotypes)[J].Virol J,2009.doi:10.1186/1743-422X-6-143.
[3]Chen N,Cao Z,Yu X,Deng X,et al.Emergence of novel European genotype porcine reproductive and respiratory syndrome virus in mainland China[J].J Gen Virol,2011,92:880-892
[4]庄金山,张建武,袁世山,等.欧洲型猪繁殖与呼吸综合征病毒感染性cDNA克隆的构建[D].北京:中国农业科学院,2008.
[5]杨 明.我国欧洲型蓝耳病毒株感染趋增[EB/OL].2012-05-18. http://www.ivdc.gov.cn/www-old/syyp/ 201205/t20120518_37662.Htm.
[6]姜 力,姜秋杰.猪“高热综合症”是目前对养猪业威胁最严重的猪病[J].吉林畜牧兽医,2007(6):22-24.
[7]Zhou L,Chen S X,Zhang J L,et a1.Molecular variation analysis of porcine reproductive and respiratory syndrome virus in China[J].Virus Res,2009,145(1):97-105.
[8]Tian Z J,An T Q,Zhou Y J,et a1.An attenuated live vaccine based on highly pathogenic porcine reproductive and respiratory syndrome virus(HP-PRRSV)protects piglets against HP-PRRS[J].Vet Microbiol,2009,138(1-2):34-40.
[9]Cai L,Qiu P,Deng X Y,et a1.The epidemic status and genetic diversity of 14highly pathogenic porcine reproductive and respiratory syndrome virus(HP-PRRSV)isolates from China in 2009[J].Vet Microbiol,201l,150(3-4):257-269.
[10]Botner A.Srandbygaard B.Sorensen K J,et al.Apperance of acute PRRS like symptoms in sow herds after vaccination with a modified live PRRS vaccine[J].Vet Rec,1997,141 (19):497-495.
[11]杨 宇,吴元华,郑雅楠,等.利用重叠延伸PCR技术进行DNA的人工合成[J]安徽农业科学,2006,34(9):1810-1811.
[12]Guarino H,Goyal S M,Murtaugh M P,et al.Detection of porcine reproductive and respiratory syndrome virus by reverse transcription-polymerase chain reaction using different regions of the viral genome[J].Vet Diagn Invest,1999,11(1):27-33..
[13]文 涛,王俊求,杨利峰,等.实时荧光定量PCR技术及其应用[J].生物技术通讯,2006,17(1):112-114.
[14]Mackay I M,Arden K E,Nitsche A.Real-time PCR in virology[J].Nucleic Acids Res,2002,30(6):1292-1305.
[15]Lurchachaiwong W,Payungporn S,Srisatidnarakul U,et al.Rapid detection and strain identification of porcine reproductive and respiratory syndrome virus(PRRSV)by real-time RT-PCR[J].Lett Appl Microbiol,2008,46(1):55-60.
[16]Chung W B,Chan W H,Chaung H C,et al.Real-time PCR for quantitation of porcine reproductive and respiratory syndrome virus and porcine circovirus type 2in naturally-infected and challenged pigs[J].J Virol Meth,2005,124:11-19.
[17]Tian H,Wu J Y,Shang Y J,et al.The development of a rapid SYBR one step real-time RT-PCR for detection of porcine reproductive and respiratory syndrome virus[J].Virol J,2010,7:90.
[18]Chen N H,Chen X Z,Hu D M,et al.Rapid differential detection of classical and highly pathogenic North American porcine reproductive and respiratory syndrome virus in China by a duplex real-time RT-PCR[J].J Virol Meth,2009,161:192-198.
[19]Wasilk A,Callahan J D,Christopher-Hennings J,et al.Detection of U.S.Lelystad,and European-like porcine reproductive and respiratory syndrome viruses and relative quantitation in boar semen and serum samples by real-time PCR[J].J Microbiol,2004,4453-4461.
[20]Kleiboeker S B,Schommer S K,Lee S M,et al.Simultaneous detection of North American and European porcine reproductive and respiratory syndrome virus using real-time quantitative reverse transcriptase-PCR[J].Vet Diagn Invest,2005,17:165-170.
