副猪嗜血杆菌OmpP2基因的克隆及生物学信息分析
2015-06-18曾文斌刘悦欣左明开幸文定白帅州
陶 政,曾文斌,刘悦欣,左明开,幸文定,白帅州,王 萍
(江西农业大学动物科学技术学院,江西南昌 330045)
副猪嗜血杆菌(Haemophilusparasuis,HPS)是猪Glasser病的病原体,在仔猪群体中具有很高的发病率和病死率,临床表现为多发性纤维素性浆膜炎、关节炎和脑膜炎[1]。随着规模化养猪业模式的发展,HPS已经成为影响养猪业的主要细菌之一,近几年,副猪嗜血杆菌病在中国日趋流行,很多地区分离到该病原体[2-5]。副猪嗜血杆菌血清型复杂多样,中国流行的优势血清型为4、5、12、13型,与国外的优势血清型4、5、13基本相同并存在差异[6]。
目前预防该病的疫苗为灭活疫苗,但是副猪嗜血杆菌的血清型多样,不同血清型之间缺乏交叉免疫保护,副猪嗜血杆菌灭活疫苗只对同一血清型的菌株具有保护作用[7]。随着分子生物学技术的快速发展,疫苗的研究方向也转向基因工程疫苗。副猪嗜血杆菌的主要毒力因子包括外膜蛋白、荚膜多糖、脂多糖、转铁结合蛋白、神经氨酸酶等[8-11]。其中外膜蛋白(outer membrane protein,Omp)是革兰阴性菌外膜的主要结构,具有良好的免疫原性,可同时激发机体的体液免疫和细胞免疫,具有异种血清型的免疫交叉保护作用,是一种潜在的共同保护性抗原。而Tadjine M等[12]报道该病原菌的15个血清型均与一个主要的外膜蛋白反应,这个蛋白属于革兰阴性菌的Omp家族,表明这个蛋白也许会成为一个很好的诊断标记的候选蛋白。
本试验分离鉴定的HPS血清13型江西分离株JXGZ03中克隆了OmpP2基因,在此基础上综合应用生物信息学软件预测其蛋白质相关数据,分析其基因结构及功能。为今后进一步开展HPS的分子生物学功能研究、新型疫苗的研制、快速诊断方法的建立等奠定了基础。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒 江西HPS血清13型分离株JXGZ03由本实验室保存,载体pMD18-T购自宝生物工程(大连)有限公司;感受态细胞Top10菌株购自天根生化科技(北京)有限公司。
1.1.2 酶及主要试剂 限制性内切酶EcoRⅠ和XhoI、rTaqDNA 聚合酶、dNTPs、DNA Marker、琼脂糖凝胶DNA回收试剂盒均为宝生物工程(大连)有限公司产品;细菌基因组DNA提取试剂盒、质粒提取试剂盒购自天根生化科技(北京)有限公司;其他化学试剂均为国产分析纯产品。
1.2 方法
1.2.1 引物设计与合成 根据GenBank数据库中的登录的HPS血清13型OmpP2基因序列(登录号:GU323699),利用Primmer3.0在线软件设计,由上海生工生物工程技术服务有限公司合成一对引物:上游 引物:5′-GAATTCATGAAAAAAACACTAGTAGC-3′;下游引物:5′-CTCGAGTTAC-CATAATACACGTAAACC-3′。上、下游引物的5'端分别引入EcoRⅠ和XhoⅠ两个酶切位点(下划线处),该引物扩增具有完整ORF的OmpP2的基因片段。
1.2.2 目的基因的扩增与克隆 PCR模板为用细菌基因组DNA提取试剂盒提取。PCR反应体系(25μL):10×buffur 2.5μL,dNTPs(2.5mmol/L)1μL,上、下游引物(10μmol/L)各1.0μL,模板DNA1.0μL,TaqDNA 聚合酶0.25μL,无菌水18.25μL;PCR 反应条件:94℃ 5min;94℃ 30s,56℃30s,72℃1min,共35个循环;最后72℃延伸10min。扩增后,取5μL PCR扩增产物于10g/L琼脂糖凝胶电泳,凝胶成像系统观察和记录结果。采用DNA回收纯化试剂盒,回收纯化扩增片段,将纯化后的目的基因片段与载体pMD18-T于16℃连接过夜,将连接产物转化至感受态细胞TOP10中,涂布于含AMP的LB的固体培养基,37℃培养12h~16h后。挑取生长良好的单个菌落接种于含AMP的LB液体培养基中培养后,进行菌液PCR及提取质粒酶切鉴定。将阳性克隆质粒命名为pMD18-T-OmpP2,并送至上海生工生物工程技术服务有限公司进行序列测定。
1.2.3 序列比对分析 利用DNA Star软件中的SeqMan对已获得的OmpP2序列片段进行拼接,并推导其氨基酸序列;运用DNAStar软件MegAlign程序对GenBank已发表的15株副猪嗜血杆菌OmpP2的基因序列进行比对和分析。同时,运用MEGA6软件绘制系统进化树。
1.2.4 OmpP2生物学信息分析 利用ProtParam(http://web.expasy.org/protparam/)分析氨基酸序列的理化性;用在线软件TMpred(http://www.ch.embnet.org/software/TMPRED_form.html)预测蛋白质跨膜区和跨膜方向;利用Protscale(http://web.expasy.org/protscale/)分析蛋白质亲疏水性;利用 SignalP 4.1Server(http://www.cbs.dtu.dk/services/SignalP/)分析蛋白的信号肽;利用NetPhos(http://www.cbs.dtu.dk/services/Net-Phos/)分析蛋白质磷酸化位点;利用Hopfield神经网络(http://npsa-pbil.ibcp.fr/cgi-bin/npsa_automat.pl?page=/NPSA/npsa_hnn.html)预测蛋白二级结构;利用Smart(http://smart.embl-heidelberg.de/)分析预测氨基酸序列的保守结构域;利用phyre2(http://www.sbg.bio.ic.ac.uk/phyre2/html/page.cgi?id=index)预测蛋白质的三级结构。
2 结果
2.1 目的基因的PCR结果
电泳结果表明,PCR扩增出大小约为1 092bp的OmpP2基因片段,与预期结果相符(图1)。
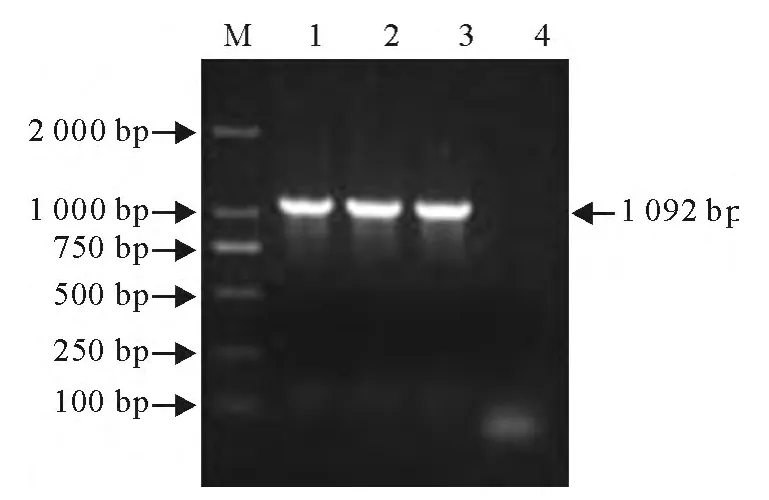
图1 OmpP2基因的PCR扩增结果Fig.1 PCR amplification results of OmpP2gene
2.2 克隆产物双酶切鉴定
将目的基因片段与载体pMD18-T连接转化到感受态细胞TOP10后,进行菌液PCR鉴定,扩增出1 092bp的目的基因片段。再对提取的pMD18-TOmpP2重组质粒经EcoRⅠ和XhoⅠ双酶切后,分别切出了1 092bp的目的片段和2 692bp载体片段(图2),表明所克隆的目的基因已成功插入到pMD18-T载体中。
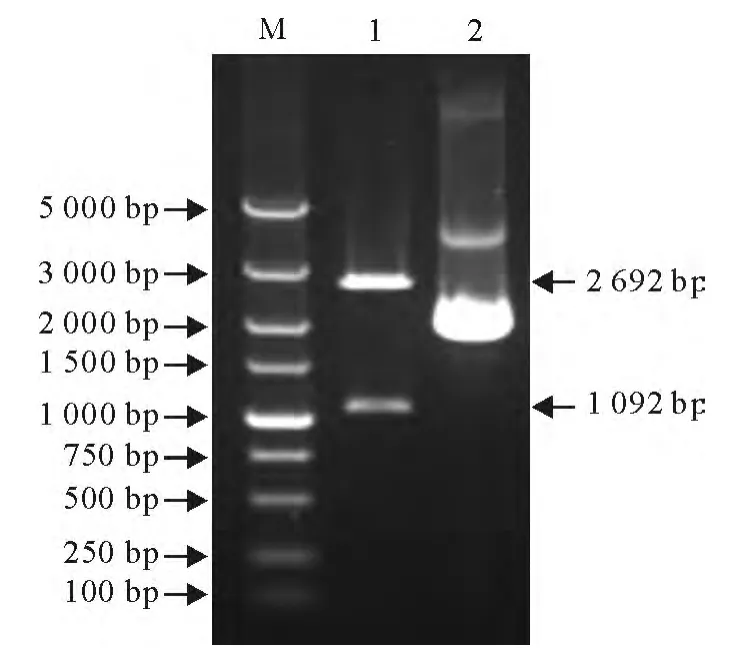
图2 pMD18-T-OmpP2重组质粒的双酶切鉴定Fig.2 Analysis of recombinant plasmid pMD18-T-OmpP2 by double enzyme digestion
2.3 基因序列分析
将重组克隆质粒送至上海生工生物工程技术服务有限公司进行序列测定,利用SeqMan软件对测序结果进行序列拼接,得到的OmpP2基因核苷酸序列及氨基酸序列(图3)。本次克隆得到的OmpP2基因序列与GenBank中副猪嗜血杆菌登录的外膜蛋白OmpP2基因序列进行比对分析(图4),与其他HPS OmpP2的核苷酸同源性达到98.7%~100%。利用MEGA6绘制其遗传进化树(图5),结果表明与F641(湖北株)之间亲缘关系最近。

图3 OmpP2编码氨基酸序列Fig.3 The encoding amino acid sequence of OmpP2
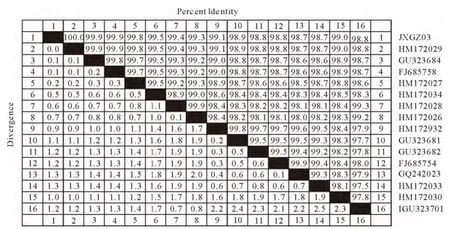
图4 OmpP2基因核苷酸序列同源性比较Fig.4 Homology comparison of OmpP2gene nucleotide sequence
2.4 OmpP2基因编码蛋白的生物信息学分析
2.4.1 OmpP2基因编码蛋白的理化性质 运用软件Expasy开发的针对蛋白质基本理化性质的分析,HPS-OmpP2基因编码的氨基酸序列含氨基酸数目共364个,分子质量为39 138.5u,理论等电点pI为9.14;该蛋白质由19种氨基酸组成,其中Gly含量最丰富(12.4%),Trp含量最少(0.6%);总的带负电荷残基和带正电荷残基分别是38个和46个;不稳定指数为18.52,说明此分类蛋白质稳定。脂肪族系数为71.18;其总平均疏水指数为-0.482,为亲水性蛋白。
2.4.2 跨膜结构分析 跨膜结构是膜中蛋白与质膜蛋白结合的主要部位,起着将蛋白固定于细胞膜上的作用,跨膜结构的预测和分析,对认识蛋白质的结构、功能、分类及在细胞中的作用部位均有一定的意义。利用在线软件Tmpred预测蛋白跨膜区域结果显示(图6),OmpP2基因编码的蛋白由内向外有一个可能的跨膜螺旋区域为5-23aa,中心在19位,预测分值为1 863(大于500);由外向内有一个可能的跨膜螺旋区域为4-22aa,中心在19位,预测分值为1 536(大于500);TM-螺旋长度在17-33aa。
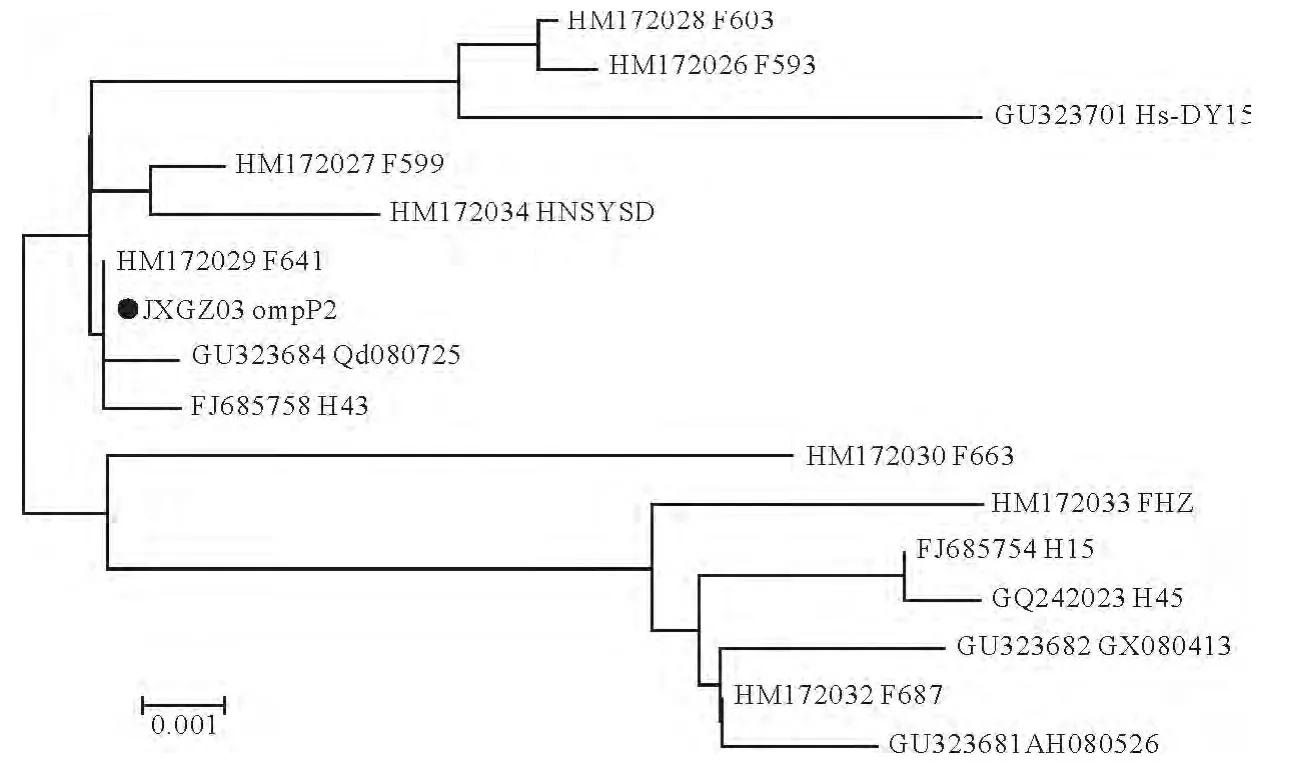
图5 OmpP2基因核苷酸序列分子进化树Fig.5 Phylogenetic tree of nucleotide sequence of OmpP2gene
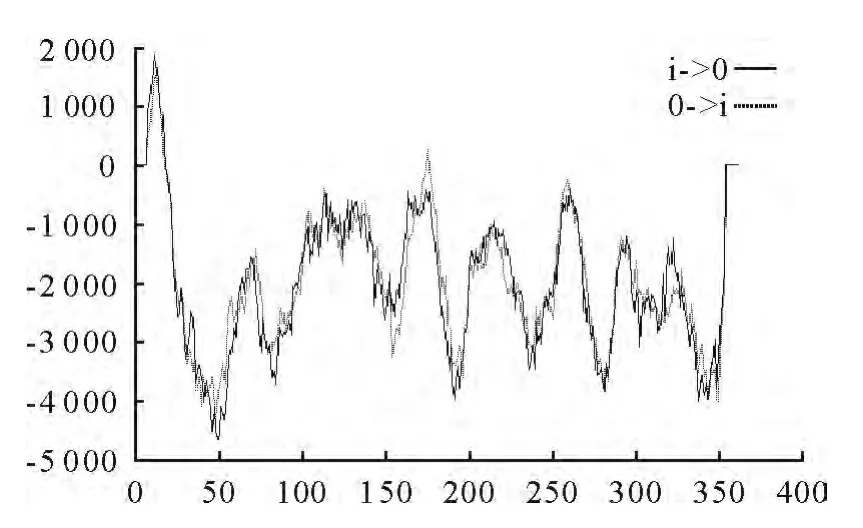
图6 OmpP2蛋白跨膜区分析Fig.6 The transmembrane domain analysis of OmpP2protein
2.4.3 OmpP2蛋白质的亲疏水性分析 运用软件ExPASy的ProtScale程序对OmpP2基因编码的蛋白质进行亲疏水性分析(图7),正值为疏水,负值为亲水,结果显示该蛋白具有多个高亲水性区域,且氨基酸序列绝大多数为亲水性残基,表明OmpP2蛋白质为水溶性蛋白质。
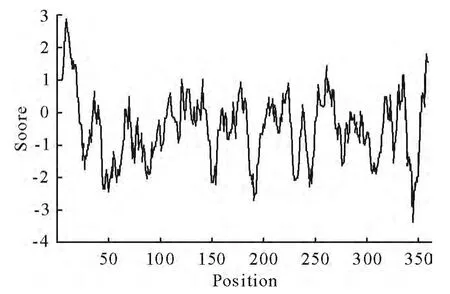
图7 OmpP2蛋白亲/疏水性分析Fig.7 The hydrophilicity analysis of OmpP2protein
2.4.4 OmpP2蛋白信号肽预测结果 通过SignalP 4.1(http://www.cbs.dtu.dk/services/Signa lP/)进行蛋白质的信号肽预测。分析表明,该基因包含由20个氨基酸组成的信号肽(图8)。信号肽是存在于蛋白质N端的一段决定蛋白质分泌和转运的额外氨基酸序列,前体蛋白质正确定位后,信号肽被切除,同时蛋白质经过折叠等立体构象的变化,转变为成熟的蛋白质。信号肽不仅可引导蛋白质的分泌,且对其正确折叠有一定的作用。
2.4.5 OmpP2潜在的磷酸化位点分析 用Net-Phos 2.0Server进行磷酸化位点分析,结果表明有12个丝氨酸(Ser)、5个苏氨酸(Thr)和9个络氨酸(Tyr)位点,可能成为蛋白激酶磷酸化位点(图9)。

图8 OmpP2蛋白信号肽预测Fig.8 Signal peptide prediction of OmpP2protein
2.4.6 OmpP2蛋白质二级结构预测 本试验使用Hopfield神经网络(HNN)预测OmpP2蛋白二级结构(图10)。表明该蛋白含有α-螺旋(h表示)占17.08%、无规则卷曲(c表示)占55.65%和延伸链(e表示)占27.27%。
2.4.7 OmpP2蛋白的保守结构域 Smart分析结果(图11)显示,OmpP2的4-345位是Pfam-Porin-4结构域。
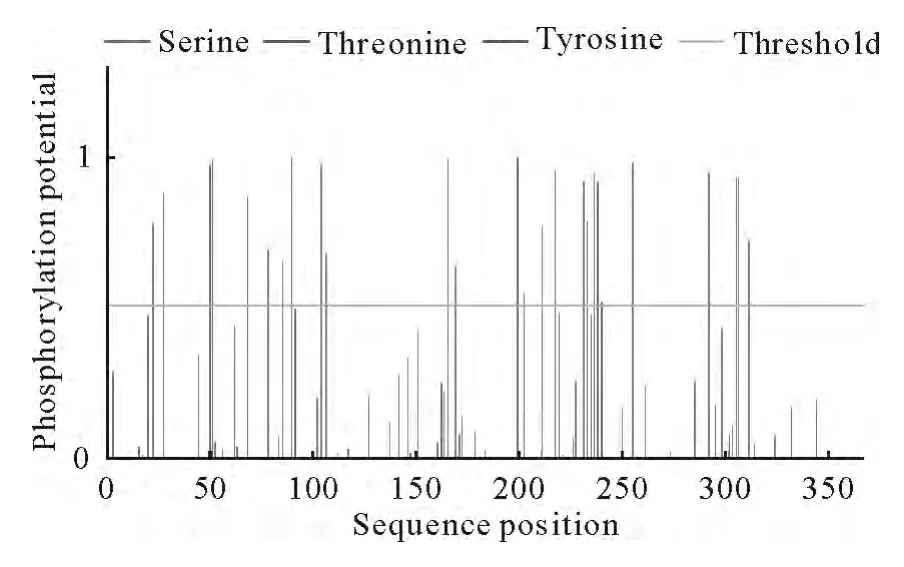
图9 OmpP2蛋白磷酸化位点Fig.9 Phosphorylation sites of OmpP2protein
2.4.8 OmpP2三级结构预测 通过Phyre2软件在线预测OmpP2三级结构,结果显示,该序列和d2fgqx1模板同源性最高,基于该模板预测315个残基(87%的序列)已被建模,可信度100%(图12)。
3 讨论

图10 OmpP2基因编码蛋白的二级结构预测Fig.10 The secondary structure prediction of OmpP2gene encoded protein

图11 OmpP2蛋白结构域预测Fig.11 The domain prediction of OmpP2protein
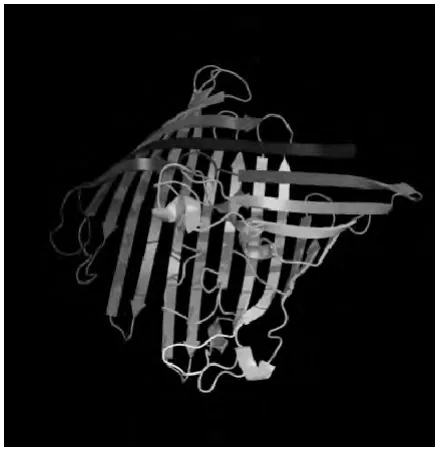
图12 OmpP2蛋白质三级结构预测Fig.12 The predicted tertiary structure of OmpP2protein
外膜蛋白是革兰阴性菌外膜的重要组成成分,在致病性和免疫原性方面发挥着重要的作用,一直是国内外科学工作者研究的热点[13]。目前流感嗜血杆菌OmpP2蛋白的生理功能和致病机理的研究较为透彻OmpP2是流感嗜血杆菌的一个毒力因子,是逃避宿主补体杀伤和参与宿主细胞的黏附作用的一个重要免疫原性蛋白[14]。最新研究表明流感嗜血杆菌OmpP2膜外结构域能激活宿主细胞的信号通路分子并诱导促炎症因子的表达,表明了OmpP2蛋白在病原菌致病性中起着重要作用[15]。美国学者McVicker等在进行流感嗜血杆菌的OmpP2蛋白单克隆抗体研究时发现,该单克隆抗体可与副猪嗜血杆菌菌体蛋白发生反应,且不同毒力菌株反应蛋白大小有所不同,在有毒力HPS菌株中OmpP2蛋白为48ku,而在非毒力菌株中却为55 ku,并预期OmpP2蛋白可用来区分HPS毒力与非毒力菌株[16-17]。副猪嗜血杆菌中关于该蛋白的功能却研究的较少。随着分子生物学技术和计算机技术的快速发展,生物信息学已成为推动基因组学和后基因学研究的一种重要技术[17]。
本研究通过PCR方法扩增得到了HPS血清13型江西分离株JXGZ03中的OmpP2基因序列,成功获得了长1 092bp的OmpP2基因,编码364个氨基酸,推导出蛋白质的分子质量理论值为39 138.5u,理 论 等 电 点 为 9.14;与 其 他 HPS OmpP2的核苷酸同源性达到98.7%~100%,遗传进化树表明与F641(湖北株)之间亲缘关系最近;Tmpred预测该蛋白由内向外和由外向内各有可能一个跨膜区域;ProtScale分析OmpP2蛋白具有多个高亲水性区域,且氨基酸序列绝大多数为亲水性残基,表明OmpP2蛋白质为水溶性蛋白质;通过SignalP 4.1分析表明,该基因包含由20个氨基酸组成的信号肽,属于分泌性蛋白;NetPhos进行磷酸化位点分析表明有12个丝氨酸(Ser)、5个苏氨酸(Thr)和9个络氨酸(Tyr)位点,可能成为蛋白激酶磷酸化位点;使用Hopfield神经网络(HNN)预测OmpP2蛋白二级结构,二级结构以无规则卷曲为主;该蛋白保守域4-345氨基酸残基是Pfam-Porin_4结构域;应用Phyre2软件成功模拟出OmpP2蛋白的3D结构,为进一步探索该蛋白结构和功能奠定基础。
本研究首次克隆了江西血清13型HPS OmpP2基因,利用生物信息学软件对其进行了生物信息学分析,不仅了解了江西省流行的HPS OmpP2的分子特征,丰富了我国副猪嗜血杆菌的遗传信息资料,也为OmpP2功能的进一步研究及研制副猪嗜血杆菌新型的基因工程疫苗奠定了基础。
[1]王晨燕,林裕胜,车勇良,等.副猪嗜血杆菌病诊断方法研究进展[J].动物医学进展,2014,35(1):86-90.
[2]王海玉.洛阳地区副猪嗜血杆菌病的血清流行病学调查分析[J].河南农业,2014(11):45-46.
[3]刘晓东,何海健,姜正前,等.浙江部分地区猪场猪繁殖与呼吸综合征与副猪嗜血杆菌病流行现状[J].中国兽医杂志,2014,50(5):53-54.
[4]郭 伶,刘孝刚.辽宁地区副猪嗜血杆菌血清型的鉴定[J].畜牧与兽医,2014,46(3):91-93.
[5]杨 群,万培伟,周泉勇,等.江西省部分地区副猪嗜血杆菌血清学调查[J].江西畜牧兽医杂志,2014(1):55-56.
[6]蔡旭旺,刘正飞,陈焕春,等.副猪嗜血杆菌的分离培养和血清型鉴定[J].华中农业大学学报,2005,24(1):55-58.
[7]王 建,邵卫星,吕占军,等.2012年我国部分省市规模化猪场副猪嗜血杆菌分离鉴定及菌株血清分型[J].动物医学进展,2014,35(3):48-52.
[8]Mullins M A,Register K B,Bayles D O,et al.Characteriza-tion and comparative analysis of the genes encodingHaemophilusparasuisouter membrane proteins P2and P5[J].J Bacteriol,2009,191(19):5988-6002.
[9]Zhang B,Tang C,Yang F L,et al.Molecular cloning,sequencing and expression of the outer membrane protein A gene fromHaemophilusparasuis[J].Vet Microbiol,2009,136(3-4):408-410.
[10]马广鹏.副猪嗜血杆菌毒力因子研究进展[J].动物医学进展,2013(02):83-88.
[11]侯 娜,张培君,龚玉梅,等.副猪嗜血杆菌潜在毒力因子的综述[J].中国畜牧兽医,2013,40(1):36-41.
[12]Tadjine M,Mittal K R,Bourdon S,et al.Production and characterization of murine monoclonal antibodies againstHaemophilusparasuisand study of their protective role in mice[J].Microbiology,2004,150(Pt 12):3935-3945.
[13]朱必凤,杨旭夫,彭 凌,等.副猪嗜血杆菌外膜蛋白的免疫原性[J].中国兽医学报,2013,33(6):838-842.
[14]Ram S,Cullinane M,Blom A M,et al.Binding of C4b-binding protein to porin:a molecular mechanism of serum resistance ofNeisseriagonorrhoeae[J].J Exp Med,2001,193(3):281-295.
[15]Galdiero S,Vitiello M,Amodeo P,et al.Structural requirements for proinflammatory activity of porin P2Loop 7fromHaemophilusinfluenzae[J].Biochemistry,2006,45(14):4491-4501.
[16]Olvera A,Pina S,Perez-Simo M,et al.Virulence-associated trimeric autotransporters ofHaemophilusparasuisare antigenic proteins expressedinvivo[J].Vet Res,2010,41(3):26.
[17]Marti-Renom M A,Stuart A C,Fiser A,et al.Comparative protein structure modeling of genes and genomes[J].Annu Rev Biophys Biomol Struct,2000,29:291-325.
