金银花幼苗对盐胁迫的生理响应
2015-06-15孟衡玲张薇卢丙越何芳芳鲁海菊
孟衡玲+张薇+卢丙越+何芳芳+鲁海菊

摘要:以金花3号金银花为材料,分别采用不同浓度NaCl盐溶液处理,分析金花3号金银花在不同盐浓度胁迫下丙二醛(MDA)、脯氨酸(Pro)、可溶性糖、超氧化物歧化酶(SOD)、过氧化物酶(POD)5个生理指标含量的变化,探讨其耐盐性。结果表明,随土壤盐分的积累及胁迫时间的延续,金花3号金银花不同程度地表现出盐害现象,对盐的最大忍受度为土壤含盐量为12.48 g/kg;在盐胁迫8 d后,在部分处理下SOD和POD含量出现不同程度的升高,丙二醛含量出现下降;Pro在盐胁迫前4 d迅速升高后下降,在部分处理下可溶性糖含量先降后升。
关键词:金银花;盐胁迫;生理指标;丙二醛;超氧化物歧化酶;过氧化物酶;脯氨酸
中图分类号: S567.7+90.1 文献标志码: A
文章编号:1002-1302(2015)04-0247-03
收稿日期:2014-05-15
基金项目:云南省应用基础研究面上项目(编号:2012FB174);云南省应用基础研究计划青年项目(编号:2013FD048)。
作者简介:孟衡玲(1981—),女,云南宣威人,博士,讲师,从事药用植物资源开发与利用研究。E-mail:menghengl@163.com。
通信作者:鲁海菊,博士,副教授,从事药用植物与微生物学研究。E-mail:lhj_biology2@126.com。
全球盐碱地面积已达9.5×108 hm2,我国盐碱地总面积约1亿hm2[1]。土壤盐渍化严重影响植物的生长和产量,已成为威胁世界农业发展的主要因素之一。金银花(Lonicera japonica Thunb)别称忍冬、双花、银花,在医药、农业、饮料食品、日用化工、园艺、旅游产业等方面都有广泛应用。我国金银花资源丰富,在各个省份均有分布,适应性很强,有“涝死庄稼旱死草,冻死石榴晒伤瓜,不会影响金银花”的农谚。目前,关于金银花化学成分、药理作用、生物学特性及栽培繁殖技术等各方面的研究较多,但关于金银花在盐胁迫下的生长和生理特性研究鲜有报道。本试验以金银花扦插苗为材料,设置5个浓度梯度的NaCl溶液进行处理,研究金银花幼苗对盐胁迫的生理响应,以期为探究金银花的耐盐机制、筛选金银花抗性品种、合理开发利用盐碱地、实现金银花的大面积种植奠定理论基础。
1 材料与方法
1.1 材料与处理方法
选用1年生金花3号金银花枝条,于2013年6月15日扦插于红河学院温室内,2013年11月20日移栽到上端口径38 cm、下端口径20 cm、高28 cm的花盆中,每个花盆装入75 kg园土和腐殖土(按2 ∶ 1比例混合),每盆栽5株,共25盆;移栽后保持通风透光、室内温度不高于30 ℃,移栽后1个月进行盐胁迫处理,设置0(CK)、0.1、0.2、0.4、0.6 mol/L 5个盐浓度梯度,每个水平处理5株苗,重复5次。按照设计的盐溶液浓度,每盆浇入NaCl溶液1 L,每4 d浇1次,为防止盆内盐分和水分流失,每个花盆下垫底盘,将浇水时流出的溶液重新倒回花盆;每次盐溶液处理后的次日,采集金银花幼苗4~7节位的成熟叶片迅速装入塑料袋,密封送入实验室待测。
1.2 调查内容与测定指标
1.2.1 外部形态特征的观察 观察记录金银花幼苗在各个盐处理浓度、不同处理时间的外部形态特征,并根据盐胁迫为害程度的轻重分为5个级别:0级:无盐胁迫为害症状;1级:有少部分叶尖、叶缘和叶脉变黄;2级:约有1/2的叶尖、叶缘焦枯;3级:大部分叶片有叶尖、叶缘焦枯和落叶现象;4级:枝枯、叶落直至死亡[2]。
1.2.2 生理指标的测定 丙二醛(MDA)采用硫代巴比妥酸(TBA)显色法[3]测定;脯氨酸、可溶性糖含量、过氧化物酶(POD)活性分别采用茚三酮显色法、硫酸蒽酮法、愈创木酚法测定[4];超氧化物歧化酶(SOD)活性采用氮蓝四唑(NBT)光化还原法[5]测定。
1.3 统计分析方法
采用Excel 2007对数据进行整理与制图,采用SPSS 13.0进行方差分析。
2 结果与分析
2.1 NaCl胁迫对金银花幼苗外部形态特征的影响
金花3号金银花经盐胁迫处理,幼苗生长缓慢,叶片扩展速度下降,叶片皱缩。由表1可见,随着盐胁迫浓度的增加,金银花受盐胁迫为害的程度逐渐增大;同一盐浓度胁迫时间越长,金银花受伤害的程度也越严重;当胁迫1个月时,0.4 mol/L 盐胁迫为害等级为3级,叶缘焦枯,有落叶现象,0.6 mol/L 盐胁迫为害等级为4级,出现植株死亡。综合比较可知,金花3号最大耐盐程度为土壤含盐量12.48 g/kg。
2.2 NaCl胁迫对金银花幼苗丙二醛(MDA)含量的影响
丙二醛(MDA)是膜脂过氧化作用的产物之一[3],通常作为脂质过氧化指标,用于表征细胞膜过氧化程度和植物对逆境反应的强弱[6]。由图1、表2可见,各盐浓度处理的金银花幼苗叶片丙二醛含量整体呈现先下降后升高再下降的趋势;胁迫8 d时,对照叶片的丙二醛含量最低,0.6 mol/L NaCl处
表1 不同浓度盐胁迫对金银花幼苗的为害等级
NaCl浓度
(mol/L) 土壤含盐
量(g/kg)
盐胁迫后不同时间的为害等级
1 d 4 d 8 d 12 d 30 d
0 0 0 0 0 0 0
0.1 3.12 0 0 0 1 1
0.2 6.24 0 0 1 2 2
0.4 12.48 0 1 2 2 3
0.6 18.72 0 1 2 3 4endprint
理的叶片丙二醛含量最高,各处理组间差异均达到显著(P<0.05)。
2.3 NaCl胁迫对金银花幼苗脯氨酸(Pro)含量的影响
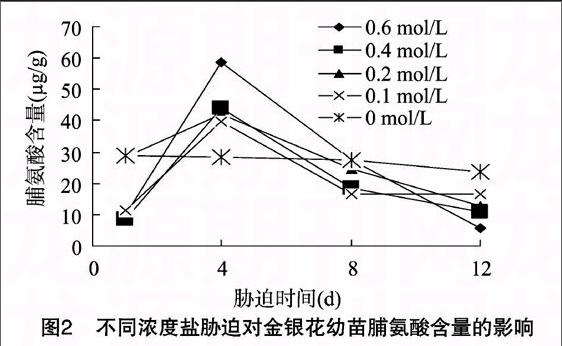
由图2、表2可见,各浓度处理的金银花叶片脯氨酸含量在前4 d内呈急剧上升态势,到处理4 d时均达到最大值,且0.6 mol/L浓度处理的脯氨酸含量最高,达到58.8 μg/g,是处理1 d对应浓度的5.50倍;盐胁迫4 d时,各处理与对照间均存在显著性差异(P<0.05)。
2.4 NaCl胁迫对金银花幼苗可溶性糖含量的影响
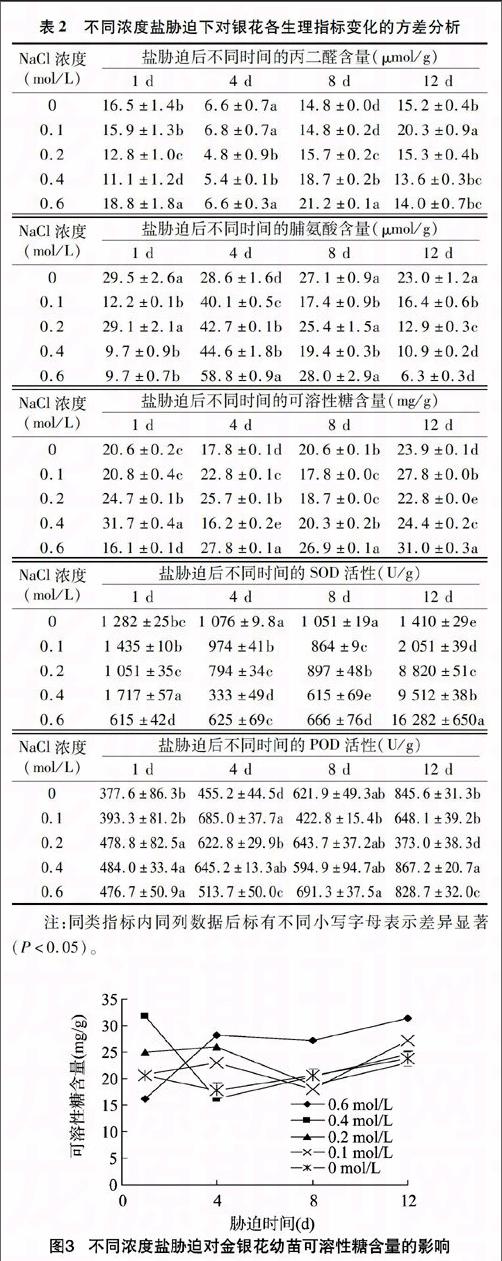
由图3可见,随着盐胁迫时间的延长及土壤中盐含量的增加,各盐浓度处理的金银花幼苗叶片可溶性糖含量在一定时间内呈先降低后升高的变化趋势;处理8 d时,各盐胁迫处理的金银花幼苗可溶性糖含量降到了最低点,随后各胁迫盐浓度下的可溶性糖含量升高,0.6 mol/L盐浓度下的糖含量最高。
2.5 NaCl胁迫对金银花幼苗超氧化物歧化酶(SOD)活性的影响
由图4、表2可见,金银花盐胁迫处理从开始到处理8 d,SOD活性基本趋于水平状态,且活性很低;胁迫8 d后,除对照和0.1 mol/L盐浓度处理没有明显变化以外,其余3个胁迫浓度下的SOD活性迅速升高,且SOD活性随盐胁迫浓度的降低而降低。方差分析表明,胁迫前8 d SOD活性没有明显变化,各处理组间无显著性差异,胁迫 12 d 时,0.6、0.4、
表2 不同浓度盐胁迫下对银花各生理指标变化的方差分析
NaCl浓度
(mol/L)
盐胁迫后不同时间的丙二醛含量(μmol/g)
1 d 4 d 8 d 12 d
0 16.5±1.4b 6.6±0.7a 14.8±0.0d 15.2±0.4b
0.1 15.9±1.3b 6.8±0.7a 14.8±0.2d 20.3±0.9a
0.2 12.8±1.0c 4.8±0.9b 15.7±0.2c 15.3±0.4b
0.4 11.1±1.2d 5.4±0.1b 18.7±0.2b 13.6±0.3bc
0.6 18.8±1.8a 6.6±0.3a 21.2±0.1a 14.0±0.7bc
NaCl浓度
(mol/L)
盐胁迫后不同时间的脯氨酸含量(μmol/g)
1 d 4 d 8 d 12 d
0 29.5±2.6a 28.6±1.6d 27.1±0.9a 23.0±1.2a
0.1 12.2±0.1b 40.1±0.5c 17.4±0.9b 16.4±0.6b
0.2 29.1±2.1a 42.7±0.1b 25.4±1.5a 12.9±0.3c
0.4 9.7±0.9b 44.6±1.8b 19.4±0.3b 10.9±0.2d
0.6 9.7±0.7b 58.8±0.9a 28.0±2.9a 6.3±0.3d
NaCl浓度
(mol/L)
盐胁迫后不同时间的可溶性糖含量(mg/g)
1 d 4 d 8 d 12 d
0 20.6±0.2c 17.8±0.1d 20.6±0.1b 23.9±0.1d
0.1 20.8±0.4c 22.8±0.1c 17.8±0.0c 27.8±0.0b
0.2 24.7±0.1b 25.7±0.1b 18.7±0.0c 22.8±0.0e
0.4 31.7±0.4a 16.2±0.2e 20.3±0.2b 24.4±0.2c
0.6 16.1±0.1d 27.8±0.1a 26.9±0.1a 31.0±0.3a
NaCl浓度
(mol/L)
盐胁迫后不同时间的SOD活性(U/g)
1 d 4 d 8 d 12 d
0 1 282±25bc 1 076±9.8a 1 051±19a 1 410±29e
0.1 1 435±10b 974±41b 864±9c 2 051±39d
0.2 1 051±35c 794±34c 897±48b 8 820±51c
0.4 1 717±57a 333±49d 615±69e 9 512±38b
0.6 615±42d 625±69c 666±76d 16 282±650a
NaCl浓度
(mol/L)
盐胁迫后不同时间的POD活性(U/g)
1 d 4 d 8 d 12 d
0 377.6±86.3b 455.2±44.5d 621.9±49.3ab 845.6±31.3b
0.1 393.3±81.2b 685.0±37.7a 422.8±15.4b 648.1±39.2b
0.2 478.8±82.5a 622.8±29.9b 643.7±37.2ab 373.0±38.3d
0.4 484.0±33.4a 645.2±13.3ab 594.9±94.7ab 867.2±20.7a
0.6 476.7±50.9a 513.7±50.0c 691.3±37.5a 828.7±32.0c
注:同类指标内同列数据后标有不同小写字母表示差异显著(P<0.05)。
02 mol/L NaCl胁迫的SOD活性迅速上升,除对照外,各处理间达到显著性差异。endprint
2.6 NaCl胁迫对金银花幼苗过氧化物酶(POD)活性的影响
由图5、表2可见,随着0.6 mol/L NaCl胁迫时间的延
长,金银花幼苗叶片过氧化物酶(POD)活性呈上升趋势;盐胁迫前4 d内,各处理的POD活性均呈增加趋势;盐胁迫8 d时,0.6 mol/L NaCl处理的POD活性最高;盐胁迫12 d时,04 mol/L NaCl处理的POD活性最高;胁迫8 d以后,除 0.2 mol/L 盐浓度处理下的POD活性有所下降,其他各浓度处理下的POD活性均呈继续上升的态势,且均达到各自的峰值(除0.1 mol/L处理)。
3 讨论
3.1 盐胁迫对金银花幼苗体内渗透调节物质的影响
在盐胁迫下,由于外界渗透势较低,盐分对植物细胞会产生渗透胁迫[7],为保持胞内水分,维持细胞的正常生理代谢,植物体内会产生一些渗透保护物质如可溶性糖、脯氨酸、甜菜碱等[8]。脯氨酸是植物在盐胁迫下的主要渗透调节物质之一,它可以保护细胞膜系统,维持胞内酶的结构,本研究中,胁 迫初期各盐浓度处理下的金银花幼苗叶片脯氨酸含量均迅速增加,到胁迫4 d时达到峰值,且脯氨酸积累量与盐浓度成正比,这与鲍雅静等对树型金银花[9]以及刘奕琳等对10个墨西哥柏种源幼苗[10]的研究结果一致。可溶性糖也是一种主要的渗透调节物质,在本研究中,随着盐胁迫时间的延长,各盐浓度处理下的金银花幼苗叶片可溶性糖含量在一定时间内呈先低后高的变化趋势,0.6 mol/L盐浓度处理下的金银花幼苗叶片可溶性糖含量变化最为明显,耐盐植物的可溶性糖含量高于不耐盐的植物[11]。张美云等认为,干旱胁迫的强度和时间对渗透物质的变化有较大的影响,在一定的限度内,脯氨酸的积累比可溶性糖要早,停止积累的时间也早于可溶性糖,游离脯氨酸和可溶性糖具有相互补偿的作用[12]。本研究结果也表明,脯氨酸于胁迫前期积累,且积累量与盐浓度呈正相关;在胁迫后期脯氨酸含量迅速降低,而可溶性糖含量积累,因此本研究也认为,脯氨酸积累与可溶性糖积累间存在着相互补偿的作用。
3.2 盐胁迫对金银花幼苗体内抗氧化酶类活性及氧化产物的影响
在正常生长条件下,植物细胞内活性氧的形成和清除之间保持着一种动态平衡,不会对植物产生危害。当植物遭受盐胁迫时,这种活性氧产生与清除之间的动态平衡被破坏,自由基积累,造成膜脂的过氧化和脱脂作用,引起植物氧化损伤[7]。抗性强的植物 SOD等保护酶能维持较高活性,防止了活性氧积累,因此保护酶的活性水平与抗旱性密切相关[13-15]。当植物受到盐胁迫时,其体内超氧阴离子水平提高,在自由基逐步积累诱导下SOD活性增强,加快了对超氧自由基的清除。在本试验中,不同浓度盐处理下的金银花幼苗叶片SOD活性在前8 d变幅很小,8 d后SOD活性迅速增加,其增加幅度与盐浓度相关;此时POD活性也迅速增加,丙二醛含量迅速减少,本研究认为丙二醛含量的降低主要是与SOD、POD 的活性升高相关,即胁迫后期活性氧的积累诱导了抗氧化物酶活性的升高,从而降低膜脂的过氧化程度[11]。
参考文献:
[1]吕贻忠,李保国.土壤学[M]. 北京:中国农业出版社,2006:356-357.
[2]许 卉,赵丽萍. 盐胁迫对金银花生理生化的影响[J]. 湖北林业科技,2007,143(1):9-12.
[3]张志良,瞿伟箐,李小方. 植物生理学实验指导[M]. 北京:高等教育出版社,2009:227-229.
[4]李 玲,李娘辉,蒋素梅,等. 植物生理学模块实验指导[M]. 北京:科学出版社,2009:97-98.
[5]常福辰,陆长梅,沙 莎. 植物生物学实验[M]. 南京:南京师范大学出版社,2007:158-160.
[6]周学丽,周青平,颜红波,等. NaCl胁迫对同德小花碱茅苗期生理特性的影响[J]. 草业科学,2009,26(6):101-105.
[7]王东明,贾 媛,崔继哲. 盐胁迫对植物的影响及植物盐适应性研究进展[J]. 中国农学通报,2009,25(4):124-128.
[8]李 彦,张英鹏,孙 明,等. 盐分胁迫对植物的影响及植物耐盐机理研究进展[J]. 中国农学通报,2008,24(1):258-265.
[9]鲍雅静,季 静,王 迪,等. 不同品种金银花叶片中脯氨酸对盐胁迫的响应[J]. 安徽农业科学,2011,39(8):4502-4503.
[10]刘奕琳,万福绪,娄晓瑞.盐胁迫对10个墨西哥柏种源幼苗生理生化的影响[J]. 南京林业大学学报:自然科学版,2013,37(4):29-33.
[11]程淑娟,唐东芹,刘群录. 盐胁迫对两种忍冬属植物活性氧平衡的影响[J]. 南京林业大学学报:自然科学版,2013,37(1):137-141.
[12]张美云,钱 吉,郑师章. 渗透胁迫下野生大豆游离脯氨酸和可溶性糖的变化[J]. 复旦学报:自然科学版,2001,40(5):558-561.
[13]陈 倩,陶功胜,谢寅峰,等. 高氯酸钾胁迫对水稻幼苗光合作用及保护酶活性的影响[J]. 江苏农业学报,2013,29(4):715-721.
[14]Mckersie B D,Chen Y,Beus M D,et al. Superoxide dismutase enhance tolerance of freezing stress in transgeneic alfalfa(Medicago sativa L.)[J]. Plant Physiology,1993,103(4):1155-1163.
[15]王志颖,刘 鹏. 柠檬酸抑制剂对铝胁迫下油菜抗氧化酶活性的影响[J]. 江苏农业学报,2013,29(5):957-966.endprint
