采用垂直电场电泳分离脱盐技术模拟海水淡化的探索
2015-06-15徐啸朱晓兵周集体李任征
徐啸朱晓兵周集体李任征
(1大连理工大学氢能与液体燃料研究中心,辽宁 大连116024;2大连理工大学环境学院,辽宁 大连116024;3盘锦市清洁生产中心,辽宁 盘锦124013)
引 言
中国淡水资源总量较多,但人均占有量仅为世界人均占有量的1/4左右。随着社会的发展,淡水资源的供给日益紧张,人们需要开拓新的淡水资源供给方式。其中,海水淡化作为一种新的淡水资源供给方式,具有其独特的优势和良好的前景。中国是海洋大国,通过海水淡化可以实现淡水资源总量的增加且淡化后的水质好。因此,海水淡化是解决淡水资源匮乏的有效方法之一。
目前,海水淡化常用方法有蒸馏法和膜法。蒸馏法是指利用热能进行海水淡化的方法,包括多级闪蒸、低温多效蒸馏等[1]。多级闪蒸的优点是淡化后水质好、传热管内无相变且无结垢现象;但需要耐腐蚀材料和大量的化学试剂来抑制设备的结垢和腐蚀现象,且操作温度高,因而其能耗大,成本高[2]。低温多效蒸馏法操作弹性较大、操作温度较低,因此对设备和传热管的材质要求较低,成本降低[3];但存在严重的结垢和腐蚀现象。膜法是利用膜的选择透过性达到海水淡化的目的,主要包括反渗透法和电渗析法。反渗透法是最节能的海水淡化方法,海水淡化过程无相变、效率高、投资成本低;但是由于对进水水质要求较高,因此需要海水预处理,但是预处理过程较为复杂。电渗析法具有化学药剂消耗少、环境污染小等优点,但是对于一些非电解质和弱电解质的物质难以去除,且不适于制备饮用水。
电泳 (electrophoresis,简称EP)是指在电场作用下,带电荷的粒子或离子相对于溶液向阴极或阳极迁移的一种现象。20世纪30年代Tiselius[4]在洛克菲勒基金会的支持下,研制了第一台电泳仪“Tiselius电泳仪”,并创立了移动界面电泳方法,并首次证明了血清的组成。自20世纪50年代以来,电泳方法已相当多元化,相继出现了纸电泳[5]、醋 酸 纤 维 素 薄 膜 电 泳[6-8]、 淀 粉 凝 胶 电泳[9-10]、聚丙 烯 酰 胺 凝 胶 电 泳[11-13]、 等 电 聚 焦 电泳[14-18]、等 速 电 泳[19]、 毛 细 管 电 泳[20-23]、 介 电 电泳方法[24-26],并将其应用于分离分析。然而大部分电泳方法是用于蛋白质、氨基酸和核酸等生物质的微量分离分析,对于海水淡化的连续分离和制备涉及较少。
本实验利用自制的垂直电场电泳装置考察模拟海水的脱盐效果。该电泳装置有两对垂直放置的铂钌电极形成相互垂直的电场,在电场的作用下,不同电性的带电粒子将向电极方向发生迁移,由于不同粒子的质荷比不同,其迁移速度不同,电泳装置中间出水口即可获得脱盐后的水溶液,从而实现模拟海水淡化的目的。本研究利用这一原理,考察模拟海水的脱盐效果 (以氯离子为研究对象),并考察了氯离子初始浓度、停留时间和电压对脱盐率、能量效率和分布比率的影响。
1 实验部分
1.1 实验试剂及仪器
试剂:氯化钠,分析纯;硝酸银,纯度≥99.8%;浓硫酸,纯度≥98%;氢氧化钠,纯度≥96%;铬酸钾 (K2CrO4),纯度≥99.5%;酚酞,纯度≥98%。
仪器:WYJ-601可调式直流稳压稳流电源,电压量程为60V,电流量程为3A,上海稳凯电源设备有限公司;BT01-100蠕动泵驱动器,保定兰格恒流泵有限公司。
1.2 电泳装置
实验所用电泳装置如图1所示。
其中,电泳槽为自制的聚氯乙烯塑料装置,尺寸为20.0cm×20.0cm×30.0cm;两对垂直放置的电极板为钛材镀贵金属铂钌,规格均为17.0 cm×20.0cm ×0.1cm;电泳槽中填料为石英砂;输入管插入电泳装置石英砂正中间深约2.0 cm处;电泳槽底部设置均匀分布的网格16个,网格中心设有圆形出水口,出水口直径约为1.0cm,各个相邻出水口之间距离为5.0cm;出水口下设有收集管,其中收集管的流速通过玻璃转子流量计控制。
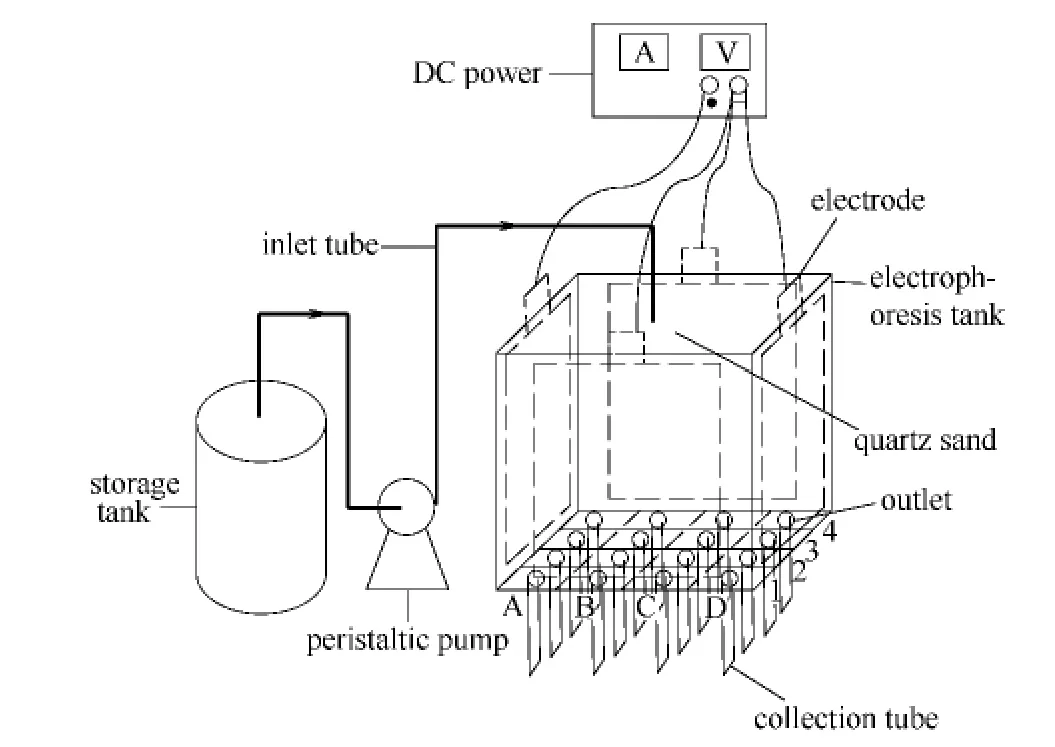
图1 电泳装置结构示意图Fig.1 Schematic diagram of electrophoresis apparatus
电泳装置出水口示意图如图2所示。
电泳装置出水分为4个区域:正极区、负极区、中间区和两极邻近区。正极区 (positive region,图中黑色部分)包括A1、A2、A3、B1和C1出水口,中间区 (central region,红棕色部分)包括B2、B3、C2和C3出水口,负极区(negative region,灰色部分)包括B4、C4、D2、D3和D4出水口,两极邻近区 (adjacent region between two electrodes,深灰色部分)包括A4和D1出水口。
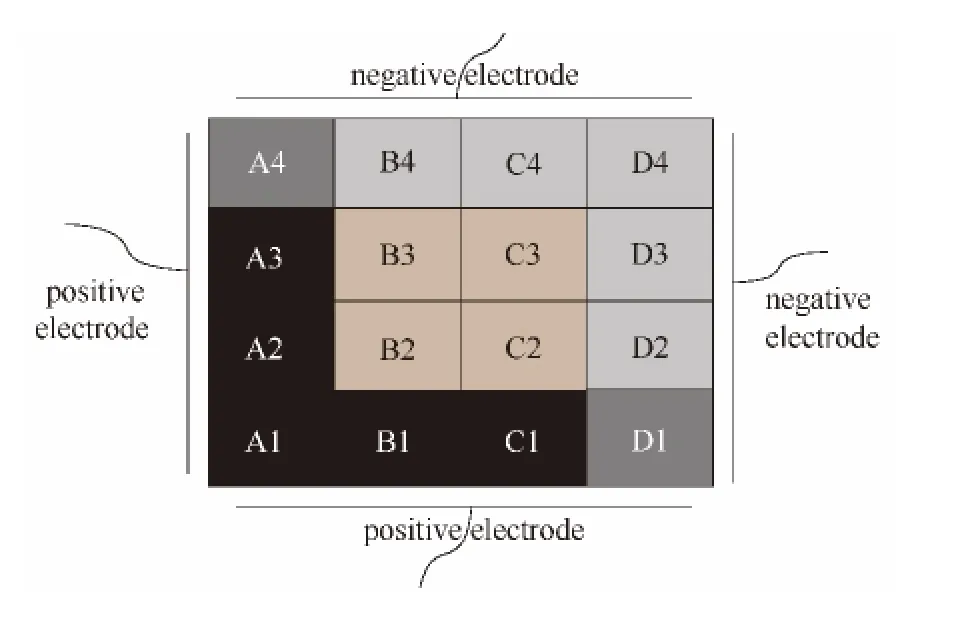
图2 电泳装置出水口示意图Fig.2 Schematic diagram of four outlets of electrophoresis apparatus,such as positive region (black),negative region (gray),central region (red brown)and adjacent region between two electrodes (dark grey)
1.3 实验步骤
1.3.1 氯离子初始浓度的影响 配制氯离子浓度分别为466.4mg·L-1、638.7mg·L-1和862.0 mg·L-1的氯化钠水溶液。将4.6LNaCl水溶液以泵流速约为2.00L·h-1通入到电泳装置中,电泳装置电压设置为36V,停留时间2.3h,收集各出水口溶液。按照1.4分析方法测定各出水口溶液的氯离子浓度,并计算各出水口脱盐率 (以氯离子为考察对象)、能量效率和分布比率。
1.3.2 停留时间的影响 配制氯离子浓度为466.4mg·L-1的氯化钠水溶液,将氯化钠水溶液通入电泳装置中,停留时间分别为2.0h、2.4h、4.2h、10.3h,电泳装置电压为36V,其他电泳条件一致,做平行实验。考察不同停留时间下的脱盐率、能量效率和分布比率。
1.3.3 电压的影响 配制氯离子浓度为466.4 mg·L-1的氯化钠水溶液,将氯化钠水溶液通入到电泳装置中,停留时间为2.3h,电泳装置电压分别设置为10V、20V、30V和36V,其他电泳条件一致,做平行实验。考察不同电压下的脱盐率、能量效率和分布比率。
1.4 分析方法
各出水口溶液中氯离子浓度的测定采用硝酸银滴定法。
脱盐率 (desalination ratio,以氯离子为考察对象)定义为各出水口氯离子浓度变化量占氯离子初始浓度的百分数,如式 (1)。
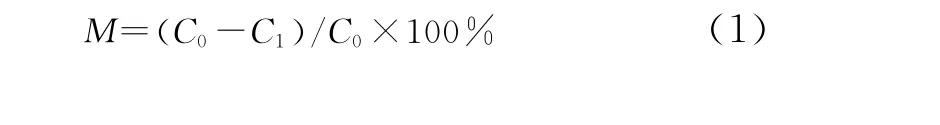
式中,C0为氯离子初始浓度,mg·L-1;C1为各出水口氯离子浓度,mg·L-1;M为脱盐率,%。
能量效率 (energy efficiency)定义为在一定的氯离子初始浓度下,单位能量下向正极区域迁移的氯离子质量,如式 (2)。
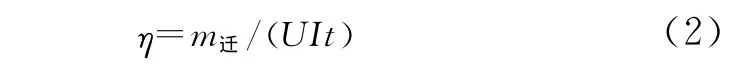
式中,η为能量效率,mg·(kW·h)-1;m迁为向正极区域迁移的氯离子的质量,mg;U为电极板两端电压,V;I为电流,A;t为通电时间,s。
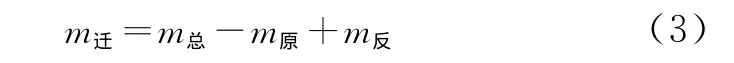
式中,m迁为向正极区域迁移的氯离子的质量,mg;m总为在正极区域获得的氯离子总质量,mg;m原为在不施加电场的条件下,正极区域原本应该获得的质量,mg;m反为在正极板发生反应的氯离子质量,mg。
分布比率 (distribution ratio)定义为各区域收集氯离子质量占各区域氯离子质量总和的百分数。
2 结果与讨论
2.1 氯离子初始浓度对脱盐率、能量效率和分布比率的影响
2.1.1 各出水口脱盐率 当氯离子初始浓度为466.4mg·L-1时,各出水口脱盐率如图3所示。
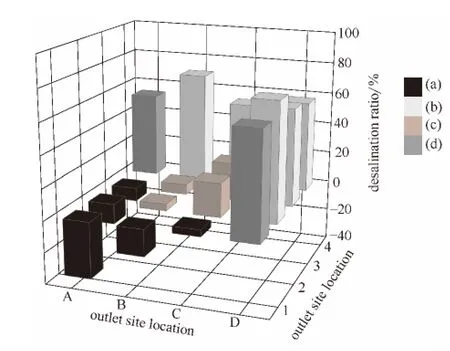
图3 各出水口脱盐率Fig.3 Desalination ratio of various outlets at
在电场作用下氯离子向正极板区域迁移,正极区出水口溶液氯离子浓度高于氯离子初始浓度,因此正极区脱盐率数值为负 (即发生氯的富集)。中间区、负极区和两极邻近区的氯离子浓度低于氯离子初始浓度,这3个区域的脱盐率为正。
从图中可知,中间区C2和C3出水口脱盐率分别为21.3%和23.4%,B2和B3出水口脱盐率较低,仅为4.3%和6.4%。理论上,氯离子向正极区迁移,则中间区出水口脱盐率应较高,可能是由于进水流速较大,离子在电泳中的停留时间较短,未得到充分迁移,导致中间出水口脱盐率较低。正极区A1出水口脱盐率最低,为-36.2%(富集氯离子);B1、A2和A3出水口脱盐率分别为-17.0%、-12.8%和-8.5%,而C1出水口脱盐率为4.3%。负极区脱盐率较高,均在50%以上;D2出水口脱盐率最高,为74.5%;C4出水口脱盐率最低,为53.2%。负极区仍有少量氯离子存在,原因可能是钠离子在静电作用下把溶液中带相反电荷的氯离子吸引到其周围,以保持局部电荷平衡,钠离子携带部分氯离子向负极区迁移。两极邻近区A4和D1出水口脱盐率分别为53.8%和66.4%。
当氯离子初始浓度为638.7mg·L-1时,各出水口脱盐率如图4所示。
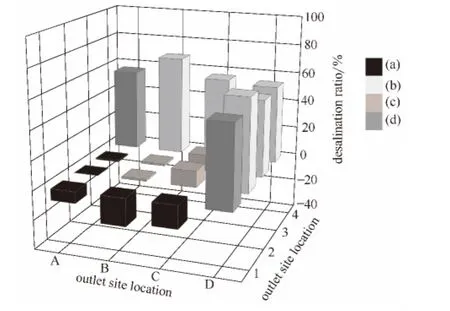
图4 各出水口脱盐率Fig.4 Desalination ratio of various outlets at
当氯离子初始浓度增加到638.7mg·L-1时,电泳装置中间区各出水口脱盐率降低,正极区各出水口 (除C1出水口外)脱盐率升高 (即富集率降低);负极区和两极邻近区各出水口脱盐率降低。
中间区C2和C3出水口脱盐率最大,均为11.1%;B2和B3出水口脱盐率最低,为1.4%。正极区B1出水口脱盐率最小 (即富集率最大),为-19.1%。负极区B4出水口脱盐率最大,为68.7%;D3出水口脱盐率最小,为53.0%。两极邻近区A4和D1出水口脱盐率均为56.2%。
当氯离子初始浓度为862.0mg·L-1时,各出水口脱盐率如图5所示。
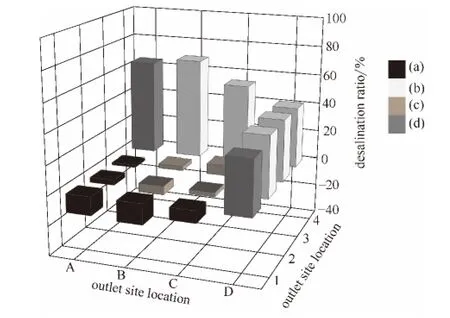
图5 各出水口脱盐率Fig.5 Desalination ratio of various outlets at
当氯离子初始浓度增加到862.0mg·L-1时,中间区脱盐率进一步降低,正极区各出水口脱盐率相对升高 (即富集率降低);负极区和两极邻近区(除A4出水口)脱盐率均降低。
中间区C3出水口脱盐率最大,为7.1%;B2出水口脱盐率最小,为-5.9%。正极区A3出水口脱盐率最大,为3.6%;B1出水口脱盐率最小(即富集率最大),为-5.9%。负极区B4出水口脱盐率最大,为68.7%;D2和D4出水口脱盐率最小,为41.2%。两极邻近区A4和D1出水口脱盐率分别为64.7%和36.5%。
2.1.2 各区域脱盐率、能量效率和分布比率的比较 不同氯离子初始浓度下4个区域脱盐率的比较如图6所示。
从图6可知,随着氯离子初始浓度增加,电泳装置中间区脱盐率逐渐降低,正极区脱盐率逐渐升高 (即富集率逐渐降低),负极区和两极邻近区的脱盐率均降低。
不同氯离子初始浓度下能量效率如表1所示。
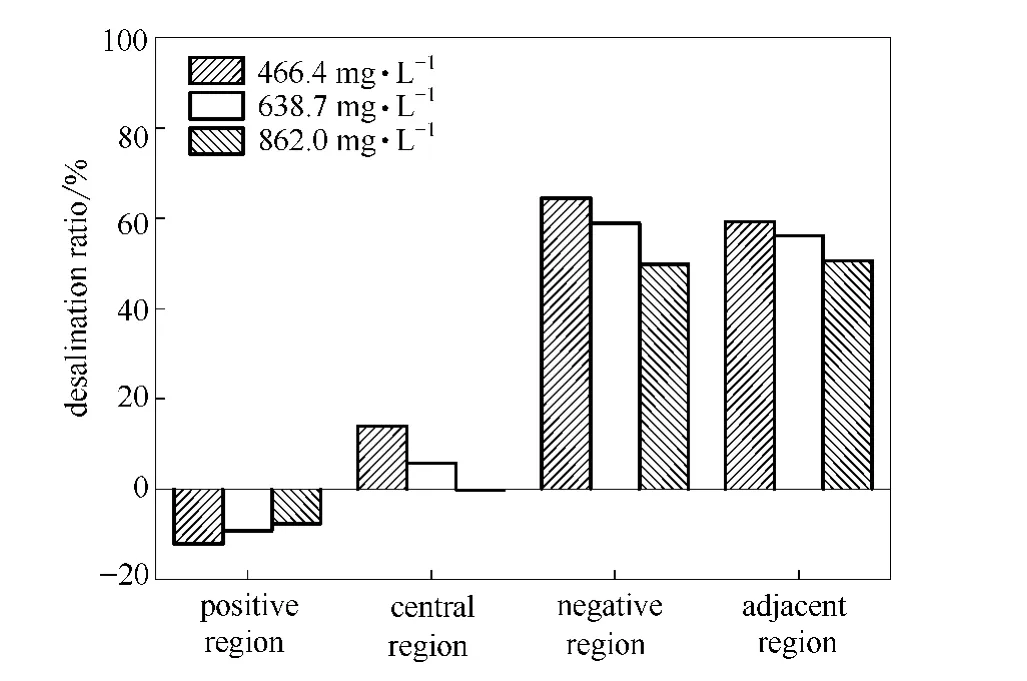
图6 不同氯离子初始浓度下的区域脱盐率比较Fig.6 Comparison of desalination ratio at different initial concentration of chloride anion
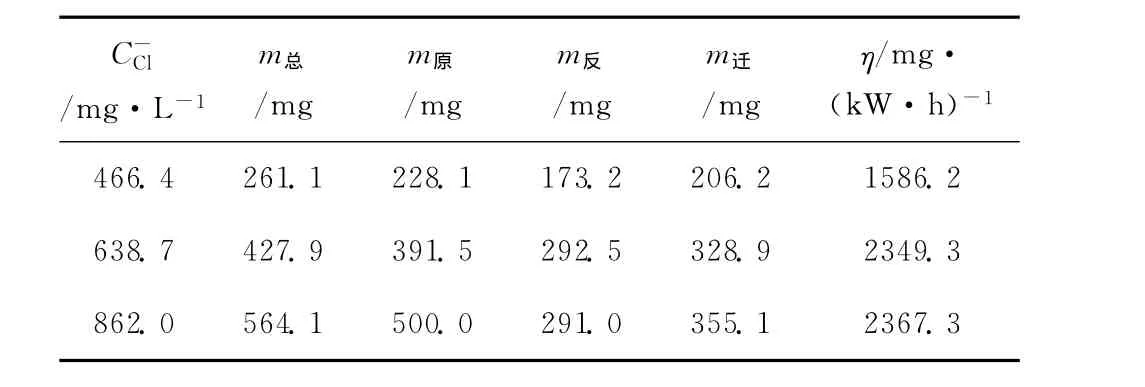
表1 不同氯离子初始浓度下的能量效率Table 1 Energy efficiency at different initial concentration of chloride anion
从表1可知,当氯离子初始浓度增加时,向正极区迁移的氯离子质量逐渐增加,能量效率逐渐升高。
当进水氯离子浓度由466.4mg·L-1增加到862.0mg·L-1时,能量效率由 1586.2mg·(kW·h)-1升高到2367.3mg·(kW·h)-1。
不同氯离子初始浓度下各区域分布比率的比较如图7所示。
从图7可知,其他电泳条件保持不变,当氯离子初始浓度增大时,电泳装置中间区分布比率增大,最大为34.6%。正极区分布比率由47.8%降低到41.1%。负极区分布比率整体呈上升趋势。两极邻近区分布比率由5.9%升高到7.2%。
综上所述,随着入水口处的氯离子初始浓度的增加,电泳装置出水口的中间区的脱盐率降低;能量效率逐渐升高;中间区、负极区和两极邻近区的分布比率增大,而正极区的分布比率减小。
2.2 停留时间对脱盐率、能量效率和分布比率的影响
2.2.1 停留时间与各区域脱盐率的关系 停留时间与各区域脱盐率的关系如图8所示。
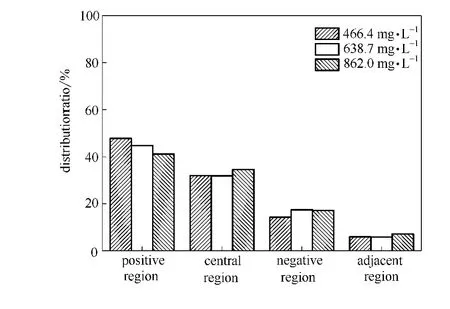
图7 不同氯离子初始浓度下分布比率的比较Fig.7 Comparison of distribution ratio at different initial concentration of chloride anion
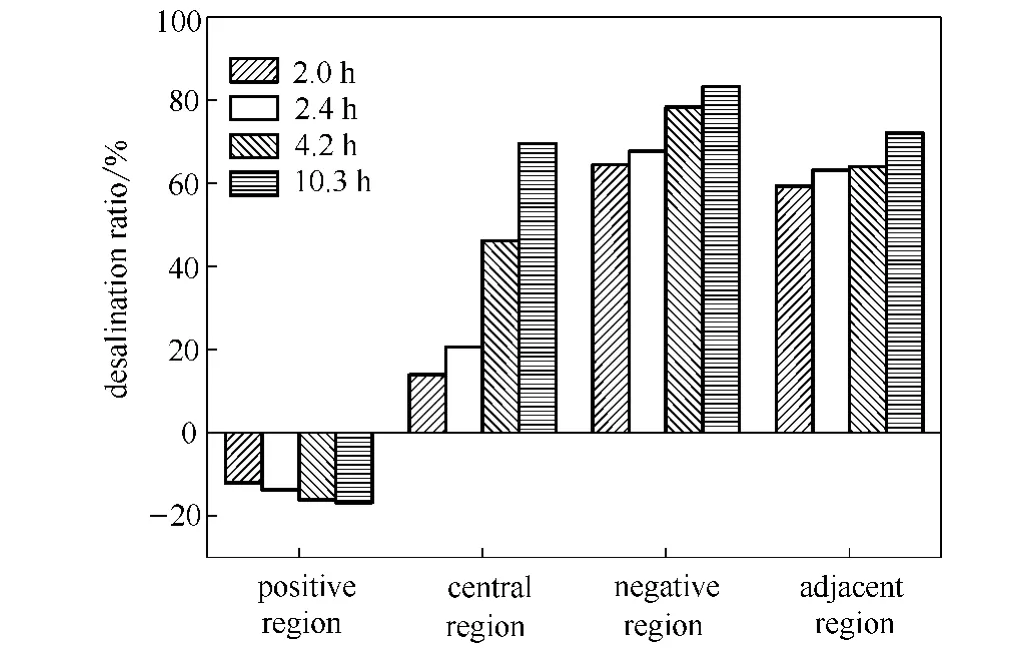
图8 不同停留时间下各区域的脱盐率Fig.8 Desalination ratio of each region at different retention time
当停留时间由2.0h增加到10.3h的过程中,电泳装置中间区脱盐率由13.9%升高到69.5%。正极区的脱盐率逐渐降低 (即富集率逐渐增大),从-12.1%降低到-16.8%。负极区脱盐率从64.4%升高到83.2%。两极邻近区脱盐率由59.2%升高到72.0%。
因此,停留时间的改变对中间区脱盐率影响最大,增加停留时间可以使中间区的氯离子充分向正极区迁移,中间区出水口离子浓度降低,从而可以从中间区出水口获得脱盐后的水溶液,且增加停留时间可以提升脱盐效果。
2.2.2 停留时间与能量效率关系 不同停留时间下的能量效率如表2所示。
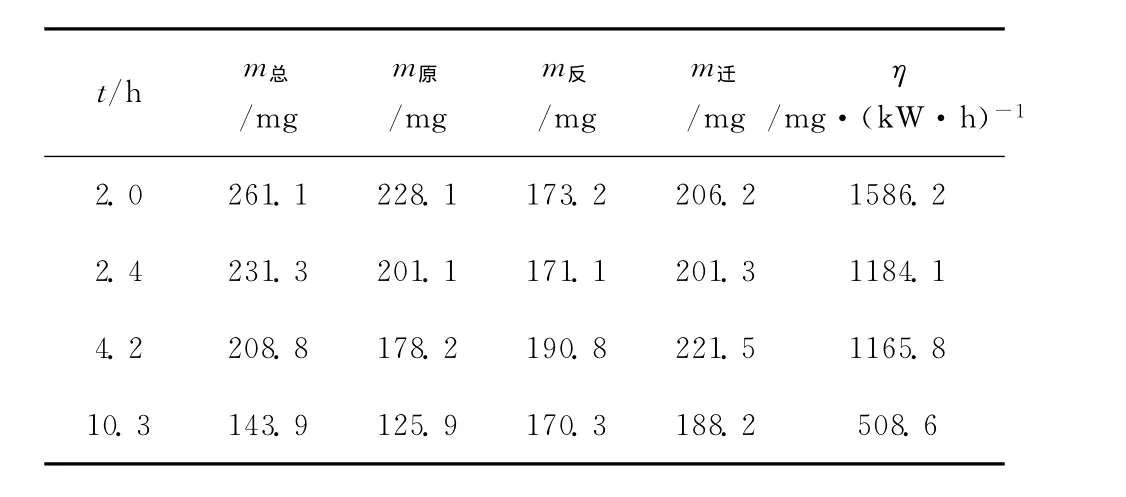
表2 不同停留时间下的能量效率Table 2 Energy efficiency at different retention time
从表2可以看出,当停留时间由2.0h增加到10.3h,电泳装置的能量效率由1586.2mg·(kW·h)-1逐渐降低到508.6mg·(kW·h)-1。
2.2.3 停留时间与分布比率的关系 根据分布比率定义,得到不同停留时间下的分布比率如图9所示。
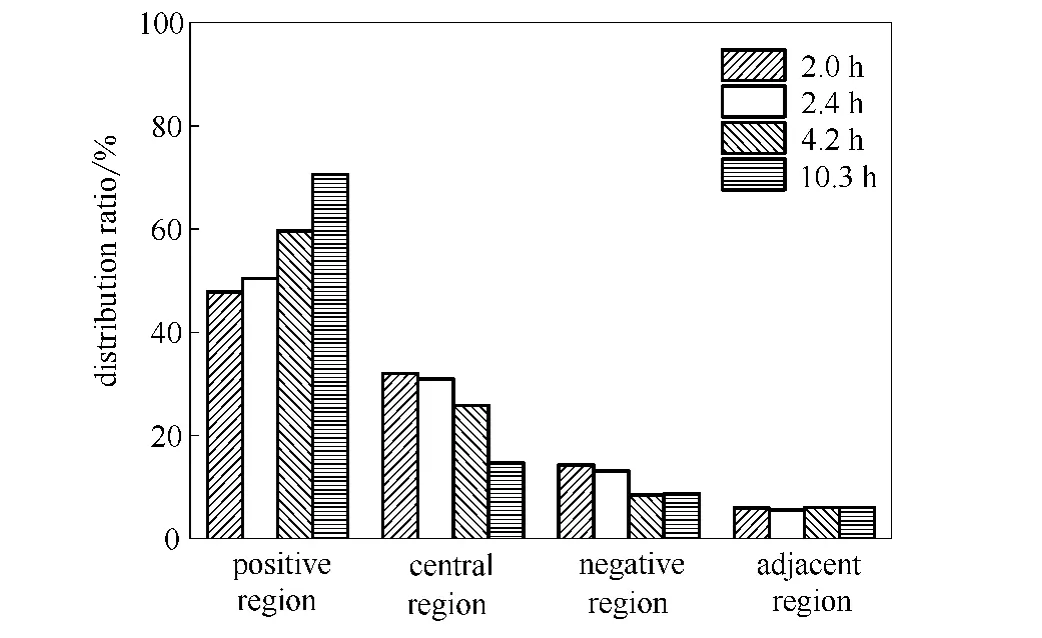
图9 不同停留时间下的分布比率Fig.9 Distribution ratio at different regions as a function of retention time
从图9可知,当停留时间从2.0h增加到10.3 h时,中间区氯离子分布比率由32.0%降低到14.7%。正极区氯离子分布比率由47.9%增加到70.6%。负极区氯离子分布比率整体呈下低趋势,由14.3%降到8.4%。两极邻近区氯离子分布比率整体呈上升趋势,但变化较小。
综上所述,随着停留时间的增加,中间区脱盐率明显升高,高达69.5%;能量效率逐渐降低;中间区和负极区的分布比率减小,而正极区和两极邻近区的分布比率增加。
2.3 电压的影响
2.3.1 电压与各区域脱盐率的关系 不同电压下各区域的脱盐率如图10所示。
当电压由10V升高到36V的过程中,电泳装置中间区脱盐率逐渐升高,正极区脱盐率由5.9%升高到13.9%。正极区脱盐率降低 (即富集率升高),由-1.4%降低到-12.1%。负极区脱盐率由21.4%升高到64.4%。两极邻近区脱盐率由23.4%升高到59.2%。因此,电压从10V升高到36V,对负极区和两极邻近区的脱盐率影响最大。2.3.2 电压与能量效率的关系 不同电压下的能量效率如表3所示。
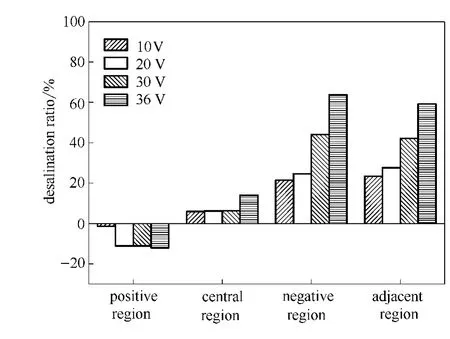
图10 不同电压下各区域的脱盐率Fig.10 Desalination ratio at various regions as a function of different applied voltage
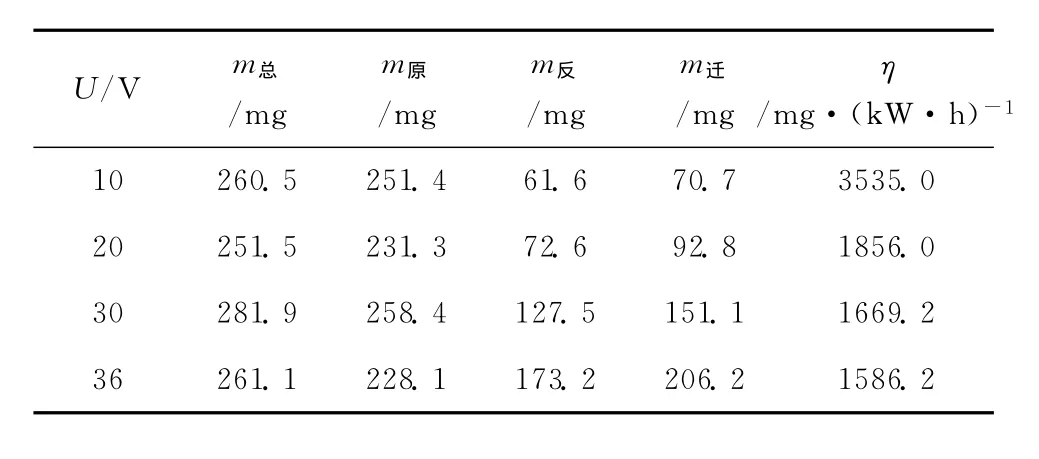
表3 不同电压下的能量效率Table 3 Energy efficiency at different applied voltage
从表3可知,当电压升高时,向正极板迁移的氯离子质量逐渐增大,但是电泳装置的能量效率逐渐降低。当电压由10V升高到36V时,电泳装置的能量效率由3535.0mg·(kW·h)-1降低到1586.2mg·(kW·h)-1。
2.3.3 电压与分布比率的关系 不同电压下的分布比率如图11所示。
从图11可知,当电压升高时,中间区的氯离子分布比率呈先上升后降低趋势,正极区的氯离子分布比率逐渐增大,负极区和两极邻近区的氯离子分布比率逐渐减小。当电压由10V升高到36V时,中间区氯离子分布比率由25.1%增加到32.6%后减小为31.9%;正极区分布比率由38.0%增加到47.8%;负极区分布比率由28.7%降到14.3%;两极邻近区分布比率由8.2%降到5.9%。
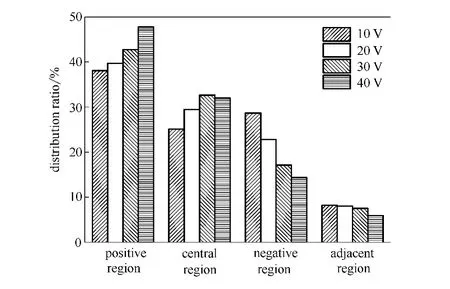
图11 不同电压下的分布比率Fig.11 Distribution ratio at different voltage
由此可见,电压的改变对于正极区和负极区的氯离子分布比率影响较大。
综上所述,随着电压的升高,中间区的脱盐率逐渐升高,最高达13.9%;能量效率逐渐降低;正极区的分布比率逐渐增大,而负极区和两极邻近区的分布比率逐渐减小,中间区分布比率呈先上升后降低趋势。
2.4 电化学反应
由于电泳实验中,施加的电极电势高于氯气、氢气析出的平衡电势,因此阳极、阴极均可能存在析氯、析氢反应。25℃时的电极反应式和标准电极电势[27]如下所示
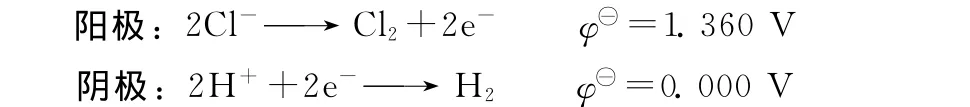
电泳装置电压为36V,停留时间2.3h,氯离子初始浓度分别为466.4mg·L-1、638.7mg·L-1和862.0mg·L-1时,发生副反应的情况如下。
2.4.1 氯离子初始浓度为466.4mg·L-1实际氯离子总质量为各出水口实际获得的氯离子总质量;理论氯离子总质量定义为氯离子初始浓度与出水口获得溶液总体积的乘积。
根据各区域氯离子浓度和体积,计算得到各区域所含氯离子质量及反应氯离子总质量,如图12所示。
正极区、中间区、负极区和两极邻近区的氯离子质量分别为261.1mg、174.7mg、78.4mg和32.3mg,各区域氯离子总质量为546.5mg。理论氯离子总质量为719.7mg。因此,在电压36V,停留时间2.3h条件下,有173.2mg氯离子在正极板发生了反应。
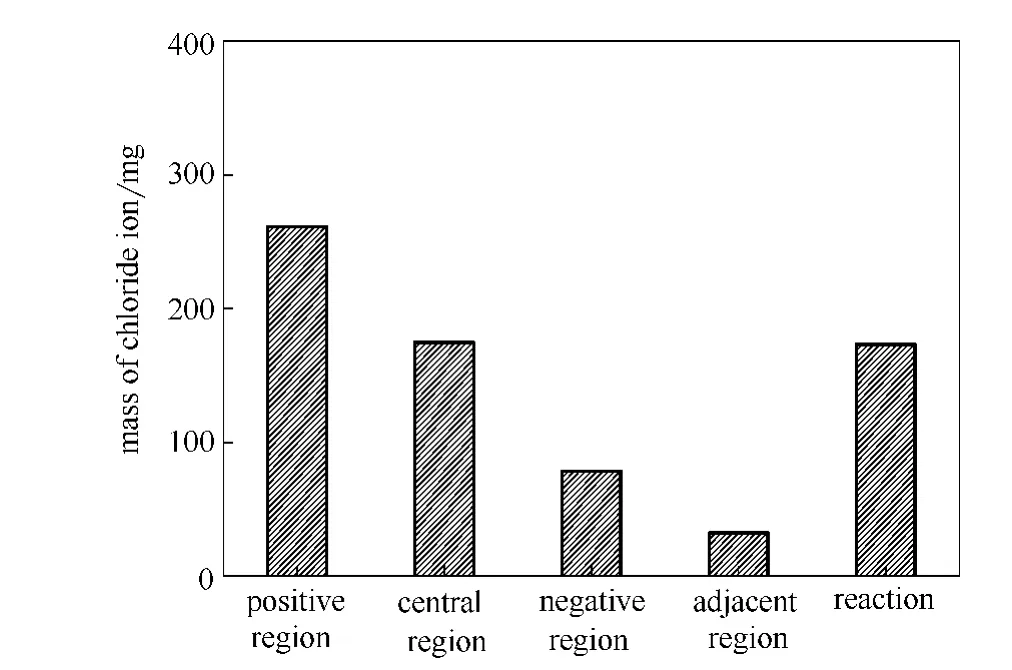
图12 各区域及反应的氯离子质量(初始浓度466.4mg·L-1)Fig.12 Chloride anion mass of each region and reaction(initial concentration of chloride anion 466.4mg·L-1)
2.4.2 氯离子初始浓度为638.7mg·L-1氯离子初始浓度为638.7mg·L-1时,各区域所含氯离子质量及反应氯离子总质量如图13所示。
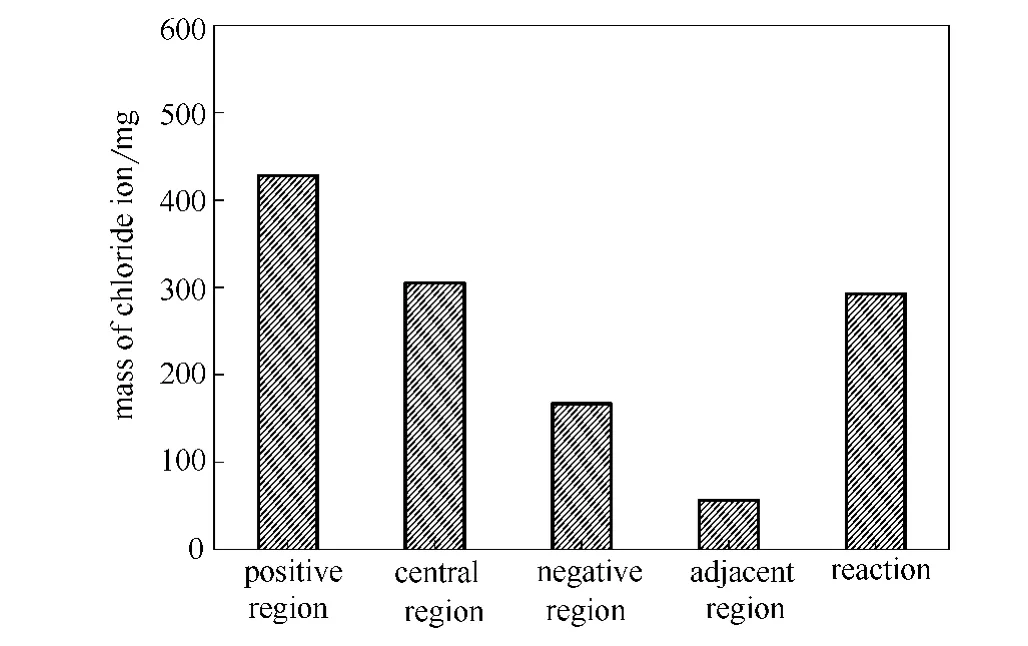
图13 各区域及反应的氯离子质量(初始浓度638.7mg·L-1)Fig.13 Chloride anion mass of each region and reaction(initial concentration of chloride anion 638.7mg·L-1)
正极区、中间区、负极区和两极邻近区氯离子质量分别为427.9mg、305.0mg、166.7mg和56.1mg,各区域氯离子总质量为955.8mg。理论氯离子总质量为1248.3mg。因此,在电压36V,停留时间2.3h下,有292.5mg氯离子在正极板发生了反应生成氯气。相比于氯离子初始浓度为466.4mg·L-1时,发生反应的氯离子量增多。
2.4.3 氯离子初始浓度为862.0mg·L-1氯离子初始浓度为862.0mg·L-1时,各区域所含氯离子质量及反应氯离子总质量如图14所示。

图14 各区域及反应的氯离子质量(初始浓度862.0mg·L-1)Fig.14 Chloride anion mass of each region and reaction(initial concentration of chloride anion 862.0mg·L-1)
正极区、中间区、负极区和两极邻近区氯离子质量分别为564.1mg、474.7mg、234.9mg和98.2mg,各区域氯离子总质量为1371.8mg。理论氯离子总质量为1662.8mg。因此,在电压36V,停留时间2.3h条件,有291.0mg氯离子在正极板发生了反应生成氯气。相比于氯离子初始浓度为638.7mg·L-1的电泳实验,发生反应的氯离子质量基本相同。
不同氯离子初始浓度下,各区域及反应的氯离子占理论氯离子质量的比例如图15所示。
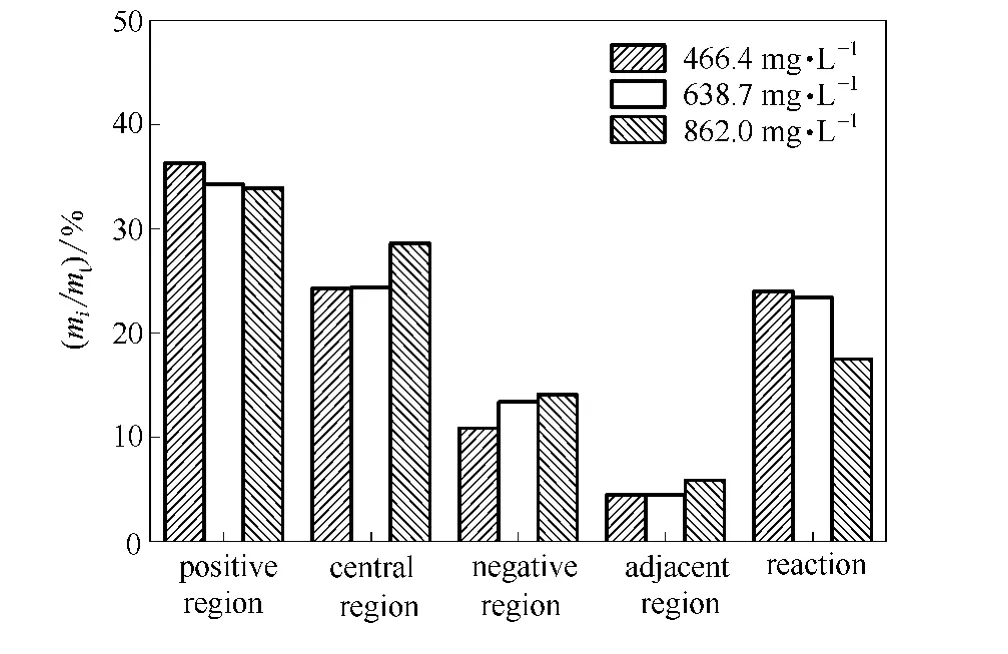
图15 各区域及反应的氯离子占理论氯离子的比例Fig.15 Ratio of each region,reaction of chlorine anion and theoretical total mass
图15给出了各区域及反应的氯离子占理论氯离子质量的比例,其中mi为各区域及反应的氯离子质量,mt为理论氯离子总质量。从图中可知,当氯离子初始浓度增加时,中间区氯离子质量占理论氯离子总质量的比例由24.3%增大到28.5%,负极区氯离子质量占理论氯离子总质量的比例由10.9%增大到14.1%,两极邻近区的氯离子质量占理论氯离子总质量的比例由4.5%增大到5.9%,正极区的氯离子质量占理论氯离子总质量的比例由36.3%减小到33.9%。发生反应的氯离子质量占理论氯离子总质量的比例由24.1%降到17.5%。即当氯离子初始浓度增加时,在正极板发生反应的氯离子质量增大,但是所占理论总质量的比例降低。
3 结 论
(1)随着入水口处的氯离子初始浓度的增加,电泳装置出水口的中间区的脱盐率降低,能量效率逐渐升高,中间区、负极区和两极邻近区的分布比率增大,而正极区的分布比率减小。
(2)随着停留时间的增加,中间区脱盐率明显升高,高达69.5%,能量效率逐渐降低,中间区和负极区的分布比率减小,而正极区和两极邻近区的分布比率增加。停留时间的增加可以使中间区的氯离子充分向正极区迁移,中间区出水口离子浓度降低,因此可以从中间出水口获得脱盐后的水溶液,且增加停留时间可以提升脱盐效果。
(3)随着电压升高,中间区的脱盐率逐渐升高,最高达13.9%,能量效率逐渐降低,正极区的分布比率逐渐增大,而负极区和两极邻近区的分布比率逐渐减小,中间区域分布比率呈先上升后降低趋势。
(4)由于电泳实验中,施加的电极电势高于氯气析出的平衡电势,因此阳极发生析氯反应。在电泳装置电压36V,停留时间2.3h条件下,当氯离子初始浓度由466.4mg·L-1增加到862.0 mg·L-1时,在正极板发生反应的氯离子质量占理论氯离子总质量的百分数由24.1%降到17.5%。
符 号 说 明
C0——氯离子初始浓度,mg·L-1
C1——各出水口氯离子浓度,mg·L-1
I——电流,A
m反——在正极板发生反应的氯离子质量,mg
m迁——向正极区域迁移的氯离子的质量,mg
m原——在不施加电场的条件下,正极区域原本应该获得的质量,mg
m总——在正极区域获得的氯离子总质量,mg
t——通电时间,s
U——电极板两端电压,V
η——能量效率,mg·(kW·h)-1
[1] Wang Junhong (王 俊 红),Gao Naiyun (高 乃 云 ),Fan Yuzhu(范玉柱),Shi Liyi(施利毅).Development and application of seawater desalination [J].IndustrialWater Treatment(工业水处理),2008,28 (5):6-9.
[2] Feng Houjun (冯厚军),Xie Chungang (谢春刚).Status and prospect of chinese seawater desalination technology[J].ChemicalIndustryandEngineering(化学工业与工程),2010,27 (2):103-109.
[3] Sun Yuwen (孙育文),Zhou Jun (周军).Application of low temperature multi-effective distilment seawater desalination technology [J].HuadianTechnology(华电技术),2009,31 (7):65-67.
[4] Tiselius A.A new apparatus for electrophoretic analysis of colloidal mixtures [J].TransactionsoftheFaraday Society,1937,33:524-531.
[5] Kojima Y.Paper electrophoretic studies on the protein fractions of bovine serum collected at regular intervals [J].JapaneseJournalofVeterinaryResearch,1959,7 (1-4):246-257.
[6] Evans D I K.Haemoglobin electrophoresis on cellulose acetate using whole blood samples [J].JournalofClinical Pathology,1971,24 (9):877-878.
[7] Na N,Liu T T,Yang X J,etal.A simple cellulose acetate membrane-based small lanes technique for protein electrophoresis[J].AnalyticalandBioanalyticalChemistry,2012,404:753-762.
[8] Yu Sufang (于素芳),Tian Ming (田明),Zhang Lili(张立立),Song Yinglin (宋 瑛 林),Wang Fang (王 芳).Analysis results of common problem in cellulose acetate membrance electrophoresis of serum protein [J].LaboratoryScience(实验室科学),2013,16 (2):36-39.
[9] Smithies O.Zone electrophoresis in starch gels:group variations in the serum proteins of normal human adults [J].TheBiochemicalJournal,1955,61 (4):629-641.
[10] Jelena B P, Miloš O, Milena D.A method for in-gel fluorescent visualization of proteins after native and sodi-um dodecyl sulfate polyacrylamide gel electrophoresis [J].AnalyticalBiochemistry,2015,480:6-10.
[11] Duan J L,Tang Q W,Li R,He B L,Yu L M,Yang P Z.Multifunctional graphene incorporated polyacrylamide conducting gel electrolytes for efficient quasi-solid-state quantum dot-sensitized solar cells [J].JournalofPower Sources,2015,284 (15):369-374.
[12] David M Neville,Jr.Molecular weight determination of protein-dodecyl sulfate complexes by gel electrophoresis in a discontinuous buffer system [J].TheJournalofBiological Chemistry,1971,246:6328-6334.
[13] Dai Hong (戴 红 ),Zhang Xinshen (张 新 申 ),Zhang Haishan (张 海 山 ).The separation of hydrolysate of enzyme-soluble pigskin sodium dodecyl sulphated polyacryamide gel electrophoresis [J].LeatherScienceand Engineering(皮革科学与工程),2002,12 (6):15-18.
[14] Vesterberg O. History of electrophoretic methods [J].JournalofChromatography,1989,480:3-19.
[15] Zhang Shourun (张 守 润 ).Study on identification of vegetables seed reliability and purity by isoelectric focusing electrophoresis [J].GansuAgricultureScienceand Technology(甘肃农业科技),2010,7:22-24.
[16] Lewin S.Electrofocusing and protein detection and isolation[J].PostgraduateMedicalJournal,1969,45 (529):729-730.
[17] Sidén A.Isoelectric focusing and crossed immunoelectrofocusing of CSF immunoglobulins in MS [J].Journalof Neurology,1979,221 (1):39-51.
[18] Cao C X,Zheng Q S,Chen W K,Zhu J H.The unvalidity of Kohlrausch'regulating function for Svensson's isoelectric focusing and stationary electrolysis at steady state [J].JournalofChromatographyA,1999,863 (2):219-226.
[19] Ruan Yuanping (阮源萍),Liu Wenyuan (刘文远),Hu Rongzong(胡荣宗),Mu Jiqian (穆纪千),Hong Shaoqun(洪少 群),Zhang Changgong (张 长 弓).Study on the combination of isotachophores is and high performance liquid chromatography for the separation of complex samples [J].ChineseJournalofChromatography(色 谱),1999,17(1):49-51.
[20] Liu T,Li J D,Zeng R,Shao X X,Wang K Y,Xia Q C.Capillary electrophoresis-electrospray mass spectrometry for the characteriz-tion of high-mannose-typeN-glycosylation and differential oxidation in glycoproteins by charge reversal and protease/glycosidase digestion [J ].AnalyticalChemistry,2001,73:5875-5885.
[21] Alshana U,Ertas N,Göger N G.Determination of parabens in human milk and other food samples by capillary electrophoresis after dispersive liquid-liquid microextraction with back-extraction [J].FoodChemistry,2015,181(15):1-8.
[22] Pyell U,Jalil A H,Pfeiffer C,Pelaz B,Parak W.Characterization of gold nanoparticles with different hydrophilic coatingsviacapillary electrophoresis and Taylor dispersion analysis (Part I):Determination of the zeta potential employing a modified analytic approximation [J].JournalofColloidandInterfaceScience,2015,450 (15):288-300.
[23] Wang L,Li J,Zhang L.Determination of polyphosphates in fish and shrimp muscles by capillary electrophoresis with indirect UV detection after phosphatase inhibition using high pressure pretreatment [J].FoodChemistry,2015,185(15):349-354.
[24] Pommer M S,Zhang Y T,Keerthi N,Chen D,Thomson J A, Meinhart C D,Soh H T.Dielectrophoretic separationof platelets from diluted whole blood in microfluidic channels [J].Electrophoresis,2008,29 (6):1213-1218.
[25] Pohl H A,Karan K.Continuous dielectrophoretic separation of cell mixtures[J].CellBiophysics,1979,1:15-28.
[26] Ballantyne G R, Holtham P N. Application of dielectrophoresis for the separation of minerals [J].MineralsEngineering,2010,23:350-358.
[27] Yin Yongjia(印永嘉),Xi Zhengkai(奚正楷),Li Dazhen(李大珍).A Short Course in Physical Chemistry(物理化学简明教程) [M].Beijing:Higher Education Press,1992:343.
