“小绿萼”梅离体快繁体系的建立
2015-06-15杨丽青杨洁毛庆山包满珠张俊卫
杨丽青+杨洁+毛庆山+包满珠+张俊卫
摘要:以梅花品种小绿萼1年生枝条为试验材料,研究了采样时间、初代培养基、基本培养基和激素组合等对带芽茎段离体繁殖的影响。结果表明:(1)最佳采样时间为4—6月;(2)最佳腋芽诱导培养基为1/2 MS+1.0 mg/L 6-BA+05 mg/L KT+0.1 mg/L NAA;(3)最佳增殖培养基QL+0.5 mg/L 6-BA+0.05 mg/L NAA,增殖系数为427;(4)无菌苗在200 mg/L IBA浸渍处理数秒后,移植到1/2 QL培养基中,生根率为80%。
关键词:梅花;离体快繁;茎段;培养基
中图分类号: S685.170.4+3 文献标志码: A
文章编号:1002-1302(2015)04-0062-03
收稿日期:2014-05-09
基金项目:国家自然科学基金(编号:31070624);国家“863”计划(编号:2011AA100207)。
作者简介:杨丽青(1986—),女,山西朔州人,硕士,从事园林植物遗传育种研究。E-mail:1270063665@qq.com。
通信作者:张俊卫,博士,副教授,从事园林植物遗传育种研究。E-mail:zjw@mail.hzau.edu.cn。
梅是原产中国的传统名花,有悠久的栽培历史和丰富的栽培品种,具有极高的观赏价值和经济价值。在生产上,梅花以扦插、嫁接等无性繁殖为主,虽然能保持品种的优良性状,但是繁殖系数小,周期长。利用组培快繁技术,不仅可在短期内快速大量繁殖基因型一致的优质苗木,而且可获得无病毒苗木,大大加快了育苗进程和提高了苗木质量。自Harada等[1]开展梅茎段离体繁殖以来,国内外在梅的离体快繁上取得了较快的进展[2-5],但目前仍存在建立快繁体系的梅花品种少,部分品种在快繁过程中出现顶芽坏死、叶片黄化等难题。小绿萼是武汉地区的梅花老品种,具有极高的观赏价值。本研究旨在分析茎段采集时间、启动和增殖培养基对小绿萼离体繁殖的影响,以期建立其快繁体系,为该品种的应用推广提供一定的基础。
1 材料与方法
1.1 材料
供试材料采于武汉市磨山中国梅花研究中心,除8—9月份停止采样,分别在3—11月中旬采集梅花品种小绿萼(图1-A)1年生枝条,用冰盒带回实验室。
1.2 方法
1.2.1 外植体灭菌及初代培养 采集回来的枝条剪成1~2 cm长的具节茎段,每茎段1~2个腋芽。用洗洁精浸泡 10~20 min,流水冲洗30 min后在超净工作台上用75%乙醇浸润30 s,转入0.1%HgCl2中消毒8~15 min,然后用无菌水冲洗6~7次,无菌滤纸拭干后接种于初代培养基(1/2MS+1.0 mg/L 6-BA+0.1 mg/L NAA);为分析不同初代培养基对腋芽诱导的影响,以4月中旬采集的小绿萼枝条为材料,灭菌后接种至2种不同初代培养基:1/2MS+1.0 mg/L 6-BA+01 mg/L NAA和1/2MS+1.0 mg/L 6-BA+0.1 mg/L NAA+0.5 mg/L KT。每处理20个外植体,重复3次,接种30 d后统计诱导率,污染率在接种后10~15 d内统计。
1.2.2 腋芽增殖培养 将伸长到1~2 cm的腋芽切下,分别转入添加了1.0 mg/L 6-BA和0.1 mg/L NAA的3种基本培养基和添加不同浓度6-BA和NAA组合的QL培养基中,观察腋芽的增殖,每处理10个外植体,重复3次,记录植株高度,生长情况,接种5周后统计腋芽增殖情况。
1.2.3 丛生长度对继代的影响 待腋芽增殖形成的丛生芽伸长到不同长度(0.1、0.5~1、1~2 cm)时,将其从基部切下,放入继代培养基(1/2MS+1.0 mg/L 6-BA+0.1 mg/L NAA+0.5 mg/L KT)中观察其生长,每处理5个外植体,重复3次。
1.2.4 生根与移栽 选择生长健壮,株高超过2 cm的试管苗在5种生根培养基中进行生根培养。移栽时先将生根苗连培养瓶一起置于温室内进行为期10 d的炼苗,在此期间逐渐松开并揭去培养瓶的盖子,而后将植株根系上的培养基洗净,移栽到含有泥炭 ∶ 蛭石=1 ∶ 1 (体积比)的塑料盆中。移栽后的第1周塑料盆上覆盖塑料薄膜以保湿,1周后慢慢揭去。
1.2.5 培养条件 培养室温度为(23±2) ℃,空气相对湿度为60%左右,光照度为1 500~2 000 lx,光照周期为14 h/d。
2 结果与分析
2.1 采样时间对腋芽诱导率的影响
茎段接种1周后腋芽开始萌发,2周后腋芽开始伸长,叶片逐渐展开,叶色浓绿(图1-B)。不同时间采集的枝条在初代培养时,污染率和腋芽诱导率差异显著 (表1),4月至6月中旬是最佳采样时期,既可以保证较高的腋芽诱导率,而且污染率相对较低,其他时期采集的枝条污染率高,腋芽诱导率低,不适宜用作离体培养的外植体。
2.2 初代培养基对腋芽诱导的影响
4月采集的小绿萼枝条,接种于2种不同初代培养基中(表2),培养于添加KT的初代培养基中的外植体, 不仅腋芽诱导率高,而且芽伸长快,叶色浓绿,无顶芽死亡、黄化问题。
这与朱军等的结果[6]相一致,即KT对长蕊绿萼腋芽的伸长生长有促进作用。
2.3 基本培养基对腋芽增殖的影响
将伸长长度达到1~2 cm的腋芽接种到添加了1.0 mg/L BA和0.1 mg/L NAA的3种基本培养基(表3)中,芽的增殖和伸长表现出显著差异(表4),QL上培养的腋芽出芽数显著高于改良N6和1/2MS,伸长长度显著高于改良N6。比较3种培养基上腋芽的生长状态以及出芽数和丛生芽平均高度,在增殖培养中采用QL作为基本培养基。
2.4 激素组合对增殖的影响
将伸长长度达到1~2 cm,且长势一致的的腋芽转入添加不同6-BA和NAA浓度组合的QL培养中基中(表5),在6-BA浓度为0.2 mg/L时,丛生芽平均高度随着NAA浓度的升高而下降,但没有达到显著差异,而增殖系数基本没有变化,表明低浓度6-BA不能诱导腋芽增殖;当6-BA浓度为 1.0 mg/L 时,丛生芽平均高度和增殖系数,随着NAA浓度的升高先上升后下降,但丛生芽平均高度的变化没有达到显著水平,而增殖系数达到显著差异;而当6-BA浓度为0.5 mg/L时,植株平均高度和增殖系数, 随着NAA浓度的升高先下降
表1 采样时间对小绿萼腋芽诱导的影响
取样时间 3月 4月 5月 6月 7月 10月 11月
诱导率(%) 16.70±0.15c 75.00±0.16b 80.00±0.06ab 95.00±0.00a 0.00±0.00c 3.70±0.06c 14.70±0.13c
污染率(%) 83.00±0.15a 10.00±0.08b 19.70±0.06b 19.60±0.06b 100.00±0.00a 96.30±0.06a 85.00±0.13a
注:同行不同小写字母表示在0.05水平上存在显著差异。
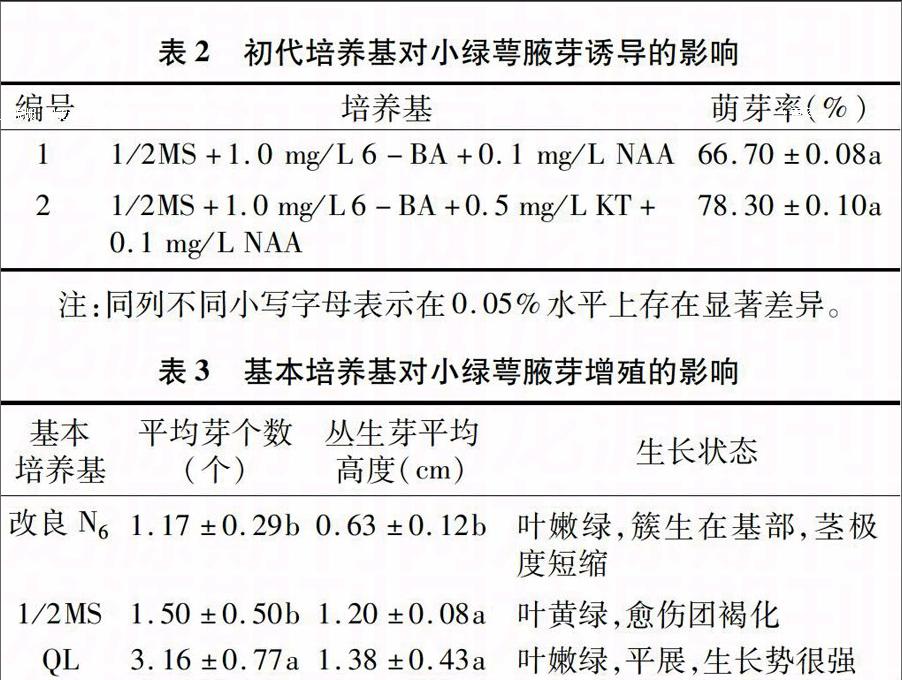
表2 初代培养基对小绿萼腋芽诱导的影响
编号 培养基 萌芽率(%)
1 1/2MS+1.0 mg/L 6-BA+0.1 mg/L NAA 66.70±0.08a
2
1/2MS+1.0 mg/L 6-BA+0.5 mg/L KT+0.1 mg/L NAA 78.30±0.10a
注:同列不同小写字母表示在0.05%水平上存在显著差异。
表3 基本培养基对小绿萼腋芽增殖的影响
基本
培养基 平均芽个数
(个) 丛生芽平均
高度(cm) 生长状态
改良N6
1.17±0.29b
0.63±0.12b
叶嫩绿,簇生在基部,茎极度短缩
1/2MS 1.50±0.50b 1.20±0.08a 叶黄绿,愈伤团褐化
QL 3.16±0.77a 1.38±0.43a 叶嫩绿,平展,生长势很强
注:同列不同小写字母表示在0.05水平上存在显著差异。
后上升,且变化值均达到显著差异。最终选用QL+0.5 mg/L 6-BA+0.05 mg/L NAA作为小绿萼增殖培养基,在此培养基上丛生芽的数量多,且生长正常(图1-C)。
2.5 丛生芽长度对继代培养的影响
将腋芽增殖培养后不同伸长长度的丛生芽,从基部切离后接种于继代培养基,生长表现出显著差异(表3),长度为1~2 cm的腋芽伸长长度最大,生长健壮,叶片平展;而长度为0.1~1 cm的腋芽生长瘦弱,叶片黄化脱落,最后死亡。
2.6 试管苗的生根培养和移栽
切取高度2~3 cm的试管苗,转入不同生根培养基(表6)中生根,培养30~40 d后形成根系(图1-D、图1-E)。植物生长调节剂的种类和浓度对试管苗生根有显著影响,只
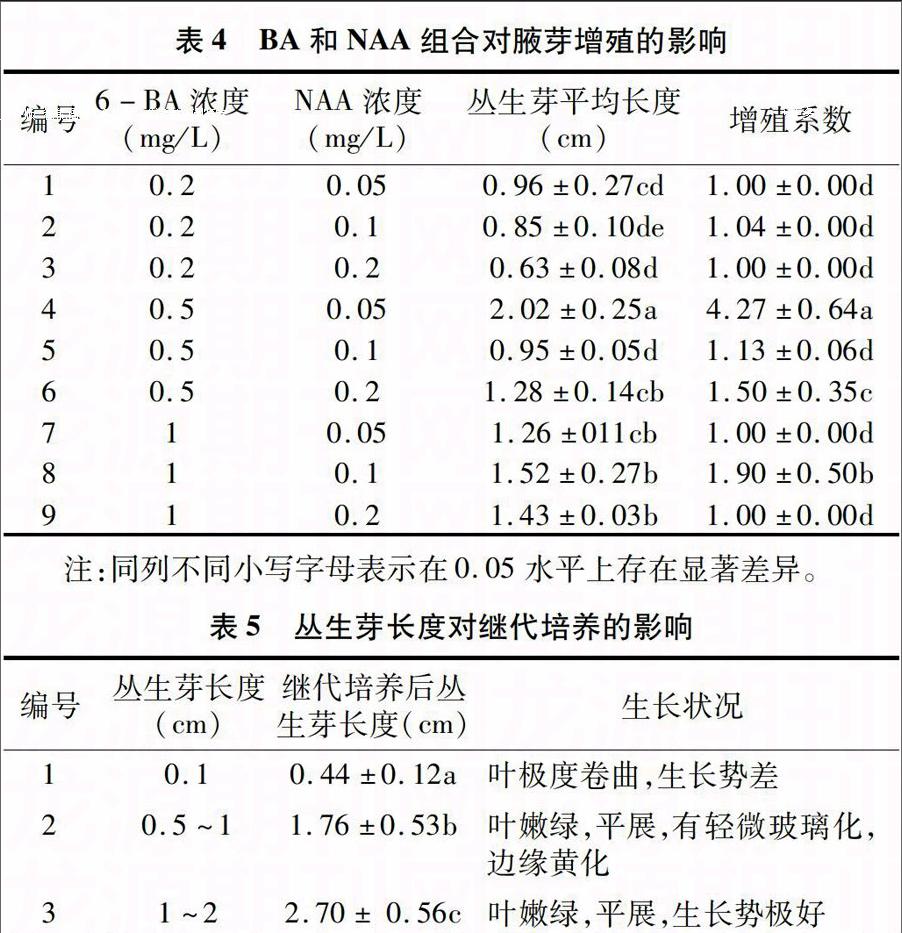
表4 BA和NAA组合对腋芽增殖的影响
编号 6-BA浓度
(mg/L) NAA浓度
(mg/L) 丛生芽平均长度
(cm) 增殖系数
1 0.2 0.05 0.96±0.27cd 1.00±0.00d
2 0.2 0.1 0.85±0.10de 1.04±0.00d
3 0.2 0.2 0.63±0.08d 1.00±0.00d
4 0.5 0.05 2.02±0.25a 4.27±0.64a
5 0.5 0.1 0.95±0.05d 1.13±0.06d
6 0.5 0.2 1.28±0.14cb 1.50±0.35c
7 1 0.05 1.26±011cb 1.00±0.00d
8 1 0.1 1.52±0.27b 1.90±0.50b
9 1 0.2 1.43±0.03b 1.00±0.00d
注:同列不同小写字母表示在0.05水平上存在显著差异。
表5 丛生芽长度对继代培养的影响
编号 丛生芽长度
(cm) 继代培养后丛
生芽长度(cm) 生长状况
1 0.1 0.44±0.12a 叶极度卷曲,生长势差
2
0.5~1
1.76±0.53b
叶嫩绿,平展,有轻微玻璃化,边缘黄化
3 1~2 2.70± 0.56c 叶嫩绿,平展,生长势极好
注:同列不同小写字母表示在0.05水平上存在显著差异。
添加了生长素IBA的培养基生根率很低,仅为3.33%,且愈伤组织多。同时添加NAA和IBA的培养基以及添加IBA和活性炭的培养基,生根率、平均生根数和平均根长显著增加,但生根效果最佳的是试管苗先用200 mg/L IBA 浸渍,再培养于 1/2QL 培养基的处理,生根率达到最高(80%),与其他处理相比差异显著,且平均根长和根数也显著增加。生根后的植株先在温室炼苗10 d左右,然后移栽入塑料盆中(图1-F),移
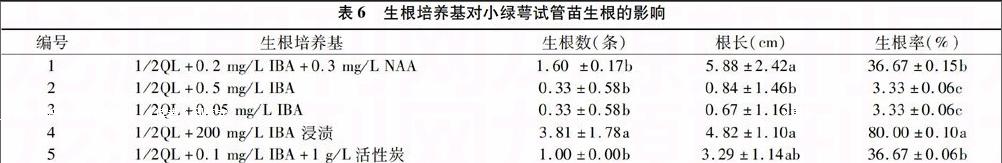
表6 生根培养基对小绿萼试管苗生根的影响
编号 生根培养基 生根数(条) 根长(cm) 生根率(%)
1 1/2QL+0.2 mg/L IBA+0.3 mg/L NAA 1.60 ±0.17b 5.88±2.42a 36.67±0.15b
2 1/2QL+0.5 mg/L IBA 0.33±0.58b 0.84±1.46b 3.33±0.06c
3 1/2QL+0.05 mg/L IBA 0.33±0.58b 0.67±1.16b 3.33±0.06c
4 1/2QL+200 mg/L IBA 浸渍 3.81±1.78a 4.82±1.10a 80.00±0.10a
5 1/2QL+0.1 mg/L IBA+1 g/L活性炭 1.00±0.00b 3.29±1.14ab 36.67±0.06b
注:同列不同小写字母表示在0.05%水平上存在显著差异。
栽存活率可达90%。
3 讨论
3.1 外植体生理状态对启动培养的影响
3月份梅花枝条上的叶芽开始膨大,萌发抽生新枝,但此时的枝条过于幼嫩,容易受灭菌剂的影响而褐化死亡,同时污染率也较高,因此本试验中3月取样的茎段萌芽率低;4—6月为梅新梢生长旺盛期,本试验在此阶段取样的茎段萌芽率最高可达90%,且新叶嫩绿,生长强健。这一结果与傅萼辉等、曲春苗等的研究相一致,即早春萌动的腋芽是比较理想的离体培养外植体,因为此时内源IAA浓度较高[7-9],有利于腋芽的萌发与生长。但与Yonemitsu等的试验结果相反,他们认为当年11月到翌年2月在休眠枝上采集的冬芽,离体繁殖的成功率高,造成这种差异的具体原因尚需进一步的分析[10]。
3.2 基本培养基对增殖培养的影响
在其他培养条件相同的情况下,果梅品种Nanko早春萌发的新芽,在WPM培养基上离体微繁时能增殖且生长健壮,而在MS培养基上的芽会逐渐褐化死亡[1]。而吕英民等离体培养铁骨红1年生枝具节茎段时,通过比较外植体在6种基本培养基(QL、MS、WPM、M1、M2、M3)上腋芽增殖系数、平均伸长长度等指标的差异,认为QL是适合铁骨红生长的最佳基本培养基[4,11]。本试验在小绿萼腋芽的增殖培养时,比较了改良N6、1/2MS和QL基本培养基对其增殖和生长的影响,也发现QL基本培养基显著优于改良N6和1/2MS。
3.3 KT和BA对腋芽萌发和伸长的影响
组织培养中常用的细胞分裂素有6-BA、KT和ZT,对梅花的增殖有不同的效果。从铁骨红试管苗增殖培养的结果看,6-BA和ZT优于KT,而且增殖系数差异显著。但增殖培养基中不添加IAA、IBA或NAA等生长素,增殖芽的伸长生长慢,影响试管苗正常生长。细胞分裂素浓度过高,增殖芽数量虽然明显增加,但多呈丛生状,茎难以伸长,且生长细弱,叶小且叶色异常,甚至出现玻璃化苗[12]。为克服增殖苗生长瘦弱,不得不采用壮苗培养基[7]。本试验在小绿萼腋芽增殖培养中所选用的3个6-BA浓度中,最适的浓度为0.5 mg/L,在添加此浓度6-BA的培养基中,不仅增殖系数最大,且丛生芽平均伸长长度也较大,当6-BA浓度提高到1.0 mg/L,虽然产生了大量的丛生芽,但是继代培养时丛生芽往往发生严重的褐化和黄化,渐渐死亡,同时玻璃化或畸形现象也逐渐加强,因此,在增殖培养中6-BA的浓度选定为0.5 mg/L。
3.4 浸渍法对生根培养的影响
在诱导梅试管苗生根时,既有单独使用IBA或NAA的报道,也有同时使用IBA和NAA的报道[1,4,6,11]。Harada 等在研究生长素对Nanko试管苗生根影响时发现,高浓度的IBA(1~2 mg/L)或NAA(0.9~1.9 mg/L)容易使试管苗基部形成愈伤,本试验在生根培养基中添加0.5 mg/L也易导致小绿萼试管苗形成大团愈伤。吕英民等在进行铁骨红试管苗生根培养时,观察到生长素种类对生根影响显著,其中NAA生根率较高,并且试管苗须根较多,但是根系比较细弱;添加IBA的试管苗根比较粗壮,但是根系较少;同时使用2种植物生长调节剂时不仅发根多,而且生长粗壮。但在本试验中,IBA和NAA同时使用虽然生根数和生根率较单独使用有所增加,但生根率偏低,而用200 mg/L IBA浸渍试管苗后培养于 1/2QL,其生根率可达80%,且平均生根数有显著增加,此结果与新疆野生巴旦杏的生根试验相似[13],其试管苗用 100 mg/L IBA浸渍处理60 min后转入1/2MS培养基中培养,暗培2周后生根率可达100%。
参考文献:
[1]Harada H,Murai Y. Micropropagation of Prunus mume[J]. Plant Cell Tissue and Organ Culture,1996,46(3):265-267.
[2]傅萼辉,徐惠珠,王豫兰,等. ‘美人梅茎段离体培养[J]. 北京林业大学学报,1995,17(增刊1):75-78.
[3]蒋泽平,梁珍海,朱 军,等. 不同基因型梅花组织培养增殖率差异[J]. 北华大学学报:自然科学版,2005,6(6):550-552.
[4]吕英民,曹 亮,张启翔. 真梅系梅花品种“铁骨红”离体培养[J]. 园艺学报,2007,34(4):1047-1049.
[5]Ning G G,Fan X L,Huang W J,et al. Micropropagation of six Prunus mume cultivars through axillary shoot proliferation,and ISSR analysis of cloned plants[J]. Acta Biologica Cracoviensia Series Botanica,2007,49(1):25-31.
[6]朱 军,郭立春.“长蕊绿萼”梅花具节茎段组织培养初报[J]. 江苏林业科技,2003,30(2):16-17.
[7]傅萼辉,徐惠珠,王豫兰,等. 梅花离体快速繁殖研究[J]. 武汉植物学研究,1991,9(3):275-280,313.
[8]曲春苗,陈瑞丹,吕晓倩. 梅花杂交种茎段培养影响因素的研究[J]. 北京林业大学学报,2012,34(增刊1):92-95.
[9]Murai Y,Harada H,Mochioka R,et al. Relationships between rooting in softwood cuttings of mume (Prunus mume Sieb. et Zucc.)and sorbitol in shoots[J]. Journal of the Japanese Society for Horticultural Science,1999,68(3):648-654.
[10]Yonemitsu H,Nishi K,Sagan S,et al.In vitro propagation of mature Japanese apricot(Prunus mume Sieb.et Zucc.)[J]. Horticultural Research,2003,2:77-82.
[11]吕英民,曹 亮,张启翔. 不同种系梅花品种组织培养繁殖研究[J]. 北京林业大学学报,2008,30(3):74-79.
[12]朱 军,张宇实,郭立春,等. ZT、IAA 对梅花试管苗增殖与生长的影响[J]. 江苏林业科技,2004,31(2):18-19.
[13]曾 斌,罗淑萍,李 疆. 新疆野生巴旦杏的组织培养和植株再生[J]. 新疆农业大学学报,2006,29(4):27-31.
