丙泊酚对脓毒性休克患者舌下微循环的影响
2015-06-13刘景峰王海曼齐志丽段美丽
刘景峰 王海曼 齐志丽 段美丽
丙泊酚对脓毒性休克患者舌下微循环的影响
刘景峰 王海曼 齐志丽 段美丽
目的 探讨丙泊酚对脓毒性休克患者舌下微循环的影响。方法 选取需要机械通气的脓毒性休克患者30例,所有患者依据病情给予经口气管插管并接呼吸机辅助通气治疗。在接受机械通气前及应用丙泊酚镇静后监测患者舌下微循环参数。同时记录患者血流动力学及氧代谢指标进行比较。结果 所有脓毒性休克患者镇静目标达到Ramsay评分3~4分时平均丙泊酚应用剂量为1.2mg/(kg·h)。镇静后微循环指标出现不同程度改变, 总血管密度TVD(P>0.05)无明显改变;灌注血管密度 PVD(P<0.05)、灌注血管比例PPV(P<0.05)及微血管流动指数MFI(P<0.05)较镇静前下降明显。镇静后去甲肾上腺素泵入剂量较镇静前轻度增加,血流动力学参数CI及MAP较镇静前亦有轻度下降,但二者相比差值无统计学意义(P>0.05)。反应组织灌注指标血乳酸(LAC)及氧代谢指标中心静脉氧饱和度(SvO2)在镇静后升高(P<0.05)。结论 脓毒性休克患者应用丙泊酚镇静可以使微循环及氧利用障碍加重。
丙泊酚 脓毒性休克 舌下微循环
镇静治疗是ICU中危重患者常用的治疗手段,它使重症患者处于“休眠”状态,降低代谢和氧需氧耗,以适应受到损害的灌注与氧供水平,从而减轻强烈病理因素所造成的损伤,为器官功能的恢复赢得时间创造条件。脓毒性休克患者往往同时接受机械通气治疗,而镇静是保证机械通气顺利进行的重要因素之一。丙泊酚具有起效快、停药后苏醒快的特点,已经成为临床常用镇静药物之一。丙泊酚用于健康成人麻醉、镇静治疗时对微循环的影响已有研究,目前的观点倾向于丙泊酚可以导致血管扩张,血压下降及轻度可逆的微循环改变,未造成脏器功能损害,但仍建议该药慎用于微循环障碍的患者,其对脓毒性休克这一以微循环障碍为病理生理机制的临床综合征的影响研究较少,故有必要明确丙泊酚镇静治疗对脓毒性休克患者微循环的影响[1]。利用测流暗视野技术(sidestream dark-filed imaging,SDF)技术观察脓毒性休克患者舌下微循环改变可以评估患者病情危重程度[2,3]。本研究通过SDF探讨脓毒性休克患者应用丙泊酚镇静时微循环改变特点。
资料与方法
1.一般资料:选取首都医科大学附属北京友谊医院重症医学科2012年2月~2014年9月收治的脓毒性休克患者30例,其中,男性18例,女性12例。患者平均年龄62.74±15.57岁。30例患者中肺炎22例,腹腔感染6例,肾盂肾炎2例。
2.脓毒性休克诊断标准:采用2012年SSC指南[4]制定的脓毒性休克标准:重症脓毒症导致的低血压(收缩压<90mmHg、平均动脉压<70mmHg,或成人收缩压下降>40mmHg,或按年龄下降>2个标准差)经液体复苏不能改善。
3.纳入标准:符合脓毒性休克标准的患者,年龄>18岁且需要机械通气患者。
4.排除标准:长期服用免疫抑制剂的患者;恶性肿瘤晚期;获得性免疫缺陷症患者;口腔内出血的患者;妊娠期患者;合并明确心功能障碍者。
5.研究方法:(1)入组患者基本治疗:所有入组患者均给予广谱抗生素积极抗感染治疗,充分液体复苏及应用去甲肾上腺素泵入维持血压,行脉搏指示连续心排出量(pulse indicator continuous cardiac output, PiCCO)血流动力学监测,给予经口气管插管接呼吸机辅助呼吸维持氧合。气管插管后常规给予丙泊酚镇静治疗。连续监测患者心电、脉氧饱和度、动脉血压、中心静脉压、血温、血乳酸,监测动脉及中心静脉血气分析结果。(2)微循环指标测定方法:采用侧流暗视野仪器(MicroScan公司,荷兰)采集舌下微循环图像,在丙泊酚镇静前及镇静后(Ramsay评分达3~4分时)分别取舌下左、中、右3个不同部位采集稳定、清晰的微血管图像至少20s,经图像转换器(MicroScan公司,荷兰)将图像存入图像分析电脑(Dell studio 1558,Dell公司),采用AVA3.0(Automated Vascular Analysis)分析软件进行舌下微循环图像的半定量分析[5]。通过目测判断每个象限(4个象限)红细胞流速,分为无流动,间断流动,缓慢流动和持续流动。血管内径分为小血管10~25μm,中血管26~50μm,大血管51~100μm。计算总血管密度(total of perfused vessel density,TVD)、灌注血管密度(perfused vessel density,PVD)、灌注血管比例(proportion of perfused vessels,PPV)、微血管流动指数(microvascular flow index,MFI)。(3)Ramsay评分标准:1分:患者焦虑、躁动不安;2分:患者配合,有定向力,安静;3分:患者对指令有反应;4分:嗜睡,对轻叩眉间或大声听觉刺激有反应;5分:嗜睡,对轻叩眉间或大声听觉刺激反应迟钝;6分:嗜睡,无任何反应。
结 果
所有脓毒性休克患者给予丙泊酚静脉泵入镇静治疗,镇静目标达到Ramsay评分3~4分时平均丙泊酚应用剂量为1.2mg/(kg·h)。镇静效果满意后监测患者舌下微循环指标,较镇静前总血管密度(TVD)无明显下降(P>0.05);微循环其他指标包括PVD、PPV、MFI,较镇静前则有明显下降(P<0.05)。为维持血流动力学稳定,镇静后去甲肾上腺素泵入剂量较镇静前轻度增加,二者差值无统计学意义(P>0.05)。血流动力学参数CI及MAP较镇静前亦有轻度下降,但二者相比差值无统计学意义(P>0.05)。PO2、PCO2指标较镇静前无明显变化(P>0.05),反应组织灌注指标及血乳酸(LAC)及氧代谢指标中心静脉氧饱和度(SvO2)在镇静后有明显升高(P<0.05,表1)。
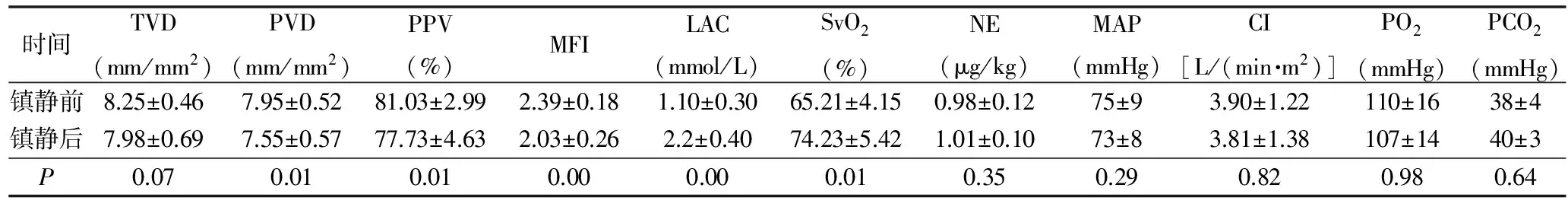
表1 患者各监测指标情况
讨 论
在过去多数情况下研究镇静剂对微循环的影响是应用显微镜,然而显微镜技术无法常规应用于人体微循环观察。本研究是利用SDF技术直视下观察丙泊酚对脓毒性休克患者舌下微循环的影响。SDF技术已经成功应用于人体舌下微循环和动物实验研究[6,7]。值得一提的是,SDF技术观察到的小血管大多数是毛细血管,因此笔者的研究可以直接观察丙泊酚对毛细血管血流的影响。另外,由于SDF技术只能观察含红细胞的血管,故TVD明显下降时提示血管无灌注血流而完全塌陷,当那些无灌注和间断灌注的血管密度增加时,会导致微血管血流的异质性,毛细血管血流异质性是脓毒性休克患者微循环障碍的典型改变之一。
本研究表明,应用丙泊酚镇静后,通过SDF技术观察到脓毒性休克患者舌下微循环影像改变。其特点为较镇静前总体血管密度无明显改变,血流停滞或间断血流毛细血管增加,通过自动分析软件计算出微循环总血管密度(TVD)无明显下降。部分微血管血流发生了变化,主要表现为毛细血管内红细胞流速不同程度下降,有些血管血流停滞,有些血管血流缓慢或间断出现,经计算后提示灌注血管密度(PVD)、灌注血管比例(PPV)、微血管流动指数(MFI)均有明显下降。以上这些微循环改变特点证实丙泊酚可以加重脓毒性休克患者微循环障碍,使得微循环的异质性更为明显,其可能的原因为丙泊酚具有钙离子通道阻滞作用,能明显降低血管张力,导致血管扩张,减少静脉回流,从而导致动脉低血压,进而减少毛细血管血流[8]。这种导致血管张力下降作用导致的血压下降可以通过输液及应用血管活性药物改善,且停用丙泊酚后舌下微循环障碍可以得到改善[6]。
本研究发现,处于丙泊酚镇静状态的患者血色素、心脏指数以及氧分压均无明显改变,即参与氧输送的因素无明显改变,但血乳酸有升高趋势,而中心静脉血氧饱和度有明显升高趋势,提示患者存在氧摄取、代谢障碍。众所周知,典型的脓毒性休克的血流动力学特点是各种炎性因子导致的病理性小动脉系统扩张。在血流受限的情况下,选择性的血管扩张可以改善氧输送,但血管过度扩张则可以导致病理性分流效应增加[9]。研究表明,脓毒性休克患者应用丙泊酚镇静时,对微循环的影响较咪达唑仑更为显著[10]。所以在脓毒性休克情况下应用丙泊酚可以使这种病理性分流效应更为明显,导致血流异质性增加,而血流异质性是导致组织氧摄取能力下降主要原因[11]。
当然,应该注意到毛细血管灌注减少还有其他原因,如核心温度、二氧化碳分压或氧分压等。笔者的研究中利用PiCCO技术实时监测患者血温,确保测量患者舌下微循环时血温保持在37.5~38.0℃,0.5℃的改变似乎对舌下微循环没有什么影响。二氧化碳分压是另一个可能的影响因素,但所有患者的PCO2保持在38~40mmHg之间,笔者认为没有明确的影响。局部氧分压可能会对毛细血管灌注造成影响,至少本研究中所有患者氧分压维持在适当水平,差异无统计学意义,但无法排除轻微氧分压改变导致局部微循环改变的可能。另外,气管插管可能会导致舌部受压,从而可能产生间断血流或无血流的毛细血管增加。实际上在研究中保证口腔充分暴露,保持气管内导管不压迫舌面,在相同情况下测得舌下微循环的改变能反映真实情况。
脓毒性休克患者在补液及应用血管活性药物维持血流动力学相对稳定情况下,应用丙泊酚镇静时可以导致微循环障碍加重并因此导致微循环对氧摄取、利用障碍更为明显。但丙泊酚镇静治疗带来的氧耗下降似乎可以使得危重患者在应激状态下氧供及氧耗达到一个新的平衡,可能有利于组织器官功能恢复。
1 Koch M, De Backer D,Vincent JL ,etal. Effects of propofol on human microcirculation[J]. British Journal of Anaesthesia, 2008 , 101 (4): 473-478
2 刘景峰,赵梦雅,王海曼,等.脓毒症相关性脑病患者舌下微循环的临床研究[J].医学研究杂志,2014, 43 (10): 49-52
3 Sakr Y, Dubois MJ, De Backer D,etal. Persistent microcirculatory alterations are associated with organ failure and death in patients with septic shock[J]. Crit Care Med,2004, 32(9): 1825-1831
4 Dellinger RP, Levy MM, Rhodes A,etal. Surviving sepsis campaign: international guidelines for management of severe sepsis andseptic shock, 2012[J]. Intensive Care Med, 2013, 39(2):165-228
5 Boerma EC, Mathura KR, Van der Voort PHJ,etal. Quantifying bedside-derived imaging of microcirculatory abnormalities in septic patients: a prospective validation study[J]. Critical Care, 2005, 9(6): R601-R606
6 Harris AG, Sinitsina I, Messmer K. The Cytoscan Model E-Ⅱ, a new reflectance microscope for intravital microscopy: comparison with the standard fluorescence method[J]. J Vasc Res, 2000, 37(6): 469-476
7 Mathura KR, Vollebregt KC, Boer K,etal. Comparison of OPS imaging and conventional capillary microscopy to study the human microcirculation[J]. J Appl Physiol, 2001, 91 (1):74-78
8 Lawton BK, Brown NJ, Reilly CS,etal. Role of L-type calcium channels in altered microvascular responses to propofol in hypertension[J]. Br J Anaesth, 2012, 108 (6): 929-935
9 De Backer D, Durand A. Monitoring the microcirculation in critically ill patients[J]. Best Pract Res Clin Anaesthesiol, 2014, 28(4):441-451
10 Penna GL, Fialho FM, Kurtz P,etal. Changing sedative infusion from propofol to midazolam improves sublingual microcirculatory perfusion in patients with septic shock[J]. J Crit Care, 2013, 28(5):825-831
11 De Backer D, Orbegozo Cortes D, Donadello K,etal. Pathophysiology of microcirculatory dysfunction and the pathogenesis of septic shock[J]. Virulence, 2014, 5(1): 73-79
(修回日期:2015-03-06)
Effect of Propofol on Sublingual Microcirculation in Patients with Septic Shock.
LiuJingfeng,WangHaiman,QiZhili,etal.
DepartmentofCriticalCareMedicine,BeijingFriendshipHospital,CapitalMedicalUniversity,Beijing100050,China
Objective To discuss the changes of sublingual microcirculation in patients with septic shock before and after the application of propofol sedation. Methods In total, 30 septic shock patients were enrolled in the study and all patients accepted intratracheal intubation and mechanical ventilation due to their conditions. Sublingual microcirculation parameters, hemodynamic parameters and oxygen metabolism indicators were recorded before and after the application of propofol dedation. Results All patients with septic shock achieve Ramsay score 3 to 4 points, and propofol dose was 1.2mg/(kg·h) on average. The microcirculation index appeared different degree of change afer the application of propofol. There was no obvious change of total vessel density(TVD)(P>0.05),but there was significant decrease in the perfused vessel density (PVD), proportion of perfused vessels (PPV) and microvascular flow index (MFI) (P<0.05). Inorder to keep the hemodynamic stable,norepinephrine dose was increased mildly,cardiac index (CI) and mean arterial pressure (MAP) showed a downward trend, but these changes were of no significant (P>0.05). Tissue perfusion index such as blood lactic acid (LAC) and oxygen metabolism index such as central venous oxygen saturation (SvO2) increased significantly (P<0.05) after the application of propofol.Conclusion Propofol may aggravate the sublingual microcirculation and oxygen metabolism in patients with septic shock.
Propofol; Septic shock; Sublingual microcirculation
首都医学发展基金资助项目(SF-2009-Ⅱ-14)
100050 首都医科大学附属北京友谊医院重症医学科
段美丽,电子信箱:beauty9659@hotmail.com
R4
A DOI 10.11969/j.issn.1673-548X.2015.10.016
2015-02-16)
